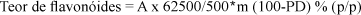Resumos
a própolis é uma resina coletada das árvores pelas abelhas Apis mellifera L., que contém inúmeras substâncias, dentre elas os flavonóides. Devido a grande variedade de sua composição química, apresenta várias ações farmacológicas, destacando-se as ações antiinflamatória, cicatrizante, antitumoral e antimicrobiana, principalmente a antifúngica. Esta ação foi testada frente a leveduras isoladas de onicomicoses, que são infecções de difícil e longo tratamento que causam efeitos indesejáveis ao paciente. A própolis surge como uma eficiente opção de tratamento, pois é de baixa toxicidade e pode ser de uso tópico. Este trabalho objetivou avaliar a otimização do processo extrativo da própolis através de parâmetros físico-químicos e demonstração da atividade antifúngica.
Apis mellifera; própolis; antifúngicos; otimização da extração; onicomicoses
Propolis is a resin collected by the bees Apis mellifera L., which contains several substances including the flavonoids. Due to a diversified chemical composition propolis presents some pharmacological actions, being distinguished the anti-inflammatory, healing, antitumoral and antimicrobial properties and, in particular, its antifungal action. This action has been tested against yeasts obtained from onychomycosis, which are infections of difficult and long treatment and they can manifest intolerable effects on the patient. The propolis appears as an efficient therapy option, as it has low toxicity and should be of dermal use. The aim of the present study was to evaluate the optimization of the propolis extractive process through physiochemical parameters and antifungal activity demonstration.
Apis mellifera; propolis; antifungal activity; extract optimization; onychomycosis
ARTIGO
Obtenção de extratos de própolis sob diferentes condições e avaliação de sua atividade antifúngica
Antifungal activity evaluation of different propolis extracts
Renata LonghiniI; Sheila M. RaksaI; Ana Carla P. OliveiraII; Terezinha I. E. SvidzinskiII; Selma L. FrancoI, * * E-mail: slfranco@uem.br, Tel. +55-44-32614528
ILaboratório de Farmacotécnica, Departamento de Farmácia e Farmacologia, Universidade Estadual de Maringá, Av. Colombo 5790, 87020-900, Maringá, PR, Brasil
IILaboratório de Micologia, Departamento de Análises Clínicas, Universidade Estadual de Maringá, Av. Colombo 5790, 87020-900, Maringá, PR, Brasil
RESUMO
a própolis é uma resina coletada das árvores pelas abelhas Apis mellifera L., que contém inúmeras substâncias, dentre elas os flavonóides. Devido a grande variedade de sua composição química, apresenta várias ações farmacológicas, destacando-se as ações antiinflamatória, cicatrizante, antitumoral e antimicrobiana, principalmente a antifúngica. Esta ação foi testada frente a leveduras isoladas de onicomicoses, que são infecções de difícil e longo tratamento que causam efeitos indesejáveis ao paciente. A própolis surge como uma eficiente opção de tratamento, pois é de baixa toxicidade e pode ser de uso tópico. Este trabalho objetivou avaliar a otimização do processo extrativo da própolis através de parâmetros físico-químicos e demonstração da atividade antifúngica.
Unitermos:Apis mellifera, própolis, antifúngicos, otimização da extração, onicomicoses.
ABSTRACT
Propolis is a resin collected by the bees Apis mellifera L., which contains several substances including the flavonoids. Due to a diversified chemical composition propolis presents some pharmacological actions, being distinguished the anti-inflammatory, healing, antitumoral and antimicrobial properties and, in particular, its antifungal action. This action has been tested against yeasts obtained from onychomycosis, which are infections of difficult and long treatment and they can manifest intolerable effects on the patient. The propolis appears as an efficient therapy option, as it has low toxicity and should be of dermal use. The aim of the present study was to evaluate the optimization of the propolis extractive process through physiochemical parameters and antifungal activity demonstration.
Keywords:Apis mellifera, propolis, antifungal activity, extract optimization, onychomycosis.
INTRODUÇÃO
A própolis é uma complexa mistura de substâncias que as abelhas coletam de várias plantas, elaboram e depositam em seus ninhos, com o objetivo de vedar a colméia. Esta mistura é constituída por 47% de resina contendo vitaminas, sais minerais, compostos fenólicos como flavonóides, ácidos graxos, álcoois aromáticos e ésteres, 30% de ceras, 5% de pólen, 4-15% de substâncias voláteis e matérias estranhas e 13% de substâncias desconhecidas (Burdock, 1998). Dentre as substâncias presentes na própolis destacam-se os flavonóides, os quais são indicados como responsáveis pelas ações, antiinflamatória, antimicrobiana e, em especial pela antifúngica (Somnez et al., 2005; Cusnhie; Lamb 2005).
A própolis é uma importante alternativa terapêutica do ponto de vista econômico e eficácia farmacológica por ser de fácil obtenção e por apresentar inúmeras propriedades farmacêuticas . (Soares et al., 2006; Tavares et al., 2006). Entre outras, está comprovada a ação antimicrobiana frente a vários agentes etiológicos, por exemplo, bactérias Gram positivas como Streptococcus pyogenes, Staphylococcus aureus e Gram negativas Escherichia coli (Burdock, 1998; Nieva, 1999; Kujumgiev, 1999; Packer; Luz, 2007) e leveduras, sobretudo Candida albicans (Fernandes et al., 1995; De Castro, 2001, Oliveira et al., 2006).
Atualmente, há estudos sobre a própolis nas mais diversas áreas, desde a caracterização da droga (Franco et al., 2000; Bruschi et al., 2003) e otimização dos processos de extração (Franco; Bueno, 1999) até controle de qualidade (Sousa et al 2007). Contudo, não há estudos que evidenciem a relação entre as condições de otimização da extração da própolis e a atividade antimicrobiana.
O processo de otimização compreende a extração sob condições diversas, tais como: temperatura de extração, comparação entre métodos e diferentes líquidos extratores (álcool em várias diluições, adição de substâncias tensoativas misturadas às soluções álcool-água ou água).
A onicomicose é uma infecção fúngica ungueal que pode ser causada por fungos filamentosos ou leveduras. Representa de 20 a 50% das onicopatias e 30% de todas as infecções micóticas superficiais. Recentemente, tem sido relatado aumento do número se casos dessas infecções que ganharam considerável importância ao longo das últimas décadas, como resultado de um aumento significativo na incidência de agentes oportunistas, dentre os quais se destacam as leveduras. Atualmente, as leveduras, que até pouco tempo não eram consideradas patogênicas para as unhas, têm sido responsabilizadas por 75% dos casos de onicomicoses na Líbia (Ellabib et al., 2002), por 59,1% dos casos em Roma (Mercantini et al., 1996) e por 49,1% dos casos na cidade do Rio de Janeiro (Araújo et al., 2003). O aumento da freqüência de onicomicoses causadas por leveduras pode ser atribuído a vários fatores, destacando-se o aumento do número de pacientes imunocomprometidos, como conseqüência do aumento da sobrevida de doentes graves e da vida média da população.
Assim, este trabalho tem por objetivo avaliar a eficiência do processo extrativo, variando-se a concentração de própolis, usando-se diversos líquidos extratores e, ao mesmo tempo, selecionar o extrato que apresente melhor atividade in vitro frente a uma coleção de leveduras isoladas de onicomicoses.
MATERIAL E MÉTODOS
Obtenção da própolis
As amostras de própolis foram coletadas das colméias de abelhas Apis mellifera L., na Fazenda Experimental de Iguatemi da Universidade Estadual de Maringá (FEI-UEM), localizadas no apiário da clareira, no interior de uma reserva de eucaliptos e ao redor de uma mata nativa. As amostras foram congeladas e, em seguida, trituradas em turboextrator, acondicionadas em frasco âmbar bem vedado e estocadas em temperatura de congelamento (-20 ºC).
Caracterização da própolis
Teor de flavonóides totais (Deutsches Arzneibuch, 1994): Cerca de 0,400 g da Própolis exatamente pesadas, foram colocados em balão de fundo redondo de 100 mL e acrescidos de 1 mL de uma solução de hexametilenotetramina a 0,5% (p/p), 20 mL de acetona e 2 mL de ácido clorídrico. Foram aquecidos em banho-maria, sob refluxo, por trinta minutos. A mistura foi filtrada para balão volumétrico de 100 mL através de pequena quantidade de algodão. O resíduo da própolis e o algodão foram lavados, em balão volumétrico de fundo redondo, com duas porções de 20 mL de acetona, aquecendo-se à fervura sob refluxo, por 10 minutos. Após resfriamento à temperatura ambiente, as soluções foram filtradas, através de algodão, para o balão volumétrico, completando-se o volume com acetona. Exatamente 10 mL da fração acetônica foi colocada em funil de separação e adicionado 20 mL de água e depois de extraídos com 15 mL de acetato de etila repetindo-se por três vezes, com porções de 10 mL de acetato de etila. As fases de acetato de etila foram reunidas e lavadas, em funil de separação, com duas porções de 50 mL de água. A seguir, a fração em acetato de etila foi filtrada para um balão volumétrico de 50mL, através de algodão e sulfato de sódio anidro. Exatamente 10 mL dessa fração foi colocado em um balão volumétrico de 25 mL, juntou-se 1mL de cloreto de alumínio e completou-se com solução metanólica de ácido acético. Ao mesmo tempo, 10 mL da fração de acetato de etila foram diluídos a 25 mL com solução metanólica de ácido acético (solução comparativa). Aguardou-se 30 minutos e procedeu-se a leitura em espectrofotômetro (425 nm). A partir da absorvância obtida (A), da perda por dessecação (PD) e da massa (m) da amostra de Própolis, obteve-se o teor de flavonóides (% em quercetina), utilizando para o cálculo a seguinte equação:
Determinação do teor de ceras (Franco et al., 2000): Para a determinação do teor de ceras, pesou-se 1,0 grama de Própolis, colocou-se em frascos de vidro com tampa e submeteu-se à extração com três frações de 10mL de éter de petróleo sob aquecimento em banho-maria fervente (b.m.f.). A fração etérea foi desprezada e as própolis remanescentes foram secas em b.m.f., resfriadas e submetidas à nova pesagem. Os resultados são expressos em porcentagem (%, p/p) e representam a média de três determinações.
Teor de cinzas totais (Farmacopéia Brasasileira, 1988): Para determinação do teor de cinzas totais, foram pesadas exatamente 3g da droga pulverizada e transferida para um cadinho de porcelana previamente calcinado, resfriado e pesado. Após distribuir a amostra uniformemente no cadinho a amostra foi incinerada, aumentando paulatinamente a temperatura, não ultrapassando 700 °C, até que todo o carvão fosse eliminado (mais ou menos 4 horas). O cadinho foi resfriado em dessecador e pesado. Calculou-se então a porcentagem de cinzas em relação à droga seca ao ar. Os resultados representam a média de 4 determinações e são expressos em porcentagem (%, p/p).
Determinação da umidade em balança com infravermelho (INFRATEST): Foram pesadas amostras contendo 3,0 g de própolis, previamente moídas e submetidas ao aquecimento a 75 ºC através de raios infravermelho pelo período de aproximadamente 1 hora, até que o peso não variasse mais do que 0,25%. Foram realizadas 5 determinações e, os resultados são expressos em porcentagem (%, p/p).
Obtenção dos extratos de própolis
Foram preparados extratos por turboextração, com concentração de própolis variando entre 5% e 30% (p/p), utilizando-se álcool 93,7% (p/p) conforme Franco e Bueno (1999). Estes extratos receberam a denominação de A, B e C. Os extratos hidroglicólicos foram preparados com propilenoglicol em três concentrações entre 30% a 50% (V/V), mantendo uma concentração fixa de própolis (p/p) e denominados de D, E e F, respectivamente. Todos os extratos foram acondicionados em frascos de cor âmbar, com batoque interno de vedação e tampa rosqueada. Os mesmos foram armazenados em local seco e sob temperatura de 25 ºC. Esta metodologia de preparação está patenteada junto ao Instituto Nacional de Propriedade Industrial (INPI) sob o número PI 0501875-7.
Otimização dos extratos
Determinação do resíduo seco (Mello; Petrovick, 2000): Foram exatamente pesadas 20,0g da solução extrativa em pesa-filtro previamente tarado e a solução foi evaporada até secura em banho de água fervente, sob agitação constante. O pesa-filtro foi colocado em estufa por 2h à temperatura de aproximadamente 105 °C, resfriado em dessecador e pesado. O resultado foi expresso em relação a 100,0 g do extrato, pela média de três determinações.
Determinação do pH (Farmacopéia Brasasileira, 1988): Foram realizadas três leituras sucessivas de pH. Para padronização do phmetro foram realizadas leituras dos tampões com pH 4,0 e 7,0, conforme estabelecido na Farmacopéia Brasileira (1988).
Determinação da densidade relativa - método do picnômetro (Farmacopéia Brasasileira, 1988): Foram colocados os extratos em picnômetro de 25,0 mL previamente pesados e foram pesados depois de preenchidos com os extratos ajustados a temperatura à 20 ºC. Os resultados foram obtidos pelo quociente entre a massa obtida dos extratos divididas pelo seu volume, segundo estabelecido na Farmacopéia Brasileira (1988). As análises foram realizadas em quintuplicatas.
Teor de flavonóides totais para os extratos de própolis (Franco; Bueno, 1999): O teor de flavonóides foi determinado para os extratos, tomando 3,0 mL de extrato e adicionados de 3,0 mL de água e 3,0 mL de acetona. Esta mistura foi extraída três vezes com acetato de etila e completado o volume em balão volumétrico para 50 mL. Foi retirada uma alíquota de 10,0 mL, adicionado 1,0 mL de cloreto de alumínio 2% (em etanol) e completado o volume para 25 mL em balão volumétrico com solução metanol acética 5% (V/V). Após 30 minutos foi feita a leitura em 425 nm. Obteve-se o teor de flavonóides (% em quercetina, n = 5) a partir da equação abaixo, onde a absorvância obtida (A), a perda por dessecação (PD) e a massa (m) da amostra correspondente de própolis são utilizados para o cálculo:
Determinação da Concentração Inibitória Mínima
A concentração inibitória mínima (CIM) foi determinada tendo como base o método de microdiluição em caldo preconizado pelo National Committee for Clinical Laboratory Standards (NCCLS 1997) com algumas adaptações para produtos naturais, a saber: A concentração do inóculo foi ajustada em espectrofotômetro (Baush & Lomb) para corresponder à turbidez do tubo 0,5 da escala Mc Farland em comprimento de onda de 530 nm de modo que o volume de 100 mL dessa suspensão continha entre 0,5 e 2,5 x 103 UFC/mL. O teste foi realizado em microplacas plásticas esterilizadas (Nunclon, Delta, Nunc A/S, Roskilde, Denmark), contendo 96 poços organizados em oito séries identificadas de A a H, cada qual com doze poços numerados de 1 a 12. Cada linha (A-H) correspondeu a uma espécie fúngica que recebeu 100 µL do inóculo aferido e cada coluna recebeu 100 µL do extrato de própolis, diluído de forma seriada na razão 2 em caldo YNBG até a diluição de 1/128. Em cada placa foram incluídos controles negativo e positivo, também foi realizado um teste de cada levedura com álcool, suas diluições e solução propilenoglicol-água nas mesmas condições que foram usados como líquido extrator no preparo do extrato. As microplacas foram incubadas em câmara úmida a 35 ºC por 48 h com monitoramento diário. A leitura do teste foi feita através de comparação visual por reflexão em espelho.
A CIM foi considerada a menor concentração do extrato capaz de inibir 100% do crescimento de cada levedura, tendo como referência o seu respectivo controle positivo.
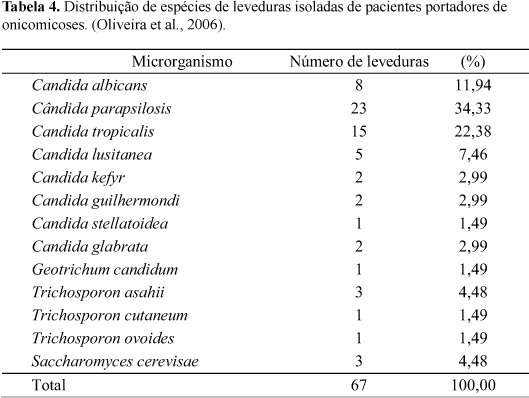
Microrganismos: o ensaio da CIM de cada extrato de própolis foi realizado, em duplo cego, sobre uma coleção de 67 leveduras de interesse médico isoladas de casos clínicos (onicomicoses) de pacientes atendidos no Laboratório de Ensino e Pesquisa em Análises Clínicas e identificadas segundo Larone (1995). Para o controle da técnica foi incluída a levedura de referência Candida albicans (ATCC 90028).
Testes estatísticos
Para acompanhamento do experimento foram obtidos os desvios padrão e os coeficientes de variação percentual. Os dados foram submetidos à análise de variância (ANOVA) e para determinação das diferenças mínimas significativas foi utilizado o teste de Tukey.
RESULTADOS E DISCUSSÃO
O controle de qualidade da matéria-prima é fundamental na produção de medicamentos. Para tanto, a determinação de cinzas totais na própolis foi realizada com intuito de estabelecer a quantidade de substância residual não volátil no processo de incineração especificado (Farmacopéia Brasiseileira, 1988).
Na Tabela 1 pode ser visualizado que o teor de cinzas totais apresenta 3,24% coerente com a estabelecida por Franco et al. (2000) que definiram parâmetros para a própolis proveniente da região de Maringá (2,45 - 3,63%). Da mesma forma, outros parâmetros analisados, como os teores de ceras e de flavonóides totais = 1,79% e a perda por dessecação apresentam valores na faixa previamente estabelecida por estes autores (teor de ceras = 4,10a 39,50% e teor de flavonóides = 1,72a 5,52% e perda por dessecação = 5,29-14,11%), o que demonstra a qualidade adequada da própolis em estudo, necessária para ser utilizada como medicamento.
Em etapa anterior, Franco e Bueno (1999) estabeleceram que, para a obtenção de extratos de própolis, a concentração mais adequada é a 10% e o líquido extrator o álcool etílico 93,7%. Neste trabalho, para a otimização, compararam-se os extratos de própolis obtidos dessa forma com os extratos hidroglicólicos e concentrações crescentes de própolis a partir de 5%. O uso das diferentes concentrações do glicol tornou-se necessário em comparação com o extrato alcoólico por serem os glicólicos de grande utilização no mercado farmacêutico, por serem estes menos agressivos que o álcool à pele e mucosas e promoverem aumento no rendimento da extração de substâncias como os flavonóides e taninos (Diemunsh; Mathis, 1980). Aliado a isto, o extrato obtido com glicóis propicia formas farmacêuticas emulsionadas mais estáveis, tornando-se importante este estudo por possibilitar informações que assegurem o sucesso da substituição, com vantagens, do álcool 93,7% (p/p) como líquido extrator no preparo de extratos de própolis.
Na otimização dos extratos foi avaliado, entre outros parâmetros, o pH. Este dado é fundamental no processo de extração, pois é responsável por selecionar e determinar as substâncias a serem extraídas, de acordo com suas características químicas e de polaridade. Atua, ainda, como sensor da estabilidade do medicamento, pois o pH é sinalizador de prováveis alterações químicas que possam estar ocorrendo no meio extrativo. Além disso, o pH ácido evita o ataque de alguns microrganismos contaminantes de medicamentos líquidos.
Conforme a Tabela 2, a faixa de pH variou de 5,46 - 5,82 para os extratos alcoólicos, enquanto que para os glicólicos variou entre 4,86 - 5,03. Através destes valores é possível visualizar a influência das substâncias sobre o pH dos líquidos extratores, os quais apresentam valores de 6,35 e 7,51 para o álcool e propilenoglicol respectivamente. Esta diminuição do pH observada nos extratos com relação ao líquido extrator mostra o caráter ácido das substâncias extraídas.
O perfil obtido para o teor de flavonóides (Tabela 3) mostra variação na faixa entre 0,08 a 1,81% nas diversas condições de extração, apresentando diferenças significantes na diferença entre médias para os extratos A, B, C e D, p < 0,001 e pertencentes à mesma população os extratos E e F, p > 0,05.
Os valores de resíduo seco acompanham o teor de flavonóides totais (Tabela 3). Estudos de Franco & Bueno (1999) mostraram que o valor do resíduo seco deve ser diretamente proporcional à graduação alcoólica, enquanto que o teor de flavonóides segue ordem inversa. Neste estudo, foi fixada a graduação alcoólica em 93,7% (p/p) para os extratos A, B e C que apresentam maiores valores de resíduo seco, sem no entanto apresentarem aumento no teor de flavonóides, principalmente para o extrato C (Tabela 3). Isto se deve, provavelmente, à saturação do líquido extrator e ao fato do álcool dissolver bem mais a resina do que a mistura glicol-água. Para os extratos A e B o teor de flavonóides permaneceu na mesma faixa, demonstrando que a variação da concentração é um fator independente. Já para os extratos glicólicos se observa certa linearidade, pois, de acordo com a diminuição da concentração do propilenoglicol, o teor de flavonóides totais também diminui. Em primeira instância, estes líquidos extratores não seriam recomendados como eficientes para a própolis, devido ao baixo teor de flavonóides obtido. Este fato é perfeitamente explicado, por ser a própolis um material resinoso, insolúvel em água. Os glicóis melhoram a extração das substâncias flavonoídicas em relação à água pura, mas não em comparação ao álcool e suas diluições, quando o material a ser extraído é uma resina. É importante ressaltar que os extratos D, E e F foram preparados com a concentração de própolis que apresentou maior teor de flavonóides.
Em avaliação preliminar dos extratos obtidos em relação aos flavonóides, pode ser observado na Tabela 3 que os extratos glicólicos são bastante seletivos em sua extração (extratos D, E e F). Nestes casos o teor de flavonóides totais foi muito baixo (0,08-0,28%). Além disso, os resultados não foram reprodutíveis (CV% = 8-29%). Essas duas limitações justificaram a exclusão destes extratos dos estudos de susceptibilidade frente às leveduras.
Os extratos de própolis que apresentaram repetibilidade quanto aos parâmetros analisados foram submetidos à avaliação da atividade antifúngica, sendo determinada a concentração inibitória mínima (CIM) de cada extrato sobre uma coleção de leveduras de interesse médico. A onicomicose foi a infecção escolhida para este teste de ação antifúngica por corresponder ao maior desafio quanto à terapêutica de micoses superficiais e cutâneas. A prevalência de onicomicoses é grande em nosso meio (Guilhermetti et al., 2004), o que parece ser uma tendência mundial (Chan et al., 2002; Elewski et al., 2002). Além disso, é significativo o isolamento, a identificação de leveduras entre os agentes de onicomicoses (Dorko et al., 2002). O caráter crônico das lesões e a dificuldade de absorção das drogas disponíveis, aliados ao elevado custo dos antifúngicos clássicos são condições limitantes para o sucesso terapêutico das onicomicoses e justificam a busca de opções mais acessíveis.
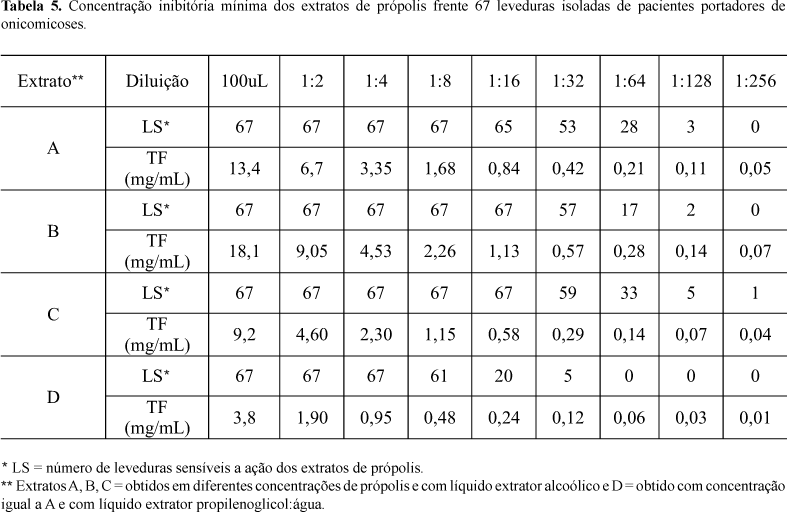
Os resultados obtidos foram promissores, mostrando que a própolis apresenta atividade antifúngica mesmo em quantidades muito pequenas. Observou-se a inibição de uma levedura até a diluição de 1:256 (cerca de 0,04 mg/mL). A atividade antifúngica foi proporcional à concentração de própolis, além disto o teste mostrou que os líquidos extratores não inibiram o crescimento fúngico, sendo assim o extrato C foi o mais eficiente.
A Figura 1 apresenta o perfil cumulativo da ação do extrato de própolis frente a leveduras. A inibição das leveduras ocorreu com todos os extratos testados. No entanto, os extratos B e C foram capazes de inibir a totalidade das 67 leveduras até quando diluídos 1:16 (0,50-1,13 mg/mL). O extrato D obtido com menor concentração de própolis, tendo como líquido extrator o propilenoglicol foi efetivo apenas quando muito concentrado (diluição 1:2), enquanto o extrato A, equivalente na concentração de própolis, mas extraído em etanol, já apresentou a mesma efetividade quando diluído até 1:4 (Tabela 5).
Os extratos preparados com etanol, nas três concentrações, mas principalmente os que apresentaram maior concentração de própolis, apresentaram efetividade com as maiores diluições. Estes resultados estão de acordo com os valores obtidos para o teor de flavonóides totais obtidos nos respectivos extratos (Tabela 3), onde é possível visualizar que a maior efetividade está ligada aos extratos que apresentam maior teor de flavonóides totais.
Considerando-se o intervalo de variação de concentração dos flavonóides totais nos extratos, o extrato C foi o que apresentou maior intervalo de inibição frente as diversas leveduras isoladas de onicomicoses (0,04-0,58mg/mL) e, o extrato B (0,14-1,13 mg/mL), o extrato A (0,11-1,68 mg/mL) e extrato D (0,24-1,9 mg/mL), mostrando, assim, a variação entre eles quanto à inibição antifúngica. Embora sejam muito semelhantes os espectros de ação dos extratos A, B e C, a ação antifúngica do extrato C se diferencia por apresentar eficiência mesmo quando em pequena concentração (0,04 mg/mL - Tabela 5).
Embora o extrato C tenha apresentado a melhor performance frente às leveduras, o extrato B apresenta perfil semelhante (efetividade frente às 67 leveduras testadas na atividade antifúngica) com as vantagens de maior facilidade de produção e menor custo.
Estes dados de CIM (Tabela 5) permitem a determinação da dose mais efetiva frente a diferentes leveduras para os quatro extratos testados. É possível detectar que extratos B e D apresentam comportamento semelhante quanto ao espectro de ação, pois ambos foram capazes de inibir o maior número de leveduras, porém diferiram quanto à diluição mais adequada exigindo assim, maior concentração do extrato D (50% da fórmula) no momento do preparo da formulação.
CONCLUSÃO
Todos os extratos alcoólicos e os glicólicos apresentaram atividade antifúngica, sendo o extrato C (etanólico) o mais eficiente e o extrato D (glicólico) que mostrou menor eficiência.
Com relação ao teor de flavonóides totais, o extrato B apresenta melhor qualidade, seguido do extrato A.
Os parâmetros estabelecidos permitem avaliar a efetividade da extração, demonstrando principalmente, a influência do glicol na seleção de substâncias extraídas.
Recebido em 21/10/06. Aceito em 21/05/07
- Araujo AJG, Bastos OMP, Souza MAJ, Oliveira JC 2003. Onicomicoses por fungos emergentes: análise clínica, diagnóstico laboratorial e revisão. An Bras Dermatol 78: 445-455.
- Burdock GA 1998. Review of the biological properties and toxicity of bee propolis. Food Chem Toxicol 36: 347-363.
- Bruschi ML, Franco SL, Gremião MPD 2003. Applications of a HPLC method in analysis of propolis extract. J Liq Chromatogr Relat Technol 26: 14, 2381-2391.
- Chan MK, Chong LY, + Achilles Project Working Group in Hong Kong. 2002. A prospective epidemiologic survey on the prevalence of foot disease in Hong Kong J Am Pediatr Med Assoc 92: 450-456.
- Cushnie TPT, Lamb AJ 2005. Antimicrobial activity of flavonoids. Int J Antimicrob Agents 26: 343-356.
- De Castro, SL 2001. Propolis: biological and pharmacological activities. Arbs Amn Rev Biomed Sci 3: 49-83.
- Deutsches Arzneibuch 1994. 10. ed. Stuttgart: Deutscher Apotheker.
- Diemunsch A-M, Mathis C 1980. Labo-Pharma- Probémes et Techniques 294: 55-63.
- Dorko E, Jautova J, Tkacikova L, Wantrubova A 2002. The frequency of Candida species in onychomycosis. Folia Microbiol 47: 727-773.
- Elewski BE, Leyden J, Rinaldi MG, Atillasoy E 2002. Office practice-based confirmation of onychomycosis: a US nationwide prospective survey Arch Intern Med 162: 2133-2138.
- Ellabib MS, Agaj M, Khalifa Z, Kavanagh K 2002.Yeasts of genus Candida are the dominant cause of onychomycosis in Libyan women but not men: results of a 2-year surveillance study. Brit J Dermatol 146: 1038-1041.
- Farmacopéia Brasileira 1988. 4. ed., Ed. Atheneu, São Paulo. p.v.2.5., v.2.9., v.2.10, v.2.19.
- Fernandes Jr A, Sugizaki, MF, Fogo ML, Funari SRC, Lopes CAM 1995. In vitro activity of propolis against bacterial and yeast pathogens isolated from human infections. J Venom Anim Toxins 1: 63-69.
- Franco SL, Bruschi ML, Moura LPP, Bueno JH 2000. Caracterização farmacognóstica da própolis da região de Maringá. Rev Bras Farmacogn 9/10: 1-10.
- Franco SL, Bueno JHF 1999. Otimização de processo extrativo de própolis. Infarma 11: 48-51.
- Guilhermetti E, Kioshima ES, Shinobu C, Silva SC, Mota VA, Svidzinski TIE 2004 Medical micology: an emergent subject in clinical analysis. Rev Bras Anal Clin 36: 51-53.
- Kujumgiev A, Tsvetkova I, Serkedijieva Y, Bankova V, Cristov R, Popov S 1999. Antibacterial, antifungal and antiviral activity of propolis of different geographic origin. J Ethnopharmacol 64: 235-240.
- Larone DH 1995. Medically important fungi. A guide to identification, AMS Press, Washington.
- Mello JCP, Petrovick PR 2000. Quality control of Baccharis trimera (Less.) DC. (Asteraceae) hydroalcoholic extracts. Acta Farma Bonaerense 19: 211-215.
- Mercantini R, Marsella R, Moretto D 1996. Onychomycosis in Rome, Italy. Mycopathologia 136: 25-32.
- National Committee for Clinical Laboratory Standards (NCCLS) 1997. Reference Method For Broth Dilution Antifungal Susceptibility Testing Of Yeasts; Approved Standard Villanova, NCCLS, v.17, p. 28. M27- A.
- Nieva Moreno MI, Isla MI, Cudmani NG, Vattuone MA, Sampietro AR 1999. Screening of antibacterial activity of Amaicha del Valle (Tucumán, Argentina) propolis. J Ethnopharmacol 68: 97-102.
- Oliveira ACP, Shinobu CS, Longhini R, Franco SL, Svidizinski TIE 2006. Antifungal activity of propolis extract against yeasts isolated from onychomycosis lesions. Mem I Oswaldo Cruz 101: 493-497.
- Packer JF, Luz MMS 2007. Método para avaliação e pesquisa da atividade antimicrobiana de produtos de origem natural. Rev Bras Farmacogn 17: 102-107.
- Soares AKA, Carmo GC, Quental DP, Nascimento DF, Bezerra FAF, Moraes MO, Moraes MEA 2006. Avaliação da segurança clínica de um fitoterápico contendo Mikania glomerata, Grindelia robusta, Copaifera officinalis, Myroxylon toluifera, Nasturtium officinale, própolis e mel em voluntários saudáveis. Rev Bras Farmacogn 16: 447-454.
- Sonmez S, Kirilmaz L, Yucesoy M, Yücel B, Ylmaz B 2005. The effect of bee propolis on oral pathogens and human gingival fibroblast. J Ethnopharmacol 102: 371-376.
- Sousa JPB, Furtado NAJC, Jorge R, Soares AEE, Bastos JK 2007. Perfis físico-químico e cromatográfico de amostras de própolis produzidas nas microrregiões de Franca (SP) e Passos (MG), Brasil. Rev Bras Farmacogn 17: 85-93.
- Tavares JP, Martins IL, Vieira AS, Lima FAV, Bezerra FAF, Moraes MO, Moraes MEA 2006. Estudo de toxicologia clínica de um fitoterápico a base de associações de plantas, mel e própolis. Rev Bras Farmacogn 16: 350-356.
Datas de Publicação
-
Publicação nesta coleção
11 Out 2007 -
Data do Fascículo
Set 2007
Histórico
-
Aceito
21 Maio 2007 -
Recebido
21 Out 2006