Resumos
O Pasalix® é um produto fitoterápico contendo uma associação de três plantas medicinais: Passiflora incarnata, Salix alba e Crataegus oxyacantha. Sua principal indicação é para o tratamento da ansiedade e insônia. O objetivo desse estudo foi avaliar a toxicologia clínica dessa formulação em voluntários saudáveis. Para isso realizou-se um ensaio clínico não aleatório, aberto, com 24 voluntários sadios do sexo masculino, que receberam ambulatorialmente dois (2) comprimidos revestidos do fitoterápico duas vezes ao dia, durante 28 dias ininterruptos. Os voluntários foram incluídos no estudo somente quando considerados saudáveis após avaliação clínica, exame físico e exames laboratoriais que antecederam o estudo. A avaliação laboratorial incluiu análise hematológica, bioquímica e sorológica. A avaliação clínica e laboratorial foi repetida após a 1ª, 2ª, 3ª e 4ª semanas de tratamento e 7 dias após a última administração. O Pasalix® foi bem tolerado pelos 24 voluntários não apresentando eventos adversos graves. Os exames clínicos, eletrocardiográficos e laboratoriais efetuados antes, durante e após o ensaio não evidenciaram sinais de toxicidade nos diversos órgãos e sistemas avaliados, confirmando a segurança da preparação para utilização em ensaios de eficácia terapêutica.
Passiflora incarnata; Passifloraceae; Salix alba; Salicaceae; Crataegus oxyacantha; Rosaceae; toxicologia clínica
Pasalix® is an herbal medicine containing a combination of three medicinal plants: Passiflora incarnata, Salix alba and Crataegus oxyacantha. Its main indication is to treat anxiety and insomnia. The purpose of this study was to evaluate the clinical toxicology of that formulation in healthy volunteers. For this, a non-randomized open clinical trial was conducted with 24 healthy male volunteers, who received two (2) coated tablets of the herbal medicine twice a day for 28 uninterrupted days. The volunteers were included in the study only when considered healthy after clinical assessment, physical examination and laboratory tests which preceded the study. The laboratory tests included: hematological, biochemical and serological analysis. The clinical and laboratory evaluation was repeated after the 1st, 2nd, 3rd and 4th weeks of the treatment and 7 days after the last administration. Pasalix® was well tolerated by the 24 volunteers, and it has showed no serious adverse events. The clinical, laboratory, and electrocardiographic data assessed before, during and after the test showed no signals of toxicity in various organs and systems evaluated, confirming the safety of the preparation for use in trials of therapeutic efficacy.
Passiflora incarnata; Passifloraceae; Salix alba; Salicaceae; Crataegus oxyacantha; Rosaceae; clinical toxicology
ARTIGO
Estudo de toxicologia clínica de um fitoterápico contendo Passiflora incarnata L., Crataegus oxyacantha L., Salix alba L. em voluntários saudáveis
Clinical toxicology study of an herbal medicine with Passiflora incarnata L., Crataegus oxyacantha L., Salix alba L. in healthy volunteers
Demétrius F. Nascimento; Ana Paula M. Santana; Ismenia O. Leite; Fernando André C. Viana; Ana Lourdes A. e Silva Leite; Renata A. de Moraes; Francisco Vagnaldo F. Jamacaru; Fernando Antônio. F. Bezerra; Manoel Odorico de Moraes; Maria Elisabete. A. de Moraes* * E-mail: betemora@ufc.br, Tel. +55-85-3223-2600, 3366-8346, Fax +55-85-3223-2903
Unidade de Farmacologia Clínica, Departamento de Fisiologia e Farmacologia, Universidade Federal do Ceará, Rua Cel. Nunes de Melo 1127, Rodolfo Teófilo, 60430-270 Fortaleza-CE, Brasil
RESUMO
O Pasalix® é um produto fitoterápico contendo uma associação de três plantas medicinais: Passiflora incarnata, Salix alba e Crataegus oxyacantha. Sua principal indicação é para o tratamento da ansiedade e insônia. O objetivo desse estudo foi avaliar a toxicologia clínica dessa formulação em voluntários saudáveis. Para isso realizou-se um ensaio clínico não aleatório, aberto, com 24 voluntários sadios do sexo masculino, que receberam ambulatorialmente dois (2) comprimidos revestidos do fitoterápico duas vezes ao dia, durante 28 dias ininterruptos. Os voluntários foram incluídos no estudo somente quando considerados saudáveis após avaliação clínica, exame físico e exames laboratoriais que antecederam o estudo. A avaliação laboratorial incluiu análise hematológica, bioquímica e sorológica. A avaliação clínica e laboratorial foi repetida após a 1ª, 2ª, 3ª e 4ª semanas de tratamento e 7 dias após a última administração. O Pasalix® foi bem tolerado pelos 24 voluntários não apresentando eventos adversos graves. Os exames clínicos, eletrocardiográficos e laboratoriais efetuados antes, durante e após o ensaio não evidenciaram sinais de toxicidade nos diversos órgãos e sistemas avaliados, confirmando a segurança da preparação para utilização em ensaios de eficácia terapêutica.
Unitermos: Passiflora incarnata, Passifloraceae, Salix alba, Salicaceae, Crataegus oxyacantha, Rosaceae, toxicologia clínica.
ABSTRACT
Pasalix® is an herbal medicine containing a combination of three medicinal plants: Passiflora incarnata, Salix alba and Crataegus oxyacantha. Its main indication is to treat anxiety and insomnia. The purpose of this study was to evaluate the clinical toxicology of that formulation in healthy volunteers. For this, a non-randomized open clinical trial was conducted with 24 healthy male volunteers, who received two (2) coated tablets of the herbal medicine twice a day for 28 uninterrupted days. The volunteers were included in the study only when considered healthy after clinical assessment, physical examination and laboratory tests which preceded the study. The laboratory tests included: hematological, biochemical and serological analysis. The clinical and laboratory evaluation was repeated after the 1st, 2nd, 3rd and 4th weeks of the treatment and 7 days after the last administration. Pasalix® was well tolerated by the 24 volunteers, and it has showed no serious adverse events. The clinical, laboratory, and electrocardiographic data assessed before, during and after the test showed no signals of toxicity in various organs and systems evaluated, confirming the safety of the preparation for use in trials of therapeutic efficacy.
Keywords: Passiflora incarnata, Passifloraceae, Salix alba, Salicaceae, Crataegus oxyacantha, Rosaceae, clinical toxicology.
INTRODUÇÃO
O fitoterápico Pasalix® é utilizado no tratamento da ansiedade e insônia. Pasalix® tem na sua composição as seguintes plantas medicinais: Passiflora incarnata (Passifloraceae), Salix alba (Salicaceae) e Crataegus oxyacantha (Rosaceae).
Passiflora incarnata, popularmente conhecida como maracujá-vermelho tem informações etnofarmacológicas que lhe atribuem às propriedades sedativas, antiespasmódicas e ansioliticas (Bergner, 1995; Newall et al., 1996; Speroni & Minghetti, 1988; Dhawan et al., 2001a; Dhawan et al., 2004; Sousa et al., 2008). Suas aplicações clínicas no mundo inteiro são evidentes pelo fato da P. incarnata ser uma planta oficial na British Herbal Pharmacopoeia 1983, Homoeopathic Pharmacopoeia da Índia 1974, United States Homoeopathic Pharmacopoeia 1981, Pharmacopoeia Helvetica 1987 e nas farmacopéias do Egito, França, Alemanha e Suíça (Dhawan et al., 2001b). Os flavonóides são relatados como sendo os fito-constituintes mais abundantes encontrados nessa espécie (Raffaelli et al., 1997). Passiflora incarnata é usada em diversas preparações farmacêuticas, em combinação com outras drogas (Tankanow et al., 2003).
Hawthorn ou Crataegus oxyacantha é uma planta usada para tratar distúrbios cardiovasculares, incluindo insuficiência cardíaca, angina pectoris, e hipertensão (Long et al., 2006). Além de suas reconhecidas propriedades como estimulante cardíaco e agente hipotensor, outras atividades descritas na literatura para C. oxyacantha são: atividade hipolipidêmica, antioxidante, antiinflamatória, digestiva e sedativa (Rigelsky & Sweet, 2002). Amplos estudos farmacológicos têm documentado que os princípios determinantes para a sua ação são as procianidinas e os flavonóides (Hostanska et al., 2007).
Salix spp., principalmente o salgueiro branco (Salix alba) é conhecida pelas suas propriedades analgésicas, antipiréticas e antiinflamatórias (Walsh, 2002; Vane, 2000; Schmid et al., 2001). As propriedades farmacológicas atribuídas a esta planta são decorrentes de sua substância ativa, salicina (pró-droga), que quando metabolizada da origem aos ácidos gentísico, saliciúrico e salicílico (principal metabólito) (Arathi & Leonard, 2005).
Apesar dessas plantas serem bastante usadas pela população não há nenhum registro clínico de eficácia e segurança com uma formulação composta pela associação Passiflora incarnata, Salix alba e Crataegus oxyacantha. De acordo com o Food and Drug Administration (FDA) e a Agencia Nacional de Vigilância Sanitária (ANVISA), a primeira etapa de experimentação de medicamentos em seres humanos, se inicia por questões éticas, pela avaliação da segurança em uma amostra de voluntários saudáveis para depois verificar a sua eficácia. O objetivo do presente estudo foi avaliar a toxicologia clínica dessa formulação em vários órgãos e sistemas. Para tanto, procuramos identificar possíveis eventos adversos e avaliar alterações laboratoriais, de significado clínico, que denotassem comprometimento das funções hematológica, metabólica, renal, hepática e cardiovascular em voluntários adultos sadios de ambos os sexos.
MATERIAL E MÉTODOS
Desenho experimental
O desenho consistiu de um estudo aberto, não randomizado, com 24 voluntários sadios, adultos, do sexo masculino com idade média de 27 (SD ± 7,69) e peso médio de 72,61 (SD ± 11,98). Nesse estudo, cada voluntário atuou como o seu próprio controle, uma vez que seus próprios dados coletados no período de pré-estudo seriam comparados com os obtidos durante e após o tratamento.
Seleção de voluntários
No período que precedeu o estudo (pré-estudo), os voluntários, que deveriam ter idade entre 18 e 50 anos, foram submetidos a exames clínico e complementares para atestar seu estado de higidez, avaliando-se suas funções hepática, renal e cardiorespiratória.
Do exame clínico constou história médica e familiar, exame físico, aferição dos sinais vitais e cálculo do índice de massa corpórea (IMC), compulsoriamente entre 19 e 30 kg/m2. Também foram realizados eletrocardiograma (ECG) e uma extensa avaliação laboratorial que incluía análises hematológica, bioquímica e sorológica (Moraes et al., 2004). A mesma avaliação, executando-se os testes sorológicos, foi repetida após a primeira, segunda, terceira, quarta semana de tratamento e 7 dias após o término do estudo.
Constaram dos exames laboratoriais: a análise hematológica através da contagem da hemoglobina, hematócrito, contagem total e diferencial de leucócitos e contagem de plaquetas; análise bioquímica através do sódio, potássio, creatinina, bilirrubina, proteínas totais, albumina, glicemia, fosfatase alcalina, AST, ALT, colesterol total, triglicérides, ácido úrico, γGT e sumário de urina. A análise sorológica para hepatite B, hepatite C, HIV, e β-HCG foram realizados somente no pré-estudo.
Foram excluídos do estudo voluntários com história de doença hepática, renal, cardíaca, epilética, com hipo ou hipertensão de qualquer etiologia que necessitasse de tratamento farmacológico; tem história ou teve infarto do miocárdio, angina e/ou insuficiência cardíaca. Além daqueles que antes do estudo, fizeram uso de medicação regular por até duas semanas, ingestão de droga experimental por até seis meses, doação ou perda de 450 mL de sangue ou mais até três meses antes do estudo, abuso de álcool ou drogas e internação hospitalar até oito semanas antes do início do estudo.
Composição do fitoterápico
Cada comprimido de Pasalix contém em sua composição 100 mg de extrato seco de Salix alba, 30 mg de extrato seco de Crataegus oxyacantha e 100 mg Passiflora incarnata.
Administração do fitoterápico
Os voluntários compareceram diariamente a Unidade de Farmacologia Clínica (UNIFAC) da Universidade Federal do Ceará (UFC), onde a medicação foi administrada por um dos investigadores. Os voluntários receberam 2 comprimidos revestidos de Pasalix®, (lote 0052, fabricado pela Marjan Indústria e Comércio Ltda) por via oral, duas vezes ao dia (manhã e tarde), juntamente com um copo de água (200 mL), durante 28 dias ininterruptamente. Os horários de administração, sinais vitais (pressão arterial e pulso), bem como todas intercorrências ocorridas durante o estudo, foram devidamente registradas nos Formulários de Relato de Caso (CRF). Os voluntários permaneceram em suas atividades rotineiras, e mantiveram as suas dietas gerais normais.
Aspectos éticos
O projeto de pesquisa, com o protocolo experimental e o "Termo de Consentimento Livre e Esclarecido", foram submetidos e aprovados pelo Comitê de Ética em Pesquisa da UFC, credenciado pelo CONEP - Conselho Nacional de Saúde/MS.
O Estudo foi conduzido de acordo com a Declaração de Helsinki (1965) e suas revisões, e a Resolução 196/96 do CNS-MS.
Todos os voluntários receberam explicações sobre a natureza e os objetivos do estudo. Após terem suas dúvidas esclarecidas, os voluntários assinaram o Termo de Consentimento Livre e Esclarecido.
Eventos adversos
Os voluntários foram orientados a relatarem qualquer evento adverso, à hora de ocorrência e o uso de medicação concomitante. Os eventos adversos relatados durante o ensaio clínico foram documentados pelo investigador no (CRF) e estes foram classificados quanto à intensidade como leve, moderado e severo. Quanto à relação de causalidade, foram utilizados os seguintes critérios: não relacionada, desconhecida, possível ou sim (Mant & Spector, 1994).
Análise estatística
O tratamento estatístico dos dados foi feito por meio da Análise de Variância (ANOVA) seguido do teste de Dunnett (p < 0,05), utilizando-se Microsoft Excel Version 7.0 e Graph Pad Prism Version 3.02. Os dados obtidos inicialmente (Pré-Estudo) foram comparados com aqueles obtidos durante e após o término do ensaio (Pós-Estudo).
RESULTADOS
Foram selecionados 24 voluntários saudáveis do sexo masculino com idade média de 27 ± 7,69 anos. Os voluntários selecionados apresentaram IMC de 25,18 ± 3,90 kg/m2 não havendo diferenças significativas no pós-estudo (p = 0,87).
A formulação foi bem tolerada por todos os voluntários, porém alguns eventos adversos foram relatados. Destes, apenas os eventos adversos sonolência e epigastralgia estão relacionados com o uso do Pasalix® como evidenciado pela avaliação clínica. O evento adverso mais relatado foi sonolência, seguida de cefaléia, febre/mialgia, epigastralgia, insônia, adinamia, Rash cutâneo, dor torácica e agitação (Tabela 1).
O uso de medicamento adicional somente foi necessário nos voluntários que apresentaram cefaléia, quadro viral, febre/mialgia, onde se utilizou Paracetamol e Tylenol®, e no rash cutâneo de um voluntário que utilizou Claritin® (cada voluntário fez uso de uma única medicação para o tratamento dos eventos adversos citados). Medicações para tratamento de reações adversas foram permitidas uma vez que os eventos eram leves e não exigiam a retirada do voluntário do estudo nem a interrupção do tratamento com o fitoterápico.
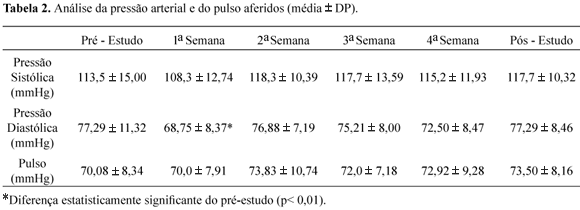
Os valores, para pulso e pressão sistólica, não variaram durante o período do ensaio clínico. A pressão diastólica, no entanto, decresceu na primeira semana do estudo (Tabela 2).
Os exames laboratoriais, eletrocardiograma e exames médicos encontravam-se em geral, dentro dos limites de normalidade durante cada semana de administração (Figuras 1-3). Não foram observadas variações estatisticamente significantes quando se comparou a avaliação durante a administração com o período basal dos voluntários (p > 0,05) como observado na Tabela 3.
DISCUSSÃO
A fitoterapia se constitui, quando cientificamente orientada, em valioso recurso terapêutico que alia as vantagens de eficácia, baixo custo e simplicidade de uso. Portanto, o uso popular, e mesmo tradicional, não são suficientes para validar eticamente os fitoterápicos como medicamentos eficazes e seguros (Marliére et al., 2008; Silveira et al., 2008).
A avaliação da relação risco/benefício é a finalidade dos estudos pré-clínicos e clínicos de medicamentos. Nesse sentido, este estudo avaliou a possível natureza tóxica dos comprimidos de Pasalix® quando administrado em voluntários sadios. A avaliação desta possível toxicidade deu-se através da realização de parâmetros laboratoriais hematológicos, hepáticos, renais e metabólicos.
As doses empregadas em estudos de fase I são administradas de forma crescente até atingir as doses terapêuticas (Mant & Spector, 1994). Em geral inicia-se com uma dose correspondente de 1 a 2% da dose que induz os primeiros sintomas ou sinais de toxicidade nas espécies animais mais sensíveis, posteriormente todo o processo é repetido em doses superiores, não existindo padrões para essa elevação (Oliveira, 2002). Neste caso, por se tratar de um fitoterápico de uso tradicional já utilizado pela população, resolvemos adotar a dose máxima diária indicada pelo fabricante da formulação que correspondia a 4 comprimidos ao dia.
A análise dos exames laboratoriais comparados ao período antes do tratamento (Figuras 1-3) não mostrou significância estatística que apontasse toxicidade nos diversos órgãos e sistemas avaliados. As variações dos exames laboratoriais observadas nas avaliações semanais apresentaram-se dentro da faixa de normalidade para cada parâmetro, tampouco apresentaram sinais de toxicidade de acordo com a Organização Mundial de Saúde (Soares et al., 2002, WHO, 2003).
Durante a realização do ensaio clínico, eventos adversos foram relatados (Tabela 1). De todos os eventos relatados, os que foram associados ao uso da medicação foram sonolência (47,76%) e epigastralgia (4,16%). Para Passiflora incarnata, a disponibilidade de informações sobre sua toxicidade é limitada e apoiada no seu uso bem estabelecido na medicina tradicional. Apesar dessa relativa escassez (Fisher et al., 2000) há um relato de eventos adversos cardiovasculares e gastrintestinais após seu uso em doses terapêuticas por uma mulher jovem, os quais poderiam estar relacionados aos alcalóides e flavonóides presentes na formulação. A sonolência encontrada na nossa pesquisa corrobora com seu efeito terapêutico (Della Loggia et al., 1981; Sopranzi et al., 1990; Capasso & Sorrentino, 2005). Sintomas gastrintestinais também podem estar associados à Crataegus oxyacantha em doses terapêuticas (Chang, 2005). Além disso, os componentes salicílicos contidos na Salix alba também estão associados a sintomas gastrintestinais devido sua ação inibitória sobre a cascata bioquímica do ácido araquidônico (Wurm et al., 1982).
Chang (2005) relata, também, que agitação e rash cutâneo e cefaléia também podem estar relacionados ao uso do extrato desta planta. Porém os episódios de cefaléia, febre/mialgia provavelmente estavam associados ao quadro viral relatado pelos voluntários.
Os valores, para pulso radial e pressão sistólica não variaram. A pressão diastólica, no entanto, decresceu na primeira semana do ensaio clínico (Tabela 2). Sabe-se que variações na pressão arterial podem ser fisiológicas e ocorrer de acordo com o estado de movimento/repouso, estresse e condições nutricionais; logo, a alteração ocorrida pode não ser devida ao uso do fitoterápico. Entretanto, estudos farmacológicos pré-clínicos relatam a atividade vasodilatadora do extrato de Hawthorn induzida pela estimulação de produção de óxido nítrico (Chen et al.,1998; Kim et al., 2000; Veveris et al., 2004). Além disso, os valores obtidos estiveram dentro da faixa de normalidade proposta para o estudo, assim como aqueles obtidos para o pulso radial.
Os eventos adversos relatados foram classificados quanto à intensidade como leves, por serem facilmente tolerados e por não interferirem nas atividades rotineiras dos voluntários. Os resultados alcançados neste estudo clínico mesmo se mostrando seguros não garantem ausência de reações adversas da formulação testada, especialmente aquelas de baixa incidência que somente seriam observadas após utilização por centenas ou milhares de pacientes. A detecção de reações adversas deverá continuar sendo monitorada no período pós-comercialização pelos programas de farmacovigilância (Ferreira, 2002; Moraes & Moraes, 2000; Alexandre et al., 2008a,b).
Conclui-se, portanto, que a administração dos comprimidos de Pasalix® duas vezes ao dia durante 28 dias consecutivos não evidenciaram sinais de toxicidade nos diversos órgãos e sistemas avaliados de acordo com os exames clínicos, eletrocardiográficos e laboratoriais. Estes resultados permitem a realização de novos estudos para avaliação de suas indicações terapêuticas e ajuste posológico.
Recebido 20 Novembro 2008; Aceito 17 Fevereiro 2009
- Alexandre RF, Bagatini F, Simões CMO 2008a. Interações entre fármacos e medicamentos fitoterápicos à base de ginkgo ou ginseng. Rev Bras Farmacogn 18: 117-126.
- Alexandre RF, Bagatini F, Simões CMO 2008b. Potenciais interações entre fármacos e produtos à base de valeriana ou alho. Rev Bras Farmacogn 18: 455-463.
- Arathi S, Leonard S 2005. Herbal Medications commonly used in the practice of rheumatology: Mechanisms of action, efficacy, and side effects. Semin Arthritis Rheu 34: 773-784.
- Bergner P 1995. Passionflower. Medical Herbalism 7: 13-14.
- Capasso A, Sorrentino L 2005. Pharmacological studies on the sedative and hypnotic effect of Kava kava and Passiflora extracts combination. Phytomedicine 12: 39-45.
- Chang W-T, Dao J, Shao Z-H 2005. Hawthorn: Potential roles in cardiovascular disease. Am J Chin Med 33: 1-10.
- Chen ZY, Zhang ZS, Kwan KY, Zhu M, Ho WK, Huang Y 1998. Endothelium-dependent relaxation induced by hawthorn extract in rat mesenteric artery. Life Sci 63: 1983-1991.
- Della Loggia R, Tubaro A, Redaelli C 1981. Effects of some plant extracts, singly and in combination, on the CNS in mice. Riv Neurol 5 1: 297-310.
- Dhawan K, Kumar S, Sharma A 2001a. Anti-anxiety studies on extracts of Passiflora incarnata Linneaus. J Ethnopharmacol 78: 165-170.
- Dhawan K, Kumar S, Sharma A 2001b. Anxiolytic activity of aerial and underground parts of Passiflora incarnata. Fitoterapia 72: 922-926.
- Dhawan K, Dhawan S, Sharma A 2004. Passiflora: a review update. J Ethnopharmacol 94: 1-23.
- Ferreira EI 2002. Como nascem e se desenvolvem os novos medicamentos. In: Silva P. Farmacologia. 6.ed. Rio de Janeiro: Guanabara Koogan, p.200-208.
- Fisher AA, Purcell P, Le Couteur DG 2000. Toxicity of Passiflora incarnata L. Clin Toxicol 38: 63-66.
- Hostanska K, Jürgenliemk G, Abel G, Nahrstedt A, Saller R 2007. Willow bark extract (BNO1455) and its fractions suppress growth and induce apoptosis in human colon and lung cancer cells. Cancer Detect Prev31: 129-139.
- Kim SH, Kang KW, Kim KW, Kim ND 2000. Procyanidins in Crataegus extract evoke endotheliumdependent vasorelaxation in rat aorta. Life Sci 67: 121-131.
- Long SR, Carey RA, Crofoot KM, Proteau PJ, Filtz TM 2006. Effect of hawthorn (Crataegus oxycantha) crude extract and chromatographic fractions on multiple activities in a cultured cardiomyocyte assay. Phytomedicine 13: 643-650.
- Mant TGK, Spector RG 1994. Phase 1 studies and pharmacokinetics. In: Lloyd J., Raven A. Handbook of clinical research 2nd. ed. New York: Churchill Livingstone.
- Marliére LDP, Ribeiro AQ, Brandão MGL, Klein CH, Acurcio FA 2008. Utilização de fitoterápicos por idosos: resultados de um inquérito domiciliar em Belo Horizonte (MG), Brasil. Rev Bras Farmacogn 18 (Supl.): 754-760.
- Moraes MEA, Moraes MO 2000. Ensaios clínicos de medicamentos no Brasil. Fármacos & Medicamentos 6: 36-40.
- Moraes MO, Bezerra FAF, Lotufo LC, Pessoa C, Moraes MEA 2004. Avaliação clínica da eficácia e segurança de fitoterápicos no Brasil. Arq Bras Fitomed Cient 1: 30-39.
- Newall CA, Anderson LA, Phillipson JD 1996. Herbal Medicines. A Guide for Health Care Professionals. London: The Pharmaceuticals.
- Oliveira GG 2002. Os ensaios clínicos. In: Silva, P. Farmacologia. 6.ed. Rio de Janeiro: Guanabara Koogan. p. 146-55.
- Raffaelli A, Moneti G, Mercati G, Toja E 1997. Mass spectrometric characterization of flavonoids in extracts from Passiflora incarnata. J Chromatogr A 777:223-231.
- Rigelsky JM, Sweet BV 2002. Hawthorn: pharmacology and therapeutic uses. Am J Health Syst Pharm 59: 417-422.
- Schmid B, Kotter I, Heide L 2001. Pharmacokinetics of salicin after oral administration of a standardized willow bark extract. Eur J Clin Pharmacol 57: 387-391.
- Silveira PF, Bandeira MAM, Arrais PSD 2008. Farmacovigilância e reações adversas às plantas medicinais e fitoterápicos: uma realidade. Rev Bras Farmacogn 18: 618-626.
- Soares JLMF, Pasqualotto AC, Rosa DD, Leite VRS 2002. Métodos diagnósticos. Porto Alegre: Artmed.
- Sopranzi N, De Feo G, Mazzanti G, Tolu L 1990. Biological and electroencephalographic parameters in rats in relation to Passiflora incarnata L. Clin Ther 132: 329-333.
- Sousa FCF, Melo CTV, Citó MCO, Félix FHC, Vasconcelos SMM, Fonteles MMF, Barbosa-Filho JM, Viana GSB 2008. Plantas medicinais e seus constituintes bioativos: Uma revisão da bioatividade e potenciais benefícios nos distúrbios da ansiedade em modelos animais. Rev Bras Farmacogn 18: 642-654.
- Speroni E, Minghetti A 1988. Neuropharmacological activity of extracts from Passiflora incarnata. Planta Med 54: 488-491.
- Tankanow R, Tamer HR, Streetman DS, Smith SG, Welton JL, Annesley T, Aaronson KD, Bleske BE 2003. Interaction Study between digoxin and a preparation of hawthorn (Crataegus oxyacantha). J Clin Pharmacol 43: 637-642.
- Vane JR 2000. The fight against rheumatism: from willow bark to COX-1 sparing drugs. Physiol Pharmacol 51: 573-586.
- Veveris M, Koch E, Chatterjee SS 2004. Crataegus special extract WS 1442 improves cardiac function and reduces infarct size in a rat model of prolonged coronary ischemia and reperfusion. Life Sci 74: 1945-1955.
- Walsh N 2002. Willow bark extract for chronic pain. Rheumatol News 1: 21.
- WHO 2003. World Health Organization. Toxicity criteria by grade. [http://www.accessdata.fda.gov/scripts/onctools/whotox.cfm] Acesso em 15/07/2003.
- Wurm G, Baumann J, Gere U 1982. Beeinflussung des arachidonsäurestoffwechsels durch flavonoide. Dtsch Apotheker Zt 122: 2062-2068.
Datas de Publicação
-
Publicação nesta coleção
18 Ago 2009 -
Data do Fascículo
Mar 2009
Histórico
-
Recebido
20 Nov 2008 -
Aceito
17 Fev 2009