Resumos
Tem sido atribuído ao flavonóide kaempferitrina e ao alcalóide galegina efeito hipoglicêmico. Folha de Pterogyne nitens, por conter tais compostos, poderia ser antidiabética. Assim, avaliamos o efeito do tratamento com Pterogyne nitens a ratos diabéticos sobre níveis glicêmicos e parâmetros fisiológicos. Ratos diabéticos (50 mg estreptozotocina/Kg peso) foram tratados durante 32 dias, 2 vezes ao dia, por gavagem com extrato etanólico de folhas de Pterogyne nitens (76 mg/0,5 mL glicerina 10% por rato) (DTPn). Grupos diabéticos controles foram tratados com: glicerina 10% (0,5 mL) (DTG), insulina (2,5 U/0,3 mL) (DTI) e água (0,5 mL) (DTA). Semanalmente determinamos: peso corporal, ingestão hídrica e alimentar, volume urinário e nível glicêmico. Os resultados dos grupos DTPn, DTG e DTA foram diferentes do DTI para todos os parâmetros, ocorrendo ganho de peso corporal e redução dos demais parâmetros no DTI. O grupo DTPn apresentou resultados semelhantes aos DTG e DTA. Através dos resultados apresentados no grupo DTI, constatamos que o modelo de estudo foi adequado. Também concluímos que o extrato vegetal e a glicerina não melhoraram e nem exacerbaram o quadro diabético. Resta a possibilidade da planta promover melhoria do diabetes com diferente: dose do extrato, via de administração ou severidade do diabetes induzido.
Planta antidiabética; ratos diabéticos; ingestão hídrica e alimentar; volume urinário; glicemia
Kaempferitrin (a flavonoid) and galegin (an alkaloid) have been indicated as hypoglycemic agents. Leaves of Pterogyne nitens, which contain both compounds, might be antidiabetic. We therefore treated diabetic rats with these leaves to observe the effects on their glycemia and physiological variables. Streptozotocin-diabetic rats were given ethanolic extract of the leaves (76 mg in 0.5 mL 10% glycerol) (DTPn), twice a day by gavage for 32 days. Diabetic controls were given 0.5 mL 10% glycerol (DTG), insulin (2.5 U in 0.3 mL) (DTI) or 0.5 mL water (DTA). During this treatment, we measured level of glycemia, the body weight, daily food and water intake and urine volume, once each week. The results for the DTPn, DTG and DTA groups all differed significantly from these for the DTI group. The latter exhibited greater body weights and lower physiological variables and glycemia than the groups DTPn, DTG and DTA, all of which gave similar results. From the data for DTI rats, we conclude that the study model was appropriate. Therefore, the plant extract (plus glycerol) neither improved nor worsened the diabetic state of the rats. It is possible that this plant might ameliorate diabetes experimental if the dose of extract, treatment route or severity of induced diabetes were altered.
Antidiabetic plant; diabetic rats; liquid and food intake; urinary volume; plasma glucose
ARTIGO
Tratamento crônico com extrato alcoólico de Pterogyne nitens não melhora parâmetros clássicos do diabetes experimental
Continuous treatment with alcohol extract from Pterogyne nitens leaves does not alter typical variables of experimental diabetes
Aline de SouzaI; Regina C. VendraminiI; Iguatemy L. BrunettiI; Luis O. RegasiniII; Vanderlan S. BolzaniII; Dulce H. S. SilvaII; Maria T. PepatoI, * * E-mail: pepatomt@fcfar.unesp.br, Tel. +55-16-3301-6546, Fax +55-16-3301-6559
IDepartamento de Análises Clínicas, Faculdade de Ciências Farmacêuticas, UNESP, 14801-902 Araraquara-SP, Brasil
IIDepartamento de Química Orgânica, Instituto de Química, UNESP, 14800-900 Araraquara-SP, Brasil
RESUMO
Tem sido atribuído ao flavonóide kaempferitrina e ao alcalóide galegina efeito hipoglicêmico. Folha de Pterogyne nitens, por conter tais compostos, poderia ser antidiabética. Assim, avaliamos o efeito do tratamento com Pterogyne nitens a ratos diabéticos sobre níveis glicêmicos e parâmetros fisiológicos. Ratos diabéticos (50 mg estreptozotocina/Kg peso) foram tratados durante 32 dias, 2 vezes ao dia, por gavagem com extrato etanólico de folhas de Pterogyne nitens (76 mg/0,5 mL glicerina 10% por rato) (DTPn). Grupos diabéticos controles foram tratados com: glicerina 10% (0,5 mL) (DTG), insulina (2,5 U/0,3 mL) (DTI) e água (0,5 mL) (DTA). Semanalmente determinamos: peso corporal, ingestão hídrica e alimentar, volume urinário e nível glicêmico. Os resultados dos grupos DTPn, DTG e DTA foram diferentes do DTI para todos os parâmetros, ocorrendo ganho de peso corporal e redução dos demais parâmetros no DTI. O grupo DTPn apresentou resultados semelhantes aos DTG e DTA. Através dos resultados apresentados no grupo DTI, constatamos que o modelo de estudo foi adequado. Também concluímos que o extrato vegetal e a glicerina não melhoraram e nem exacerbaram o quadro diabético. Resta a possibilidade da planta promover melhoria do diabetes com diferente: dose do extrato, via de administração ou severidade do diabetes induzido.
Unitermos: Planta antidiabética, ratos diabéticos, ingestão hídrica e alimentar, volume urinário, glicemia.
ABSTRACT
Kaempferitrin (a flavonoid) and galegin (an alkaloid) have been indicated as hypoglycemic agents. Leaves of Pterogyne nitens, which contain both compounds, might be antidiabetic. We therefore treated diabetic rats with these leaves to observe the effects on their glycemia and physiological variables. Streptozotocin-diabetic rats were given ethanolic extract of the leaves (76 mg in 0.5 mL 10% glycerol) (DTPn), twice a day by gavage for 32 days. Diabetic controls were given 0.5 mL 10% glycerol (DTG), insulin (2.5 U in 0.3 mL) (DTI) or 0.5 mL water (DTA). During this treatment, we measured level of glycemia, the body weight, daily food and water intake and urine volume, once each week. The results for the DTPn, DTG and DTA groups all differed significantly from these for the DTI group. The latter exhibited greater body weights and lower physiological variables and glycemia than the groups DTPn, DTG and DTA, all of which gave similar results. From the data for DTI rats, we conclude that the study model was appropriate. Therefore, the plant extract (plus glycerol) neither improved nor worsened the diabetic state of the rats. It is possible that this plant might ameliorate diabetes experimental if the dose of extract, treatment route or severity of induced diabetes were altered.
Keywords: Antidiabetic plant, diabetic rats, liquid and food intake, urinary volume, plasma glucose.
INTRODUÇÃO
A síndrome clínica Diabetes mellitus é um quadro de doenças metabólicas caracterizado por hiperglicemia, sendo esta resultante de defeitos na secreção e/ou ação da insulina. Esta síndrome provoca alterações de vias dos metabolismos de carboidratos, lipídeos e proteínas, bem como de eletrólitos e água. Tais alterações apresentam como conseqüências, tanto em humanos como em animal experimental: perda de peso, apesar da grande ingestão alimentar, aumento do volume urinário e de ingestão hídrica, hiperglicemia, glicosúria e elevação de uréia urinária (Sacks, 2006).
Neste sentido, temos desenvolvido vários estudos, em ratos diabéticos para a avaliação dos efeito do tratamento crônico com algumas plantas popularmente tidas como hipoglicemiantes, verificando seus efeitos sobre diversos parâmetros alterados no Diabetes mellitus (Pepato et al., 1993, 2001, 2002, 2003, 2004, 2005; Brunetti et al., 2006).
A espécie Pterogyne nitens, popularmente conhecida como "amendoim", "amendoim-bravo", "tipá", "viraró", "bálsamo", etc, pertence à família Leguminosae-Fabaceae e é a única espécie do gênero Pterogyne (Corral et al., 1969). Esta planta apresenta valor ornamental, bem como também tem grande emprego nas construções civil e naval. No entanto, nenhum dado da literatura evidenciou características etnofarmacológicas desta espécie (Carvalho, 1994).
Recentemente, nossos estudos químicos de Pterogyne nitens, permitiram a descrição de novos compostos presentes nas folhas deste vegetal (Fernandes et al. 2008; Ferreira et al., 2009; Regasini et al., 2007, 2008a, 2008b). Dentre estes, foram isolados um alcalóide guanidínico (galegina) (Regasini et al., 2009), além de um flavonol diglicosilado (kaempferitrina) (Regasini et al., 2008c).
É conhecido que o composto kaempferitrina comporta-se como constituinte majoritário da fração n-butanólica das folhas de Bauhinia forficata (Leguminosae), sendo proposto que esse seja um dos constituintes responsáveis pela ação hipoglicemiante desta leguminosa (Souza et al., 2004). Já estudos com humanos e em modelos animais com a galegina, isolada de Galega officinalis, indicaram um pronunciado efeito hipoglicemiante desse alcalóide (Reuter, 1963; Benigni et al., 1964). A importância da galegina não somente restringe-se a fitoterapia, mas também ao desenvolvimento de fármacos, uma vez que esta serviu de modelo estrutural para a descoberta e desenvolvimento dos hipoglicemiantes orais da classe das biguanidas (Bailey & Day, 2004).
Considerando: i) o potencial terapêutico apresentado pelos compostos de origem natural kaempferitrina e galegina, ii) as quantidades apreciáveis encontradas desses compostos no extrato bruto (extrato etanólico) das folhas de Pterogyne nitens, iii) a possibilidade da junção de kaempferitrina/galegina em um único extrato poder culminar em um efeito hipoglicemiante potencializado, julgamos interessante a avaliação deste vegetal no diabetes experimental.
MATERIAL E MÉTODOS
Coleta e identificação do material botânico
As folhas de Pterogyne nitens foram coletadas no Instituto Botânico, São Paulo -SP, Brasil, pela Dra. Maria Cláudia Marx Young, na primeira quinzena do mês de maio de 2003. O material botânico foi identificado e autenticado pela Dra. Inês Cordeiro do mesmo Instituto, no qual foi depositada uma exsicata sob o número SP 56-749.
Preparo do extrato bruto
As folhas de Pterogyne nitens foram secas à temperatura ambiente e, finamente pulverizadas em moinho de facas. O pó obtido foi submetido à maceração em hexano, a fim de eliminar os constituintes de baixa polaridade (ácidos graxos e terpenos). A torta obtida foi submetida a remaceração em etanol até exaustão.
Preparo da solução de Pterogyne nitens
Setecentos e sessenta mg de extrato de Pterogyne nitens foram adicionados a 5 mL de solução aquosa de glicerina a 10% e levada ao sonicador (Banho Maria de ultra-som 27 ºC) por 25 minutos, tempo este necessário para a formação de uma suspensão fina. Este procedimento foi realizado a cada administração aos animais.
Indução do diabetes
Os animais foram submetidos a jejum de 14-16 horas para administração por via endovenosa (jugular) de 50 mg de estreptozotocina (STZ) por Kg de peso corporal, dissolvida em tampão citrato pH 4,5. Os animais no dia da administração de STZ encontravamse com peso corporal médio de 111,86 ± 1,72 g.
Administração de insulina
Administramos 2,5 U de insulina (8,33 U/mL/ rato) por via subcutânea a um dos grupos de animal diabético, sendo o volume injetado por rato de 0,3 mL pela manhã (8:00 horas) e 0,3 mL a tarde (18:00 horas). Para o preparo desta solução utilizamos insulina Biohulim NPH (BIOBRÁS) de 100 U/mL.
Experimento de tratamento crônico com Pterogyne nitens
Após a aprovação do protocolo experimental pelo Comitê de Ética em Pesquisa da Faculdade de Ciências Farmacêuticas de Araraquara (CEP/FCF/Car. º21/2006), 50 ratos Wistar machos permaneceram por cerca de 2 dias nas gaiolas metabólicas a fim de se adaptarem, recebendo ração normal e água "ad libitum" e num ambiente com ciclo de luz-escuro de 12 horas (luzes acesas as 7:00 e apagadas às 19:00 horas), temperatura constante de 23 ºC e umidade de 55 ± 5%.
Tais animais foram então submetidos à administração de STZ, e após 4 dias realizamos o pareamento dos animais baseado em peso corporal, glicemia (coleta de sangue pela cauda) e glicosúria. O pareamento consistiu na escolha de 4 animais com valores entre si próximos de tais parâmetros, os quais foram então aleatoriamente determinados para comporem os grupos diabético tratado com água (DTA), grupo diabético tratado glicerina 10% (veículo dissolvente do extrato) (DTG), grupo diabético tratado com insulina (DTI) e grupo diabético tratado com extrato de Pterogyne nitens (DTPn). Tal método foi repetido até formar n=10 para cada grupo. Os 10 animais restantes foram desprezados.
O tratamento foi iniciado 3 dias após o pareamento e conduzido por 32 dias (39 dias pós-STZ), sendo que cada animal do grupo experimental (DTPn) recebeu por gavagem, duas vezes ao dia, 76 mg/0,5 mL glicerina 10% de extrato de Pterogyne nitens; os grupo controles DTA e DTG receberam o mesmo volume de água e glicerina respectivamente, ambos pela mesma via de administração. Um quarto grupo recebeu duas doses diárias de insulina (DTI).
Semanalmente as gaiolas metabólicas foram preparadas e os parâmetros fisiológicos: ingestão hídrica e alimentar e volume urinário, bem como o peso corporal e glicemia foram quantificados.
Metodologia para dosagens bioquímicas
Glicemia-método da glicose-oxidase (Trinder, 1969) - Kit Reagente da Labtest e Glicosúria-método da o-toluidina (Dubowski, 1962). A glicemia foi realizada em Autoanalyzer R-XT Techinicon Bayer, Dublin, Irlanda) e a glicosúria em espectrofotômetro Femto 600S (São Paulo, Brasil).
Análise estatística
Utilizamos o programa de computação de Análise de Variância SIGMA-STAT 2.03 (One Way Anova) para a análise dos dados. Também empregamos para a análise dos resultados o teste Student Newman-Keuls
RESULTADOS E DISCUSSÃO
Neste trabalho avaliamos o efeito da administração por 32 dias do extrato da planta Pterogyne nitens através de gavagem a ratos diabéticos. Para tanto analisamos os parâmetros fisiológicos que freqüentemente sofrem alterações no Diabetes bem como o nível de glicose plasmática.
Para uma maior confiabilidade experimental, realizamos o pareamento dos animais que permitiu iniciarmos os tratamentos em 4 grupos de animais que apresentavam o mesmo nível de severidade do quadro diabético, como pode ser comprovado na Tabela 1 ao constatar os valores médios próximos de peso corporal, glicemia e glicosúria.
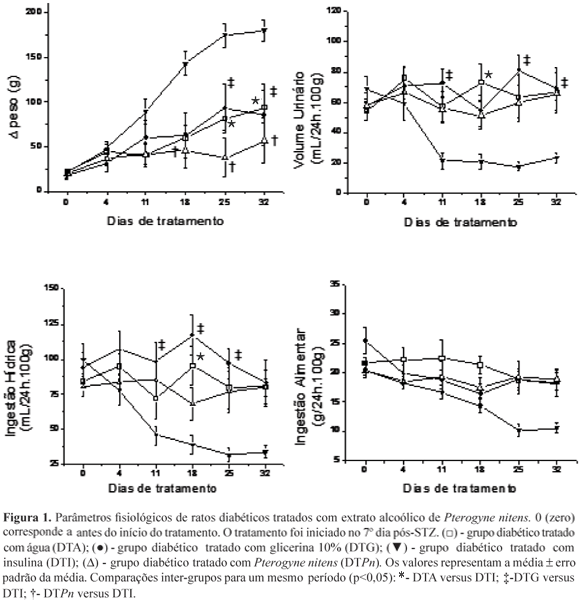
O efeito do tratamento oral com o extrato de Pterogyne nitens sobre os parâmetros fisiológicos pode ser observado na Figura 1. Em relação à variação do peso corporal, que corresponde à diferença entre o peso corporal de cada animal verificado no dia da determinação semanal em relação ao peso observado no dia da administração de STZ, não encontramos diferenças significativas quando os grupos DTPn e DTG foram comparados ao DTA. Observou-se também que o grupo DTI sofreu um aumento de peso corporal em relação ao DTPn a partir do 18o dia de tratamento e em relação aos grupos DTG e DTA a partir do 25o dia de tratamento. Assim, apenas o tratamento insulínico (grupo controle positivo) levou a um maior crescimento corporal, o qual foi detectado em relação aos tratamentos com a planta, com glicerina e com água principalmente nos três últimos períodos. Considerando a variação de peso corporal constatamos então que o modelo de estudo utilizado foi adequado e que o extrato vegetal bem como a glicerina não melhorou e nem piorou o quadro diabético.
Os resultados obtidos de ingestão hídrica (Figura 1) mostraram não ocorrer diferenças entre os grupos DTPn e DTG em relação ao DTA e uma tendência a redução deste parâmetro no grupo DTI em relação ao DTPn nos diferentes tempos estudados. Para comparações entre os grupos DTA e DTI houve diferença significativa somente no 18o dia de tratamento, e para DTG x DTI, a diferença ocorreu do 11º dia ao 25º dia de tratamento, revelando sempre menores valores para o grupo DTI. Desta maneira o tratamento com a planta não apresentou efeito algum de melhoria na polidipsia. O mesmo tipo de resultado foi encontrado para a excreção urinária (Figura 1) e uma tendência a tais resultados para ingestão alimentar (Figura 1), o que é justificável uma vez que ingestão hídrica e alimentar e volume urinário estão fisiologicamente relacionadas entre si.
Na Figura 2 estão apresentados os resultados da glicose plasmática. Novamente não foram observadas diferenças em nenhum dos tempos avaliados quando os grupos DTPn e DTA foram comparados. Encontramos valores significativamente menores para DTI quando este foi comparado aos grupos DTA, DTG e ao DTPn, durante todo decorrer do tratamento, período a período. Além disso, pode ser notado também que o tratamento insulínico foi eficaz aos animais pois revelou uma queda acentuada já no 11o dia de tratamento e valores normais a partir do 25o dia de tratamento (Mitruka & Rawnsley, 1981). Já, o tratamento com o extrato de Pterogyne nitens não foi efetivo, levando a uma tendência de elevação desses parâmetros com o tempo de tratamento bem como o mesmo ocorreu no grupo tratado com glicerina.
Procurando explorar mais os resultados dos parâmetros fisiológicos e da glicemia, analisamos os mesmos de maneira somatizada, isto é, obtidos ao longo de todo o período em estudo (Tabela 2). Esta forma de análise demonstrou que DTPn, DTG e DTA são diferentes estatisticamente quando comparados ao grupo DTI para todos os parâmetros avaliados. Assim, nota-se que o grupo DTI revelou elevação em relação ao DTPn, DTG e DTA para variação de peso corporal e redução para os demais parâmetros. Esta forma de análise clarificou o efeito do tratamento insulínico em relação aos grupos DTA e DTG para todos os parâmetros avaliados, mostrando que utilizamos um modelo experimental adequado para o estudo do vegetal.
Apesar do tratamento com glicerina (DTG) ter levado a um maior nível de glicemia e ingestão hídrica em relação ao grupo DTA (Tabela 2), parece que esse efeito não acarretou problema em relação a sua utilização como veículo de dissolução do extrato vegetal porque este último não levou a alteração de nenhum dos parâmetros quando comparada ao grupo DTA e além disso encontramos valores menores desses parâmetros no grupo DTPn em relação ao DTG.
Ao iniciarmos o estudo, o extrato de Pterogyne nitens parecia ser bastante promissor como candidato a apresentar efeito hipoglicemiante, no entanto constatamos, por ambos os tipos de análise dos resultados, a ineficácia do mesmo sobre o quadro diabético. Várias possibilidades podem ser sugeridas para a ausência de efeito. Uma delas pode ser a severidade do diabetes induzido nos animais (nível glicêmico aproximadamente de 540 mg/dL) o qual foi bastante severo (Grover et al., 2000) e possivelmente levou a uma destruição total das células β,inviabilizando assim, sua capacidade de regeneração. Além disso, provavelmente, pelos resultados obtidos, o vegetal também não exerceu efeito periférico. Uma segunda possibilidade pode ser a elevada concentração utilizada do extrato. Há dados na literatura que indicam que extrato preparado com semente de Eugenia jambolana e administrado a ratos diabéticos na concentração de 2,5 a 5,0 g/kg de peso corporal foi capaz de reduzir o nível glicêmico enquanto que o mesmo não ocorreu com a dose de 7,5 g/kg de peso corporal (Prince et al., 1998). Mais evidências que contribui para a sugestão da dose administrada ter sido elevada foi a ocorrência de 4 mortes de animais do grupo DTPn observadas ao longo do período de tratamento, possivelmente em função de efeitos adversos. Também não deve ser excluído que outra via de administração poderia levar a uma melhor resposta terapêutica.
A continuidade deste estudo deverá avaliar o efeito deste extrato em ratos com diabetes brando, semelhante ao tipo 2, assim como dose menores do mesmo.
CONCLUSÃO
Assim, concluímos que em relação aos parâmetros fisiológicos e bioquímicos, o extrato alcoólico de Pterogyne nitens nas condições utilizadas não melhorou e nem piorou o quadro diabético.
AGRADECIMENTOS
Os autores agradecem as agencias de fomento FAPESP, FUNDUNESP e PADC-Araraquara e ao auxílio técnico de Marcos A. Dangona. Aline de Souza é graduanda e estagiária na disciplina de Bioquímica Clínica da FCF-Araraquara e recebeu bolsa de Treinamento Técnico da Fapesp.
Received 30 May 2008; Accepted 10 December 2008
- Bailey CJ, Day C 2004. Metformin: its botanical background. Pract Diab Int 21: 115-117.
- Benigni R, Capra C, Cattorini PE 1964. Plante medicinali, chimica farmacologia e terapia Milão: Ed Inverni Della Beta, p.626-632.
- Brunetti IL, Vendramini RC, Januário AH, França SC, Pepato MT 2006. Effects of toxicity of Eugenia punicifolia extacts in streptotzotocin-diabetc rats. Pharm Biol 44: 35-43.
- Carvalho PER 1994. Espécies florestais brasileiras: recomendações silviculturais, potencialidades e uso da madeira Rio de Janeiro: Ed. Colombo: Embrapa-CNPF, p. 640.
- Dubowski KM 1962. An o-toluidine method for body fluid glucose determination. Clin Chem 9: 215-235.
- Corral RA, Orazi OO, Petrucceli MF 1969. Guanidine alkaloids of Pterogyne nitens Tul. Experientia 25: 1020-1021.
- Fernandes DC, Regasini LO, Vellosa JCR, Pauletti, PM, Castro-Gamboa I, Bolzani VS, Oliveira OMM, Silva DHS 2008. Myeloperoxidase inhibitory and radical scavenging activities of flavones from Pterogyne nitens. Chem Pharm Bull 56: 723-726.
- Ferreira FG, Regasini LO, Oliveira AM, Campos JADB, Silva DHS, Cavalheiro AJ, Santos, RA, Bassi CL, Bolzani VS, Soares CP 2009. Avaliação da mutagenicidade e antimutagenicidade de diferentes frações de Pterogyne nitens (Leguminosae), utilizando o ensaio de micronúcleo em Tradescantia pallida. Rev Bras Farmacogn 19: 61-67.
- Grover JK, Vats V, Rathi SS 2000. Anti-hyperglycemic effect of Eugenia jambolana and Tinospora cordifolia in experimental diabetes and their effects on key metabolic enzymes involved in carbohidrate metabolism. J Ethnopharmacol 73: 461-470.
- Mitruka BM, Rawnsley HM 1981. Clinical biochemical and hematological reference values in normal experimental animals and normal humans 2nd ed. New York (NY): Masson.
- Pepato MT, Oliveira JR, Kettelehut IC, Migliorini RH 1993. Assessment of the antidiabetic activity of Myrcia uniflora extracts in streptozotcin diabetic rats. Diabetes Res 22: 49-57.
- Pepato MT, Folgado VBB, Kettelhut IC, Brunetti IL 2001. Lack of antidiabetic effect of a Eugenia jambolana leaf decoction on rat streptozotocin diabetes. Braz J Med Biol Res 34: 389-395.
- Pepato MT, Keller EH, Baviera AM, Kettelhut IC, Vendramini RC, Brunetti IL 2002. Anti-diabetic activity of Bauhinia forficata decoction in streptozotocindiabetic rats. J Ethnopharmacol 81: 191-197.
- Pepato MT, Baviera AM, Vendramini RC, Perez MPMS, Kettelhut IC, Brunetti IL 2003. Cissus sicyoides (princess vine) in the long-term treatment of streptozotocin-diabetic rats. Biotechnol Appl Biochem 37: 15-20.
- Pepato MT, Baviera AM, Vendramini RC, Brunetti IL 2004. Evaluation of toxicity after one-months treatment with Bauhinia forficata decoction in streptozotocininduced diabetic rats. BMC Complement Altern Med 4: 1-7.
- Pepato MT, Mori DM, Baviera AM, Harami JB, Vendramini RC, Brunetti IL 2005. Fruit of the jambolana tree (Eugenia jambolana Lam.) and experimental diabetes. J Ethnopharmacol 96: 43-48.
- Prince PS, Menon VP, Pari L 1998. Hipoglycaemic activity of Syzygium cumini seeds:effect on lipid peroxidation in alloxan diabetic rats. J Ethnopharmacol 61: 1-7.
- Regasini LO, Lopes AA, Silva DHS, Furlan M, Young MCM, Maria DA, Barreiro EJ, Bolzani VS 2007. Antiproliferative effect of Pterogyne nitens on melanoma cells. Rev Ciênc Farm Básica Apl 28: 335-340.
- Regasini LO, Fernandes DC, Castro-Gamboa I, Silva DHS, Furlan M, Bolzani VS, Barreiro EJ, Cardoso-Lopes EM, Young MCM, Torres LB, Vellosa JCR, Oliveira OMM 2008a. Constituintes químicos das flores de Pterogyne nitens (Caesalpinioideae). Quim Nova 31: 802-806.
- Regasini LO, Oliveira CM, Vellosa JCR, Oliveira OMMF, Silva DHS, Bolzani VS 2008b. Free radical scavenging activity of Pterogyne nitens Tul. (Fabaceae). Afr J Biotechnol 7: 4609-4613.
- Regasini LO, Vellosa JCR, Silva DHS, Furlan M, Oliveira OMM, Khalil NM, Brunetti IL, Young MCM, Barreiro EJ, Bolzani VS 2008c. Flavonols from Pterogyne nitens and their evaluation as myeloperoxidase inhibitors. Phytochemistry 69: 1739-1744.
- Regasini LO, Castro-Gamboa I, Silva DHS, Furlan M, Barreiro EJ, Ferreira PMP, Pessoa C, Lotufo LVC, Moraes MO, Young MCM, Bolzani VS 2009. Cytotoxic guanidine alkaloids from Pterogyne nitens J Nat Prod 72: 473476.
- Reuter G 1963. Arginin als vorstufe von galegin in Galega officinalis. Arch Pharm 296: 516-522.
- Sacks DB 2006. Carbohydrates. In:Burtis CA, Ashwood ER, Bruns DE, editors. Tietz textbook of clinical chemistry and molecular diagnostics4th. St Louis, Missouri: Elsevier Saunders, p.837-867.
- Souza E, Zanatta l, Seifriz I, Creczynski-Pasa TB, Pizzolatti MG, Szpoganicz B 2004. Hypoglycemic effect and antioxidant potential of kaempferol-3,7-O-(α)-dirhamnoside from Bauhinia forficata Leaves. J Nat Prod 67: 829-832.
- Trinder P 1969. Determination of blood glucose using an peroxidase system with a non-carcinogenic chromogen. J Clin Pathol 22: 158-161.
Datas de Publicação
-
Publicação nesta coleção
01 Set 2009 -
Data do Fascículo
Jun 2009
Histórico
-
Recebido
30 Mar 2008 -
Aceito
10 Dez 2008