Resumos
OBJETIVO: Demonstrar as possibilidades da utilização da videotoracoscopia na cirurgia cardíaca com circulação extracorpórea (CEC). MÉTODOS: Entre fevereiro de 2006 e novembro de 2008, 102 pacientes foram submetidos consecutivamente a cirurgia cardíaca minimamente invasiva videoassistida. As doenças cardíacas abordadas foram valvopatia mitral (n=56), aórtica (n=14), comunicação interatrial (n=32), seis pacientes apresentavam insuficiência tricúspide associada e do grupo total, doze tinham fibrilação atrial. A idade variou de 18 a 68 anos, sendo 57 pacientes do sexo feminino. O método cirúrgico constou de canulação arterial e venosa femoral, incisão de quatro a seis centímetros (cm) ao nível do 3º ou 4º espaço intercostal direito (EICD), dependendo da doença do paciente, entre as linhas axilar anterior e hemiclavicular direita, sulco mamário ou periareolar direita e toracoscopia. RESULTADOS: Os procedimentos cirúrgicos compreenderam: plastia (n=20) ou troca valvar mitral (n=36); troca valvar aórtica (n=14); atriosseptoplastia com remendo de pericárdio bovino (n=32); plastia valvar tricúspide com anel rígido (n=6); e correção cirúrgica da fibrilação atrial por radiofrequência (n=12). Todas as cirurgias foram realizadas sem intercorrências. Não houve conversão para toracotomia. Dois pacientes evoluíram com fibrilação atrial no pós-operatório. Houve um (0,9%) episódio de acidente vascular cerebral, sete dias após a alta hospitalar, e um óbito (0,9%) decorrente de síndrome da resposta inflamatória sistêmica (SIRS). CONCLUSÃO: Este trabalho demonstra a abrangência de afecções possíveis de serem abordadas pela videocirurgia cardíaca com CEC, sendo um procedimento seguro, eficaz e com baixa morbidade e mortalidade. A cirurgia cardíaca minimamente invasiva videoassistida já é uma realidade no Brasil, demonstrando excelentes resultados estéticos e funcionais
Procedimentos cirúrgicos minimamente invasivos; Cirurgia torácica vídeo-assistida; Valvas cardíacas; Cardiopatias congênitas; Fibrilação atrial
OBJECTIVE: To demonstrate the possibilities of the use of videothoracoscopy in cardiac surgery using cardiopulmonary bypass (CPB). METHODS: Between February 2006 and November 2008, 102 patients underwent consecutively minimally invasive video-assisted cardiac surgery. The cardiac pathologies approached were: mitral valvopathy (n=56), aortic (n=14), interatrial communication (IC) (n=32), six patients presented associated tricuspid insufficiency and 12 presented atrial fibrillation. The age ranged from 18 to 68 years and 57 were female. The surgical approach was: femoral arterial and venous cannulation, minithoracotomy ranging from four to six centimeters (cm) at the level of the 3º or 4º right intercostal space (RICS), depending on the pathology of the patient, between anterior axillary line and hemiclavicular line, submammary or right periareolar groove through the right breast and thoracoscopy. RESULTS: The surgical procedures were: plasty (n=20) or mitral valve replacement (n=36), aortic valve replacement (n=14), atrioseptoplasty using pericardial patch (n=32), tricuspid valve repair with rigid ring (n=6) and surgical correction of atrial fibrillation with radiofrequency (n=12). There were no complications during the procedures. There was no conversion to thoracotomy in neither case. Two patients developed atrial fibrillation in the postoperative period. There was an episode of stroke seven days after the hospital discharge and one death (0.9%) due to systemic inflammatory response syndrome (SIRS). CONCLUSION: This study demonstrates the coverage of pathologies that are possible to be approached by video-assisted cardiac surgery with cardiopulmonary bypass being a safe and effective procedure with low morbimortality. Minimally invasive video-assisted cardiac surgery is already a reality in Brazil, demonstrating excellent aesthetic and functional results
Minimally invasive surgical procedures; Thoracic surgery, video-assisted; Heart valves; Heart defects, congenital; Atrial fibrillation
ARTIGO ORIGINAL
Cirurgia cardíaca videoassistida: resultados de um projeto pioneiro no Brasil
Robinson PoffoI; Renato Bastos PopeII; Rafael Armínio SelbachIII; Cláudio Alexandre MokrossIV; Fabiane FukutiIV; Iosmar da Silva JúniorV; Andréia AgapitoVI; Isaias CidralVII
IMestre em Clínica Cirúrgica pela Universidade Federal do Paraná. Coordenador do Programa de Cirurgia Cardíaca Minimamente Invasiva do Hospital Israelita Albert Einstein - SP - São Paulo. Coordenador dos Serviços de Cirurgia Cardiovascular do Hospital Hans Dieter Schmidt e Centro Hospitalar Unimed de Joinville - SC
IICirurgião Cardiovascular
IIIEspecialista em Cirurgia do Aparelho Digestivo; Cirurgião
IVEspecialista em Cirurgia Plástica; Cirurgião
VTítulo Superior em Anestesiologia; Anestesiologista
VIInstrumentadora
VIIPerfusionista
Endereço para correspondência Endereço para correspondência: Robinson Poffo Av. Albert Einstein, 627/701 São Paulo, SP, Brasil. - CEP 05652-901 E-mail: drpoffo@einstein.br
RESUMO
OBJETIVO: Demonstrar as possibilidades da utilização da videotoracoscopia na cirurgia cardíaca com circulação extracorpórea (CEC).
MÉTODOS: Entre fevereiro de 2006 e novembro de 2008, 102 pacientes foram submetidos consecutivamente a cirurgia cardíaca minimamente invasiva videoassistida. As doenças cardíacas abordadas foram valvopatia mitral (n=56), aórtica (n=14), comunicação interatrial (n=32), seis pacientes apresentavam insuficiência tricúspide associada e do grupo total, doze tinham fibrilação atrial. A idade variou de 18 a 68 anos, sendo 57 pacientes do sexo feminino. O método cirúrgico constou de canulação arterial e venosa femoral, incisão de quatro a seis centímetros (cm) ao nível do 3º ou 4º espaço intercostal direito (EICD), dependendo da doença do paciente, entre as linhas axilar anterior e hemiclavicular direita, sulco mamário ou periareolar direita e toracoscopia.
RESULTADOS: Os procedimentos cirúrgicos compreenderam: plastia (n=20) ou troca valvar mitral (n=36); troca valvar aórtica (n=14); atriosseptoplastia com remendo de pericárdio bovino (n=32); plastia valvar tricúspide com anel rígido (n=6); e correção cirúrgica da fibrilação atrial por radiofrequência (n=12). Todas as cirurgias foram realizadas sem intercorrências. Não houve conversão para toracotomia. Dois pacientes evoluíram com fibrilação atrial no pós-operatório. Houve um (0,9%) episódio de acidente vascular cerebral, sete dias após a alta hospitalar, e um óbito (0,9%) decorrente de síndrome da resposta inflamatória sistêmica (SIRS).
CONCLUSÃO: Este trabalho demonstra a abrangência de afecções possíveis de serem abordadas pela videocirurgia cardíaca com CEC, sendo um procedimento seguro, eficaz e com baixa morbidade e mortalidade. A cirurgia cardíaca minimamente invasiva videoassistida já é uma realidade no Brasil, demonstrando excelentes resultados estéticos e funcionais.
Descritores: Procedimentos cirúrgicos minimamente invasivos/métodos. Cirurgia torácica vídeo-assistida. Valvas cardíacas/cirurgia. Cardiopatias congênitas/cirurgia. Fibrilação atrial/terapia.
INTRODUÇÃO
Com a constante evolução da cirurgia cardíaca, novas técnicas e tecnologias vêm sendo aplicadas com o objetivo de tornar os procedimentos cirúrgicos cada vez mais seguros e menos invasivos. Um novo capítulo começa a ser escrito com a introdução da cirurgia cardíaca minimamente invasiva videoassistida, tornando-se possível a abordagem cirúrgica de diversas doenças cardíacas através de incisões cada vez menores, diminuindo a agressão ao organismo. Isto se reflete em menor trauma operatório, culminando com melhor evolução do paciente, sem comprometer o resultado cirúrgico [1]. O objetivo deste trabalho é demonstrar as possibilidades da utilização da videotoracoscopia na cirurgia cardíaca com circulação extracorpórea (CEC) em nosso meio.
MÉTODOS
Entre o período de fevereiro de 2006 e novembro de 2008, 102 pacientes foram submetidos a cirurgia cardíaca minimamente invasiva videoassistida de forma consecutiva. Todos os pacientes operados por esta técnica estão incluídos no presente estudo. Este projeto foi aprovadopelo Comitê de Ética do Hospital Hans Dieter Schmidt de Joinville. Os pacientes foram informados das possibilidades cirúrgicas quanto à realização do procedimento e optaram pela cirurgia minimamente invasiva, tendo assinado termo de consentimento informado.
Em uma fase inicial (primeiros 40 casos), foram incluídos pacientes eletivos e sem cirurgia cardíaca ou torácica prévia, com fração de ejeção acima de 55% e peso acima de 50 quilogramas (kg). Os critérios de exclusão foram: dilatação da aorta ascendente, pacientes obesos, portadores de arteriopatia periférica e deformidades torácicas. Nos pacientes portadores de valvopatia mitral, foram excluídos aqueles com insuficiência aórtica de moderada a importante. Os exames complementares pré-operatórios solicitados foram: eletrocardiograma, radiografia de tórax, ecocardiograma transtorácico e transesofágico, ultrassom de artérias carótidas, aorta abdominal, ilíacas e femorais. Nos pacientes nos quais se suspeitava de alguma obstrução das artérias periféricas, angiotomografia da aorta tóraco-abdominal foi solicitada. Cuidado especial tomou-se no momento do cateterismo cardíaco, evitando-se puncionar vasos femorais, dando preferência à punção da artéria radial e, durante o exame, era realizada a aortografia completa. Após os primeiros 40 casos, passamos a incluir os pacientes com fração de ejeção abaixo de 55%, emergências, reoperações e obesos.
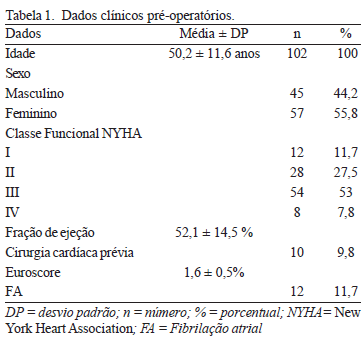
A idade dos pacientes variou de 18 a 68 anos, sendo 57 (55,8%) do sexo feminino. A fração de ejeção média era de 52,16 ± 14,57%. A maioria dos pacientes (80,4%) estava em classe funcional II ou III da New York Heart Association (Tabela 1).
As doenças cardíacas abordadas foram: valvopatia mitral (n=56); valvopatia aórtica (n=14); comunicação interatrial (CIA) (n=32), dos quais 28 pacientes eram portadores de CIA tipo ostium secundum e quatro de CIA tipo sinus venosus com drenagem anômala parcial das veias pulmonares. Como doenças associadas, seis pacientes apresentavam insuficiência tricúspide, sendo quatro associadas a valvopatia mitral e dois a CIA, além disso, doze doentes tinham fibrilação atrial crônica (FA), sendo 10 no grupo da valvopatia mitral e dois no grupo da CIA. Dez pacientes já haviam sido submetidos a cirurgia cardíaca prévia (Tabela 2).
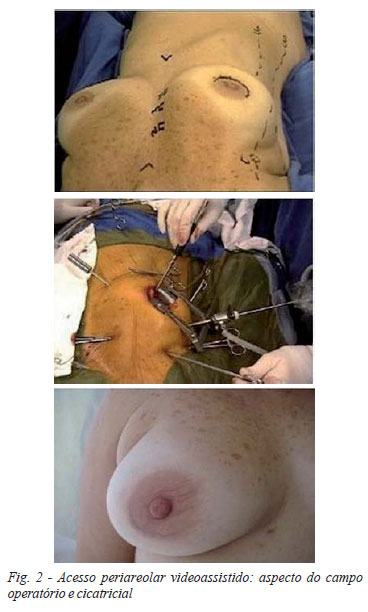
A abordagem cirúrgica dependeu da patologia em questão. No caso da valvopatia mitral, a operação foi realizada por minitoracotomia ântero-lateral à direita videoassistida [2] (Figura 1), em uma fase inicial, e posteriormente adotou-se a técnica periareolar [3] (Figura 2). Os pacientes foram intubados utilizando-se sonda orotraqueal de Carlens, para ventilação seletiva e posicionados com o lado direito do tórax elevado em 20º, permanecendo o braço ao longo do corpo. Pás descartáveis para desfibrilação cardíaca externa foram colocadas na região da escápula direita e região ântero-lateral do hemitórax esquerdo. Feita incisão de aproximadamente 4 cm, no nível do 4º espaço intercostal direito (EICD), entre as linhas axilar anterior (LAA) e hemiclavicular direita (LHD). No caso da técnica peri-areolar, a incisão foi feita ao redor do mamilo, em aproximadamente 50% da circunferência areolar inferior. Para afastamento das costelas utilizou-se afastador específico para cirurgia minimamente invasiva (Estech, Inc.) ou apenas afastador de tecidos moles Alexis® (Applied Medical).
O pulmão direito foi seletivado. No mesmo espaço intercostal, na linha axilar média foi introduzido trocarte para ótica de 10 mm ou 5 mm de 30º, com entrada para insuflador de CO2. O instrumental cirúrgico utilizado era específico para este tipo de procedimento, constando de pinças, porta-agulhas e tesouras longas, com aproximadamente 35 cm, para videotoracoscopia. Sob visão da ótica, o pericárdio foi aberto 2 cm anteriormente ao nervo frênico. Esta incisão estendeu-se da veia cava inferior à superior. O pericárdio foi tracionado por meio de quatro pontos, os quais foram exteriorizados, através da parede torácica utilizando-se um puncionador/gancho.
Após a heparinização plena do paciente, a CEC era estabelecida por meio de canulação femoral, sendo incisada a pele no sulco inguinal preferencialmente à direita e os vasos femorais canulados utilizando a técnica de Seldinger. Para canulação arterial utilizou-se cânula Bio-medicus® nº 17 ou 19 French (Fr.) (Medtronic, Inc.) e para linha venosa, cânula femoral nº 19 ou 21 Fr. (Estech, Inc.). A drenagem venosa foi assistida a vácuo. O paciente foi mantido a 28ºC. Para perfeito posicionamento das cânulas, utilizamos o ecocardiograma transesofágico.
Através do 2º EICD, na LAA, introduziu-se pinça aórtica transtorácica (Chitwood clamp - Estech, Inc.). Utilizando-se a videotoracoscopia, a aorta ascendente foi pinçada e puncionada com cânula DLP® (Medtronic, Inc.) de cardioplegia anterógrada. Na fase inicial deste estudo, esta cânula era mantida no lugar por meio de ponto em bolsa, de poliéster trançado 2-0 com teflon, passada por um torniquete. A linha cardioplégica era exteriorizada através da incisão. Esta mesma linha foi utilizada para posterior aspiração da raiz aórtica. Utilizou-se cardioplegia sanguínea de baixo volume hipotérmica (4ºC), repetida a cada 20 minutos. Posteriormente, com o objetivo de simplificar o método, trocamos a cardioplegia para a solução HTK (Custodiol®) [4], administrada de forma anterógrada, sendo feita punção da aorta ascendente com uma agulha de metal de 30 cm (Geister, Inc.). Esta cardioplegia permite um tempo de isquemia de até 180 minutos, não sendo necessária a sua readministração se o tempo de pinçamento aórtico for inferior a este período.
Nas reoperações valvares mitrais, a oclusão aórtica foi obtida com auxílio de Endoclamp (Estech Inc.) introduzido via femoral. O mesmo permite a manutenção do fluxo arterial, administração de cardioplegia de forma anterógrada e aspiração da raiz aórtica para retirada de ar da aorta ascendente [5].
A abertura do átrio esquerdo foi anterior às veias pulmonares direitas e o afastamento atrial feito por meio de afastador transtorácico específico (Estech, Inc.) passado pelo 4º EICD, lateral à região da artéria torácica interna direita. Com a introdução da ótica no átrio esquerdo, a valva mitral era inspecionada. Para auxiliar na aspiração do sangue proveniente das veias pulmonares, introduziu-se trocarte de 7 mm no 7º EICD na LAA, através do qual se passou um aspirador de átrio esquerdo maleável (DLP® Medtronic, Inc.). Era então realizado o procedimento valvar e, posteriormente, a ablação das veias pulmonares, nos casos onde a fibrilação atrial estava presente, utilizando-se radiofrequência [6] (Cardioblator, Medtronic, Inc.).
O pinçamento aórtico, a atriotomia esquerda, o procedimento valvar e a ablação cirúrgica da fibrilação atrial foram realizados exclusivamente utilizando-se a visibilização do monitor de vídeo. Desde a abertura do átrio esquerdo, manteve-se a injeção de CO2 através do trocarte da ótica, na vazão de 3 litros por minuto, com o objetivo de diminuir a possibilidade de embolia aérea. A atriorrafia esquerda foi realizada com fio de polipropileno 3-0, através da qual se deixou um cateter de aspiração ventricular esquerda passado através da valva ou prótese para retirada de ar residual.
Foram feitas manobras de deaeração de câmaras esquerdas mobilizando-se a mesa cirúrgica em posição de Trendelenburg e anti-Trendelenburg e alternância de lateral esquerda-direita. Foi realizada aspiração pela raiz aórtica e ventrículo esquerdo. Após inspeção das cavidades esquerdas com auxílio da ecocardiografia transesofágica, não havendo ar residual, o pinçamento aórtico era então interrompido e o paciente reaquecido.
Após saída de CEC, os vasos femorais foram descanulados e a heparina revertida. A minitoracotomia foi fechada de forma convencional. O hemitórax direito foi drenado através da incisão do trocarte de introdução da ótica nos casos de correção de CIA e através da incisão do trocarte para aspiração do átrio esquerdo nos demais casos.
Nos casos em que o átrio direito foi aberto (correção de CIA e FA ou anuloplastia tricúspide), duas técnicas para drenagem venosa foram utilizadas: a canulação venosa única e a bicaval. Nos casos de canulação venosa única, utilizou-se cânula femoral de duplo estágio (Estech Inc.). Após o cadarçamento das veias cavas, o átrio direito era aberto paralelo ao septo inter-atrial e a cânula que atravessava o átrio direito rebatida para detrás do afastador atrial direito. Em pacientes obesos ou naqueles portadores de CIA com drenagem venosa anômala, optou-se por canular concomitantemente à veia femoral, a veia jugular interna direita (bicaval). Utilizou-se a técnica por punção de Seldinger e introdução de cânula venosa nº 16 Fr. (Edwards Lifesciences). Nestes casos, aplicavam-se pinças de bulldog nas veias cavas antes da abertura atrial direita, para evitar entrada de ar no circuito. Nos pacientes que apresentavam FA associada à CIA, procedeu-se à ablação por radiofrequência do átrio direito. O acesso cirúrgico utilizado foi o mesmo da abordagem da valvopatia mitral, excluindo-se apenas o trocarte para colocação do aspirador de átrio esquerdo, sendo que a deaeração era feita apenas pela raiz aórtica com controle ecocardiográfico transesofágico [7-9].
A valvopatia aórtica foi abordada através de incisão de aproximadamente 6 cm, no nível do 3º EICD, entre a borda lateral direita do esterno e linha hemiclavicular direita [10,11]. O pinçamento aórtico, a introdução da videotoracoscopia e a instituição da CEC foram feitos da mesma forma que a abordagem da valva mitral. Após a abertura do saco pericárdico, para facilitar a exposição da aorta, pontos de fio polifilamentar 2.0 foram passados no pericárdio, na região anterior à artéria pulmonar, e tracionados através da incisão. A aortotomia foi realizada de forma transversal, próxima à junção sino-tubular. Para melhor exposição da valva, pontos de poliéster 2.0 trançado foram passados na região comissural e tracionados. A cardioplegia foi administrada diretamente nos óstios coronarianos utilizando-se a solução HTK. A deaeração de câmaras esquerdas foi feita deixando um cateter de aspiração na raiz aórtica e controle com o ecocardiograma transesofágico.
RESULTADOS
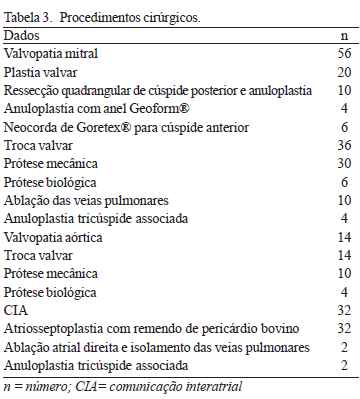
Os procedimentos cirúrgicos mitrais compreenderam: plastia valvar em 20 casos, sendo realizados ressecção quadrangular de cúspide posterior e anuloplastia com anel semi-rígido Carpentier-Edwards Physio Annuloplasty Ring® (Edwards Lifesciences) em 10 casos, anuloplastia com anel Geoform® (Edwards Lifesciences) em quatro pacientes, implante de neocorda de PTFE (Gore-Tex) para cúspide anterior e implante de anel semi-rígido Carpentier-Edwards Physio Annuloplasty Ring® (Edwards Lifesciences) em seis casos. Trinta e seis paciente foram submetidos a troca valvar mitral, sendo implantadas 30 próteses metálicas de duplo folheto e seis próteses biológicas de pericárdio bovino. Nestes pacientes mitrais, 10 eram portadores de fibrilação atrial e foram submetidos a ablação das veias pulmonares por radiofrequência e quatro foram submetidos a anuloplastia tricúspide utilizando anel rígido Edwards MC3 (Edwards Lifesciences).
Os procedimentos aórticos consistiram em troca valvar aórtica em 14 pacientes. Implantou-se prótese metálica de duplo folheto em 10 casos e nos demais, prótese biológica de pericárdio bovino.
Nos 32 pacientes portadores de CIA, procedeu-se à atriosseptoplastia com remendo de pericárdio bovino. Deste grupo de pacientes, dois foram submetidos a ablação por radiofrequência do átrio direito e das veias pulmonares por serem portadores de fibrilação atrial e dois submetidos a anuloplastia tricúspide utilizando anel rígido Edwards MC3 (Edwards Lifesciences) (Tabela 3).
Todas as cirurgias foram realizadas sem intercorrências. Não houve conversão para toracotomia em nenhum dos casos. Os tempos médios de CEC e pinçamento aórtico para os pacientes valvares foram, respectivamente, 123,8 ± 46,2 min (85 a 210 min) e 102,41 ± 42,71 min (60 a 190 min). Nos pacientes operados de correção de CIA, os tempos médios de CEC e pinçamento aórtico foram, respectivamente, 53,1 ± 10,68 min (38 a 70 min) e 39,9 ± 7,82 min (30 a 55 min). O volume médio de sangramento no pós-operatório foi de 201,6 ± 101,9 ml (50-450 ml). O tempo médio de ventilação mecânica foi de 8,6 ± 3,5 horas (0 - 13,1 h). O tempo médio de permanência em UTI foi de 29,9 ± 7,8 horas (16-42 h) e o período médio de internação hospitalar foi de 6,5 ± 1,9 dias (4-12 dias).
Dois pacientes apresentaram fibrilação atrial, os quais foram tratados química e eletricamente. Um destes pacientes manteve-se em ritmo de fibrilação atrial, o qual era portador de estenose mitral e fibrilação atrial crônica. Quatro (3,9%) pacientes apresentaram derrame pleural à direita com necessidade de nova drenagem torácica e outros seis (5,8%) desenvolveram enfisema subcutâneo limitado à parte superior do hemitórax direito. Referente à dor pós-operatória, 9 (8,8%) pacientes referiram dor intensa no local do trocarte utilizado para a toracoscopia ou no local da drenagem torácica. Não houve casos de reoperação por sangramento, insuficiência renal, alterações neurológicas ou cognitivas durante o período de internamento.
Todos os pacientes foram submetidos ao controle ecocardiográfico no momento da alta. Nos pacientes valvopatas, todas as válvulas implantadas (metálicas e biológicas) encontravam-se normofuncionantes e sem leak paravalvar. No caso das plastias mitrais (n=20), a insuficiência valvar foi quantificada como inexistente ou trivial em 18 casos e leve em dois. Nos pacientes submetidos a correção de CIA não se encontrou shunt residual. Não foram observadas complicações referentes à cicatrização do acesso cirúrgico ou à canulação periférica. Houve um (0,9%) episódio de acidente vascular cerebral, sete dias após a alta hospitalar, e um (0,9%) óbito decorrente de síndrome da resposta inflamatória sistêmica (SIRS).
DISCUSSÃO
Em meados da década de 1990, surgem na literatura médica mundial vários relatos a respeito de técnicas de cirurgia cardíaca menos invasivas [12-14]. Os objetivos são a melhor recuperação do paciente, com menos dor e complicações pós-operatórias, culminando com diminuição da permanência hospitalar e consequente redução de custos [15,16]. Outro ponto é o aspecto estético e a satisfação do paciente decorrente da redução do trauma cirúrgico (cicatriz) (Figura 3) [17,18]. Com o advento da videotoracoscopia, houve a possibilidade de incisões cada vez menores ou até a ausência destas [19]. Vários são os fatores que fazem com que esta técnica ainda seja pouco usual em nosso meio [2].
Há a necessidade da adaptação do cirurgião e do ambiente cirúrgico, pois ocorre uma mudança na forma com que estamos habituados a trabalhar com o coração. O acesso às cavidades cardíacas é restrito pelo comprimento limitado da incisão, o qual é compensado pelo uso da videotoracoscopia. O manuseio de instrumentos longos e a visibilização indireta do campo operatório são algumas das dificuldades acrescentadas ao método, que com o aumento da experiência e domínio da técnica, não são impedimentos para sua aplicação. Outro ponto importante é a proteção miocárdica. Na fase inicial, utilizávamos cardioplegia sanguínea anterógrada intermitente, o que agregava maior dificuldade ao método, devido à interrupção periódica para administração da cardioplegia. Recentemente adotamos o uso da Solução HTK (Custodiol®) administrada de forma hipotérmica (6ºC) e anterógrada, muito utilizada para proteção miocárdica em transplantes cardíacos, o que permite tempo de isquemia maior, não sendo necessária a repetição da administração se o tempo de pinçamento aórtico for inferior a 180 minutos, conferindo maior segurança ao procedimento [4].
As contra-indicações para este método são: pacientes com deformidades acentuadas do tórax (pectus excavatum), arteriopatia periférica, aneurisma da aorta ascendente e insuficiência valvar aórtica acima de ++/IV nos pacientes valvopatas mitrais. No início de nossa série (primeiros 40 casos), excluímos os pacientes com má função ventricular, obesos, reoperações cardíacas e endocardite. Com o domínio da técnica, percebemos que talvez, estas sejam as principais indicações deste método (pacientes de maior risco), pois há menor manipulação da cavidade torácica, levando a menor agressão ao organismo. Exemplo disto são as reoperações valvares mitrais onde se utilizou o Endoclamp (Estech, Inc.) [5]. Apenas dissecou-se o suficiente para termos acesso ao átrio esquerdo, não havendo necessidade de descolar-se as aderências da aorta ou da superfície miocárdica. Para sua utilização é necessário um ecocardiografista habilidoso, pois a efetividade e a segurança deste dispositivo estão diretamente relacionadas à sua perfeita localização.
Os tempos de CEC e pinçamento aórtico na fase inicial foram mais longos, decrescendo sensivelmente com a familiaridade da técnica. Vários trabalhos sobre cirurgia cardíaca minimamente invasiva videoassistida têm demonstrado que, apesar dos tempos de CEC e pinçamento serem mais longos quando comparados à técnica convencional via toracotomia mediana, é um procedimento seguro e está associado a menor morbidade: menor dor pós-operatória, menor sangramento, tempo de extubação, permanência em UTI e internação hospitalar mais curtos e retorno às atividades mais rapidamente [20,21].
Na correção cirúrgica da CIA e anuloplastia tricúspide, o ponto mais importante é o acesso exato no 4º EICD, pois se o acesso for abaixo, a cúpula diafragmática pode interferir na manipulação dos instrumentos e na visibilização das estruturas cardíacas, sendo que a aorta fica mais distante tornando difícil a administração cardioplégica. Para facilitar a exposição e mover o diafragma do campo operatório, é possível passar um ponto de fio polifilamentar 2.0 no anel fibroso do diafragma e exteriorizá-lo através da pele no 7º EICD na linha axilar média (LAM) e tracionar. Isto faz com que o diafragma mova-se para baixo. Cuidado especial deve ser tomado para não aprofundar o ponto no diafragma, pois se corre o risco de atingir o fígado. Nos casos associados de drenagem venosa parcial das veias pulmonares direitas, a videotoracoscopia facilita a visibilização e correção destas estruturas.
Em quatro pacientes com má função ventricular (<35% FE) e insuficiência mitral secundária, utilizamos a anuloplastia com anel Geoform® (Edwards Lifesciences), que demonstrou ser um método que leva a rápida recuperação pós-operatória. Nos pacientes obesos, notamos que a restrição ao leito é curta, o que possibilita uma reabilitação mais rápida, evitando possíveis complicações pulmonares e tromboembólicas. Em relação à endocardite, dois pacientes foram operados de emergência por apresentarem insuficiência mitral aguda decorrente à infecção valvar mitral e tiveram evolução pós-operatória favorável, mostrando ser factível a sua utilização em casos onde haja apenas uma valva comprometida. Nestes casos, onde há ruptura aguda da cordoalha ou cúspide e o átrio esquerdo é de tamanho normal, a abordagem videotoracoscópica facilitou a exposição e manuseio desta valva, permitindo inclusive reconstruções mais complexas (Figura 4).
Em uma fase mais avançada, idealizamos um acesso inédito para cirurgia cardíaca minimamente invasiva videoassistida, combinando a efetividade deste método a um acesso onde a manipulação das estruturas cardíacas fosse facilitada: o acesso periareolar [3]. Normalmente, o mamilo está exatamente sobre o 4º EICD, não sendo necessária uma grande incisão para chegar nesta região. Este acesso é utilizado há décadas na cirurgia plástica, demonstrando baixos índices de complicações e um excelente resultado estético [22]. Atualmente, é o nosso acesso de escolha, principalmente para pacientes do sexo feminino, portadores de valvopatia mitral, comunicação interatrial e correção de fibrilação atrial, sendo que já utilizamos em 46 casos sem complicações referentes ao local da incisão (Figura 2).
Na substituição valvar aórtica, a visibilização da aorta ascendente é feita mais lateralmente, havendo necessidade de tração do pericárdio para melhor exposição valvar. Acreditamos ser extremamente difícil a substituição da aorta ascendente e reimplante dos óstios coronários, se porventura for necessário. Utilizamos naqueles casos onde a secção do esterno deve ser evitada, como por exemplo: osso esternal submetido a radioterapia ou em pacientes que necessitam do apoio de muletas para deambular.
Dois pacientes evoluíram com fibrilação atrial no pós-operatório imediato, os quais foram tratados com amiodarona e cardioversão elétrica, sendo que um destes recebeu alta em fibrilação atrial, o qual era portador de estenose mitral e fibrilação atrial crônica e foi mantido em regime de anticoagulação oral. Como rotina, estes pacientes foram tratados e mantidos na unidade de tratamento intensivo (UTI) até a estabilização do quadro, sendo este o motivo de termos um paciente com permanência em UTI de 42h.
Quatro (3,9%) pacientes apresentaram derrame pleural à direita com necessidade de nova drenagem torácica, isto muito provavelmente pelo posicionamento e tipo do dreno utilizado. Este era implantado no orifício deixado pelo trocarte da ótica, normalmente no 4º EICD. Por ser implantado em uma posição mais alta, houve a formação do derrame. Para solucionar este problema optou-se pela colocação de dreno de Blake® nº 19 (Ethicon, Inc.) sob aspiração negativa de 15 cm H2O direcionado para a superfície diafragmática e para o interior do saco pericárdico. Este dreno é feito de silicone extremamente flexível, longo e apresenta sulcos longitudinais que quando associado à pressão negativa possui grande capacidade de drenagem.
Outros seis (5,8%) pacientes desenvolveram enfisema subcutâneo limitado à parte superior do hemitórax direito, o qual resolveu após aplicação de aspiração negativa de 15 cm H2O no dreno torácico. Referente à dor pós-operatória, 9 (8,8%) pacientes referiram dor intensa no local do trocarte utilizado para a toracoscopia. Estes eventos ocorreram em uma fase inicial, onde utilizávamos trocarteres e drenos mais calibrosos. Em virtude deste problema fizemos três modificações: diminuímos o trocarte da ótica de 10 para 5 mm, mudamos o tipo do dreno torácico para um mais fino e flexível (dreno de Blake®) e instituímos a analgesia controlada pelo paciente (ACP) em bomba de infusão endovenosa de Fentanil® na dose de 30 µg/h, permitindo que o próprio paciente, no caso de dor, administrasse um bolus de 15 µg em intervalos de 10 minutos, limitando a dose total em 60 µg/h. A respeito da analgesia controlada pelo paciente no tratamento da dor aguda pós-operatória, a evolução tecnológica possibilitou este conceito, no qual o paciente ao sentir dor, se auto-aplica a medicação analgésica, por via venosa, utilizando uma bomba programável em que por meio de um botão libera-se uma quantidade determinada de substância.
Não houve casos de reoperação por sangramento, insuficiência renal, alterações neurológicas ou cognitivas durante o período de internamento. Todos os pacientes foram submetidos ao controle ecocardiográfico no momento da alta. Nos pacientes valvopatas, todas as válvulas implantadas (metálicas e biológicas) encontravam-se normofuncionantes e sem leak paravalvar. No caso das plastias mitrais (n=20), a insuficiência valvar foi quantificada como inexistente ou trivial em 18 casos e leve em dois. O ponto fundamental para o sucesso das plastias foi a participação do ecocardiografista no pré e transoperatório, o qual realizava a análise valvar de forma a identificar o mecanismo da insuficiência, sendo que antes de visibilizar a valva, já era possível planejar o tipo de plastia a ser realizada. Desde o início deste projeto adotamos o uso da ecocardiografia transesofágica transoperatória de forma mandatória e rotineira, visando oferecer segurança e eficácia ao método.
Um paciente apresentou quadro de acidente vascular cerebral, sete dias após a alta hospitalar, o qual havia sido submetido à correção de CIA com drenagem anômala parcial das veias pulmonares e correção cirúrgica da fibrilação atrialpor radiofrequência. À reinternação apresentava-se com dislalia, a qual evoluiu para normalização. O ritmo encontrava-se sinusal e o ecocardiograma transesofágico não evidenciou a presença de trombos intracavitários. Todos os pacientes que tiveram implante de próteses mecânicas ou correção da fibrilação atrial foram submetidos a regime de anticoagulação oral. O único (0,9%) óbito ocorrido nesta série foi de uma paciente submetida a troca valvar mitral, decorrente a SIRS, apesar de um tempo de CEC e pinçamento aórtico curtos (85 e 60 min, respectivamente). Na literatura encontramos índices de mortalidade na cirurgia valvar mitral minimamente invasiva videoassistida variando de 1% a 3,9% [23].
Nesta série, várias foram as doenças tratadas utilizando-se esta técnica cirúrgica, apesar da disparidade deste grupo, foram obtidos resultados pós-operatórios homogêneos, isto provavelmente devido à menor agressão cirúrgica ao organismo. Referente aos procedimentos cirúrgicos, apesar do acesso restrito, pode-se realizar tanto trocas quanto plastias valvares. A qualidade do procedimento deve vir sempre antes de questões estéticas, não podendo haver comprometimento do resultado [24]. Segundo Mack [25], vários são os fatores para a adoção de novas tecnologias: o método deve ser efetivo, versátil, de fácil reprodutibilidade, seguro, durável e ter boa relação custobenefício. Após termos operado estes 102 pacientes, podemos dizer que há uma curva de aprendizado, a qual é superada com o domínio da técnica e empenho de toda a equipe envolvida. Isto foi refletido nos tempos de CEC e pinçamento aórtico, os quais foram decrescendo sensivelmente a partir do quadragésimo caso.
Acreditamos que, para esta técnica ser amplamente adotada, há necessidade de treinamento adequado e direcionado para a videocirurgia, assim como a adequação do ambiente cirúrgico com incorporação de equipamentos que possibilitem a realização da cirurgia cardíaca videoassistida.
CONCLUSÕES
Este trabalho demonstra a abrangência de doenças possíveis de serem abordadas pela videocirurgia cardíaca com CEC, sendo um procedimento seguro, eficaz e com baixa morbidade e mortalidade. A cirurgia cardíaca minimamente invasiva videoassistida já é uma realidade no Brasil, demonstrando excelentes resultados estéticos e funcionais.
REFERÊNCIAS
1. Mohr FW, Onnasch JF, Falk V, Walther T, Diegeler A, Krakor R, et al. The evolution of minimally invasive valve surgery: 2 year experience. Eur J Cardiothorac Surg. 1999;15(3):233-8.
2. Poffo R, Bonin M, Selbach RA, Pilatti M. Troca valvar mitral minimamente invasiva videoassistida. Rev Bras Cir Cardiovasc. 2007;22(4):491-4.
3. Poffo R, Selbach RA, Mokross CA, Fukuti F, Pilatti M, Cidral I. Correção cirúrgica da comunicação inter-atrial: uma novaabordagem. In: 10º Congresso da SICVESP; 2007; Águas de São Pedro; SP. Anais: Rev Bras Cir Cardiovasc. 2007;22(4):530.
4. Poffo R, Pope RB, Selbach RA, Cidral I. Solução de HTK (Custodiol®) na cirurgia valvar minimamente invasiva videoassistida: proteção miocárdica segura e eficaz. In: 36º Congresso da Sociedade Brasileira de Cirurgia Cardiovascular; 2009; Belo Horizonte; MG. Anais: Rev Bras Cir Cardiovasc. 2009;24(1 supl):90.
5. Van Nooten G, Van Belleghem Y, Van Overbeke H, Caes F, François K, De Pauw M, et al. Redo mitral surgery using the Estech endoclamp. Heart Surg Forum. 2001;4(1):31-3.
6. Kottkamp H, Hindricks G, Hammel D, Autschbach R, Mergenthaler J, Borggrefe M, et al. Intraoperative radiofrequency ablation of chronic atrial fibrilation: a left atrial curative approach by elimination of anatomic "anchor" reentrant circuits. J Cardiovasc Electrophysiol. 1999;10(6):772-80.
7. Ryan WH, Cheirif J, Dewey TM, Prince SL, Mack MJ. Safety and efficacy of minimally invasive atrial septal defect closure. Ann Thorac Surg. 2003;75(5):1532-4.
8. Shetty DP, Dixit MD, Gan MD, Das MB, Harish R, Kapoor L, et al. Video-assisted closure of atrial septal defect. Ann Thorac Surg. 1996;62(3):940.
9. Chang CH, Lin PJ, Chu JJ, Liu HP, Tsai FC, Lin FC, et al. Video-assisted cardiac surgery in closure of atrial septal defect. Ann Thorac Surg. 1996;62(3):697-701.
10. Yakub MA, Pau KK, Awang Y. Minimally invasive "pocket incision" aortic valve surgery. Ann Thorac Cardiovasc Surg. 1999;5(1):36-9.
11. Benetti F, Rizzardi JL, Concetti C, Bergese M, Zappetti A. Minimally aortic valve surgery avoiding sternotomy. Eur J Cardiothorac Surg. 1999;16(Suppl 2):S84-5.
12. Carpentier A, Loulmet D, Carpentier A, Le Bret E, Haugades B, Dassier P, et al. Chirurgie à coeur ouvert par vidéo-chirurgie et mini-thoracotomie: premier cas (valvuloplastie mitrale) opéré avec succès. CR Acad Sci III. 1996;319(3):219-23.
13. Chitwood WR Jr, Wixon CL, Elbeery JR, Moran JF, Chapman WH, Lust RM. Video-assisted minimally invasive mitral valve surgery. J Thorac Cardiovasc Surg. 1997;114(5):773-80.
14. Mohr FW, Falk V, Diegeler A, Walther T, van Son JA, Autschbach R. Minimally invasive port-access mitral valve surgery. J Thorac Cardiovasc Surg. 1998;115(3):567-74.
15. Duhaylongsod FG. Minimally invasive cardiac surgery defined. Arch Surg. 2000;135(3):296-301.
16. Grossi EA, Galloway AC, LaPietra A, Ribakove GH, Ursomanno P, Delianides J, et al. Minimally invasive mitral valve surgery: a 6-year experience with 714 patients. Ann Thorac Surg. 2002;74(3):660-3.
17. Massetti M, Nataf P, Babatasi G, Khayat A. Cosmetic aspects in minimally invasive cardiac surgery. Eur J Cardiothoracic Surg. 1999;16(Suppl 2):S73-5.
18. Walther T, Falk V, Metz S, Diegeler A, Battelllini R, Autschbach R, et al. Pain and quality of life after minimally invasive versus conventional cardiac surgery. Ann Thorac Surg. 1999;67(6):1643-7.
19. Chitwood WR Jr. Current status of endoscopic and robotic mitral valve surgery.Ann Thorac Surg. 2005;79(6):S2248-53.
20. Modi P, Hassan A, Chitwood WR Jr. Minimally invasive mitral valve surgery: a systematic review and meta-analysis. Eur J Cardiothorac Surg. 2008;34(5):943-52.
21. Richardson L, Richardson M, Hunter S. Is a port-access mitral valve repair superior to the sternotomy approach in accelerating postoperative recovery? Interac Cardiovasc Thorac Surg. 2008;7(4):678-83.
22. Pitanguy I. Transareolar incision for augmentation mammaplasty. Aesthetic Plast Surg. 1978;2:363-72.
23. Mohr FW. Minimally invasive mitral valve repair: the Leipzig experience. In: 84th American Association for Thoracic Surgery Annual Meeting - Adult Cardiac Symposium; 2004; Toronto; Canadá. Anais: 84th AATS Annual Meeting - Adult Cardiac Symposium; 2004; 50-4.
24. Schroeyers P, Wellens F, De Geest R, Degrieck I, Van Praet F, Vermeulen Y, et al. Minimally invasive video-assisted mitral valve surgery: our lessons after a 4-year experience. Ann Thorac Surg. 2001;72(3):S1050-4.
25. Mack MJ. Cardiac surgery: the future is minimal! J Card Surg. 2000;15(1):6-8.
Artigo recebido em 13 de maio de 2009
Artigo aprovado em 27 de julho de 2009
Trabalho realizado no Hospital Israelita Albert Einstein, São Paulo, SP, Brasil. Hospital Hans Dieter Schmidt - Centro Hospitalar Unimed -Hospital Dona Helena - Joinville, SC, Brasil.
- 1. Mohr FW, Onnasch JF, Falk V, Walther T, Diegeler A, Krakor R, et al. The evolution of minimally invasive valve surgery: 2 year experience. Eur J Cardiothorac Surg. 1999;15(3):233-8.
- 2. Poffo R, Bonin M, Selbach RA, Pilatti M. Troca valvar mitral minimamente invasiva videoassistida. Rev Bras Cir Cardiovasc. 2007;22(4):491-4.
- 3. Poffo R, Selbach RA, Mokross CA, Fukuti F, Pilatti M, Cidral I. Correção cirúrgica da comunicação inter-atrial: uma novaabordagem. In: 10ş Congresso da SICVESP; 2007; Águas de São Pedro; SP.
- Anais: Rev Bras Cir Cardiovasc. 2007;22(4):530.
- 4. Poffo R, Pope RB, Selbach RA, Cidral I. Solução de HTK (Custodiol®) na cirurgia valvar minimamente invasiva videoassistida: proteção miocárdica segura e eficaz. In: 36ş Congresso da Sociedade Brasileira de Cirurgia Cardiovascular; 2009; Belo Horizonte; MG.
- Anais: Rev Bras Cir Cardiovasc. 2009;24(1 supl):90.
- 5. Van Nooten G, Van Belleghem Y, Van Overbeke H, Caes F, François K, De Pauw M, et al. Redo mitral surgery using the Estech endoclamp. Heart Surg Forum. 2001;4(1):31-3.
- 6. Kottkamp H, Hindricks G, Hammel D, Autschbach R, Mergenthaler J, Borggrefe M, et al. Intraoperative radiofrequency ablation of chronic atrial fibrilation: a left atrial curative approach by elimination of anatomic "anchor" reentrant circuits. J Cardiovasc Electrophysiol. 1999;10(6):772-80.
- 7. Ryan WH, Cheirif J, Dewey TM, Prince SL, Mack MJ. Safety and efficacy of minimally invasive atrial septal defect closure. Ann Thorac Surg. 2003;75(5):1532-4.
- 8. Shetty DP, Dixit MD, Gan MD, Das MB, Harish R, Kapoor L, et al. Video-assisted closure of atrial septal defect. Ann Thorac Surg. 1996;62(3):940.
- 9. Chang CH, Lin PJ, Chu JJ, Liu HP, Tsai FC, Lin FC, et al. Video-assisted cardiac surgery in closure of atrial septal defect. Ann Thorac Surg. 1996;62(3):697-701.
- 10. Yakub MA, Pau KK, Awang Y. Minimally invasive "pocket incision" aortic valve surgery. Ann Thorac Cardiovasc Surg. 1999;5(1):36-9.
- 11. Benetti F, Rizzardi JL, Concetti C, Bergese M, Zappetti A. Minimally aortic valve surgery avoiding sternotomy. Eur J Cardiothorac Surg. 1999;16(Suppl 2):S84-5.
- 12. Carpentier A, Loulmet D, Carpentier A, Le Bret E, Haugades B, Dassier P, et al. Chirurgie à coeur ouvert par vidéo-chirurgie et mini-thoracotomie: premier cas (valvuloplastie mitrale) opéré avec succès. CR Acad Sci III. 1996;319(3):219-23.
- 13. Chitwood WR Jr, Wixon CL, Elbeery JR, Moran JF, Chapman WH, Lust RM. Video-assisted minimally invasive mitral valve surgery. J Thorac Cardiovasc Surg. 1997;114(5):773-80.
- 14. Mohr FW, Falk V, Diegeler A, Walther T, van Son JA, Autschbach R. Minimally invasive port-access mitral valve surgery. J Thorac Cardiovasc Surg. 1998;115(3):567-74.
- 15. Duhaylongsod FG. Minimally invasive cardiac surgery defined. Arch Surg. 2000;135(3):296-301.
- 16. Grossi EA, Galloway AC, LaPietra A, Ribakove GH, Ursomanno P, Delianides J, et al. Minimally invasive mitral valve surgery: a 6-year experience with 714 patients. Ann Thorac Surg. 2002;74(3):660-3.
- 17. Massetti M, Nataf P, Babatasi G, Khayat A. Cosmetic aspects in minimally invasive cardiac surgery. Eur J Cardiothoracic Surg. 1999;16(Suppl 2):S73-5.
- 18. Walther T, Falk V, Metz S, Diegeler A, Battelllini R, Autschbach R, et al. Pain and quality of life after minimally invasive versus conventional cardiac surgery. Ann Thorac Surg. 1999;67(6):1643-7.
- 19. Chitwood WR Jr. Current status of endoscopic and robotic mitral valve surgery.Ann Thorac Surg. 2005;79(6):S2248-53.
- 20. Modi P, Hassan A, Chitwood WR Jr. Minimally invasive mitral valve surgery: a systematic review and meta-analysis. Eur J Cardiothorac Surg. 2008;34(5):943-52.
- 21. Richardson L, Richardson M, Hunter S. Is a port-access mitral valve repair superior to the sternotomy approach in accelerating postoperative recovery? Interac Cardiovasc Thorac Surg. 2008;7(4):678-83.
- 22. Pitanguy I. Transareolar incision for augmentation mammaplasty. Aesthetic Plast Surg. 1978;2:363-72.
- 23. Mohr FW. Minimally invasive mitral valve repair: the Leipzig experience. In: 84th American Association for Thoracic Surgery Annual Meeting - Adult Cardiac Symposium; 2004; Toronto; Canadá. Anais: 84th AATS Annual Meeting - Adult Cardiac Symposium; 2004; 50-4.
- 24. Schroeyers P, Wellens F, De Geest R, Degrieck I, Van Praet F, Vermeulen Y, et al. Minimally invasive video-assisted mitral valve surgery: our lessons after a 4-year experience. Ann Thorac Surg. 2001;72(3):S1050-4.
- 25. Mack MJ. Cardiac surgery: the future is minimal! J Card Surg. 2000;15(1):6-8.
Endereço para correspondência:
Datas de Publicação
-
Publicação nesta coleção
08 Dez 2009 -
Data do Fascículo
Set 2009
Histórico
-
Aceito
27 Jul 2009 -
Recebido
13 Maio 2009