Resumos
A incidência de câncer gástrico espontâneo em ratos é extremamente rara. Por outro lado, embora o câncer experimental de estômago possa ser induzido por carcinógenos químicos, através da ressecção da região fúndica do estômago, pela vagotomia ou pelo refluxo, esses métodos apresentam um percentual de desenvolvimento tumoral baixo e errático. Além disso, geralmente decorre um longo período de tempo até o pleno crescimento do tumor. O presente trabalho procurou estabelecer um modelo de tumor experimental de crescimento rápido, uniforme e com elevado índice de pega, que permitisse a avaliação de novas terapêuticas para o tratamento do câncer gástrico. Para tanto, utilizou-se uma suspensão de células do carcinossarcoma 256 de Walker que foi inoculada no estômago através de uma cânula orogástrica. A implantação ocorreu na mucosa previamente lesionada por clampeadura da parede, nas regiões da junção esôfago-gástrica, pequena curvatura e grande curvatura. O crescimento tumoral ocorreu em todos os animais e, embora na junção esôfago-gástrica a incidência de pega tenha sido de apenas 20%, possivelmente em função do epitélio queratinizado, na pequena curvatura a incidência foi de 80% e na grande curvatura todos os animais apresentaram tumor. Esses dados demonstraram que é possível implantar o tumor em 100% dos animais inoculados, o que comprova a exequibilidade da técnica. A vantagem dessa metodologia sobre as outras já descritas na literatura, também usando o carcinossarcoma 256 de Walker, é que o tumor cresce a partir da mucosa, reproduzindo as condições de desenvolvimento do tumor gástrico espontâneo. A média de sobrevida dos animais inoculados é de 13,2±1,98 dias. Além disso, como o tumor se desenvolve em todos os animais inoculados, pode-se dispensar métodos radiológicos e ultra-sonográficos para evidenciar a sua presença. Trata-se, portanto, de um método simples e eficaz e que possibilita a implantação do tumor em um grande número de animais, facilitando, inclusive, o estudo do tumor em diversas fases do seu desenvolvimento, testes de novos fármacos e esquemas terapêuticos.
Tumor gástrico experimental; Modelo para avaliação de drogas anticâncer; Tumor de Walker
The spontaneous incidence of gastric cancer in rat is extremely low. Furthermore, the development of this type of cancer induced by chemical carcinogens, fundic resection, vagotomy or reflux is very low, erratic and takes several months. The present work developed a relatively easy and reliable method for topical implantation of a fast growth tumor in the rat gastric mucosa. Cells from Walker tumor were injected through a canula in the rat stomach previously injured by clamping the mucosa in three different gastric regions. The tumors were found 100% in the large curvature, 80% in the small curvature and 20% in the esophagogastric juction. The surviving time of the inoculated animals was 13,2±1,92 days. The neoplastic tissue showed a rapid and constant growth pattern and it has allowed to inoculate a large series of rats.
Experimental gastric tumor; Drug evaluation tumor model; Walker tumor
11 Artigo do Laboratório de Oncologia Experimental do Departamento de Fisiologia e Farmacologia da Faculdade de Medicina da Universidade Federal do Ceará . Artigo do Laboratório de Oncologia Experimental do Departamento de Fisiologia e Farmacologia da Faculdade de Medicina da Universidade Federal do Ceará .2 Cirurgião, Mestre em Farmacologia e aluno de doutorado do curso de pós-graduação em Farmacologia da Universidade Federal do Ceará.3 Bolsista de iniciação científica do PIBIC/CNPq no laboratório de Oncologia Experimental do Departamento de Fisiologia e Farmacologia da UFC.4 Professor Adjunto do Departamento de Patologia e Medicina Legal da Faculdade de Medicina da UFC. 5 Ph.D. em Oncologia Experimental, Professor Adjunto do Departamento de Fisiologia e Farmacologia e coordenador da disciplina de Oncologia da Faculdade de Medicina da UFC.
Paulo Ferdinando de Melo Oliveira21 Artigo do Laboratório de Oncologia Experimental do Departamento de Fisiologia e Farmacologia da Faculdade de Medicina da Universidade Federal do Ceará . Artigo do Laboratório de Oncologia Experimental do Departamento de Fisiologia e Farmacologia da Faculdade de Medicina da Universidade Federal do Ceará .2 Cirurgião, Mestre em Farmacologia e aluno de doutorado do curso de pós-graduação em Farmacologia da Universidade Federal do Ceará.3 Bolsista de iniciação científica do PIBIC/CNPq no laboratório de Oncologia Experimental do Departamento de Fisiologia e Farmacologia da UFC.4 Professor Adjunto do Departamento de Patologia e Medicina Legal da Faculdade de Medicina da UFC. 5 Ph.D. em Oncologia Experimental, Professor Adjunto do Departamento de Fisiologia e Farmacologia e coordenador da disciplina de Oncologia da Faculdade de Medicina da UFC.
Iuri Aderaldo Henriques31 Artigo do Laboratório de Oncologia Experimental do Departamento de Fisiologia e Farmacologia da Faculdade de Medicina da Universidade Federal do Ceará . Artigo do Laboratório de Oncologia Experimental do Departamento de Fisiologia e Farmacologia da Faculdade de Medicina da Universidade Federal do Ceará .2 Cirurgião, Mestre em Farmacologia e aluno de doutorado do curso de pós-graduação em Farmacologia da Universidade Federal do Ceará.3 Bolsista de iniciação científica do PIBIC/CNPq no laboratório de Oncologia Experimental do Departamento de Fisiologia e Farmacologia da UFC.4 Professor Adjunto do Departamento de Patologia e Medicina Legal da Faculdade de Medicina da UFC. 5 Ph.D. em Oncologia Experimental, Professor Adjunto do Departamento de Fisiologia e Farmacologia e coordenador da disciplina de Oncologia da Faculdade de Medicina da UFC.
Filadelfo Rodrigues Filho31 Artigo do Laboratório de Oncologia Experimental do Departamento de Fisiologia e Farmacologia da Faculdade de Medicina da Universidade Federal do Ceará . Artigo do Laboratório de Oncologia Experimental do Departamento de Fisiologia e Farmacologia da Faculdade de Medicina da Universidade Federal do Ceará .2 Cirurgião, Mestre em Farmacologia e aluno de doutorado do curso de pós-graduação em Farmacologia da Universidade Federal do Ceará.3 Bolsista de iniciação científica do PIBIC/CNPq no laboratório de Oncologia Experimental do Departamento de Fisiologia e Farmacologia da UFC.4 Professor Adjunto do Departamento de Patologia e Medicina Legal da Faculdade de Medicina da UFC. 5 Ph.D. em Oncologia Experimental, Professor Adjunto do Departamento de Fisiologia e Farmacologia e coordenador da disciplina de Oncologia da Faculdade de Medicina da UFC.
Paulo Roberto Carvalho de Almeida41 Artigo do Laboratório de Oncologia Experimental do Departamento de Fisiologia e Farmacologia da Faculdade de Medicina da Universidade Federal do Ceará . Artigo do Laboratório de Oncologia Experimental do Departamento de Fisiologia e Farmacologia da Faculdade de Medicina da Universidade Federal do Ceará .2 Cirurgião, Mestre em Farmacologia e aluno de doutorado do curso de pós-graduação em Farmacologia da Universidade Federal do Ceará.3 Bolsista de iniciação científica do PIBIC/CNPq no laboratório de Oncologia Experimental do Departamento de Fisiologia e Farmacologia da UFC.4 Professor Adjunto do Departamento de Patologia e Medicina Legal da Faculdade de Medicina da UFC. 5 Ph.D. em Oncologia Experimental, Professor Adjunto do Departamento de Fisiologia e Farmacologia e coordenador da disciplina de Oncologia da Faculdade de Medicina da UFC.
Manoel Odorico Moraes51 Artigo do Laboratório de Oncologia Experimental do Departamento de Fisiologia e Farmacologia da Faculdade de Medicina da Universidade Federal do Ceará . Artigo do Laboratório de Oncologia Experimental do Departamento de Fisiologia e Farmacologia da Faculdade de Medicina da Universidade Federal do Ceará .2 Cirurgião, Mestre em Farmacologia e aluno de doutorado do curso de pós-graduação em Farmacologia da Universidade Federal do Ceará.3 Bolsista de iniciação científica do PIBIC/CNPq no laboratório de Oncologia Experimental do Departamento de Fisiologia e Farmacologia da UFC.4 Professor Adjunto do Departamento de Patologia e Medicina Legal da Faculdade de Medicina da UFC. 5 Ph.D. em Oncologia Experimental, Professor Adjunto do Departamento de Fisiologia e Farmacologia e coordenador da disciplina de Oncologia da Faculdade de Medicina da UFC.
Acta Cir. Bras., 13(4):243-8, 1998.
RESUMO: A incidência de câncer gástrico espontâneo em ratos é extremamente rara. Por outro lado, embora o câncer experimental de estômago possa ser induzido por carcinógenos químicos, através da ressecção da região fúndica do estômago, pela vagotomia ou pelo refluxo, esses métodos apresentam um percentual de desenvolvimento tumoral baixo e errático. Além disso, geralmente decorre um longo período de tempo até o pleno crescimento do tumor. O presente trabalho procurou estabelecer um modelo de tumor experimental de crescimento rápido, uniforme e com elevado índice de pega, que permitisse a avaliação de novas terapêuticas para o tratamento do câncer gástrico. Para tanto, utilizou-se uma suspensão de células do carcinossarcoma 256 de Walker que foi inoculada no estômago através de uma cânula orogástrica. A implantação ocorreu na mucosa previamente lesionada por clampeadura da parede, nas regiões da junção esôfago-gástrica, pequena curvatura e grande curvatura. O crescimento tumoral ocorreu em todos os animais e, embora na junção esôfago-gástrica a incidência de pega tenha sido de apenas 20%, possivelmente em função do epitélio queratinizado, na pequena curvatura a incidência foi de 80% e na grande curvatura todos os animais apresentaram tumor. Esses dados demonstraram que é possível implantar o tumor em 100% dos animais inoculados, o que comprova a exequibilidade da técnica. A vantagem dessa metodologia sobre as outras já descritas na literatura, também usando o carcinossarcoma 256 de Walker, é que o tumor cresce a partir da mucosa, reproduzindo as condições de desenvolvimento do tumor gástrico espontâneo. A média de sobrevida dos animais inoculados é de 13,2±1,98 dias. Além disso, como o tumor se desenvolve em todos os animais inoculados, pode-se dispensar métodos radiológicos e ultra-sonográficos para evidenciar a sua presença. Trata-se, portanto, de um método simples e eficaz e que possibilita a implantação do tumor em um grande número de animais, facilitando, inclusive, o estudo do tumor em diversas fases do seu desenvolvimento, testes de novos fármacos e esquemas terapêuticos.
DESCRITORES: Tumor gástrico experimental. Modelo para avaliação de drogas anticâncer. Tumor de Walker.
INTRODUÇÃO
Em função da sua elevada incidência em nosso meio13 e da ineficência dos tratamentos até então preconizados16, o conhecimento da história natural do câncer gástrico é de fundamental importância para que se possa buscar novas opções terapêuticas e estabelecer prognósticos mais precisos no tratamento dessa patologia. Uma das formas mais adequadas de se fazer esse tipo de estudo é através de tumores experimentais. Entretanto, a incidência de tumores gástricos espontâneos em animais de laboratório é extremamente rara5. Uma outra opção, através de carcinógenos químicos, é errática e bastante demorada15,16,21. O mesmo acontece com as alterações neoplásicas provocadas pela ressecção da região fúndica do estômago1,8, pela vagotomia17,22, e pelo refluxo14,10. SUKOVATYKH19 descreveu um método de desenvolvimento de um tumor através da implantação de uma pequena cápsula contendo células tumorais do carcinossarcoma 256 de Walker perto da serosa. ACKERMAN2 também descreveu um outro método de implantação do mesmo tumor através da inoculação de suas células com uma agulha fina entre a mucosa e a serosa. Ambos os casos resultaram em tumores que se desenvolveram rapidamente invadindo prematuramente a cavidade peritoneal, impedindo dessa forma o estudo do tumor e do seu tratamento no órgão alvo. Mesmo assim, os dois modelos se desenvolviam a partir da serosa e não da região glandular como ocorre espontaneamente com o câncer gástrico. Daí a necessidade de se estabelecer outros modelos de tumores experimentais que permitam a avaliação segura e eficaz de novas modalidades de terapêutica. Para essa finalidade, o modelo animal deve apresentar elevado índice de pega, fácil manuseio nos testes laboratoriais e um comportamento biológico semelhante ao do tumor gástrico. Fundamentado nesses princípios o presente trabalho se propôs a desenvolver um modelo que atendesse as essas expectativas utilizando o carcinossarcoma 256 de Walker6, pois, trata-se de uma neoplasia bem caracterizada, facilmente mantida em laboratório, de crescimento rápido e uniforme, que raramente apresenta regressões e a sua eficiência já foi comprovada em testes terapêuticos11.
MÉTODO
O modelo utilizado foi desenvolvido em nosso laboratório a partir da implantação do carcinossarcoma 256 de Walker no estômago de rato. O tumor de Walker nos foi gentilmente cedido, em 1992, pelo professor Rui Curi, do Instituto de Ciências Biológicas da Universidade de São Paulo e vem, desde então, sendo mantido no Laboratório de Oncologia Experimental da Universidade Federal do Ceará, através de transplantes sucessivos a cada 10 a 12 dias. Após esse período de evolução, o tumor foi retirado dos animais doadores e colocado em uma placa de Petri contendo 9 ml de Ringer com lactato e 1 ml de cloranfenicol (100 mg/ml). O tecido foi então transferido, sem focos necróticos, para outra placa de Petri contendo a mesma solução de Ringer com lactato e cloranfenicol, onde foi triturado em pequenos fragmentos de 2mm, em média, que aí permaneceram incubados por 3 minutos. Esses fragmentos foram, em seguida, colocados em um Erlenmeyer estéril e submetidos a um agitador com bala magnética por 5 minutos. Posteriormente, o homogenato foi filtrado em gaze estéril e 1 mL da suspensão contendo 106 células foi inoculado, por via intramuscular, na face interna da coxa direita de ratos Wistar, machos, com 6 a 8 semanas de idade, pesando entre 100 e 120 g.
Para a inoculação no estômago foram utilizados ratos Wistar, adultos, machos, com 10 a 12 semanas, pesando entre 180 e 200g, provenientes do Biotério Central da Universidade Federal do Ceará. Os animais foram divididos, aleatoriamente, em grupos de 10 e 12 ratos para inoculação do tumor e mantidos em jejum por 24 horas, com água ad libitum. Após anestesia por via inalatória com éter e antissepsia com polvidine (polivinilpirrolidona), foi realizada uma laparotomia por incisão mediana, com elevação de 5 cm do estômago do animal para fora da incisão. Um catéter de polietileno de 2 mm foi introduzido através da boca, orofaringe e esôfago, chegando até o estômago. Através desse tubo foi injetado 1 mL da suspensão de células tumorais no estômago. Previamente a inoculação, a mucosa gástrica foi lesionada por clampeadura na junção esôfago-gástrica, grande curvatura e pequena curvatura, usando para tal uma pinça hemostática de 15 cm e tendo-se o cuidado para não perfurar a parede do estômago (figura 1). Posteriormente, a parede abdominal foi suturada com mononylon 4 zeros. Desde o pós-operatório imediato os animais ficaram sob dieta ad libitum tanto para água como para alimentos sólidos.
Na padronização da metodologia, os animais foram divididos em 1 grupo de 12 animais e 3 grupos de 10 animais cada. Todos foram observados diariamente, até o dia do sacrifício ou morte espontânea. O grupo 1 teve o intuito de estabelecer o índice de pega do tumor. Para tanto, os animais foram inoculados seguindo a técnica já descrita e sacrificados no décimo primeiro dia após o implante do tumor. No grupo 2, os animais foram inoculados pela mesma técnica e observados até a sua morte espontânea. Esse grupo objetivou estudar a média de sobrevida dos animais. No grupo 3 foi utilizado o modelo de implantação semelhante aos anteriores, substituindo a suspensão de células tumorais por uma solução salina a 0,9%. Os animais foram sacrificados no quadragésimo dia. O grupo 4 foi inoculado com a mesma suspensão de células tumorais sem a clampeadura da mucosa gástrica. Os animais também foram sacrificados no quadragésimo dia.
RESULTADOS
No grupo 1, onde se procurou estabelecer o índice de pega dos tumores, dois animais morreram no pós operatório imediato (5 e 12 horas), sendo, portanto, excluídos do estudo. Um outro morreu no décimo dia de evolução tumoral e os demais foram sacrificados no décimo primeiro dia. O exame macro e microscópico evidenciou a implantação do tumor em todos os oito animais, o que denota um índice de pega de 100%. Embora a implantação tenha ocorrido com mais eficiência na grande curvatura, onde todos os animais inoculados apresentaram tumor, 8/10 apresentaram tumor na pequena curvatura e 2/10 apresentaram tumor e na junção gastro-esofágica (figura 2).
: Locais de implantação do tumor e índice de pega: grande curvatura (a) 100%, pequena curvatura (b) 80% e junção esôfago-gástrica (c) 20%.
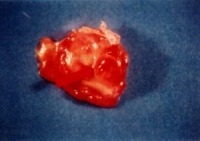
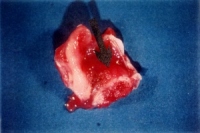
As figuras 3a e 3b mostram o desenvolvimento macroscópico do tumor na região da grande curvatura do estômago, nas faces interna e externa, respectivamente. O tumor de cor amarelada, bastante vascularizado, apresenta em média entre 1,5 a 2,0 cm de diâmetro, elevando a superfície da mucosa do estômago e infiltrando as outras camadas, chegando algumas vezes a invadir a cavidade peritoneal e órgãos circunjacentes, como o fígado e pâncreas. Alguns casos, em função da obstrução do piloro, ocorreu dilatação no estômago. Não foram observadas metástases à distância.
: Fotografia do tumor mostrando o desenvolvimento neoplástico na grande curvatura na parte externa do estômago.
: Fotografia do tumor mostrando o desenvolvimento neoplásico na grande curvatura na parte interna do estômago, evidenciando ulceração na mucosa.
Antes do sacrifício dos animais, fez-se também um estudo radiológico do tumor como forma de estabelecer outro parâmetro que confirmasse a presença do tumor em grupos de animais que não fossem ser sacrificados. Dessa forma, caso não houvesse um índice de 100% de pega, poder-se-ia selecionar para os demais experimentos apenas os animais portadores de tumor. Na figura 4b, incidência em perfil, evidencia-se a presença do tumor através da região de subtração na imagem radiológica, enquanto que na figura 4a, pode-se constatar a típica imagem em ponta de lápis característica do estreitamento esofágico pelo crescimento do tumor na transição esôfago-gástrica.
: Radiologia em perfil de um rato portador do tumor gástrico experimental, ressaltando a imagem em ponta do lápis, característica do desenvolvimento da massa tumoral na junção esôfago-gástrica.
: Radiologia em perfil de um rato portador do tumor gástrico experimental, ressaltando a imagens de substração locais de implantação da neoplasia.
Nas figuras 5a e 5b, correspondente a uma das regiões de inoculação do tumor, constata-se a invasão da mucosa e sua infiltração através do interstício glandular. Nessa região evidencia-se a presença de ulcerações macro e microscópicas na parede do estômago. Numa etapa seguinte o tumor se dissemina infiltrando maciçamente a submucosa (figura 5c), onde também apresenta inúmeras figuras de mitose. A figura 5d mostra, na região esôfago-gástrica, onde o epitélio é queratinizado, células tumorais invadindo a mucosa e submucosa do esôfago. O tumor, como um todo, exibe um padrão misto, carcinossarcomatoso, semelhante ao tumor original. Demonstra-se, nesses achados, que o modelo de tumor experimental proposto, pelas características da sua implantação, reproduz o desenvolvimento do tumor gástrico espontâneo, que se inicia na mucosa mas evolui principalmente em direção às camadas submucosa, muscular e serosa, preservando parcialmente a mucosa.
: Célula do tumor experimental de estômago infiltrando o interstício entre as glândulas da mucosa 9 (HE 200X).
: Célula do tumor experimental de estômago infiltrando a mucosa e submucosa da junção esôfago-gástrica (HE 200X).
Em 2 casos o tumor invadiu órgãos circunjacentes, como fígado e pâncreas, chegando em um deles a ficar aderido à parede abdominal. Ascite de natureza hemorrágica foi também observada em 3 casos mais avançados da doença. A peritonite difusa foi encontrada em 1 caso, onde observou-se destruição parcial do estômago e de outras vísceras abdominais.
Os tumores foram mensurados em todos os animais e a massa tumoral foi calculada subtraindo-se a média dos pesos dos estômagos de animais normais de mesmo peso médio e idade pelo do peso dos estômagos dos animais inoculados com o tumor, obtendo-se um peso médio de 4,8 ± 0,6 g.
O grupo 2 avaliou a sobrevida dos animais inoculados. Dois desses animais morreram no décimo dia, um no décimo segundo dia, cinco no décimo terceiro dia, um no décimo quarto dia e um no décimo oitavo dia após a inoculação, todos com tumores implantados nos locais previamente lesionados. A média de sobrevida dos animais portadores de tumor foi de 13,2±1,98 dias. O tumor, com características histológicas carcinossarcomatosa semelhante ao original, estava presente em todos os animais o que foi comprovado através de exames histopatológicos.
Em nenhum dos animais do terceiro e quarto grupos, usados como controle e sacrificados no quadragésimo dia pós-inoculação, foi constatado desenvolvimento tumoral ou qualquer ulceração da mucosa gástrica nos locais de implantação o que mostra a eficiente reconstituição da mucosa.
DISCUSSÃO
Os resultados do presente trabalho, onde o índice de pega do carsinossarcoma 256 de Walker inoculado na mucosa gástrica foi 100%, atestam a viabilidade da técnica de implantação mecânica do tumor pela lesão da mucosa por clampeadura e inoculação simultânea de células através de uma sonda orogástrica. A referida técnica se mostrou bem mais fácil e tão eficiente quanto a de outros autores que utilizaram a implantação de cápsulas intra-abdominais3 ou a injeção de células entre as camadas muscular e mucosa2. Além disso, mesmo não sendo uma neoplasia originalmente desenvolvida no estômago, o tumor cresce a partir de uma lesão na mucosa, reproduzindo a biologia do tumor gástrico espontâneo20 e também apresenta elevado grau de agressividade o que contribui para avaliar a eficiência de novos métodos terapêuticos.
Ficou evidente, que existe a necessidade de concomitância entre a inoculação de células tumorais e a lesão da mucosa gástrica, já que ao serem introduzidas células sem provocar lesão da mucosa, não houve desenvolvimento tumoral. Da mesma forma que o simples estímulo de salina na mucosa lesada também não provocou desenvolvimento neoplásico. Além disso, nenhum crescimento tumoral foi observado fora das áreas lesionadas. Esses achados confirmam conclusões prévias de POTH e colaboradores12 e COHN4 de que não há implantação tumoral na mucosa íntegra.
Dos três sítios gástricos escolhidos para o acestamento tumoral, a grande curvatura com 100% e a pequena curvatura com 80% de pega, mostraram maior facilidade para implantação do que na junção esôfago-gástrica (cárdia) com apenas 20%. Isso ocorreu, possivelmente, devido a presença de queratina que normalmente compõe a parede esofágica dos roedores e que funcionaria como obstáculo para o implante do tumor nessa região9.
Embora o índice de pega tenha sido de 100% na grande curvatura, a utilização dos três sítios deu a certeza do implante em todos os animais, além de permitir a análise do crescimento da neoplasia nas três áreas mais comuns de desenvolvimento tumoral no estômago20. Evidentemente, em vários casos o tumor se desenvolveu simultaneamente em dois ou até nos três locais de inoculação, o que, nesse caso, o diferencia do modelo do tumor espontâneo de estômago que rarissimamente aparece simultaneamente em mais de um local18. Mas, isso torna o modelo mais confiável, e exclui a necessidade de métodos auxiliares radiológicos e ultra-sonográficos para comprovação do diagnóstico de certeza do crescimento tumoral.
Ao contrário dos achados de IWANA DE MATOS & FRANCO7, que evidenciaram a presença de tumores secundários em vários órgãos dos animais inoculados por via intramuscular com o carcinossarcoma 256 de Walker, o tumor que se desenvolveu no estômago, mesmo sendo ricamente vascularizado e extremamente invasivo, não apresentou metástases a distância, o que possivelmente ocorreu em função da sua agressividade em um órgão vital, cuja evolução do tecido neoplásico dificultava a ingesta alimentar impedindo a sobrevivência do animal até o aparecimento de focos metastáticos secundários.
CONCLUSÃO
Trata-se de um método de simples exequibilidade que possibilita a implantação do tumor no estômago de um grande número de animais, facilitando, inclusive, o estudo da neoplasia em diversas fases do seu desenvolvimento, além de permitir a realização de testes de novos fármacos e esquemas terapêuticos.
REFERÊNCIAS
1. ACKERMAN, N.B. - Fundic resection in rats and its long term effect on development of gastric cancer. Gastroenterology, 53:280-7, 1967.
2. ACKERMAN, N.B. - The natural history of tumors implanted beneath the gastric serosa in rats. Am. J. Surg., 119:646-8, 1970.
3. AGOSTINO, D.; SEAL, S.H. & NICKSON, J.J. - Capsule implantation: Method for establishing simulated colon carcinoma in rats. Proc. Soc. Exp. Biol. Med., 100: 717-8, 1959.
4. COHN Jr., I. - Implantation in cancer of the colon. Surg.Gynec. Obstet., 124: 500-8, 1967.
5. CRAIN, R. - Spontaneous tumors in the Rochester strain of the Wistar rat. Am. J. Path., 34: 311-35, 1958.
6. EARLE, W.R. - A study of the Walker rat mammary carcinoma 256, in vivo and in vitro. Am. J. Cancer, 24: 566-612, 1935.
7. IWANA DE MATTOS, M.C.F.; MONTENEGRO, M.R. & SILVA, C.R.V. - Walker 256 carcinossarcoma: Pathologic microscopic and ultrastructural features of the tumoral circulating cells. Ciência e Cultura, 32(7): 849-57, 1980.
8. LANGHANS, P.; HEGER, R.A.; HOHENSTEIN, J.; SCHLAKE, W.; BÜNTE, H. - Operation sequel carcinoma of the stomach: Experimental studies of surgical techniques with and without resection. World J. Surg., 5: 595-605, 1981.
9. MACHELLA, T.E. & GRIFFITH Jr., J.Q. - The digestive system. In: The rat in laboratory investigation, FARRIS, L. & GRIFFITH Jr., J.Q. edts., p 166-179, J.B. Lippincott Company, Philadelphia, 1968.
10. MIWA, K.; HASEGAWA, H.; FIGIMURA, T.; MATSUMOTO, H.; MIYATA, R.; KOSAKA, T.; MIYAZAKI, I. & HATTORI, T. - Duodenal reflux through the pylorus induces gastric adenocarcinoma in the rat. Carcinogenesis, 13: 2313-6, 1992.
11. MORAES, M.O.; FONTELES, M.C.; MORAES, M.E.A.; MACHADO, M.I.L. & MATOS, F.J.A. - Screening for Anticancer Activity od Plants from the Northeast of Brazil, Fitoterapia 68(3): 235-40, 1997.
12. POTH, E.J.; JACOBSEN, L.W. & DUNLOP, W. - Control of tumours transplantations after primary anastomosis of the colon. Surgery, 49: 723-6, 1961.
13. PRO ONCO/INCA - Estimativa da incidência e mortalidade por câncer no Brasil, Instituto Nacional do Câncer, Rio de Janeiro, 1997.
14. RITCHIE, W.P. - Alkaline reflux gastritis: a critical reappraisal. Gut, 25: 975-87, 1984.
15. SCHOENTAL, R. Induction of tumors of the stomach in rats and mice by N-nitroso-alkyluretanes. Nature, 199: 190-3, 1963.
16. SIGIMURA, T.; FUGIMURA, S.; BABA, T. Tumor production in the glandular stomach and alimentary tract of the rat by N-Methyl-N'-Nitro-N-Nitrosoguanidine. Cancer Res., 30: 455-9, 1970.
17. SOMASUNDARAN, K. & GANGULY, A.K. - Effect of vagal stimulation on gastric mucosal barrier in albino rats. Arq. Gastroenterol., 24: 75-9, 1987.
18. SUGIMURA, T. & SASAKO, M. - Gastric cancer. 1. ed. Tokyo, Oxford University Press, 1997.
19. SUKOVATYKH, L.S.; FISHER, M.E.; MAKKAVEEVA, M.; FRADKIN Jr., S.Z.; MASHEVESKY, A.A.; ELJPERIN, B.M. & STANKEVICH, M.P. - The study of carcinemia and metastazing of the Walker carcinosarcoma implanted in gastric wall. Vopr. Onkol., 16: 60-3, 1970.
20. TAHARA, E. - Pathology of Gastric Cancer. In: SURGIMURA, T. & SASAKO, M. Gastric cancer. 1. ed. Tokyo, Oxford University Press, 1997. p 100-8.
21. TATEMATSU, M.; YAMAMOTO, M.; IWATA, H.; FUCAMI, H.; YUASA, H. TEZUKA, N.; MASUI, T.; NAKANISHI, H. - Induction of glandular stomach cancer in CBH mice treated with N-Methyl-N-Nitrosurea in the drinking water. Jpn. J. Cancer Res., 84:1258-64, 1993.
22. TATSUTA, M.; LISHI, H.; YAMAMURA, H.; BABA, M. & TANIGUCHI, H. - Effects of bilateral and unilateral vagotomy on gastric carcinogenesis induced by N-Methyl-N'-Nitro-N-Nitrosoguanidine in Wistar rats. Int. J. Cancer, 42: 414-8, 1988.
OLIVEIRA, P.F.M.; HENRIQUES, I.A.; RODRIGUES-FILHO, F.; ALMEIDA, P.R.C. & MORAES, M.O. - A model of experimental tumor obtained by the inoculation of Walker tumor in rat stomach. Acta Cir.Bras.,13(4):243-8, 1998.
SUMMARY: The spontaneous incidence of gastric cancer in rat is extremely low. Furthermore, the development of this type of cancer induced by chemical carcinogens, fundic resection, vagotomy or reflux is very low, erratic and takes several months. The present work developed a relatively easy and reliable method for topical implantation of a fast growth tumor in the rat gastric mucosa. Cells from Walker tumor were injected through a canula in the rat stomach previously injured by clamping the mucosa in three different gastric regions. The tumors were found 100% in the large curvature, 80% in the small curvature and 20% in the esophagogastric juction. The surviving time of the inoculated animals was 13,2±1,92 days. The neoplastic tissue showed a rapid and constant growth pattern and it has allowed to inoculate a large series of rats.
SUBJECT HEADINGS: Experimental gastric tumor. Drug evaluation tumor model. Walker tumor.
Endereço para correspondência:
Dr. Manoel Odorico Moraes
Laboratório de Oncologia Experimental
Departamento de Fisiologia e Farmacologia da UFC
Rua Cel. Nunes de Melo 1127 - Caixa Postal 3157
60.431-970 Fortaleza - Ceará
Fone: 085 243 9201 - FAX: 085 243 9333
e-mail: odorico@roadnet.com.br
Data do recebimento: 11.08.98
Data da revisão: 02.09.98
Data da aprovação:05.10.98
- 1. ACKERMAN, N.B. - Fundic resection in rats and its long term effect on development of gastric cancer. Gastroenterology, 53:280-7, 1967.
- 2. ACKERMAN, N.B. - The natural history of tumors implanted beneath the gastric serosa in rats. Am. J. Surg, 119:646-8, 1970.
- 3. AGOSTINO, D.; SEAL, S.H. & NICKSON, J.J. - Capsule implantation: Method for establishing simulated colon carcinoma in rats. Proc. Soc. Exp. Biol. Med., 100: 717-8, 1959.
- 4. COHN Jr., I. - Implantation in cancer of the colon. Surg.Gynec. Obstet, 124: 500-8, 1967.
- 5. CRAIN, R. - Spontaneous tumors in the Rochester strain of the Wistar rat. Am. J. Path, 34: 311-35, 1958.
- 6. EARLE, W.R. - A study of the Walker rat mammary carcinoma 256, in vivo and in vitro Am. J. Cancer, 24: 566-612, 1935.
- 7. IWANA DE MATTOS, M.C.F.; MONTENEGRO, M.R. & SILVA, C.R.V. - Walker 256 carcinossarcoma: Pathologic microscopic and ultrastructural features of the tumoral circulating cells. Cięncia e Cultura, 32(7): 849-57, 1980.
- 8. LANGHANS, P.; HEGER, R.A.; HOHENSTEIN, J.; SCHLAKE, W.; BÜNTE, H. - Operation sequel carcinoma of the stomach: Experimental studies of surgical techniques with and without resection. World J. Surg, 5: 595-605, 1981.
- 9. MACHELLA, T.E. & GRIFFITH Jr., J.Q. - The digestive system. In: The rat in laboratory investigation, FARRIS, L. & GRIFFITH Jr., J.Q. edts., p 166-179, J.B. Lippincott Company, Philadelphia, 1968.
- 10. MIWA, K.; HASEGAWA, H.; FIGIMURA, T.; MATSUMOTO, H.; MIYATA, R.; KOSAKA, T.; MIYAZAKI, I. & HATTORI, T. - Duodenal reflux through the pylorus induces gastric adenocarcinoma in the rat. Carcinogenesis, 13: 2313-6, 1992.
- 11. MORAES, M.O.; FONTELES, M.C.; MORAES, M.E.A.; MACHADO, M.I.L. & MATOS, F.J.A. - Screening for Anticancer Activity od Plants from the Northeast of Brazil, Fitoterapia 68(3): 235-40, 1997.
- 12. POTH, E.J.; JACOBSEN, L.W. & DUNLOP, W. - Control of tumours transplantations after primary anastomosis of the colon. Surgery, 49: 723-6, 1961.
-
13PRO ONCO/INCA - Estimativa da incidência e mortalidade por câncer no Brasil, Instituto Nacional do Câncer, Rio de Janeiro, 1997.
- 14. RITCHIE, W.P. - Alkaline reflux gastritis: a critical reappraisal. Gut, 25: 975-87, 1984.
- 15. SCHOENTAL, R. Induction of tumors of the stomach in rats and mice by N-nitroso-alkyluretanes. Nature, 199: 190-3, 1963.
- 16. SIGIMURA, T.; FUGIMURA, S.; BABA, T. Tumor production in the glandular stomach and alimentary tract of the rat by N-Methyl-N'-Nitro-N-Nitrosoguanidine. Cancer Res, 30: 455-9, 1970.
- 17. SOMASUNDARAN, K. & GANGULY, A.K. - Effect of vagal stimulation on gastric mucosal barrier in albino rats. Arq. Gastroenterol, 24: 75-9, 1987.
- 18. SUGIMURA, T. & SASAKO, M. - Gastric cancer. 1. ed. Tokyo, Oxford University Press, 1997.
- 19. SUKOVATYKH, L.S.; FISHER, M.E.; MAKKAVEEVA, M.; FRADKIN Jr., S.Z.; MASHEVESKY, A.A.; ELJPERIN, B.M. & STANKEVICH, M.P. - The study of carcinemia and metastazing of the Walker carcinosarcoma implanted in gastric wall. Vopr. Onkol., 16: 60-3, 1970.
- 20. TAHARA, E. - Pathology of Gastric Cancer. In: SURGIMURA, T. & SASAKO, M. Gastric cancer. 1. ed. Tokyo, Oxford University Press, 1997. p 100-8.
- 21. TATEMATSU, M.; YAMAMOTO, M.; IWATA, H.; FUCAMI, H.; YUASA, H. TEZUKA, N.; MASUI, T.; NAKANISHI, H. - Induction of glandular stomach cancer in CBH mice treated with N-Methyl-N-Nitrosurea in the drinking water. Jpn. J. Cancer Res., 84:1258-64, 1993.
- 22. TATSUTA, M.; LISHI, H.; YAMAMURA, H.; BABA, M. & TANIGUCHI, H. - Effects of bilateral and unilateral vagotomy on gastric carcinogenesis induced by N-Methyl-N'-Nitro-N-Nitrosoguanidine in Wistar rats. Int. J. Cancer, 42: 414-8, 1988.
Datas de Publicação
-
Publicação nesta coleção
14 Jan 1999 -
Data do Fascículo
Out 1998