Resumos
Vários métodos são utilizados para avaliar e estimar as lesões intestinais de isquemia e reperfusão (IR). Assim, o objetivo do presente trabalho é realizar o estudo comparativo dos aspectos colorimétrico e histológico da lesão intestinal após IR. Para tal, foram utilizados 30 ratos Wistar, machos, pesando entre 310 a 410g, distribuídos em 3 grupos: Grupo Controle (GC), Grupo Isquemia e Reperfusão-1 (GIR-1) e Grupo Isquemia e Reperfusão-3 (GIR-3), com 10 animais cada. Nos grupos GIR-1 e GIR-3 foi realizada isquemia intestinal, por meio de falsa ligadura da artéria mesentérica anterior, durante 30 minutos e após esta a perfusão sangüínea foi restaurada. Estes animais foram submetidos a eutanásia após 1 e 3 dias de reperfusão, respectivamente, sendo colhido material para realização dos estudos colorimétrico, usando o Methyl Thiazolyl Blue (MTT) e histológico pela hematoxilina e eosina. Os resultados obtidos demonstraram uma menor proporção de células viáveis e um maior grau de lesão da túnica mucosa nos animais do grupo GIR-3 em relação ao controle (p<0,05). Desta forma os autores concluem que o estudo colorimétrico, usando o MTT, mostrou-se tão eficaz e confiável quanto o estudo histológico na avaliação das repercussões intestinais produzidas pela IR deste órgão.
Isquemia; Reperfusão; Sais tetrazólicos; Intestino; Ratos
Many methods are used to evaluate ischemia reperfusion injury, but the most employed one is the histological study. However, it only demonstrates on mucosal tunic, the index of lesion and morphologic preserved cells, but not the index of viable functional cells, present in the sample. With this purpose, a colorimetric method was used, employing Methyl Thiazolyl Blue (MTT). The experiment was conducted in 30 Wistar male rats, distributed in 3 groups: Group Control (GC), Group ischemia and reperfusion-1 (GIR-1) and Group ischemia and reperfusion-3 (GIR-3), with 10 animals each. The Groups GIR-1 and GIR-3 were submitted to intestinal ischemia for 30 minutes by a false ligature of superior mesenteric artery, and submitted to euthanasia after 1 and 3 days of reperfusion, when material was picked for absorbency and histological procedures. It was observed a smaller proportion of viable cells and a larger degree of mucosal lesion in GIR-3 group (p<0.05), while GC group was the one with the larger proportion of viable cells and smaller degree of the mucosal injury (p<0.05). This way we concluded that MTT is as effective and reliable as the histological study at evaluating alterations produced by intestinal ischemia-reperfusion.
Ischemia; Reperfusion; Tetrazolium salts; Intestine; Rats
5 ORIGINAL ARTICLE
LESÃO INTESTINAL APÓS ISQUEMIA-REPERFUSÃO: ESTUDO COMPARATIVO USANDO SAL TETRAZÓLICO (MTT) E HISTOLOGIA1 1 Trabalho realizado no Laboratório de Cirurgia Experimental da Universidade do Estado do Pará (LCE-UEPA), com apoio do Instituto Evandro Chagas, FUNTEC-SECTAM e EMBRAPA. 2 Professor Adjunto da Disciplina de Técnica Operatória e Cirurgia Experimental do Departamento de Saúde Integrada do Centro de Ciências Biológicas e da Saúde (DSIN-CCBS-UEPA). 3 Patologista, chefe do Departamento de Patologia da Universidade Federal do Pará (UFPA). 4 Médica formada pela UFPA em 1999. 5 Graduando do curso de Medicina da UFPA. 6 Graduando do curso de Medicina da UEPA; estagiário do LCE-UEPA.
Marcus Vinicius Henriques Brito2 1 Trabalho realizado no Laboratório de Cirurgia Experimental da Universidade do Estado do Pará (LCE-UEPA), com apoio do Instituto Evandro Chagas, FUNTEC-SECTAM e EMBRAPA. 2 Professor Adjunto da Disciplina de Técnica Operatória e Cirurgia Experimental do Departamento de Saúde Integrada do Centro de Ciências Biológicas e da Saúde (DSIN-CCBS-UEPA). 3 Patologista, chefe do Departamento de Patologia da Universidade Federal do Pará (UFPA). 4 Médica formada pela UFPA em 1999. 5 Graduando do curso de Medicina da UFPA. 6 Graduando do curso de Medicina da UEPA; estagiário do LCE-UEPA.
Marialva de Araújo3 1 Trabalho realizado no Laboratório de Cirurgia Experimental da Universidade do Estado do Pará (LCE-UEPA), com apoio do Instituto Evandro Chagas, FUNTEC-SECTAM e EMBRAPA. 2 Professor Adjunto da Disciplina de Técnica Operatória e Cirurgia Experimental do Departamento de Saúde Integrada do Centro de Ciências Biológicas e da Saúde (DSIN-CCBS-UEPA). 3 Patologista, chefe do Departamento de Patologia da Universidade Federal do Pará (UFPA). 4 Médica formada pela UFPA em 1999. 5 Graduando do curso de Medicina da UFPA. 6 Graduando do curso de Medicina da UEPA; estagiário do LCE-UEPA.
Glayce June Sasaki Acácio4 1 Trabalho realizado no Laboratório de Cirurgia Experimental da Universidade do Estado do Pará (LCE-UEPA), com apoio do Instituto Evandro Chagas, FUNTEC-SECTAM e EMBRAPA. 2 Professor Adjunto da Disciplina de Técnica Operatória e Cirurgia Experimental do Departamento de Saúde Integrada do Centro de Ciências Biológicas e da Saúde (DSIN-CCBS-UEPA). 3 Patologista, chefe do Departamento de Patologia da Universidade Federal do Pará (UFPA). 4 Médica formada pela UFPA em 1999. 5 Graduando do curso de Medicina da UFPA. 6 Graduando do curso de Medicina da UEPA; estagiário do LCE-UEPA.
Glayce Josy Sasaki Acácio5 1 Trabalho realizado no Laboratório de Cirurgia Experimental da Universidade do Estado do Pará (LCE-UEPA), com apoio do Instituto Evandro Chagas, FUNTEC-SECTAM e EMBRAPA. 2 Professor Adjunto da Disciplina de Técnica Operatória e Cirurgia Experimental do Departamento de Saúde Integrada do Centro de Ciências Biológicas e da Saúde (DSIN-CCBS-UEPA). 3 Patologista, chefe do Departamento de Patologia da Universidade Federal do Pará (UFPA). 4 Médica formada pela UFPA em 1999. 5 Graduando do curso de Medicina da UFPA. 6 Graduando do curso de Medicina da UEPA; estagiário do LCE-UEPA.
José Maciel Caldas dos Reis6 1 Trabalho realizado no Laboratório de Cirurgia Experimental da Universidade do Estado do Pará (LCE-UEPA), com apoio do Instituto Evandro Chagas, FUNTEC-SECTAM e EMBRAPA. 2 Professor Adjunto da Disciplina de Técnica Operatória e Cirurgia Experimental do Departamento de Saúde Integrada do Centro de Ciências Biológicas e da Saúde (DSIN-CCBS-UEPA). 3 Patologista, chefe do Departamento de Patologia da Universidade Federal do Pará (UFPA). 4 Médica formada pela UFPA em 1999. 5 Graduando do curso de Medicina da UFPA. 6 Graduando do curso de Medicina da UEPA; estagiário do LCE-UEPA.
Brito MVH, Araújo M, Acácio GJS, Acácio GJS, Reis JMC. Lesão intestinal após isquemia-reperfusão: estudo comparativo usando sal tetrazólico (MTT) e histologia. Acta Cir Bras [serial online] 2001 Jan-Mar;16(1). Available from: URL: http://www.scielo.br/acb.
RESUMO: Vários métodos são utilizados para avaliar e estimar as lesões intestinais de isquemia e reperfusão (IR). Assim, o objetivo do presente trabalho é realizar o estudo comparativo dos aspectos colorimétrico e histológico da lesão intestinal após IR. Para tal, foram utilizados 30 ratos Wistar, machos, pesando entre 310 a 410g, distribuídos em 3 grupos: Grupo Controle (GC), Grupo Isquemia e Reperfusão-1 (GIR-1) e Grupo Isquemia e Reperfusão-3 (GIR-3), com 10 animais cada. Nos grupos GIR-1 e GIR-3 foi realizada isquemia intestinal, por meio de falsa ligadura da artéria mesentérica anterior, durante 30 minutos e após esta a perfusão sangüínea foi restaurada. Estes animais foram submetidos a eutanásia após 1 e 3 dias de reperfusão, respectivamente, sendo colhido material para realização dos estudos colorimétrico, usando o Methyl Thiazolyl Blue (MTT) e histológico pela hematoxilina e eosina. Os resultados obtidos demonstraram uma menor proporção de células viáveis e um maior grau de lesão da túnica mucosa nos animais do grupo GIR-3 em relação ao controle (p<0,05). Desta forma os autores concluem que o estudo colorimétrico, usando o MTT, mostrou-se tão eficaz e confiável quanto o estudo histológico na avaliação das repercussões intestinais produzidas pela IR deste órgão.
DESCRITORES:Isquemia. Reperfusão. Sais tetrazólicos. Intestino. Ratos.
INTRODUÇÃO
É freqüente na prática médica a ocorrência de estados isquêmicos como, oclusões arteriais, transplantes, isquemia mesentérica e choque, os quais acometem número crescente de indivíduos, de variadas faixas etárias e determinam alta morbimortalidade1,2,3,4,5.
Entretanto a lesão de reperfusão, diferentemente da lesão isquêmica, é capaz de produzir alteração sistêmica, e não apenas nos locais acometidos pelo fenômeno, de modo que o restabelecimento do fluxo sangüíneo para uma área isquêmica pode ocasionar lesão em todo organismo1,4,5.
Em vista das importantes e graves repercussões determinadas pela isquemia e reperfusão (IR) vários métodos são utilizados com o objetivo de avaliar e estimar adequadamente as alterações produzidas por este fenômeno5,6,7.
No entanto, um dos métodos mais utilizados, ainda hoje, para avaliação das alterações intestinais produzidas pela IR é o estudo histológico2,3,6,8,9,10. Porém, tal método, apesar da simplicidade e baixo custo, denota tempo demasiadamente longo para obtenção dos resultados11 e somente demonstra na túnica mucosa, o índice de lesões e de células estruturalmente preservadas, e não o índice de células funcionalmente viáveis, presente na amostra12.
Para avaliação deste índice pode ser empregado método colorimétrico, com o Methyl Thiazolyl Blue (MTT)12,13,14, sal tetrazólico, de cor amarelo ouro, que é reduzido por células vivas e pode medir a atividade enzimática celular, principalmente da desidrogenase12,13,14.
Em vista das características e utilidades dos sais tetrazólicos, surgiu a curiosidade de estudar a eficácia do método colorimétrico, com o MTT, para avaliar os efeitos da IR sobre a viabilidade funcional das células de intestino delgado de ratos e comparar estes resultados aos obtidos por estudo histológico, método já consagrado pela literatura.
MÉTODOS
No presente estudo, foram utilizados 30 ratos (Rattus norvegicus albinus, Rodentia, Mammalia), da linhagem Wistar, machos, adultos, com peso individual variando entre 310 e 410g, provenientes do Biotério do Instituto Evandro Chagas (Belém-Pará), previamente adaptados ao Laboratório de Cirurgia Experimental da Universidade do Estado do Pará por um período de 15 dias antes do início do experimento e mantidos em ambiente controlado com água e ração oferecidos ad libitum durante todo o experimento.
Os animais utilizados foram distribuídos nos seguintes grupos:
-
Grupo Controle (GC): grupo de 10 animais, não submetidos a procedimento cirúrgico e utilizados na determinação do padrão de normalidade para a viabilidade celular e estudo histológico.
-
Grupo Isquemia e Reperfusão-1 (GIR-1): grupo de 10 animais em que foi realizada isquemia intestinal, por meio de falsa ligadura da artéria mesentérica anterior, por 30 minutos. Após este período, a falsa ligadura foi liberada e a perfusão sangüínea restaurada. Estes animais foram submetidos à eutanásia após 24 horas de reperfusão.
-
Grupo Isquemia e Reperfusão-3 (GIR-3): grupo de 10 animais em que foi realizada isquemia intestinal, por meio de falsa ligadura da artéria mesentérica anterior, por 30 minutos. Após este período, a falsa ligadura foi liberada e a perfusão sangüínea restaurada. Estes animais foram submetidos à eutanásia após 3 dias de reperfusão.
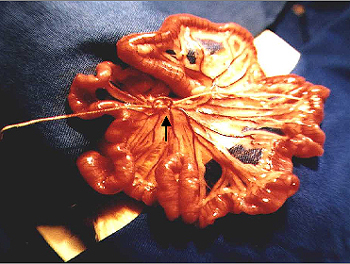
Os animais dos grupos GIR-1 e GIR-3, sob anestesia com éter etílico, foram submetidos à laparotomia mediana de aproximadamente 5 cm, com abertura da parede por planos. Posteriormente procedeu-se a identificação da artéria mesentérica anterior, que foi dissecada com auxílio de pinça Halsted curva e reparada com dupla laçada de fio multifilamentar seda sutupak 2-0, o qual era tracionado, até parada do fluxo sanguíneo mesentérico, constatada por ausência de pulso na arcada intestinal, cianose das alças e ausência de peristalse. Sendo o reparo mantido tracionado com auxílio de uma pinça de Kelly reta (Fig.1).
Após o início da isquemia, as alças intestinais eram cuidadosamente devolvidas à cavidade abdominal e após 30 minutos de isquemia o reparo foi solto, e a perfusão restaurada, sendo procedido o fechamento da cavidade peritoneal por planos.
Em data preestabelecida (1º e 3º DPO), os animais foram submetidos a eutanásia com dose inalatória letal de éter etílico, sendo realizado coleta de material para os estudos colorimétrico pelo MTT e histológico pela Hematoxilina e Eosina (HE).
Para a verificação da viabilidade celular, foi colhido, com auxílio de um punch dermatológico (Miltrex Instrument Company Inc., 3mm Lote 96B01), um fragmento circular de 3 mm de diâmetro, contendo todas as túnicas do intestino delgado, a meia distância entre o duodeno e íleo terminal. Sendo padronizado o local de colheita, à média distância entre as bordas mesentérica e antimesentérica.
No dia programado para a eutanásia dos animais, foram preparados tubos de ensaio tipo Eppendorf de 1,5cc, contendo 550 microlitros (ml) de solução salina tamponada (PBS), no qual foram adicionados 55 ml de solução de MTT (MTT Sigma - 5 mg de MTT em 1ml de PBS).
Imediatamente após sua retirada, a peça foi introduzida no frasco de Eppendorf, previamente preparado com MTT, onde permaneceu reagindo por duas horas a 37ºC.
Ao final deste período, foi introduzido no frasco 400 ml de ácido isopropílico (HCl a 0,004 N em propanol), sendo aguardados 5 minutos para a digestão tissular, após o que foi realizada masseração do tecido e homogeneização da solução em aparelho elétrico para tubos de ensaio.
Após 30 minutos da adição do ácido isopropílico em cada tubo de ensaio, 1 ml da solução foi levado à leitura em espectrofotômetro (Analytical Instruments - ZEISSâ, SPEKOL 1.100), calibrado em um comprimento de onda de 570 hm, sendo realizado cinco aferições para cada animal, cujos resultados foram anotados no protocolo do trabalho, e sua média aritmética adotada como o resultado da absorvância de cada animal.
Um segmento de intestino delgado, com 4 cm de comprimento, também foi coletado no jejuno médio para realização de estudo histológico, sendo fixado em formol a 10% por um período de cinco dias, enviados para processamento histológico e os cortes corados pela HE.
Para a avaliação do grau de lesão da túnica mucosa, foi utilizado a modificação da classificação de CHIU e col. (1970)8, que propuseram graduações histológicas para mucosa intestinal exposta a isquemia progressiva, conforme descrito abaixo:
-
Grau 0: Mucosa sem alterações.
-
Grau 1: vilosidades bem constituídas, sem lise celular ou processo inflamatório, porém com formação do espaço subepitelial de GRUENHAGEN.
-
Grau 2: Presença de lises celulares, formação do espaço subepitelial de GRUENHAGEN e espaçamento aumentado entre as vilosidades.
-
Grau 3: Destruição da porção livre das vilosidades, presença de capilares dilatados e de células inflamatórias.
-
Grau 4: Destruição estrutural das vilosidades, havendo apenas esboço de algumas, formadas por células inflamatórias e material necrótico, com hemorragia e ulceração glandular basal.
-
Grau 5: Destruição de toda túnica mucosa, não mais sendo observado qualquer estrutura glandular, mas apenas material amorfo depositado sobre a tela submucosa.
Os resultados obtidos foram anotados em protocolo do trabalho e tratados estatisticamente pelo teste KRUSKAL-WALLIS, sendo adotado como 0,05 ou 5% o índice de rejeição da hipótese de nulidade.
RESULTADOS
O grupo GIR-3 apresentou uma menor proporção de células viáveis e um maior grau de lesão da túnica mucosa (p<0,05), enquanto que o grupo controle foi o que obteve a maior proporção de células viáveis e menor grau de lesão da túnica mucosa (p<0,05), (Tabelas 1 e 2 e Fig. 2).
- Média dos valores do grau de lesão da túnica mucosa, à microscopia óptica convencional, segundo os grupos do experimento.
- Comparação entre os resultados relativos de absorvância e histologia, segundo os grupos de experimento.
DISCUSSÃO
Os efeitos da IR, assim como da hipoperfusão tecidual sistêmica, sobre o intestino tem sido estudada por diversos métodos5,6,7. Porém, apesar dos vários métodos disponíveis, o mais utilizado e citado na literatura, é o estudo histológico2,3,6,8,9,10.
Entretanto, este procedimento apesar de simples e de baixo custo, denota tempo demasiadamente longo para obtenção dos resultados11 e somente demonstra na túnica mucosa, o índice de lesões e de células estruturalmente preservadas, e não o índice de células funcionalmente viáveis, presente na amostra12.
Para avaliação deste índice foi empregado, neste estudo o método colorimétrico, com o Methyl Thiazolyl Blue (MTT)12,13,14, que permite detecção de células viáveis e de radicais livres10,13,14, assim como, sana certas desvantagens do método histológico, como demora na obtenção dos resultados e erros subjetivos de interpretação.
Quando este sal tetrazólico entra em contato com células vivas metabolicamente ativas, sofre clivagem pelas mitocôndrias funcionantes, passando da cor amarelo ouro à cor azul escuro14, e quanto mais intensa a tonalidade azul escuro, observada pela espectrofotometria, maior o número de células vivas presente na amostra12,13. Da mesma forma, quando o sal tetrazólico entra em contato com radicais superóxido, nos locais de atividade desta molécula, também sofre viragem da coloração10,13,14.
Para viabilizar a avaliação das alterações causadas pela IR intestinal e comparação dos resultados obtidos, foram utilizados três grupos de estudo. Nos quais o grupo GC permitiu, o conhecimento de informações basais dos animais empregados no experimento. Já os grupos GIR-1 e GIR-3, foram definidos após a realização do plano piloto, no qual, os resultados obtidos com os grupos GC e GIR-1, embora apresentassem valores absolutos diferentes, não foram estatisticamente significantes.
Quando analisados os resultados do estudo, foi observado que o grupo GIR-3 apresentou menor viabilidade celular e maior grau de lesão da túnica mucosa em relação ao grupo controle (p<0,05).
Entretanto os animais submetidos à isquemia (GIR-1 e GIR-3) não diferiram significativamente entre si (p>0,05), apesar do tempo mais prolongado de reperfusão no grupo GIR-3. Isso somado ao fato de que os grupos GC e GIR-1 também não foram estatisticamente diferentes (p>0,05), indica que as lesões de reperfusão necessitam de tempo superior à 24 horas para serem significativas, assim como, confirma o paradoxo de que a reperfusão de área isquêmica pode agravar o grau de lesão tecidual1,10,15.
LANGER (1986)4 considera como irreversivelmente lesada, a célula que apresenta alterações enzimáticas do mecanismo de transporte transmembrana, quer a nível celular ou de organelas com redução da respiração mitocondrial e da produção de energia, assim como, a formação de radicais livres de oxigênio, principalmente no interior das mitocôndrias4. No entanto, no presente trabalho observou-se que nas primeiras 24 horas de reperfusão, a lesão celular ainda não havia se instalado totalmente, sugerindo sofrimento celular, porém com preservação da função.
Assim, no presente trabalho o MTT e a histologia se equivalem nos diferentes grupos do estudo, ou seja, quanto maior o grau de lesão histológica em um grupo, menor é a viabilidade celular obtida pelo método colorimétrico. E desta forma, pode-se afirmar que o MTT, apesar de ter um custo algo elevado e necessitar de espectrofotômetro para leitura das amostras, tem grande aplicabilidade prática na avaliação das alterações intestinais produzidas pela isquemia intestinal, mostrando-se tão sensível quanto a histologia, método já consagrado pela literatura.
Além disso, apesar das características e vantagens do método colorimétrico, a intenção do estudo, não é substituir a histologia como procedimento de avaliação das alterações intestinais pós-IR, mas sim oferecer uma alternativa complementar, que poderá ser utilizada, não só para confirmar os resultados histológicos, enfatizando as alterações ocorridas, como também para definir parâmetros como tempo de isquemia, número de animais e tempo de reperfusão, durante a realização do plano piloto, uma vez que os resultados são obtidos de maneira mais simples e rápida.
CONCLUSÃO
Desta forma os autores concluem que o método colorimétrico, utilizando sal tetrazólico (MTT), mostrou-se tão sensível quanto a histologia na detecção e quantificação das alterações intestinais produzidas pela isquemia-reperfusão intestinal.
REFERÊNCIAS
1. Pinheiro VB. Alterações no metabolismo do oxigênio em um modelo de isquemia-reperfusão sistêmica em cães [Tese Mestrado]. Universidade Federal de São Paulo-Escola Paulista de Medicina; 1995.
2. Galvão FHF, Waitzberg LD, Lagulo FA, Sementilli A, Rompenso CS, Lima-Gonçalvez E. Alterações histopatológicas do intestino delgado após preservação hipotérmico com as soluções da Universidade de Wiscosin e Euro-Collins: estudo experimental. Rev Ass Med Brasil 1995;41:187-92.
3. Haglund U, Hulten L, Ahren C, Lundgren O. Mucosal lesion in the human small intestine in shock. Gut 1975;16:979-84.
4. Langer B. Radicais livres, isquemia e inflamação. Rev Paul Med 1986;104:305-10.
5. Yassin IMM, Barros Das BAA, Parks GT, Maccaigue MD, Leggett P, Halliday IM, Rowlands JB. Lower limb ischemia-reperfusion injury alters gastrointestinal structure and function. Br J Med 1997;84:1425-9.
6. Cicalese L, Lee K, Schraut W, Watkins S, Borle A, Stanko R. Pyruvate prevents ischemia-reperfusion mucosal injury of rat small intestine. Am J Surg 1996;171:97-101.
7. Roldan AJE, Kerzberg ME, Boveris A. Cineta de la quimioluminescencia del intestino de la rata durante isquemia y reperfusion. Medicina Buenos Aires 1989;49:336-40.
8. Chiu JC, Mcardle HÁ, Brown R, Scott JH, Gurd NF. Intestinal mucosal lesion in low-flow states. Arch Surg 1970;101:478-83.
9. Weixiong H, Aneman A, Nilsson U, Lundgren O. Quantification of tissue damage in the feline small intestine during ischemia-reperfusion: the importance of free radicals. Acta Physiol Scand 1994;150:241-50.
10. Schanaider A, Perrotta U, Madi K. Importância dos radicais livres derivados do oxigênio na fisiopatologia das afecções isquêmicas intestinais. F Méd Bras 1991;103:53-8.
11. Junqueira CL, Carneiro J. A histologia e seus métodos de estudo. In: Junqueira CL, Carneiro JL. Histologia básica. Rio de Janeiro: Guanabara Koogan; 1990. p 1-18.
12. Altman FP. Studies on the reduction of tetrazolium salts. Histochemistry 1974;38:155-71.
13. Mosmann T. Rapid colorimetric assay for cellular growth and survival: Application to proliferation and cytotoxicity assays. J Immunol Methods 1983;65:55-63.
14. Altman FP. Tetrazolium salts: a consumers guide. Histoch J 1976;8:471-85.
15. Boros M, Takaichi S, Hatanaka K. Ischemia time dependency of reperfusion injury following complete arterial occlusion in the rat small intestine. Transplant Proc 1995;27:2789-90.
Brito MVH, Araújo M, Acácio GJS, Acácio GJS, Reis JMC. Ischemia-reperfusion injury of intestine: comparative study using tetrazolium salt (MTT) and histology. Acta Cir Bras [serial online] 2001 Jan-Mar;16(1). Available from: URL: http://www.scielo.br/acb.
ABSTRACT: Many methods are used to evaluate ischemia reperfusion injury, but the most employed one is the histological study. However, it only demonstrates on mucosal tunic, the index of lesion and morphologic preserved cells, but not the index of viable functional cells, present in the sample. With this purpose, a colorimetric method was used, employing Methyl Thiazolyl Blue (MTT). The experiment was conducted in 30 Wistar male rats, distributed in 3 groups: Group Control (GC), Group ischemia and reperfusion-1 (GIR-1) and Group ischemia and reperfusion-3 (GIR-3), with 10 animals each. The Groups GIR-1 and GIR-3 were submitted to intestinal ischemia for 30 minutes by a false ligature of superior mesenteric artery, and submitted to euthanasia after 1 and 3 days of reperfusion, when material was picked for absorbency and histological procedures. It was observed a smaller proportion of viable cells and a larger degree of mucosal lesion in GIR-3 group (p<0.05), while GC group was the one with the larger proportion of viable cells and smaller degree of the mucosal injury (p<0.05). This way we concluded that MTT is as effective and reliable as the histological study at evaluating alterations produced by intestinal ischemia-reperfusion.
SUBJECT HEADINGS: Ischemia. Reperfusion. Tetrazolium salts. Intestine. Rats.
Endereço para correspondência:
Marcus Vinicius Henriques Brito
Trav. Apinagés 630/201.
Belém Pará
66033-170
Tel: (91)242-5179 ou 9981-6321
e-mail: mnbrito@amazon.com.br
Data do recebimento: 18/07/2000
Data da revisão: 02/09/2000
Data da aprovação: 03/11/2000
- 1. Pinheiro VB. Alteraçőes no metabolismo do oxigęnio em um modelo de isquemia-reperfusăo sistęmica em căes [Tese Mestrado]. Universidade Federal de Săo Paulo-Escola Paulista de Medicina; 1995.
- 2. Galvăo FHF, Waitzberg LD, Lagulo FA, Sementilli A, Rompenso CS, Lima-Gonçalvez E. Alteraçőes histopatológicas do intestino delgado após preservaçăo hipotérmico com as soluçőes da Universidade de Wiscosin e Euro-Collins: estudo experimental. Rev Ass Med Brasil 1995;41:187-92.
- 3. Haglund U, Hulten L, Ahren C, Lundgren O. Mucosal lesion in the human small intestine in shock. Gut 1975;16:979-84.
- 4. Langer B. Radicais livres, isquemia e inflamaçăo. Rev Paul Med 1986;104:305-10.
- 5. Yassin IMM, Barros Das BAA, Parks GT, Maccaigue MD, Leggett P, Halliday IM, Rowlands JB. Lower limb ischemia-reperfusion injury alters gastrointestinal structure and function. Br J Med 1997;84:1425-9.
- 6. Cicalese L, Lee K, Schraut W, Watkins S, Borle A, Stanko R. Pyruvate prevents ischemia-reperfusion mucosal injury of rat small intestine. Am J Surg 1996;171:97-101.
- 7. Roldan AJE, Kerzberg ME, Boveris A. Cineta de la quimioluminescencia del intestino de la rata durante isquemia y reperfusion. Medicina Buenos Aires 1989;49:336-40.
- 8. Chiu JC, Mcardle HÁ, Brown R, Scott JH, Gurd NF. Intestinal mucosal lesion in low-flow states. Arch Surg 1970;101:478-83.
- 9. Weixiong H, Aneman A, Nilsson U, Lundgren O. Quantification of tissue damage in the feline small intestine during ischemia-reperfusion: the importance of free radicals. Acta Physiol Scand 1994;150:241-50.
- 10. Schanaider A, Perrotta U, Madi K. Importância dos radicais livres derivados do oxigęnio na fisiopatologia das afecçőes isquęmicas intestinais. F Méd Bras 1991;103:53-8.
- 11. Junqueira CL, Carneiro J. A histologia e seus métodos de estudo. In: Junqueira CL, Carneiro JL. Histologia básica. Rio de Janeiro: Guanabara Koogan; 1990. p 1-18.
- 12. Altman FP. Studies on the reduction of tetrazolium salts. Histochemistry 1974;38:155-71.
- 13. Mosmann T. Rapid colorimetric assay for cellular growth and survival: Application to proliferation and cytotoxicity assays. J Immunol Methods 1983;65:55-63.
- 14. Altman FP. Tetrazolium salts: a consumers guide. Histoch J 1976;8:471-85.
- 15. Boros M, Takaichi S, Hatanaka K. Ischemia time dependency of reperfusion injury following complete arterial occlusion in the rat small intestine. Transplant Proc 1995;27:2789-90.
Datas de Publicação
-
Publicação nesta coleção
11 Set 2003 -
Data do Fascículo
Mar 2001
Histórico
-
Aceito
03 Nov 2000 -
Recebido
18 Jul 2000 -
Revisado
02 Set 2000