Resumos
OBJETIVO: Estudar os efeitos da isquemia e reperfusão hepática total sobre acúmulo de neutrófilos no interstício pulmonar de ratos, em condições de normalidade e submetidos ao estado de choque hemorrágico controlado. MÉTODOS: 32 ratos Wistar, machos, foram divididos em quatro grupos de oito animais cada: grupo Sham, submetido aos procedimentos padrões com um período de 60 minutos de observação; grupo Choque, submetido a choque hemorrágico controlado (PAM = 40 mmHg, 20 min.) seguido de reposição volêmica (Ringer lactato + sangue, 3:1) e reperfusão (60 min.); grupo Pringle, submetido a isquemia hepática total (15 min.) e reperfusão (60 min.); grupo Total submetido a choque hemorrágico controlado (15 min.) seguido de reposição volêmica (Ringer lactato + sangue, 3:1) e reperfusão (60 min.). Após o sacrifício dos animais, procedeu-se à contagem de neutrófilos no interstício pulmonar. RESULTADOS: Os valores encontrados para contagem de neutrófilos no interstício pulmonar indicaram que, os animais dos grupos Pringle, Total e, também, do grupo Choque, não diferiram dos animais do grupo Sham com valores de (Sham 21,08± 14,12; Choque 35,15± 18,74; Pringle 19,78± 15,38; Total 23,90± 16,37) (p=0.253) CONCLUSÃO: Em ratos submetidos a estado de choque hemorrágico controlado associado a isquemia hepática de 15 minutos, seguida de 60 minutos de reperfusão, não ocorreu acúmulo significativo de neutrófilos no interstício pulmonar.
Isquemia; Reperfusão; Choque hipovolêmico; Manobra de Pringle; Neutrófilos
OBJECTIVE: The purpose of this experimental work was to study the effects of total hepatic ischemia and reperfusion on the accumulation of neutrophils in the lung of rats, under normal conditions and submitted to controlled hemorrhagic shock state. METHODS: thirty two adult male Wistar rats, were divided into four groups: the Sham group, was submitted to the standard procedures for a period of 60 min. of observation; Shock group, was submitted to controlled hemorrhagic shock (PAM=40 mmHg, 20 min.) followed by volemic resuscitation (lactated Ringer’s solution + blood, 3:1) and reperfusão for 60 min.; Pringle group, was submitted to total hepatic ischemia for 15 min. and reperfusão for 60 min.; The Total group, was submitted to controlled hemorrhagic shock for 15 min. followed by volemic resuscitation (lactated Ringer’s solution + blood, 3:1) and reperfusão for 60 min.). The counting of neutrophils on the lung tissue was performed after the euthanasia of animals. RESULTS: The values found for the counting of neutrophils on the lung tissue indicate that the animals from the Pringle, Total, and Shock groups, did not differ from the Sham group, having the following values: Sham, 21,08± 14,12; Shock, 35,15± 18,74; Pringle, 19,78± 15,38; Total, 23,90± 16,37) (p=0.253). CONCLUSION: Rats submitted to controlled hemorrhagic shock state associated to total hepatic ischemia for 15 minutes, followed by 60 minutes of reperfusion, did not present significant neutrophils accumulation on the lung tissue.
Ischemia; Reperfusion; Hypovolemic shock; Pringle’s maneuver; Neutrophil
7 ARTIGO ORIGINAL
ISQUEMIA E REPERFUSÃO HEPÁTICA TOTAL ASSOCIADA AO ESTADO DE CHOQUE HEMORRÁGICO CONTROLADO: EFEITOS NO SEQÜESTRO DE NEUTRÓFILOS NO PULMÃO DO RATO1 1 . Trabalho realizado no Laboratório de Investigação em Cirurgia do Trauma (LICIT) da Disciplina de Cirurgia da Faculdade de Ciências Médicas da UNICAMP - Campinas, S.P., no Núcleo de Medicina e Cirurgia Experimental da FCM - UNICAMP. 2 . Professor Titular e Chefe da Disciplina de Cirurgia do Trauma do Departamento de Cirurgia da Faculdade de Ciências Médicas - UNICAMP. Coordenador do Laboratório de Investigação em Cirurgia do Trauma (LICIT) do Núcleo de Medicina e Cirurgia Experimental da FCM - UNICAMP. 3 . Mestre em Cirurgia do Trauma. Aluno de Doutorado do curso de pós-graduação do Departamento de Cirurgia da Faculdade de Ciências Médicas - UNICAMP. 4 . Aluno de Mestrado do curso de pós-graduação do Departamento de Cirurgia da Faculdade de Ciências Médicas - UNICAMP. 5 . Doutora em Ciências Médicas - Anatomia Patológica. Bióloga do Laboratório de Investigação em Cirurgia do Trauma (LICIT) - UNICAMP. 6 . Mestre em Anatomia Patológica. Professora da Universidade de Alfenas. 7 . Médico Residente da Disciplina de Anatomia Patológica da Faculdade de Ciências Médicas - UNICAMP.
Mario Mantovani2 1 . Trabalho realizado no Laboratório de Investigação em Cirurgia do Trauma (LICIT) da Disciplina de Cirurgia da Faculdade de Ciências Médicas da UNICAMP - Campinas, S.P., no Núcleo de Medicina e Cirurgia Experimental da FCM - UNICAMP. 2 . Professor Titular e Chefe da Disciplina de Cirurgia do Trauma do Departamento de Cirurgia da Faculdade de Ciências Médicas - UNICAMP. Coordenador do Laboratório de Investigação em Cirurgia do Trauma (LICIT) do Núcleo de Medicina e Cirurgia Experimental da FCM - UNICAMP. 3 . Mestre em Cirurgia do Trauma. Aluno de Doutorado do curso de pós-graduação do Departamento de Cirurgia da Faculdade de Ciências Médicas - UNICAMP. 4 . Aluno de Mestrado do curso de pós-graduação do Departamento de Cirurgia da Faculdade de Ciências Médicas - UNICAMP. 5 . Doutora em Ciências Médicas - Anatomia Patológica. Bióloga do Laboratório de Investigação em Cirurgia do Trauma (LICIT) - UNICAMP. 6 . Mestre em Anatomia Patológica. Professora da Universidade de Alfenas. 7 . Médico Residente da Disciplina de Anatomia Patológica da Faculdade de Ciências Médicas - UNICAMP.
Mauro José Fontelles3 1 . Trabalho realizado no Laboratório de Investigação em Cirurgia do Trauma (LICIT) da Disciplina de Cirurgia da Faculdade de Ciências Médicas da UNICAMP - Campinas, S.P., no Núcleo de Medicina e Cirurgia Experimental da FCM - UNICAMP. 2 . Professor Titular e Chefe da Disciplina de Cirurgia do Trauma do Departamento de Cirurgia da Faculdade de Ciências Médicas - UNICAMP. Coordenador do Laboratório de Investigação em Cirurgia do Trauma (LICIT) do Núcleo de Medicina e Cirurgia Experimental da FCM - UNICAMP. 3 . Mestre em Cirurgia do Trauma. Aluno de Doutorado do curso de pós-graduação do Departamento de Cirurgia da Faculdade de Ciências Médicas - UNICAMP. 4 . Aluno de Mestrado do curso de pós-graduação do Departamento de Cirurgia da Faculdade de Ciências Médicas - UNICAMP. 5 . Doutora em Ciências Médicas - Anatomia Patológica. Bióloga do Laboratório de Investigação em Cirurgia do Trauma (LICIT) - UNICAMP. 6 . Mestre em Anatomia Patológica. Professora da Universidade de Alfenas. 7 . Médico Residente da Disciplina de Anatomia Patológica da Faculdade de Ciências Médicas - UNICAMP.
Elcio Shiyoiti Hirano4 1 . Trabalho realizado no Laboratório de Investigação em Cirurgia do Trauma (LICIT) da Disciplina de Cirurgia da Faculdade de Ciências Médicas da UNICAMP - Campinas, S.P., no Núcleo de Medicina e Cirurgia Experimental da FCM - UNICAMP. 2 . Professor Titular e Chefe da Disciplina de Cirurgia do Trauma do Departamento de Cirurgia da Faculdade de Ciências Médicas - UNICAMP. Coordenador do Laboratório de Investigação em Cirurgia do Trauma (LICIT) do Núcleo de Medicina e Cirurgia Experimental da FCM - UNICAMP. 3 . Mestre em Cirurgia do Trauma. Aluno de Doutorado do curso de pós-graduação do Departamento de Cirurgia da Faculdade de Ciências Médicas - UNICAMP. 4 . Aluno de Mestrado do curso de pós-graduação do Departamento de Cirurgia da Faculdade de Ciências Médicas - UNICAMP. 5 . Doutora em Ciências Médicas - Anatomia Patológica. Bióloga do Laboratório de Investigação em Cirurgia do Trauma (LICIT) - UNICAMP. 6 . Mestre em Anatomia Patológica. Professora da Universidade de Alfenas. 7 . Médico Residente da Disciplina de Anatomia Patológica da Faculdade de Ciências Médicas - UNICAMP.
Rosana Celestina Morandin5 1 . Trabalho realizado no Laboratório de Investigação em Cirurgia do Trauma (LICIT) da Disciplina de Cirurgia da Faculdade de Ciências Médicas da UNICAMP - Campinas, S.P., no Núcleo de Medicina e Cirurgia Experimental da FCM - UNICAMP. 2 . Professor Titular e Chefe da Disciplina de Cirurgia do Trauma do Departamento de Cirurgia da Faculdade de Ciências Médicas - UNICAMP. Coordenador do Laboratório de Investigação em Cirurgia do Trauma (LICIT) do Núcleo de Medicina e Cirurgia Experimental da FCM - UNICAMP. 3 . Mestre em Cirurgia do Trauma. Aluno de Doutorado do curso de pós-graduação do Departamento de Cirurgia da Faculdade de Ciências Médicas - UNICAMP. 4 . Aluno de Mestrado do curso de pós-graduação do Departamento de Cirurgia da Faculdade de Ciências Médicas - UNICAMP. 5 . Doutora em Ciências Médicas - Anatomia Patológica. Bióloga do Laboratório de Investigação em Cirurgia do Trauma (LICIT) - UNICAMP. 6 . Mestre em Anatomia Patológica. Professora da Universidade de Alfenas. 7 . Médico Residente da Disciplina de Anatomia Patológica da Faculdade de Ciências Médicas - UNICAMP.
Lucélia Rita Gaudino Caputo6 1 . Trabalho realizado no Laboratório de Investigação em Cirurgia do Trauma (LICIT) da Disciplina de Cirurgia da Faculdade de Ciências Médicas da UNICAMP - Campinas, S.P., no Núcleo de Medicina e Cirurgia Experimental da FCM - UNICAMP. 2 . Professor Titular e Chefe da Disciplina de Cirurgia do Trauma do Departamento de Cirurgia da Faculdade de Ciências Médicas - UNICAMP. Coordenador do Laboratório de Investigação em Cirurgia do Trauma (LICIT) do Núcleo de Medicina e Cirurgia Experimental da FCM - UNICAMP. 3 . Mestre em Cirurgia do Trauma. Aluno de Doutorado do curso de pós-graduação do Departamento de Cirurgia da Faculdade de Ciências Médicas - UNICAMP. 4 . Aluno de Mestrado do curso de pós-graduação do Departamento de Cirurgia da Faculdade de Ciências Médicas - UNICAMP. 5 . Doutora em Ciências Médicas - Anatomia Patológica. Bióloga do Laboratório de Investigação em Cirurgia do Trauma (LICIT) - UNICAMP. 6 . Mestre em Anatomia Patológica. Professora da Universidade de Alfenas. 7 . Médico Residente da Disciplina de Anatomia Patológica da Faculdade de Ciências Médicas - UNICAMP.
André Almeida Schenka7 1 . Trabalho realizado no Laboratório de Investigação em Cirurgia do Trauma (LICIT) da Disciplina de Cirurgia da Faculdade de Ciências Médicas da UNICAMP - Campinas, S.P., no Núcleo de Medicina e Cirurgia Experimental da FCM - UNICAMP. 2 . Professor Titular e Chefe da Disciplina de Cirurgia do Trauma do Departamento de Cirurgia da Faculdade de Ciências Médicas - UNICAMP. Coordenador do Laboratório de Investigação em Cirurgia do Trauma (LICIT) do Núcleo de Medicina e Cirurgia Experimental da FCM - UNICAMP. 3 . Mestre em Cirurgia do Trauma. Aluno de Doutorado do curso de pós-graduação do Departamento de Cirurgia da Faculdade de Ciências Médicas - UNICAMP. 4 . Aluno de Mestrado do curso de pós-graduação do Departamento de Cirurgia da Faculdade de Ciências Médicas - UNICAMP. 5 . Doutora em Ciências Médicas - Anatomia Patológica. Bióloga do Laboratório de Investigação em Cirurgia do Trauma (LICIT) - UNICAMP. 6 . Mestre em Anatomia Patológica. Professora da Universidade de Alfenas. 7 . Médico Residente da Disciplina de Anatomia Patológica da Faculdade de Ciências Médicas - UNICAMP.
Mantovani M, Fontelles MJ, Hirano ES, Morandin RC, Caputo LRG, Schenka AA. Isquemia e reperfusão hepática total associada ao estado de choque hemorrágico controlado: efeitos no sequestro de neutrófilos no pulmão do rato. Acta Cir Bras [serial online] 2002 Jan-Fev;17(1). Disponível em: URL: http://www.scielo.br/acb.
RESUMO: OBJETIVO: Estudar os efeitos da isquemia e reperfusão hepática total sobre acúmulo de neutrófilos no interstício pulmonar de ratos, em condições de normalidade e submetidos ao estado de choque hemorrágico controlado. MÉTODOS: 32 ratos Wistar, machos, foram divididos em quatro grupos de oito animais cada: grupo Sham, submetido aos procedimentos padrões com um período de 60 minutos de observação; grupo Choque, submetido a choque hemorrágico controlado (PAM = 40 mmHg, 20 min.) seguido de reposição volêmica (Ringer lactato + sangue, 3:1) e reperfusão (60 min.); grupo Pringle, submetido a isquemia hepática total (15 min.) e reperfusão (60 min.); grupo Total submetido a choque hemorrágico controlado (15 min.) seguido de reposição volêmica (Ringer lactato + sangue, 3:1) e reperfusão (60 min.). Após o sacrifício dos animais, procedeu-se à contagem de neutrófilos no interstício pulmonar. RESULTADOS: Os valores encontrados para contagem de neutrófilos no interstício pulmonar indicaram que, os animais dos grupos Pringle, Total e, também, do grupo Choque, não diferiram dos animais do grupo Sham com valores de (Sham 21,08± 14,12; Choque 35,15± 18,74; Pringle 19,78± 15,38; Total 23,90± 16,37) (p=0.253) CONCLUSÃO: Em ratos submetidos a estado de choque hemorrágico controlado associado a isquemia hepática de 15 minutos, seguida de 60 minutos de reperfusão, não ocorreu acúmulo significativo de neutrófilos no interstício pulmonar.
DESCRITORES: Isquemia. Reperfusão. Choque hipovolêmico. Manobra de Pringle. Neutrófilos.
INTRODUÇÃO
O trauma é uma das principais causas de morte na população, ocupando o terceiro lugar se consideradas todas as idades e, a primeira, na faixa etária até os 44 anos de vida. Dentre estas causas, o fígado representa um dos principais órgãos atingidos no trauma abdominal1. Deste modo, os pacientes vítimas de lesões hepáticas graves, em razão do choque hemorrágico a que estão sujeitos, podem evoluir para um estado de resposta inflamatória generalizada com séria repercussão sistêmica e, consequentemente, para um quadro de complicação pulmonar, conhecido como Síndrome da Angustia Respiratória do Adulto SARA2 ou, ainda, apresentar o comprometimento simultâneo de vários órgãos da economia, resultando na conhecida Insuficiência de Múltiplos órgãos e Sistemas IMOS3.
Nestes pacientes, o princípio básico do tratamento cirúrgico é sustar o sangramento pela oclusão temporária do ligamento hepatoduodenal, manobra descrita por Pringle em 19084. Embora, na prática, represente uma manobra rápida, fácil e eficaz, este procedimento provoca isquemia total do fígado, podendo levar à alterações importantes na estrutura histológica do órgão, piorando a fase de reperfusão em razão da liberação de substâncias desencadeantes da resposta inflamatória, como as citocinas e, pela migração de neutrófilos para os tecidos, representando, portanto, um modelo humano de isquemia e reperfusão (I/R)5.
Assim, o objetivo deste trabalho experimental foi estudar os efeitos da isquemia e reperfusão hepática total sobre acúmulo de neutrófilos no pulmão de ratos, em condições de normalidade e, submetidos ao estado de choque hemorrágico controlado.
MÉTODOS
Todos os procedimentos seguiram a orientação do protocolo previamente estabelecido segundo o projeto piloto elaborado e desenvolvido pela Disciplina de Cirurgia do Trauma e, aprovado pela Comissão de Ética na Experimentação Animal do Instituto de Biologia da UNICAMP.
Animais
Neste experimento, foram utilizados 32 ratos machos, adultos, da linhagem Wistar (CEMIB UNICAMP, Campinas, SP), com pesos que variaram de 185 a 250 gramas (212,65± 20,79) e com idade aproximada de 08 semanas. Todos os animais foram mantidos em condições ambientais convencionais e controladas de luminosidade e temperatura, recebendo dieta padrão do LICIT constituída de ração NUVILAB CR-1 (Nuvital Nutrientes Ltda., Paraná, Brasil) e água ad libitum. Um período prévio de permanência de uma semana, antes do início do experimento, foi instituído objetivando a aclimatação dos animais ao biotério.
Grupos
Os ratos foram aleatoriamente distribuídos em quatro grupos de oito animais cada, sendo:
-
Grupo Sham Ratos em condições de normalidade, submetidos, unicamente, à laparotomia e, posteriormente, a um período de 60 minutos de observação, equivalente ao período de reperfusão nos demais grupos;
-
Grupo Choque Ratos submetidos à sangria com instalação do estado de choque hemorrágico controlado, com pressão arterial média (PAM) mantida em 40 mmHg, por um período de 20 minutos, seguido da reposição volêmica com solução de Ringer lactato e sangue total (3 : 1) até atingir a PAM de 80 mmHg, com posterior período de reperfusão de 60 minutos.
-
Grupo Pringle Ratos submetidos à laparotomia seguida por 15 minutos de manobra de Pringle e, posterior período de reperfusão hepática total de 60 minutos.
-
Grupo Total Ratos submetidos à sangria com instalação do estado de choque hemorrágico controlado, com PAM mantida em 40 mmHg, por um período de 20 minutos, seguido da reposição volêmica com solução de Ringer Lactato e sangue total (3 : 1) até atingir a PAM de 80 mmHg. A seguir, foram submetidos à laparotomia e 15 minutos de manobra de Pringle, seguida de reperfusão hepática total por um período de 60 minutos.
Procedimentos cirúrgicos
Os ratos foram submetidos a jejum de 12 horas na noite anterior ao experimento. Os procedimentos cirúrgicos foram realizados sob anestesia intraperitoneal (IP) com uma solução de cloridrato de cetamina, 80 mg/Kg (Cristália, Itapira, SP) + cloridrato xilazina, 10 mg/Kg (Bayer S.A., São Paulo, SP) e, sulfato de atropina (Halex Istar, são Paulo, SP) 0,05 mg/Kg. Oxigênio foi administrado num fluxo de 2 l/min., fornecido sob campânula plástica semi-aberta, de modo a encobrir parcialmente a cabeça do animal e permitir a livre troca gasosa com o meio ambiente. Após indução anestésica, realizaram-se a depilação e os animais foram, então, colocados em posição supina sobre prancha com aquecimento elétrico controlado.
Usando-se técnica asséptica, a artéria carótida direita e veia jugular direita foram dissecadas e cateterizadas com cateteres de polietileno (PE 40), previamente heparinizados, que foram utilizados para efetivação da sangria arterial com estabelecimento do estado de choque hemorrágico controlado, além da coleta venosa de amostras de sangue para exames e, infusão de líquidos para reposição volêmica, respectivamente. A seguir, a artéria femural direita foi dissecada e cateterizada com cateter de polietileno (PE 40) heparinizado, que foi utilizado para controle da pressão arterial média (PAM) dos animais (Registrador Mingograf 804. Siemens-Elema, Alemanha). Durante todas as fases do experimento, as seguintes variáveis foram monitorizadas continuamente: eletrocardiograma (ECG), PAM, freqüência cardíaca (FC), freqüência respiratória (FR) e temperatura retal (TR), a qual, foi mantida entre 36°C 38°C, controlada por aquecimento externo. Medidas das pressões parciais do oxigênio (pO2) e do dióxido de carbono (pCO2), dos eletrólitos (Na+, K+) e do lactato, arteriais, assim como, do hematócrito (Ht), foram obtidas em cada fase do experimento.
A instalação do choque hemorrágico controlado foi obtida pela sangria, a intervalos regulares, de volumes equivalentes a 5% da volemia, até a obtenção dos níveis pressóricos iguais a 40 mmHg de PAM para os animais do grupo choque e grupo total (Figura 1). Retiradas posteriores foram efetuadas, se necessário. A laparotomia mediana foi realizada com hemostasia rigorosa dos vasos sangüíneos. O ligamento hepatoduodenal (artéria hepática, veia porta e ducto biliar) foi identificado e pinçado (manobra de Pringle) com clamp arterial delicado. Após o período de reperfusão de 60 minutos os animais foram sacrificados por exsanguinação para retirada dos pulmões.
Processamento do tecido pulmonar
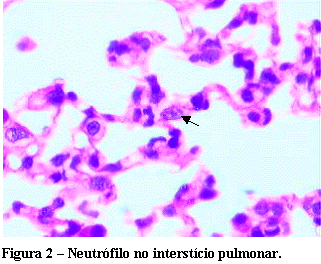
Em seguida a inspeção da cavidade torácica, o procedimento de lavagem dos vasos sangüíneos pulmonares foi iniciado. Para tanto, a artéria aorta foi pinçada imediatamente acima do músculo diafragma torácico e, as veias cavas, superior e inferior, ao longo de seus trajetos. Em seguida, efetuou-se a cardiomiotomia do ventrículo esquerdo para dar vazão ao líquido da lavagem. O ventrículo direito foi puncionado com cateter intravenoso n.º 16 e 20 ml de solução fisiológica foi injetada, de maneira suave, com a finalidade de remover, do leito dos vasos sangüíneos, quaisquer resquícios de sangue ali contido. Após esta etapa, o coração e os pulmões foram retirados em bloco e o lobo inferior do pulmão direito, fixado em formalina a 10% e, posteriormente, embebido em parafina. Cortes de quatro micrômetros de espessura foram submetidos à coloração pela técnica de hematoxilina/eosina, para estudo histológico e contagem do número de neutrófilos no interstício pulmonar (Figura 2).
A leitura das lâminas foi realizada de maneira aleatória e o resultado final da contagem de neutrófilos, em cada corte, foi obtido pela média aritmética dos valores relativos a 10 campos microscópicos, com aumento de 400 X, alternando-se dois campos sem leitura para cada campo considerado.
Análise estatística
Todos os dados obtidos foram armazenados em um banco de dados utilizando-se o programa Excel versão 97 (Microsoft Co. USA), para computador pessoal. Nas comparações entre os grupos a significância estatística foi avaliada através da Análise de Variância (ANOVA de um critério Teste F). Na presença de diferenças entre os grupos, estas foram identificadas pelo método de Student-Newman-Kuels. Adotou-se o nível de significância de 5% (p £ 0,05) e os valores estão representados sob a forma de média ± desvio-padrão da média. Os valores de "p" foram obtidos através do programa estatístico SAS versão 6.12 (Statistical Analysis Siystem Software Cary, NC, USA).
RESULTADOS
Neste experimento, os grupos foram homogêneos, pois não ocorreram diferenças significativas quanto aos pesos dos animais estudados. O peso médio± desvio-padrão, de cada grupo, está representado na tabela 1.
Variáveis pré-operatórios
Em todos os animais, as variáveis de interesse, avaliadas no pré-operatório, encontravam-se dentro dos limites de normalidade. Exceto pela dosagem da pressão parcial do dióxido de carbono no sangue arterial (pCO2), não houve diferenças significativas entre os grupos estudados, demonstrando que todos os animais foram retirados da mesma população. Os valores da média± desvio-padrão, para cada grupo estudado, estão representados na tabela 2.
Evolução hemodinâmica
Para cada grupo e, durante todas as fases de cada experimento, as medidas da PAM, FR e FC foram obtidas para avaliar a evolução hemodinâmica dos animais. Como os valores da PAM foram previamente padronizados no estado de choque (40 mmHg) e na de reposição (80 mmHg), nos grupos Choque e Total, a análise estatística desta variável foi feita nas seguintes fases dos diferentes grupos: sinais vitais iniciais (SVI), início da reperfusão (RP0), reperfusão 30 minutos (RP30) e reperfusão 60 minutos (RP60). O Gráfico 1 ilustra, mais detalhadamente, a média dos valores da PAM nos diferentes grupos, ao longo de todo o experimento.
Na comparação entre os valores da PAM no início do experimento (SVI), não foi verificada qualquer diferença significativa entre os diferentes grupos (p=0.265), estando todos equiparados quanto a esta variável hemodinâmica.
Na fase inicial da reperfusão (RP0), todos os grupos apresentavam PAM significativamente diferentes (p<0.0001), exceto entre os grupos Pringle e Total (p=0.123), que evoluíram com valores muito próximos (43.25± 3.01 mmHg e 46.00± 3.46 mmHg) e bem abaixo dos demais grupos. Aos 30 minutos de reperfusão (RP30) apenas o grupo Sham apresentava diferença significativa com os demais grupos, com PAM apresentando valor superior a estes (96,5± 14.8 mmHg). Após 60 minutos de reperfusão (RP60) a medida da PAM mostrou-se novamente diferente apenas no grupo Sham que, como já vimos, apresentou valores acima dos demais grupos durante todo o experimento, exceto nos sinais vitais iniciais (SVI).
Seqüestro de neutrófilos
O número de neutrófilos por campo, presente no pulmão, em cada grupo, após 60 minutos de reperfusão, esta representado na Tabela 3.
O Gráfico 2 ilustra, mais detalhadamente, a média dos valores do acúmulo de neutrófilos, por campo, no interstício pulmonar, após 60 minutos de reperfusão, nos diferentes grupos estudados.
DISCUSSÃO
O trauma hepático constitui-se na forma mais comum de trauma abdominal fechado, superado apenas pela lesão do baço6. O impacto direto ou a compressão da parede abdominal, produzidos pelo agente vulnerante, podem causar rupturas parenquimatosas desses órgãos com vultosas hemorragias intraperitoneais e choque. Embora a maioria das lesões hepáticas apresentem-se de pequenas dimensões e requeiram pequenos procedimentos cirúrgicos, ou até mesmo uma conduta conservadora, algumas, de maior gravidade, podem ser letais se não forem adequadamente controladas.
Enquanto a causa mais comum de morte nas lesões hepáticas extensas continua sendo a hemorragia, os pacientes que sobrevivem ao trauma inicial podem evoluir com outras complicações inerentes às alterações induzidas pelo estado de choque hemorrágico, traduzidas pela síndrome de Isquemia e reperfusão. Com objetivo de diminuir as perdas sangüíneas, a manobra de Pringle é o procedimento mais comumente utilizado pelos cirurgiões, podendo, no entanto, induzir a lesões hepáticas caracterizadas por alterações próprias desta síndrome, com liberação de enzimas hepatocelulares, redução do fluxo biliar e disfunções metabólicas.
Embora, esta técnica comporte-se como uma maneira segura, muita controvérsia ainda existe sobre o tempo total de tolerância hepática à isquemia. Deste modo, muitos estudos têm sido realizados, não somente para avaliar o tempo máximo que o tecido hepático pode suportar o clampeamento da tríade portal, mas também, para avaliar os efeitos da manobra quando executada de maneira intermitente.
Na literatura, diversos autores preconizam que o tempo de isquemia do órgão, se contínuo, não deverá exceder 30 minutos e, o procedimento intermitente deverá ser adotado quando o período para correção das lesões superar este valor7,8. Assim, o fígado, que pode suportar grandes danos sem que haja considerável comprometimento da função, mostra-se bastante sensível a hipóxia e aos efeitos da reperfusão subsequente que, de maneira associada, induzem a alterações, atribuídas, pelo menos em parte, à liberação de radicais livres durante a fase de reperfusão8,9,10.
Por outro lado, a isquemia e reperfusão, atualmente, são referidos como os fatores mais importantes na gênese de disfunções orgânicas conseqüentes à lesões traumáticas, as quais, dependendo do órgão afetado e do tempo de interrupção do fluxo sangüíneo, podem estar restritas não somente ao órgão isquemiado, como também, desencadear fenômenos que podem levar à lesão de outros órgãos distantes11,12.
Neste sentido, estudos mais recentes indicam que, na fase inicial do choque hemorrágico, os neutrófilos parecem desempenhar uma importante ação no estabelecimento da síndrome inflamatória sistêmica (SIRS), pois tornam-se ativados e aderentes às células endoteliais em resposta a I/R. Esta interação entre estes polimorfonucleares (PMN) e as células do endotélio vascular, representa o mais importante componente responsável pela resposta inflamatória e é coordenada por um sistema de citocinas, ainda, pouco conhecido, gerador de vários radicais livres11,13,14. Outrossim, POGGETTI et al.12, 1999, também demonstraram que existem evidências indicando que os PMN participam como mediadores das lesões teciduais que levam à falência orgânica em animais submetidos a I/R. Portanto, estas células, cuja função básica é a fagocitose, secretam enzimas e radicais superóxido que destroem os microrganismos fagocitados; porém, em resposta ao trauma, podem encontrar-se em estado de hiperatividade com liberação de grande quantidade destas substâncias tóxicas para o interstício, levando à SARA e, posteriormente, à IMOS.
Deste modo, as lesões induzidas pela síndrome de I/R podem ser atribuídas a dois mecanismos distintos. Um, caracterizados pela interação dos PMN com as células endoteliais capilares, mediada pelas citocinas inflamatórias e moléculas de adesão; o outro, pela produção excessiva e posterior liberação de radicais oxigênio, altamente reativos e citotóxicos, durante a fase de reperfusão14,15.
Atualmente, acredita-se que os macrófagos constituem uma população celular com fundamental importância na patogênese da SIRS pois são responsáveis pela síntese de mediadores inflamatórios conhecidos (citocinas), entre os quais, pode-se destacar: o fator de necrose tumoral - a (TNF), a interleucina 6 (IL-6) e a proteína inflamatória de macrófagos 2 (MIP-2), que parecem ter importância fundamental no desencadeamento e desenvolvimento da síndrome16,17.
No fígado, encontram-se grande população de macrófagos fixos (células de Kupffer) e, procedimentos que causam a I/R hepática total, ou mesmo parcial, induzem à síntese de citocinas inflamatórias18,19. Assim, após lesão hepática e manobra de Pringle, estas células podem ser a fonte primária de citocinas que podem levar ao aumento do número de neutrófilos e da permeabilidade microvascular nos tecidos de outros órgãos da economia, como no pulmão, sugerindo, deste modo, que a lesão causada pela I / R deste órgão pode ser outro fator desencadeante que contribui para o início da SIRS e, consequentemente, da IMOS, em pacientes vítimas de trauma hepático extenso, principalmente, quando associado com grave estado de choque hemorrágico11,19,20.
Desta maneira, inúmeros órgãos podem estar envolvidos, merecendo destaque o pulmão, o rim e o intestino, além de outros, tais como, o coração, o cérebro, o baço, o pâncreas e a supra-renal que, também, podem ser estudados utilizando-se o presente modelo de I / R hepática total.
Portanto, neste modelo experimental de I/R hepática total, os resultados obtidos mostram que, entre os diferentes grupos analisados, não ocorreu uma diferença estatisticamente significativa quanto ao acúmulo de neutrófilos no interstício pulmonar após um período de 60 minutos de reperfusão (p=0.253).
Curiosamente, diferente do que se poderia esperar, os animais do grupo Pringle e grupo Total, apresentaram valores da contagem de neutrófilos no pulmão muito semelhantes e pouco diferiram do grupo Sham, sugerindo que o pinçamento da tríade portal por um período de 15 minutos, não foi o fator fundamental para o acúmulo dessas células no tecido pulmonar destes animais, sendo os resultados confirmados pela análise estatística que não mostrou diferença significativa entre os grupos aos quais a manobra para isquemia hepática foi realizada.
Por outro lado, seja qual for a origem do choque hemorrágico, a sua instalação está relacionada ao posterior desencadeamento da resposta inflamatória sistêmica, traduzida pelo recrutamento e ativação de neutrófilos nos diversos órgãos. Aqui, verifica-se que o grupo Choque apresentou os maiores valores, quando comparado aos demais grupos, embora, estatisticamente não significante.
De qualquer forma, neste trabalho, de maneira inexplicada, como verificado nos animais do grupo Total, a manobra de Pringle representou um fator determinante para diminuir ou retardar o acúmulo de neutrófilos que poderia ser estimulado pelo estado de choque hemorrágico. Neste sentido, algumas possíveis explicações podem ser sugeridas: ou o represamento de sangue no leito vascular esplâncnico causado pelo pinçamento do pedículo hepático ou, ainda, a grande hemodiluição a que estes animais foram submetidos, poderiam ser as condições responsáveis por este resultado, sem, no entanto, desprezar o fator tempo de I/R hepática que, neste caso, pode ter sido insuficiente para promover o acúmulo destas células no interstício pulmonar que, segundo MARTINS JR21, 1997, é tempo-dependente, atingindo concentração máxima somente após 120 minutos de reperfusão.
No primeiro caso, o acúmulo sangüíneo esplâncnico levaria ao retardamento do tempo de reperfusão e, também, da migração de PMN para o tecido pulmonar. Quanto ao fator hemodiluição, neste trabalho, verificou-se que os animais do grupo Pringle e Total foram aqueles que necessitaram de maior quantidade de infusão de líquidos para manter os valores da PAM dentro dos parâmetros estipulados pelo protocolo adotado, principalmente, durante a fase de isquemia hepática. Esta infusão maciça de líquidos levou a uma hemodiluição, com baixos valores do hematócrito (grupo Pringle, 32± 6%; grupo Total 27± 2%) , que repercutiu durante a fase de reperfusão, o que poderia diminuir o aporte de PMN ao interstício pulmonar.
CONCLUSÃO
Assim, no presente estudo, pode-se concluir que, em ratos submetidos a estado de choque hemorrágico controlado associado a isquemia hepática total de 15 minutos, seguida de 60 minutos de reperfusão, não ocorreu acúmulo significativo de neutrófilos no interstício pulmonar.
REFERÊNCIAS
Mantovani M, Fontelles MJ, Hirano ES, Morandin RC, Caputo LRG, Schenka AA. Total hepatic warm ischemia and reperfusion associated with controlled hemorrhagic shock: effects of neutrophil sequestration in lung of rats. Acta Cir Bras [serial online] 2002 Jan-Feb;17(1). Available from: URL: http://www.scielo.br/acb.
ABSTRACT: OBJECTIVE: The purpose of this experimental work was to study the effects of total hepatic ischemia and reperfusion on the accumulation of neutrophils in the lung of rats, under normal conditions and submitted to controlled hemorrhagic shock state. METHODS: thirty two adult male Wistar rats, were divided into four groups: the Sham group, was submitted to the standard procedures for a period of 60 min. of observation; Shock group, was submitted to controlled hemorrhagic shock (PAM=40 mmHg, 20 min.) followed by volemic resuscitation (lactated Ringers solution + blood, 3:1) and reperfusão for 60 min.; Pringle group, was submitted to total hepatic ischemia for 15 min. and reperfusão for 60 min.; The Total group, was submitted to controlled hemorrhagic shock for 15 min. followed by volemic resuscitation (lactated Ringers solution + blood, 3:1) and reperfusão for 60 min.). The counting of neutrophils on the lung tissue was performed after the euthanasia of animals. RESULTS: The values found for the counting of neutrophils on the lung tissue indicate that the animals from the Pringle, Total, and Shock groups, did not differ from the Sham group, having the following values: Sham, 21,08± 14,12; Shock, 35,15± 18,74; Pringle, 19,78± 15,38; Total, 23,90± 16,37) (p=0.253). CONCLUSION: Rats submitted to controlled hemorrhagic shock state associated to total hepatic ischemia for 15 minutes, followed by 60 minutes of reperfusion, did not present significant neutrophils accumulation on the lung tissue.
KEY WORDS: Ischemia. Reperfusion. Hypovolemic shock. Pringles maneuver. Neutrophil.
Conflito de interesses: nenhum
Fontes de financiamento: CNPq
Endereço para correspondência:
Prof. Dr. Mario Mantovani
Rua José de Campos Sales, 650
Campinas São Paulo
13095-350
Tel: (19) 3251-7049 / 3788-7852
Fax: (19) 3788-9446
e-mail: mmmed@uol.com.br
Data do recebimento: 23/09/2001
Data da revisão: 01/11/2001
Data da aprovação: 12/12/2001
- Patcher HL, Liang HG, Hofstetter SR. Liver and biliary tract trauma. In: Mattox KL, Feliciano DV, Moore EE. Trauma. 4ed. New York: McGraw-Hill; 1999. p 63382.
- Offner PJ, Greene KE. Respiratory insufficiency. In: Mattox KL, Feliciano DV, Moore EE. Trauma. 4ed. New York: McGraw-Hill; 1999. p 130939.
- Moore FA, Moore EE, Haenel JB. Post-injury multiple organ failure. In: Mattox KL Feliciano DV, Moore EE. Trauma. 4ed. New York: McGraw-Hill; 1999. p 142760.
- Smith NA. Pringles maneuver. Curr Surg 1982;39:127.
- Poggetti SR, Moore FA, Moore EE, Bensard DD, Anderson BO, Banerjee A. Liver injury is a reversible neutrophil-mediated event following gut ischemia. Arch Surg 1992;127:1759.
- Cirocchi R, Contine A, Mazieri M, Bisacci R, Fabbri C, Bisacci C, Fabbri B. Il packing periepatico associato a wrapping nel trattamento dei grandi traumi epatici bilobari. Chir Ital 1999;51:25964.
- Isozaki H, Adam R, Gigou M, Szekely AM, Shen M, Bismuth H. Experimental study of the protective effect of intermittent hepatic pedicle clamping in the rat. Br J Surg 1992;79:3103.
- Gonce ME, Brackett DJ, Sqires RA, Gibson DD, Balla AK, Lerner MR, McCay PB, Pennington LR. Development of circulatory and metabolic shock following transient portal triad occlusion. J Surg Res 1995;59:53443.
- Turnage RH, Kedesky KM, Myers SI, Guice KS, Oldham KT. Hepatic hypoperfusion after intestinal reperfusion. Surgery 1996;119:15160.
- Man K, Fan ST, Ng IO, Lo CM, Liu CL, Yu WC, Wong J. Tolerance of the liver to intermittent Pringle maneuver in hepatectomy for liver tumors. Arch Surg 1999;134:5339.
- Calhoon JH, Trinkle JK. Pathophysiology of chest trauma. Chest Surg Clin 1997;7:199211.
- Poggetti SR, Souza JR AL, Fontes B. Isquemia e reperfusão. In: Younes RN, Birolini D. Bases fisiopatológicas da cirurgia. São Paulo: Lemar; 1999. p 135 51.
- Anderson BO, Moore EE, Moore FA, Leff JA, Terada LS, Harken AH, Repine JE. Hypovolemic shock promotes neutrophil sequestration in lungs by a xanthine oxidase-related mechanism. J Appl Physiol 1991;71:18625.
- Grinyó JM. Reperfusion injury. Transplant Proc 1997;29:5962.
- Evora PRB, Pearson PJ, Seccombe JF, Schaff HV. Caracterização da lesão de isquemia/reperfusão. In: Silva JR OC, Zucoloto S, Beer JR A. Modelos experimentais de pesquisa em cirurgia. São Paulo: Robe Editorial; 1998. p 43338.
- Dorinski PM, Gadek JE. Mechanism of a multiple nonpulmonary organ failure in ARDS. Chest 1989;96:88592.
- Christiman JW, Holden EP, Blackwell TS. Strategies for blocking the systemic effects of cytokines in the sepsis syndrome. Crit Care Med 1995;23:95563.
- Schmeling DJ, Caty MG, Oldham KT, Guice KS, Hinshaw DB. Evidence for neutrophil-related acute lung injury after intestinal ischemia-reperfusion. Surgery 1989;109:195202.
- Colletti LM, Remick DG, Burth GD, Kunkel SL, Streater RM, Campbell JR DA. Role of tumor necrosis factor-a in the pathophysiologic alterations after hepatic ischemia/reperfusion injury in the rat. J Clin Invest 1990;85:193643.
- Deitch EA. Multiple organ failure: pathophysiologic and potential future therapy. Ann Sug 1992;26:11734.
- Martins Jr O. Efeitos da isquemia e reperfusão hepática total no seqüestro de neutrófilos no pulmão, rim e íleo terminal e na produção de citocinas: estudo experimental em ratos [Tese Doutorado]. Universidade de São Paulo Faculdade de Medicina; 1997.
Datas de Publicação
-
Publicação nesta coleção
03 Set 2003 -
Data do Fascículo
Fev 2002
Histórico
-
Aceito
12 Dez 2001 -
Recebido
23 Set 2001 -
Revisado
01 Nov 2001