Resumos
Objetivo: Investigar o efeito da pele de rã como curativo oclusivo em feridas cutâneas. Métodos: Quinze cães mestiços, de ambos os sexos, pesando 9,45 ± 2,62kg, sob anestesia geral, foram submetidos a 34 lesões cutâneas quadradas, com 400mm² de área, localizadas nas regiões toracodorsal direita e esquerda. Nas 17 lesões da região toracodorsal direita, após descongelamento, peles de Rana catesbeiana preservadas em solução de NaCl e glicerol sob temperatura de --4ºC foram empregadas como curativo oclusivo (Grupo Teste). As 17 lesões da região toracodorsal esquerda foram tratadas com gaze umedecida em solução de NaCl a 0,9% (Grupo Controle). As freqüências de feridas cicatrizadas (FC) e não cicatrizadas (FNC) e a incidência de destruição de peles de rã foram analisadas. Cinco séries de amostras de peles de rã foram examinadas histologicamente até o aparecimento de destruição. Características histológicas do processo inflamatório das feridas foram avaliadas através dos percentuais de intensidade de Polimorfonucleares (PPMN), Mononucleares (PM) e Infiltrado Linforreticular (PIL). O testes t de Student bicaudal e qui-quadrado (chi²) foram aplicados quando indicados. Resultados: 1) Não houve diferenças significativas nas freqüências de FC e FNC entre os Grupos estudados; 2) Houve incidência de destruição de peles de 31,00%, limitada à área de contato com a ferida; tendência para aumento da incidência de destruição durante o período de estudo foi sugerida; 3) As alterações histológicas das peles de rã, caracterizadas por infiltrado constituído sobretudo por mononucleares, bem como por destruição das camadas de Malpighi e subjacentes, foram observadas na área de contato com a ferida canina; 4) Os valores do PPMN não foram estatisticamente diferentes entre os grupos. Prevalência do PM e exclusividade do PIL no Grupo Teste foram verificadas. Conclusão: A pele de rã não é efetiva no tratamento de feridas caninas e a rejeição foi sugerida como um fator causal.
Curativos biológicos; Pele; Cicatrização de feridas; Cães
Objective: To study the effect of frog skin as occlusive dressing on cutaneous wounds. Methods: Fifteen mongrel dogs, of both sexes, weighing 9.45 ± 2.62 kg, under general anesthesia, were submitted to 34 square shaped skin lesions, with 400 mm² of area, on both right and left thoracodorsal surfaces. After defrosting, Rana catesbeiana skins preserved in a ClNa and glycerol solution at --4ºC were used as biological occlusive dressing on 17 lesion located in the right thoracodorsal region (Test Group). The 17 lesions on the left thoracodorsal side were treated with gauze moistened in a 0.9% ClNa solution (Control Group). The frequency of healed (HW) and non-healed wounds (NHW), and the incidence of frog skin destruction, were analyzed. Five sequences of frog skin samples were histologically examined till tissue destruction started to appear. Inflammatory histological findings were evaluated by percentage of intensity of Polymorphonuclear cells (PPMNC), Mononuclear cells (PMC), and lymphoreticular infiltration (PLI). Two tailed Student's t test and chi square test (chi²) were used as indicated. Results: 1) There was no significant difference in HW and NHW between Groups; 2) There was a 31.00% incidence of frog skin destruction limited to the surface in contact with dog wounds. An increased tendency of destruction was perceived during the studied period; 3) Histological changes of frog skin, characterized by tissue infiltration mainly from mononuclear cells, and by destruction of Malpighi and subjacent layers, were observed at the surface, limited to the wound contact area; 4) PPMNC values attained were not statistically different between groups. In the Test Group PM prevailed and PLI was exclusively seen. Conclusion: Frog skin is ineffective in treatment of canine cutaneous wounds and rejection was suggested as a causative factor.
Biological dressings; Skin; Wound healing; Dogs
2
¾ ARTIGO ORIGINAL
PELE DE RANA CATESBEIANA COMO CURATIVO BIOLÓGICO OCLUSIVO NO TRATAMENTO DE FERIDAS CUTÂNEAS PRODUZIDAS EM CÃES. ALTERAÇÕES MACROSCÓPICAS E MICROSCÓPICAS RESULTANTES DA INTERAÇÃO DESSES TECIDOS. ESTUDO PRELIMINAR
1 1 . Trabalho realizado no Departamento de Medicina Veterinária UFRPE, no Núcleo de Cirurgia Experimental do Departamento de Cirurgia e no Departamento de Patologia UFPE. 2 . Mestre em Medicina Veterinária pela UFRPE. 3 . Professor Adjunto, Doutor ¾ Departamento de Patologia UFPE. 4 . Professor Adjunto, Doutor. Coordenador do Núcleo de Cirurgia Experimental ¾ Departamento de Cirurgia UFPE. 5 . Professor Adjunto, Doutor ¾ Departamento de Medicina Veterinária UFRPE.
Suyiene Cordeiro Falcão2 1 . Trabalho realizado no Departamento de Medicina Veterinária UFRPE, no Núcleo de Cirurgia Experimental do Departamento de Cirurgia e no Departamento de Patologia UFPE. 2 . Mestre em Medicina Veterinária pela UFRPE. 3 . Professor Adjunto, Doutor ¾ Departamento de Patologia UFPE. 4 . Professor Adjunto, Doutor. Coordenador do Núcleo de Cirurgia Experimental ¾ Departamento de Cirurgia UFPE. 5 . Professor Adjunto, Doutor ¾ Departamento de Medicina Veterinária UFRPE.
Silvia Limongi Lopes3 1 . Trabalho realizado no Departamento de Medicina Veterinária UFRPE, no Núcleo de Cirurgia Experimental do Departamento de Cirurgia e no Departamento de Patologia UFPE. 2 . Mestre em Medicina Veterinária pela UFRPE. 3 . Professor Adjunto, Doutor ¾ Departamento de Patologia UFPE. 4 . Professor Adjunto, Doutor. Coordenador do Núcleo de Cirurgia Experimental ¾ Departamento de Cirurgia UFPE. 5 . Professor Adjunto, Doutor ¾ Departamento de Medicina Veterinária UFRPE.
Antônio Roberto de Barros Coelho4 1 . Trabalho realizado no Departamento de Medicina Veterinária UFRPE, no Núcleo de Cirurgia Experimental do Departamento de Cirurgia e no Departamento de Patologia UFPE. 2 . Mestre em Medicina Veterinária pela UFRPE. 3 . Professor Adjunto, Doutor ¾ Departamento de Patologia UFPE. 4 . Professor Adjunto, Doutor. Coordenador do Núcleo de Cirurgia Experimental ¾ Departamento de Cirurgia UFPE. 5 . Professor Adjunto, Doutor ¾ Departamento de Medicina Veterinária UFRPE.
Edvaldo Lopes de Almeida5 1 . Trabalho realizado no Departamento de Medicina Veterinária UFRPE, no Núcleo de Cirurgia Experimental do Departamento de Cirurgia e no Departamento de Patologia UFPE. 2 . Mestre em Medicina Veterinária pela UFRPE. 3 . Professor Adjunto, Doutor ¾ Departamento de Patologia UFPE. 4 . Professor Adjunto, Doutor. Coordenador do Núcleo de Cirurgia Experimental ¾ Departamento de Cirurgia UFPE. 5 . Professor Adjunto, Doutor ¾ Departamento de Medicina Veterinária UFRPE.
Falcão SC, Lopes SL, Coelho ARB, Almeida EL. Pele de Rana catesbeiana como curativo biológico oclusivo no tratamento de feridas cutâneas produzidas em cães: alterações macroscópicas e microscópicas resultantes da interação desses tecidos. Estudo preliminar. Acta Cir Bras [serial online] 2002 Maio-Jun;17(3). Disponível em URL: http://www.scielo.br/acb.
RESUMO ¾ Objetivo: Investigar o efeito da pele de rã como curativo oclusivo em feridas cutâneas. Métodos: Quinze cães mestiços, de ambos os sexos, pesando 9,45 ± 2,62kg, sob anestesia geral, foram submetidos a 34 lesões cutâneas quadradas, com 400mm2 de área, localizadas nas regiões toracodorsal direita e esquerda. Nas 17 lesões da região toracodorsal direita, após descongelamento, peles de Rana catesbeiana preservadas em solução de NaCl e glicerol sob temperatura de ¾4ºC foram empregadas como curativo oclusivo (Grupo Teste). As 17 lesões da região toracodorsal esquerda foram tratadas com gaze umedecida em solução de NaCl a 0,9% (Grupo Controle). As freqüências de feridas cicatrizadas (FC) e não cicatrizadas (FNC) e a incidência de destruição de peles de rã foram analisadas. Cinco séries de amostras de peles de rã foram examinadas histologicamente até o aparecimento de destruição. Características histológicas do processo inflamatório das feridas foram avaliadas através dos percentuais de intensidade de Polimorfonucleares (PPMN), Mononucleares (PM) e Infiltrado Linforreticular (PIL). O testes t de Student bicaudal e qui-quadrado (c2) foram aplicados quando indicados. Resultados: 1) Não houve diferenças significativas nas freqüências de FC e FNC entre os Grupos estudados; 2) Houve incidência de destruição de peles de 31,00%, limitada à área de contato com a ferida; tendência para aumento da incidência de destruição durante o período de estudo foi sugerida; 3) As alterações histológicas das peles de rã, caracterizadas por infiltrado constituído sobretudo por mononucleares, bem como por destruição das camadas de Malpighi e subjacentes, foram observadas na área de contato com a ferida canina; 4) Os valores do PPMN não foram estatisticamente diferentes entre os grupos. Prevalência do PM e exclusividade do PIL no Grupo Teste foram verificadas. Conclusão: A pele de rã não é efetiva no tratamento de feridas caninas e a rejeição foi sugerida como um fator causal.
DESCRITORES ¾ Curativos biológicos. Pele. Cicatrização de feridas. Cães.
INTRODUÇÃO
Elementos existentes na Natureza podem constituir materiais alternativos para o tratamento local das feridas devido aos custos elevados dos curativos oclusivos, sintéticos ou biossintéticos1.
Materiais biológicos, empregados como curativo oclusivo, têm sido recomendados por vários investigadores por possuírem propriedades antibacteriana e analgésica, acelerarem a formação de tecido de granulação e epitelização, propiciarem barreira à invasão bacteriana, assim como promoverem retenção do exsudato, características admitidas como benéficas para a cicatrização2,3.
Tecidos biológicos de origem animal, como membrana amniótica humana e eqüina1,4,5,6,7,8,9, pele de cadáver humano10,11,12,13, pele de cão14, pele de cobaia15, pele de porco6, placenta humana7, pericárdio bovino16,17 e eqüino18, membrana de queratinócitos humanos autólogos cultivados16,19, pele de anfíbio3,20,21 e camada submucosa de intestino delgado de porco2, têm sido empregados como curativo biológico oclusivo em feridas cutâneas.
No entanto, os tecidos de origem biológica obtidos a partir de animais da mesma espécie ou de espécies diferentes comportam-se, do ponto de vista imunológico, respectivamente, como materiais alogênicos e xenogênicos, podendo induzir rejeição, constituindo assim fator que restringe a eficácia e o tempo de uso como curativo ou enxerto10,11,15,16,22,23,24.
O presente trabalho, etapa de uma linha de pesquisa, tem como objetivo o estudo do efeito da pele de Rana catesbeiana, usada como curativo biológico oclusivo, sobre a cicatrização de feridas produzidas em cães. Algumas alterações macroscópicas e microscópicas decorrentes da interação entre peles de rã dessa espécie e as superfícies cruentas das feridas caninas constituíram também objeto de estudo e observação.
MÉTODOS
Foram utilizados 15 cães adultos, mestiços, sendo oito fêmeas e sete machos, pesando 9,45 ± 2,62kg. Como medicação pré-anestésica foi administrado sulfato de atropina a 0,25%, na dose 0,044mg/kg. A anestesia foi induzida com xilazina na dose 1mg/kg, por via intramuscular. A manutenção anestésica foi obtida com cetamina na dose de 2,0 a 4,0mg/kg por via intravenosa25. Durante os experimentos, os animais receberam 250ml de solução de NaCl a 0,9% por via intravenosa.
Modelo experimental e grupos estudados
A exérese do retalho de pele total dos cães foi realizada em local previamente demarcado com lápis dermográfico em torno de moldes quadrados de película de RX, medindo 20mm de lado. Desse modo, em 14 animais obteve-se uma ferida de cada lado da região toracodorsal com área de 400mm2, distando 8cm da coluna vertebral. Em um animal as lesões tegumentares, em número de três, foram produzidas de cada lado da região toracodorsal, distando 10cm entre si e 8cm da coluna vertebral.
Assim, foram estudadas 17 lesões cutâneas produzidas na região toracodorsal direita e 17 na região toracodorsal esquerda. As feridas toracodorsais direitas foram recobertas com retalho de pele de rã de tamanho tal que ultrapassasse as margens da lesão em aproximadamente 1cm (Grupo Teste), enquanto as feridas toracodorsais esquerdas foram tratadas com gaze umedecida em solução de NaCl a 0,9% (Grupo Controle). Ambos os curativos foram sucessivamente recobertos por gaze seca esterilizada, fixadas com esparadrapo, envoltos por faixa de crepom no 10 e, finalmente, contidos com vestimenta tubular de malha de algodão. Em todos os animais foram empregados colares elizabetanos. Nos dois grupos, a troca de curativos ocorreu em prazo de 24 horas em 18 feridas (nove de cada Grupo) e de 48 horas em 16 lesões (oito de cada Grupo). Os curativos eram observados diariamente.
Obtenção, acondicionamento e preservação das peles de rã
As peles de rã foram colhidas durante abate em ranário. Em seguida procedia-se à limpeza da pele, observando-se os padrões de assepsia, através de lavagem exaustiva com solução fisiológica e retirada de restos de tecidos não pertencentes à camada cutânea com gaze. Retalhos de pele dorsal e ventral foram acondicionados em recipientes de vidro esterilizados, imersos numa solução composta de 85% de cloreto de sódio a 0,9% e de 15% de glicerol a 99,5%, estocados à temperatura de -4ºC, durante três meses. Para utilização da pele, procedeu-se ao descongelamento rápido em banho-maria à temperatura de 60ºC.
Parâmetros avaliados e observados
Cicatrização das feridas
As freqüências de Feridas Cicatrizadas (FC) e Não Cicatrizadas (FNC) foram comparadas entre os Grupos estudados, ao final de 28 dias, atendendo-se ao conceito de que a cicatrização de feridas cutâneas planas completa-se por combinação dos processos de contração e epitelização.
Características macroscópicas da pele de rã
As características macroscópicas dos curativos de pele de rã, constituídas por atributos denominados de Integridade do Curativo* * Quando a pele de rã permaneceu íntegra sobre a ferida. e Destruição do Curativo** * Quando a pele de rã permaneceu íntegra sobre a ferida. foram avaliadas nos períodos de zero ao 7o DPO (1o Período), do 7o ao 14o DPO (2o Período) e do 14o ao 28o DPO (3o Período).
Observações microscópicas do processo de destruição da pele de rã
Um retalho de pele de rã normal preservada, não utilizada como curativo, foi submetido a exame microscópico. Em cinco cães (Animais nos 8, 9, 10, 11 e 14), seqüências de retalhos de pele de rã entre o 1o e o 5o DPO, até o aparecimento dos primeiros sinais macroscópicos de adelgaçamento ou destruição, foram submetidos a exames histológicos. Observações microscópicas foram também realizadas em retalho de pele de rã, no 280 DPO. Adotou-se a hematoxilina-eosina (HE) como meio de coloração e microscopia óptica como técnica de leitura.
Características microscópicas do processo inflamatório nas feridas
Foram realizadas biópsias das feridas incluindo-se a transição entre a pele normal e a área cruenta, no 7o, 14o e 28o DPO. Após processamento, as lâminas foram coradas pela hematoxilina-eosina (HE), para estudo através de microscopia óptica. As características histológicas do processo inflamatório nas feridas dos Grupos Teste e Controle foram avaliadas, semiquantitativamente, por escores, e posteriormente transformados em valores de Percentuais de Intensidade de Polimorfonucleares (PPMN), de Mononucleares (PM) e de Infiltrado Linforreticular (PIL), adotando-se o seguinte critério: (-) = 0%; (+) = 25%; (++) = 50%; (+++) = 75%; e (++++) = 100%. Realizou-se estudo comparativo em períodos correspondentes e ao final de 28 dias de observação, entre os Grupos Teste e Controle.
Análise estatística
Para análise estatística dos dados de freqüência de cicatrização das feridas e de destruição da pele de rã foi aplicado o teste do qui-quadrado (c2), com probabilidade de erro pretendida de p £ 0,05. Para análise estatística dos valores dos percentuais de intensidade de Polimorfonucleares (PPMN), Mononucleares (PM) e Infiltrado Linforreticular (PIL) na ferida, foi utilizado o teste t de Student bicaudal, com probabilidade de erro pretendida de p £ 0,05.
Os experimentos foram conduzidos de acordo com recomendações contidas no International Principles for Biomedical Research Involving Animal26. Após 28 dias, oito animais foram doados, enquanto sete foram mantidos com finalidade de estudos imunológicos posteriores.
RESULTADOS
Estudo da cicatrização das feridas
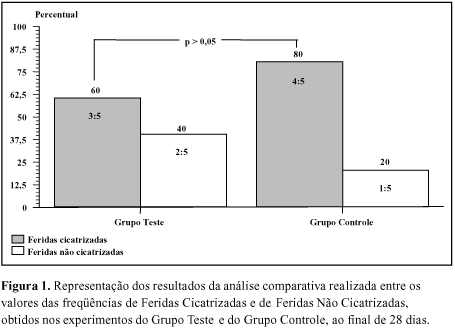
Constatou-se não haver diferenças significativas nas freqüências de Feridas Cicatrizadas (FC) e Não Cicatrizadas (FNC), durante 28 dias (Figura 1).
Estudo das características macroscópicas da pele de rã
A destruição incompleta (adelgaçamento) ou completa (perfuração) dos retalhos de pele de rã, restrita à área de contato com a superfície cruenta da ferida produzida nos cães, ocorreu em 31,00% de 171 retalhos que não se deslocaram totalmente do local da ferida (Tabela 1) (Figura 2-A).
Em apenas dois animais dentre 15 (cães nos 1 e 4) não se observou destruição da pele de rã ao longo do período de observação. O episódio mais precoce de destruição ocorreu no 3o DPO (Cão no 13), enquanto o episódio mais tardio foi detectado no 8o DPO (Cão no 12). Nos animais em que se observou destruição da pele de rã, houve reprodução desse fenômeno em até 11 oportunidades (Cão no 15), durante o período de avaliação. Em um caso, a pele de rã apresentou três áreas distintas de destruição, tendo o retalho sofrido deslocamento parcial, permitindo que houvesse locais diversos de exposição da pele de rã à superfície da ferida (Cão no 9, 12o DPO) (Figura 2-B).
Em nove feridas produzidas no Grupo Teste, os episódios de destruição da pele de rã ocorreram em tempo inferior a 24 horas, em número de 42, enquanto em oito feridas tais episódios aconteceram entre 24 e 48 horas, em número de 11.
Observou-se, ainda, incidência de destruição de 22,35% no 1o Período, de 34,48% no 2o Período e de 50% no 3o Período de observação (Tabela 1). Não foram constatadas diferenças estatisticamente significativas entre os valores das freqüências de Destruição do Curativo nas comparações realizadas entre o 1o e o 2o Períodos e entre o 2o e o 3o Períodos programados para estudo (Tabela 1). No entanto, verificou-se que os valores das freqüências de destruição da pele de rã foram significativamente maiores no 3o do que no 1o Período (Tabela 1).
Observações das características microscópicas do processo de destruição da pele de rã
Os exames microscópicos de uma série de peles de rã, iniciados por um exemplar de pele íntegra normal, não usada como curativo oclusivo (Figura 3), assim como por uma seqüência dessas peles, trocadas a cada 24h (1o ao 5o DPO), compreendida entre o primeiro contato com as feridas produzidas nos cães (animais nos 8, 9, 10, 11 e 14) e os indícios macroscópicos de destruição (adelgaçamento ou ruptura), revelaram alterações constituídas por infiltração de polimorfonucleares e de mononucleares nas camadas dérmica e epidérmica, bem como por desintegração das camadas malpighiana e subjacente, de evolução progressiva, até a ruptura completa da pele dessa espécie de anfíbio (Figura 4A, B, C e D). Nessa série, as áreas de pele do ranídeo circunvizinhas à ferida e em contato com a pele íntegra do cão apresentaram processo inflamatório discreto e conservação da estrutura tecidual satisfatória (Figura 5). Achados equivalentes foram observados na pele de rã usada no cão no 3 no 28o DPO (Figura 6A e B).
Estudo das características microscópicas do processo inflamatório nas feridas
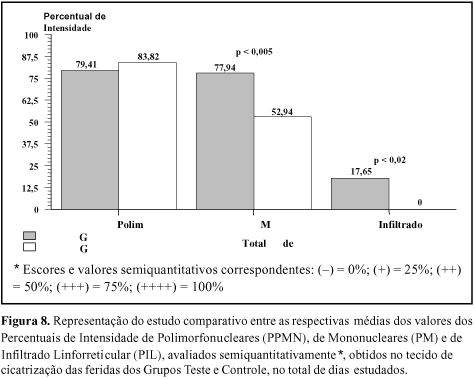
Quando os percentuais de intensidade de polimorfonucleares nas feridas (PPMN) foram comparados em períodos correspondentes e no total de dias estudados, entre as lesões do Grupo Teste e do Grupo Controle, não houve diferenças estatisticamente significativas (Figuras 7 e 8). Constatou-se que os percentuais de intensidade de mononucleares (PM) nas feridas do Grupo Teste foram significativamente maiores que aqueles verificados nas feridas do Grupo Controle, no 1o e 3o Períodos e no total de dias estudados (Figuras 7 e 8). Embora não tenha havido diferença estatisticamente significativa em relação ao Grupo Controle, a presença de Infiltrado Linforreticular (PIL) na hipoderme das feridas dos cães foi detectada exclusivamente no Grupo Teste, nos períodos programados para estudo e no total de dias estudados (Figuras 7 e 8).
DISCUSSÃO
A inexistência de diferenças significantes entre freqüências de FC e FNC nos Grupos Teste e Controle (Figura 1) poderia refletir a influência do processo de destruição da pele de rã, tornando essa cobertura biológica pouco eficaz.
Na literatura consultada, foram encontrados apenas dois estudos experimentais sobre emprego de pele de anfíbios, como curativo biológico oclusivo, em lesões cutâneas. No primeiro, pele de Rana tigrina foi testada em feridas cutâneas produzidas cirurgicamente em ratos Wistar3. No segundo, pele de Rana catesbeiana foi usada em lesões cutâneas produzidas por queimadura em ratos dessa mesma linhagem20. Em ambos os relatos houve cicatrização mais acelerada nas feridas tratadas com pele de rã, sem ocorrência de destruição desse tecido. Nesses estudos não foram referidos pré-tratamento da pele do ranídeo com objetivo de desvitalização tecidual ou atenuação antigênica. Por outro lado, não foi mencionado o emprego de processos para indução de tolerância por depleção linfocitária, pela administração de soro antilinfocítico ou por uso de drogas imunossupressoras27,28, nos animais da linhagem estudada.
Na presente pesquisa, a relação entre a pele de rã utilizada como cobertura temporária e a área da ferida poderia ser considerada como uma interação entre tecidos viáveis de espécies diferentes, desde que nenhum processo que modificasse deliberadamente a estrutura da pele anfíbia foi empregado. O uso de glicerol a 15% na conservação da pele anfíbia teve como objetivo a proteção das células contra a hipotermia29. Peles viáveis de Rana catesbeiana secretam um peptídeo (ranalexina) com propriedades antimicrobianas30. A viabilidade do tecido poderia ser ainda inferida a partir da ação inibitória contra S. aureus e S. b-hemolítico observada, in vitro, em testes previamente realizados por nós, com discos de pele de Rana catesbeiana fresca ou conservada em solução contendo 85% de NaCl a 0,9% e 15% de glicerol a 99,5% em temperaturas de ¾4ºC e ¾196ºC31.
A ocorrência de destruição da pele de rã, de intensidade substancial (31,00%), caráter precoce, repetitivo e eventualmente múltiplo, restrita à área de contato com a ferida cutânea, presenciada na maioria dos animais (13 em 15) (Figura 2, A e B), cujo estudo estatístico sugeriu tendências de aumento ao longo do período de 28 dias (Tabela 1), poderia significar fenômeno relacionado com a interação imunológica entre tecidos biologicamente ativos. Observações relevantes, caracterizadas pelo aparecimento das primeiras destruições da pele de rã em intervalo de três a oito dias após contato com as feridas e de reprodução freqüente do fenômeno, poderiam significar processo de estimulação de anticorpos naturais preexistentes ou de prévia sensibilização dos cães por tecido viável entranho, constituindo, desse modo, fenômeno sugestivo de rejeição.
De modo geral, numa interação xenogênica, o reconhecimento de uma espécie por outra, através de anticorpos naturais (ACN) (preformados) ou induzidos (pré-sensibilização), guarda uma relação diretamente proporcional à distância filogenética existente entre as mesmas, permitindo assim a identificação de espécies discordantes em maior ou menor grau. Recentemente, vários autores têm admitido a necessidade da presença de células apresentadoras de antígenos (CAA) do receptor para o reconhecimento efetivo de xenoantígenos28,32. Assim, o fenômeno de rejeição xenogênica poderia ser classificado como agudo, do tipo humoral ou celular.
Nos mamíferos, as células de Langerhans (CL), provavelmente oriundas de monócitos da medula óssea, localizadas no epitélio estratificado da pele, pertencentes ao grupo de células apresentadoras de antígeno (CAA), têm função de processar e apresentar moléculas antigênicas do complexo principal de histocompatibilidade (CPH) da classe II do tecido estranho aos linfócitos do receptor, dando início a resposta imunológica celular ou humoral, sendo tais células consideradas o componente mais periférico da via aferente do sistema imunológico33,34. Essas células, também migram pela via aferente linfática até a paracortex dos linfonodos regionais, onde se interdigitam com diversos linfócitos T, simultaneamente, apresentando os antígenos trazidos da pele35. Esses dados permitem inferir que a pele de mamíferos encontra-se habilitada para iniciar vários tipos de resposta imunológica. Tendo como base o distanciamento filogenético entre cães e rãs, podendo constituir uma relação discordante de grau provavelmente avançado, assim como a capacitação da pele de mamíferos em iniciar resposta imunológica humoral e celular, poder-se-ia cogitar que a destruição da pele anfíbia fosse conseqüência de rejeição xenogênica, circunstância esta não referida em outras espécies com relação discordante de grau presumivelmente menor3,20.
Inicialmente, nos transplantes de pele, quando ainda não se encontra estabelecida a vascularização do enxerto, o tecido transplantado permanece em íntimo contato com os capilares linfáticos do tecido subjacente do receptor. Os linfócitos não sensibilizados para o processo de rejeição, trazidos pelo sangue do hospedeiro, encontram-se com moléculas antigênicas na interface do enxerto e a ferida, tornando-se sensibilizados após processamento nos gânglios linfáticos regionais, quando então retornam, por via sanguínea, como células efetoras, invadindo e proliferando no enxerto. Devido principalmente ao envolvimento do enxerto e dos linfonodos regionais, o processo é denominado de via de sensibilização periférica34. Tal processo poderia também ocorrer em enxerto não vascularizado, como no caso dos curativos biológicos oclusivos de origem xenogênica, tendo em vista a presença de intenso infiltrado de células mononucleares, do receptor encontrado nas camadas dérmica e epidérmica da pele de rã, assim como pela desintegração dessas estruturas.
Durante o uso de pele de Rana catesbeiana como cobertura temporária de feridas produzidas por queimadura grave em humanos, conservada por congelamento, sem a preocupação de manter a viabilidade desse tecido, não foram relatados fenômenos de rejeição21. Por outro lado, a depressão imunológica encontrada em pacientes portadores de queimaduras extensas também poderia concorrer para o aumento de tolerância aos enxertos36,37.
Vários tecidos de origem alogênica11,12 ou xenogênica1,15,23,24,38,quando usados como curativo biológico ou mesmo como enxerto, são susceptíveis de desintegração por processo de rejeição. Nesses casos, para obter-se tolerância, o pré-tratamento desses materiais biológicos com glicerol a 85%11,12, glutaraldeído21 ou hipotermia profunda (¾80 a ¾196oC)15, assim como pela administração de drogas imunossupressoras como malononitrilamidas ou ciclosporina aos receptores23,24, têm sido preconizados. O estado de imunodepressão adquirida do hospedeiro permite alongamento da sobrevida de enxertos cutâneos39.
Outras estruturas biológicas como membrana amniótica humana e eqüina4,8, por não possuírem células epiteliais que expressem moléculas antigênicas, não induzem rejeição. Recentemente, submucosa de intestino de porco, por constituir estrutura acelular, formada essencialmente de colágeno tipo I, tem sido empregada experimentalmente como curativo biológico, sem que fenômeno de rejeição tenha sido observado2.
As alterações histológicas de destruição em comparação com a pele anfíbia normal (Figura 3) foram constituídas por infiltração de polimorfonucleares e de mononucleares nas camadas dérmica e epidérmica da pele de rã, bem como por desintegração dessas estruturas, de evolução progressiva (Figura 4A, B, C e D) e em correspondência com a área cruenta da ferida. Por outro lado, fora da área cruenta, constituída pela pele íntegra do cão, houve conservação satisfatória da estrutura original da pele de rã (Figura 5). Esses achados foram também observados no 28o DPO (Figura 6A e B). Portanto, parece que interface formada pela pele de rã e o tecido desprovido de tegumento constitui condição primordial para o estabelecimento do fenômeno de destruição.
Quando os percentuais de intensidade de polimorfonucleares nas feridas (PPMN), em períodos correspondentes e no total de dias estudados, foram comparados entre as feridas do Grupo Teste e do Grupo Controle, não foram constatadas diferenças estatisticamente significativas (Figuras 7 e 8). Os polimorfonucleares não demonstram especificidade pelo antígeno, porém desempenham papel importante no processo inflamatório35. Para justificar esses resultados, sugere-se ocorrência de processo inflamatório inicial não específico, decorrente do trauma, da fase inicial da cicatrização e da presença das peles de rã ou da gaze nas feridas dos cães, como tecidos estranhos.
A presença de intensa quantidade de mononucleares nas feridas, traduzidas pela constatação de percentuais de intensidade de mononucleares (PM) significativamente maiores nas feridas do Grupo Teste, no 1o e 3o Períodos e no total de dias estudados (Figuras 7 e 8), poderia caracterizar atividade imunológica. Os monócitos sanguíneos, quando transferidos para o tecido, transformam-se em macrófagos e são considerados como células assessoras da resposta imune, pertencentes ao sistema mononuclear fagocitário (SMF) e que realizam funções de fagocitose e processamento, bem como apresentação de moléculas antigênicas aos linfócitos T (resposta celular) e B (resposta humoral)40. Como os macrófagos, os monócitos teciduais são também considerados células apresentadoras de antígenos (CAA) (HLA ¾ Classe II)35.
A presença exclusiva de infiltrado linforreticular na hipoderme das feridas tratadas com pele de rã reforçaria a hipótese de imunorreatividade (Figuras 7 e 8).
Desse modo, poder-se-ia cogitar que a maior intensidade de mononucleares e a exclusividade de infiltrado linforreticular, nas feridas tratadas com pele de rã, poderiam significar atividade inflamatória de caráter imune.
Em virtude de o microambiente úmido propiciado pelos curativos oclusivos ser essencialmente proteolítico, além da ação estimuladora das proteinases sobre formas latentes de fatores de crescimento, bem como de sua atuação na quebra do tecido conectivo com objetivo de gerar peptídeos quimiotáxicos16, seria admissível supor que essas enzimas pudessem também desempenhar ação proteolítica sobre a cobertura constituída por tecido biológico. No entanto, o microambiente proteolítico é característico do fluido exsudativo das feridas nos estágios precoces da cicatrização16 e, neste caso, poderia não justificar a ocorrência de destruição total ou parcial da pele de rã, presenciada desde o 3o até o 28o DPO, ou seja, ocorrendo nos três períodos programados para estudo e, aparentemente, de caráter progressivo (Tabela 1).
Ação destrutiva sobre o tecido biológico usado como curativo poderia também ser exercida através de enzimas proteolíticas de origem bacteriana38. Contudo, nos exames microscópicos realizados, não foram observadas colônias de bactérias nas peles de rã e nas feridas cutâneas dos cães, capazes de ser detectadas pelo método de leitura microscópica empregado.
Finalmente, a comprovação de processo de rejeição dependeria da realização de provas cruzadas de histocompatibilidade pós-sensibilização41 ou de exames imunohistoquímicos, não programados para esta etapa da pesquisa.
A elucidação da causa do processo de destruição mencionado faz parte de projetos a serem desenvolvidos com propósito de estabelecer o modo mais eficaz de utilização da pele de Rana catesbeiana, como curativo biológico oclusivo, em feridas cutâneas excisionais produzidas em animais da espécie canina.
CONCLUSÃO
Não houve benefícios no uso de pele de rã, como curativo biológico, sobre a cicatrização de feridas tegumentares produzidas em cães.
Falcão SC, Lopes SL, Coelho ARB, Almeida EL. Rana catesbeiana skin as occlusive biological dressing in the treatment of skin wounds caused in dogs. Macroscopic and microscopic changes resulting from the interaction of these tissues. Preliminary study. Acta Cir Bras [serial online] 2002 May-Jun;17(3). Available from URL: http://www.scielo.br/acb.
ABSTRACT ¾ Objective: To study the effect of frog skin as occlusive dressing on cutaneous wounds. Methods: Fifteen mongrel dogs, of both sexes, weighing 9.45 ± 2.62 kg, under general anesthesia, were submitted to 34 square shaped skin lesions, with 400 mm2 of area, on both right and left thoracodorsal surfaces. After defrosting, Rana catesbeiana skins preserved in a ClNa and glycerol solution at ¾4ºC were used as biological occlusive dressing on 17 lesion located in the right thoracodorsal region (Test Group). The 17 lesions on the left thoracodorsal side were treated with gauze moistened in a 0.9% ClNa solution (Control Group). The frequency of healed (HW) and non-healed wounds (NHW), and the incidence of frog skin destruction, were analyzed. Five sequences of frog skin samples were histologically examined till tissue destruction started to appear. Inflammatory histological findings were evaluated by percentage of intensity of Polymorphonuclear cells (PPMNC), Mononuclear cells (PMC), and lymphoreticular infiltration (PLI). Two tailed Student's t test and chi square test (c2) were used as indicated. Results: 1) There was no significant difference in HW and NHW between Groups; 2) There was a 31.00% incidence of frog skin destruction limited to the surface in contact with dog wounds. An increased tendency of destruction was perceived during the studied period; 3) Histological changes of frog skin, characterized by tissue infiltration mainly from mononuclear cells, and by destruction of Malpighi and subjacent layers, were observed at the surface, limited to the wound contact area; 4) PPMNC values attained were not statistically different between groups. In the Test Group PM prevailed and PLI was exclusively seen. Conclusion: Frog skin is ineffective in treatment of canine cutaneous wounds and rejection was suggested as a causative factor.
KEY WORDS ¾ Biological dressings. Skin. Wound healing. Dogs.
Conflito de interesses: nenhum
Fontes de financiamento: nenhuma
Endereço para correspondência:
Prof. Antônio Roberto de Barros Coelho
Rua Galvão Raposo, 234
50610-330 ¾ Recife ¾ PE
Tel./Fax: (81) 3227- 0142
e-mail: rbarros@elogica.com.br
Data do recebimento: 24/10/2001
Data da revisão: 12/12/2001
Data da aprovação: 11/01/2002
** Quando a pele de rã, permanecendo sobre a ferida, sofreu destruição parcial (adelgaçamento) ou total (ruptura) em área correspondente à superfície cruenta da lesão.
- 1. Chanda J, Rao SB, Mohanty M, Muraleedharan CV, Arthur VL, Bhuvaneshwar GS, Valiathan MS. Use of glutaraldehyde-gentamicin-treated bovine pericardium as a wound dressing. Biomaterials 1994;15:68-70.
- 2. Prevel DC, Eppley LB, Summerlin DJ, Sidner R, Jackson JR, McCarty M, Badylak SF. Small intestinal submucosa: utilization as a wound dressing in full-thickness rodent wounds. Ann Plast Surg 1995;35:381-8.
- 3. Sai KP, Reddy PN, Babu M. Investigations on wound healing by using amphibian skin. Indian J Exp Biol 1995;33:673-6.
- 4. Bigbie RB, Schumacher J, Swain SF, Purihit RC, Wright JC. Effects of amnion and live yeast cell derivative on second-intention healing in horses. Am J Vet Res 1991;52:1376-82.
- 5. Ganatra MA, Durrani KM. Method of obtaining and preparation of fresh human amniotic membrane for clinical use. J Park Med Assoc 1996;46:126-8.
- 6. Ramsey DT, Pope ER, Wagner-Mann C. Effects of three occlusive dressings materials on healing of full-thickness skin wounds in dogs. Am J Vet Res 1995;56:941-9.
- 7. Subrahmanyam M. Amniotic membrane as a cover for microskin grafts. Br J Plast Surg 1995;48:477-8.
- 8. Tayyar M, Turan R, Ayata D. The use of amniotic membrane plus heparin to prevent post operative adhesions in the rabbit. J Exp Clin Med 1993;18: 57-60.
- 9. Zachariou Z. Amniotic membranes as prosthetic material: experimental utilization data of a model. J Pediatr Surg 1997;32:1458-63.
- 10. Escudero MD, Otero J, Gago E. El donante de tejidos. In: Navidade-López A, Kulisevsky J, Caballero F. El donante de órganos y tejidos: evaluación y manejo. Barcelona: Springer; 1997. p. 508-20.
- 11. Richters CD, Hoekstra MJ, Van Baare J, du Pont JS, Kamperdijk EW. Immunogenicity of glycerol-preserved human cadaver skin in vitro. J Burn Care Rehabil 1997;18:228-33.
- 12. Van Baare J, Ligtvoet EE, Middelkoop E. Microbiological evaluation of glycerolized cadaveric donor skin. Transplantation 1998;65:966-70.
- 13. Wai RTJ. Use of glycerol-preserved skin in plastic surgery. Burns 1994; 20: 27-31.
- 14. Silva SC, Junior SCS. Queimaduras: tratamento local. In: Raia AA, Zerbine EJ. Clínica cirúrgica Alípio Correia Netto. 4a ed. São Paulo: Sarvier; 1988. p. 217-35.
- 15. Jia X, Zhu Z, Kong Q. Storage temperature and skin xenograft survival. Chung Hua Wai Ko Tsa Chih 1995; 33:184-5.
- 16. Chem WYJ, Rogers AA, Lydon MJ. Characterization of biologic properties of wound fluid collected during early stages of wound healing. J Invest Dermatol 1992;99:559-64.
- 17. Dahm M, Lyman WD, Schwell AB, Factor SM, Frater RW. Immunogenicity of glutaraldehyde-tanned bovine pericardium. J Thorac Cardiovasc Surg 1990;99:1082-90.
- 18. Bellenzani MCR, Matera JM, Giacóia MR. Homologous pericardium as a biological dressing for treatment of distal limb wounds in horses: an experimental study. Acta Cir Bras 1998;13:238-42.
- 19. Soeda J, Inokuchi S, Ueno S, Yokoyama S, Kidokoro M, Nakamura Y, Katoh S, Sawada Y, Osada M, Mitomi T. Use of cultured human epidermal allografts for the treatment of extensive partial thickness scald burn in children. Tokai J Exp Clin Med 1993;18: 65-70.
- 20. Rodrigues JM, Medeiros AC. Tratamento de queimaduras do dorso de ratos com pele de rã como curativo biológico. In: 9o Congresso de Iniciação Científica ž UFRN 1998, Natal. Anais do 9o Congresso de Iniciação Científica ž UFRN. Imprensa Universitária; 1998, p. 49.
- 21. Piccolo NS, Piccolo MTS, Piccolo MS, de Paula PRS. Xenoenxerto. In: Gomes DR. Queimaduras. Rio de Janeiro: Revinter; 1995. p. 153-8.
- 22. Santillan-Doherty P, Jasso-Victoria R, Sotres-Veja A, Olmos R, Arreola JL, Garcia D, Vanda B, Gaxiola M, Santiba A, Martin S, Cabello R. Thoracoabdominal wall repair with glutaraldehyde-preserved bovine pericardium. J Invest Surg 1996;9:45-55.
- 23. Schorlemmer HV, Kurrle R. The new immunosuppressive malononitrilamide MNA 279 prolongs skin xenografts survival in a mouse-to-rat model. Transplant Proc 1997;29:3497-500.
- 24. Schorlemmer HV, Kurrle RS. Malononitrilamides reduce IgM e IgG xenoantibodies and prolong skin xenografts survival in a mouse-to-rat model. Transplant Proc 1998;30:976-9.
- 25. Mansoni F. Miorrelaxantes. In: Mansoni F. Anestesiologia veterinária: farmacologias e técnicas. 1a ed. Rio de Janeiro: Guanabara Koogan; 1988. p. 95-101.
- 26. Howards-Jones N. A CIOMS ethical code for animal experimentation. WHO Chronicle 1985;39:51-6.
- 27. Barbuto JAM. Tolerância imunológica. In: Galich VLG, Vaz CAC. Imunologia básica. 1a ed. São Paulo: Artes Médicas; 1989. p. 225-46.
- 28. Le Mauff B, Soulillou JP. Bases fundamentais dos xenotransplantes. In: Neumann J, Abbud Filho M, Garcia VD. Transplante de órgãos e tecidos. São Paulo: Sarvier; 1997. p. 442-6.
- 29. Wood EJ, Harris IR. Reconstructed human skin: transplant, graft or biological dressing? Essays Biochem 1995;29:65-85.
- 30. Clarck DP, Durell S, Maloy WL, Zasloff M. Ranalexin. A novel antimicrobial peptide from bullfrog (Rana catesbeiana) skin, structurally related to the bacterial antibiotic, polymyxin. J Biol Chem 1994;269:10849-55.
- 31. Falcão SC, Almeida EL, Mota RA, Coelho MCO. Efeito inibitório da pele de Rana catesbiana sobre cepas de S. aureus, S. b-hemolíticos e P. mirabillis In: I Simpósio de Pesquisa e Pós-graduação 1997, Recife. Anais do I Simpósio de Pesquisa e Pós-Graduação ž UFRPE. Imprensa Universitária da UFRPE; 1997. p. 101.
- 32. Tizard IR. Imunologia veterinária: uma introdução. 5a ed. São Paulo: Roca; 1998. p. 408-19.
- 33. Carrillo-Farga J, Castell A, Pérez A, Rondán A. Langerhans-like cells in amphibian epidermis. J Anat 1990;172:39-45.
- 34. Klein J. Allograft reaction. In: Klein J. Immunology. Oxford: Blackwell Scientific Publications; 1990. p. 460-76.
- 35. Castro S, Tousan R, Sporlerder H, Fernandes S, Silva AS, Deboni L, Neumann J. Sistema imune. In: Neumann J, Filho M.A, Garcia V.D. Transplante de órgãos e tecidos. São Paulo: Sarvier; 1997. p. 3-33.
- 36. Kolenik SA, Leffell DJ. The use of cryopreserved human skin allografts in wound healing following Mohs surgery. Dermatol Surg 1995;21:615-20.
- 37. Sucena RC. Queimaduras: princípios atuais e controvérsias. In: Melega JM, Zanine AS, Psillaki JM. Cirurgia plástica reparadora. 2a ed. São Paulo: MEDSI; 1992. p. 205-15.
- 38. Vasconcelos Filho JOM. Utilização de artéria bovina tratada pelo glutaraldeído em aorta abdominal de cão; análise morfológica de 11 enxertos após 180 dias de implantação [Tese ž Mestrado ]. Universidade Federal de Pernambuco ž Centro de Ciências da Saúde; 1988.
- 39. Cunha JEM. Transplante de órgãos. In: Goldenberg S, Bevilacqua RG. Bases da cirurgia. 2a ed. São Paulo: Editora Pedagógica e Universitária; 1981. p. 247-63.
- 40. Isaac L. Células do sistema imune. In: Calich VLG, Vaz CAC. Imunologia básica. 1a ed. São Paulo: Artes Médicas; 1989. p. 34-48.
- 41. Neumann J. Avaliação imunológica pré-transplante. In: Neumann J, Abbud Filho M, Garcia VD. Transplante de órgãos e tecidos. São Paulo: Sarvier; 1997. p. 34-44.
Datas de Publicação
-
Publicação nesta coleção
01 Jul 2002 -
Data do Fascículo
Maio 2002
Histórico
-
Aceito
11 Jan 2002 -
Revisado
12 Dez 2001 -
Recebido
24 Out 2001