Resumos
Na síndrome de isquemia e reperfusão os pulmões podem ser alvo de lesão a distância como nos casos de choque, trauma ou ainda nos casos de transplante hepático. Objetivo: Avaliar o efeito protetor da N-acetilcisteína (NAC) sobre os pulmões após isquemia hepática. Métodos: Foram utilizados 12 ratos, machos, linhagem EPM-1 Wistar, separados aleatoriamente em dois grupos com seis animais (controle e experimento). Os animais de ambos os grupos foram submetidos à anestesia com cloridrato de quetamina e cloridrato de xilazina. Realizou-se a incisão mediana longitudinal, identificação do hilo hepático e da veia cava caudal. Quinze minutos antes do clampeamento injetou-se solução glicosada a 5% no grupo controle e NAC diluída em solução glicosada a 5% no grupo experimento. Os animais foram mantidos em isquemia hepática durante 30 minutos, sendo em seguida realizada toracotomia e remoção cirúrgica dos pulmões para avaliação histológica com coloração pela hematoxilina-eosina. Resultados: A análise dos cortes do parênquima pulmonar mostrou semelhança nos dois grupos estudados, ocorrendo colapso alveolar, infiltrado neutrofílico, congestão vascular e áreas hemorrágicas, compatíveis com a repercussão sistêmica da isquemia hepática. Conclusão: A NAC não modifica a lesão pulmonar decorrente da isquemia, à microscopia óptica.
Fígado; Pulmão; Isquemia; Reperfusão; Antioxidantes; Ratos
In ischemia and reperfusion syndrome, the lungs can be the target of remote lesion as it happens in cases of shock, trauma, or liver transplantation. Objective: The aim was to evaluate the effect of N-acetylcysteine (NAC) in the lungs following liver ischemia. Methods: 12 male EPM-1 Wistar rats were used, divided into two groups of six animals each (control and experimental). Animals of both groups received anesthesia with ketamine and xylazine. Longitudinal medial incision was performed for identification of the hepatic hilum and caudal vena cava. 5% glucose solution was injected in the control group 15 minutes before hepatic hilum clamping, and NAC dissolved in the same solution was injected in the experimental group. The animals were maintained in hepatic ischemia during 30 minutes, followed by surgical resection of the lungs for histological evaluation, stained by HE. Results: Cavity collapse, neutrophil-permeation, vessel congestion, and hemorrhagic areas were observed which are compatible with systemic repercussion of liver ischemia, in all animals of both groups. Conclusion: NAC does not protect lungs from morphological changes following liver ischemia.
Liver; Lung; Ischemia; Reperfusion; Antioxidant; Rats
5
¾ ARTIGO ORIGINAL
EFEITO DA N-ACETILCISTEÍNA NO PULMÃO APÓS ISQUEMIA HEPÁTICA EM RATOS
1 1 . Trabalho realizado na Disciplina de Técnica Operatória e Cirurgia Experimental da Universidade Federal de São Paulo-Escola Paulista de Medicina (UNIFESP-EPM). 2 . Aluno do Programa de Pós-graduação em Técnica Operatória e Cirurgia Experimental ¾ UNIFESP-EPM. 3 . Professora da Disciplina de Técnica Operatória e Cirurgia Experimental ¾ UNIFESP-EPM. 4 . Chefe da Disciplina de Histologia e Hematologia do Departamento de Morfologia ¾ UNIFESP-EPM. 5 . Aluno do Curso de Pós-graduação de Morfologia ¾ UNIFESP-EPM. 6 . Coordenador do Programa de Pós-graduação em Técnica Operatória e Cirurgia Experimental ¾ UNIFESP-EPM.
Cláudio Sérgio Salim2 1 . Trabalho realizado na Disciplina de Técnica Operatória e Cirurgia Experimental da Universidade Federal de São Paulo-Escola Paulista de Medicina (UNIFESP-EPM). 2 . Aluno do Programa de Pós-graduação em Técnica Operatória e Cirurgia Experimental ¾ UNIFESP-EPM. 3 . Professora da Disciplina de Técnica Operatória e Cirurgia Experimental ¾ UNIFESP-EPM. 4 . Chefe da Disciplina de Histologia e Hematologia do Departamento de Morfologia ¾ UNIFESP-EPM. 5 . Aluno do Curso de Pós-graduação de Morfologia ¾ UNIFESP-EPM. 6 . Coordenador do Programa de Pós-graduação em Técnica Operatória e Cirurgia Experimental ¾ UNIFESP-EPM.
Edna Frasson de Souza Montero3 1 . Trabalho realizado na Disciplina de Técnica Operatória e Cirurgia Experimental da Universidade Federal de São Paulo-Escola Paulista de Medicina (UNIFESP-EPM). 2 . Aluno do Programa de Pós-graduação em Técnica Operatória e Cirurgia Experimental ¾ UNIFESP-EPM. 3 . Professora da Disciplina de Técnica Operatória e Cirurgia Experimental ¾ UNIFESP-EPM. 4 . Chefe da Disciplina de Histologia e Hematologia do Departamento de Morfologia ¾ UNIFESP-EPM. 5 . Aluno do Curso de Pós-graduação de Morfologia ¾ UNIFESP-EPM. 6 . Coordenador do Programa de Pós-graduação em Técnica Operatória e Cirurgia Experimental ¾ UNIFESP-EPM.
Manoel de Jesus Simões4 1 . Trabalho realizado na Disciplina de Técnica Operatória e Cirurgia Experimental da Universidade Federal de São Paulo-Escola Paulista de Medicina (UNIFESP-EPM). 2 . Aluno do Programa de Pós-graduação em Técnica Operatória e Cirurgia Experimental ¾ UNIFESP-EPM. 3 . Professora da Disciplina de Técnica Operatória e Cirurgia Experimental ¾ UNIFESP-EPM. 4 . Chefe da Disciplina de Histologia e Hematologia do Departamento de Morfologia ¾ UNIFESP-EPM. 5 . Aluno do Curso de Pós-graduação de Morfologia ¾ UNIFESP-EPM. 6 . Coordenador do Programa de Pós-graduação em Técnica Operatória e Cirurgia Experimental ¾ UNIFESP-EPM.
Marcos de Souza Abrahão2 1 . Trabalho realizado na Disciplina de Técnica Operatória e Cirurgia Experimental da Universidade Federal de São Paulo-Escola Paulista de Medicina (UNIFESP-EPM). 2 . Aluno do Programa de Pós-graduação em Técnica Operatória e Cirurgia Experimental ¾ UNIFESP-EPM. 3 . Professora da Disciplina de Técnica Operatória e Cirurgia Experimental ¾ UNIFESP-EPM. 4 . Chefe da Disciplina de Histologia e Hematologia do Departamento de Morfologia ¾ UNIFESP-EPM. 5 . Aluno do Curso de Pós-graduação de Morfologia ¾ UNIFESP-EPM. 6 . Coordenador do Programa de Pós-graduação em Técnica Operatória e Cirurgia Experimental ¾ UNIFESP-EPM.
Carlos Eduardo Benetti Ramalho5 1 . Trabalho realizado na Disciplina de Técnica Operatória e Cirurgia Experimental da Universidade Federal de São Paulo-Escola Paulista de Medicina (UNIFESP-EPM). 2 . Aluno do Programa de Pós-graduação em Técnica Operatória e Cirurgia Experimental ¾ UNIFESP-EPM. 3 . Professora da Disciplina de Técnica Operatória e Cirurgia Experimental ¾ UNIFESP-EPM. 4 . Chefe da Disciplina de Histologia e Hematologia do Departamento de Morfologia ¾ UNIFESP-EPM. 5 . Aluno do Curso de Pós-graduação de Morfologia ¾ UNIFESP-EPM. 6 . Coordenador do Programa de Pós-graduação em Técnica Operatória e Cirurgia Experimental ¾ UNIFESP-EPM.
Djalma José Fagundes6 1 . Trabalho realizado na Disciplina de Técnica Operatória e Cirurgia Experimental da Universidade Federal de São Paulo-Escola Paulista de Medicina (UNIFESP-EPM). 2 . Aluno do Programa de Pós-graduação em Técnica Operatória e Cirurgia Experimental ¾ UNIFESP-EPM. 3 . Professora da Disciplina de Técnica Operatória e Cirurgia Experimental ¾ UNIFESP-EPM. 4 . Chefe da Disciplina de Histologia e Hematologia do Departamento de Morfologia ¾ UNIFESP-EPM. 5 . Aluno do Curso de Pós-graduação de Morfologia ¾ UNIFESP-EPM. 6 . Coordenador do Programa de Pós-graduação em Técnica Operatória e Cirurgia Experimental ¾ UNIFESP-EPM.
Salim CS, Montero EFS, Simões MJ, Abrahão MS, Ramalho CEB. Efeito da N-acetilcisteína no pulmão após isquemia hepática em ratos. Acta Cir Bras [serial online] 2002 Maio-Jun;17(3). Disponível em URL: http://www.scielo.br/acb.
RESUMO ¾ Na síndrome de isquemia e reperfusão os pulmões podem ser alvo de lesão a distância como nos casos de choque, trauma ou ainda nos casos de transplante hepático. Objetivo: Avaliar o efeito protetor da N-acetilcisteína (NAC) sobre os pulmões após isquemia hepática. Métodos: Foram utilizados 12 ratos, machos, linhagem EPM-1 Wistar, separados aleatoriamente em dois grupos com seis animais (controle e experimento). Os animais de ambos os grupos foram submetidos à anestesia com cloridrato de quetamina e cloridrato de xilazina. Realizou-se a incisão mediana longitudinal, identificação do hilo hepático e da veia cava caudal. Quinze minutos antes do clampeamento injetou-se solução glicosada a 5% no grupo controle e NAC diluída em solução glicosada a 5% no grupo experimento. Os animais foram mantidos em isquemia hepática durante 30 minutos, sendo em seguida realizada toracotomia e remoção cirúrgica dos pulmões para avaliação histológica com coloração pela hematoxilina-eosina. Resultados: A análise dos cortes do parênquima pulmonar mostrou semelhança nos dois grupos estudados, ocorrendo colapso alveolar, infiltrado neutrofílico, congestão vascular e áreas hemorrágicas, compatíveis com a repercussão sistêmica da isquemia hepática. Conclusão: A NAC não modifica a lesão pulmonar decorrente da isquemia, à microscopia óptica.
DESCRITORES ¾ Fígado. Pulmão. Isquemia. Reperfusão. Antioxidantes. Ratos.
INTRODUÇÃO
A rejeição aguda no transplante de fígado está, de certa forma, sob controle. A lesão de isquemia e reperfusão parece apresentar uma relação direta com a intensidade e a freqüência de episódios de rejeição aguda no alotransplante1.
Modelos experimentais de isquemia e reperfusão hepática têm sido utilizados para avaliar a fisiopatologia dessa lesão e diferentes formas de modulação1,2.
Quando o suprimento sanguíneo de um órgão é interrompido, inicia-se o processo de isquemia, levando a uma série de eventos bioquímicos que irão resultar em uma disfunção celular.
A isquemia hepática pode ser realizada de forma total ou seletiva, porém a manobra de Pringle, na qual se oclui todo o pedículo, é a mais utilizada na prática clínica.
Na isquemia hepática total observa-se a diminuição dos níveis de ATP e aumento dos níveis de hipoxantina3,4, o que ocorre devido ao metabolismo anaeróbico. A lesão da célula endotelial e ativação de macrófagos levam a um aumento do TNF-alfa5, aumento da interleucina-16, conversão da xantina-desidrogenase para xantina-oxidase7, ativação do complemento8 e agregação plaquetária9, redução dos níveis de glutationa (GSH)10 e aumento na produção de vasodilatadores (óxido nítrico)2. Concomitantemente a essas lesões descritas, há liberação de espécies reativas de oxigênio (ERO) que podem ser derivadas dos neutrófilos ativados7, oxidação das catecolaminas11, células endoteliais12 e prostaglandinas13, que seriam, em última análise, as causas do dano tecidual que levaria à disfunção do órgão.
Essas lesões que surgem em decorrência do estresse oxidativo hepático podem ser também encontradas em órgãos localizados a distância, como pulmões, rins, intestinos, etc.2,14.
Alguns métodos físicos e químicos buscam a modulação dos efeitos deletérios dessas EROs. Dentre os métodos químicos tem sido estudada a utilização de várias drogas, especialmente os antioxidantes, destacando-se a N-acetilcisteína (NAC), que é também protetora do parênquima pulmonar.
O objetivo deste experimento é avaliar as alterações morfológicas pulmonares em ratos submetidos ao clampeamento total do pedículo hepático, utilizando a NAC.
MÉTODOS
Foram utilizados 12 ratos (Rattus novergicus albinus), linhagem EPM-1 Wistar, machos, com quatro meses de idade, peso variando entre 300 e 380 gramas, fornecidos pelo Centro de Desenvolvimento de Modelos de Animais de Experimentação (CEDEME) da UNIFESP-EPM. Os animais foram mantidos em caixas adequadas com temperatura e luz controladas e água e alimentação ad libitum.
A amostra foi distribuída aleatoriamente em dois grupos, o grupo controle e o grupo experimento, com seis animais em cada um. Os animais de ambos os grupos foram anestesiados com cloridrato de quetamina na dose de 60mg.kg¾1 e cloridrato de xilazina na dose de 10mg.kg¾1, ambas na mesma seringa, por via intramuscular. Com o plano anestésico adequado foram realizadas a epilação e anti-sepsia da região abdominal, seguindo-se a laparotomia através de uma incisão mediana longitudinal. Realizou-se o afastamento das vísceras abdominais para a identificação e dissecção do pedículo hepático (artéria, veia porta e ducto biliar) e localização da veia cava caudal. Realizou-se, então, 15 minutos antes do clampeamento do pedículo hepático, a punção e aplicação na veia cava caudal de 1ml.kg¾1 de solução glicosada a 5% no grupo controle e 150mg.kg¾1 de NAC diluídos em solução glicosada a 5% no mesmo volume no grupo experimento. Para a realização da isquemia foi feito o clampeamento do hilo hepático durante 30 minutos, em seguida foi feita a toracotomia para remoção cirúrgica de um fragmento do parênquima pulmonar, o qual foi fixado em formol a 10%, diafanizado, incluído em parafina e submetido a cortes de 3m de espessura, os quais foram corados pela hematoxilina-eosina (HE).
RESULTADOS
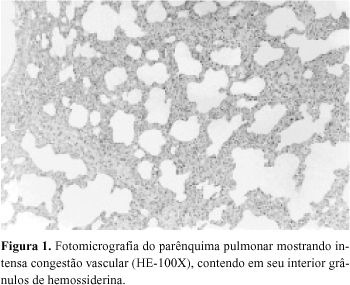
A análise do parênquima pulmonar mostrou, de forma semelhante em todos os animais de ambos os grupos estudados, intensa congestão vascular (Figura 1), áreas hemorrágicas, hemácias e macrófagos contendo em seu interior grânulos de hemossiderina (Figura 2), colapso alveolar, congestão e infiltrado neutrofílico (Figura 3), em comparação ao parênquima pulmonar normal (Figura 4).
DISCUSSÃO
A lesão morfológica do parênquima pulmonar, resultante da isquemia hepática, não se alterou com a administração de NAC. A importância de estudar a repercussão sistêmica da isquemia hepática reside no fato de compreender a fisiopatologia da lesão, mostrando o melhor momento de intervir com vistas à síndrome de isquemia e reperfusão, promovida nos órgãos localizados a distância.
Diferentes trabalhos já mostraram as lesões celulares provocadas pela liberação de substâncias tóxicas na isquemia e reperfusão hepática, como os mediadores inflamatórios (espécies reativas de oxigênio e produtos do complemento) que podem trazer sérios danos ao órgão isquêmico ou mesmo atingir outros órgãos localizados a distância14.
Em condições normais ocorre pequena liberação de espécies reativas tóxicas de oxigênio (ERO), as quais têm o seu efeito bloqueado pela enzima superóxido-dismutase (SOD) e pela glutationa (GSH).
Já na fase de isquemia, com a interrupção do fornecimento de oxigênio as células endoteliais e os leucócitos sofrem alterações, levando a maior liberação de EROs, como o ânion superóxido (O2¾), o radical hidroxila (OH¾) e o peróxido de hidrogênio (H2O2). Porém, há menor síntese das enzimas SOD e GSH.
As EROs podem promover lesão de qualquer componente bioquímico da célula, mas os lipídeos, proteínas e os ácidos nucléicos são os seus principais alvos. Visando bloquear os efeitos destes EROs, diversas substâncias, como os antioxidantes, são testadas em vários estudos experimentais.
Dentre as drogas antioxidantes destaca-se a N-acetilcisteína, um tiol de baixo peso molecular, derivada de um aminoácido que possui efeito antioxidante, atuando na remoção de radicais livres15, sendo também precursora na síntese da glutationa intracelular, um antioxidante natural9.
Já no início do século passado, Pringle16 descreveu a manobra de pinçamento do pedículo hepático com a finalidade de conter hemorragias provenientes de trauma deste órgão. Esta manobra é utilizada pelos cirurgiões para a contenção de hemorragias do fígado durante ressecções, traumas e transplantes, interrompendo o suprimento sanguíneo do órgão.
O presente estudo mostrou que, já na fase de isquemia hepática, ocorre sofrimento do parênquima pulmonar, no qual há predominância do colapso alveolar, congestão vascular e infiltrado neutrofílico.
O estudo realizado dispensou a análise estatística por não ter mostrado indícios histológicos de alterações com a utilização do antioxidante NAC. Estudos mais detalhados, como a microscopia eletrônica, bioquímica, etc., serão necessários para melhor avaliação. Além disso, provavelmente, o efeito da NAC poderá ser evidenciado durante a fase de reperfusão.
CONCLUSÃO
Com base nos achados histológicos, a N-acetilcisteína não modificou a lesão pulmonar observada à microscopia óptica.
Salim CS, Montero EFS, Simões MJ, Abrahão MS, Ramalho CEB. Effect of N-acetilcysteine in lungs after liver ischemia in rats. Acta Cir Bras [serial online] 2002 May-Jun;17(3). Available from URL: http://www.scielo.br/acb.
ABSTRACT ¾ In ischemia and reperfusion syndrome, the lungs can be the target of remote lesion as it happens in cases of shock, trauma, or liver transplantation. Objective: The aim was to evaluate the effect of N-acetylcysteine (NAC) in the lungs following liver ischemia. Methods: 12 male EPM-1 Wistar rats were used, divided into two groups of six animals each (control and experimental). Animals of both groups received anesthesia with ketamine and xylazine. Longitudinal medial incision was performed for identification of the hepatic hilum and caudal vena cava. 5% glucose solution was injected in the control group 15 minutes before hepatic hilum clamping, and NAC dissolved in the same solution was injected in the experimental group. The animals were maintained in hepatic ischemia during 30 minutes, followed by surgical resection of the lungs for histological evaluation, stained by HE. Results: Cavity collapse, neutrophil-permeation, vessel congestion, and hemorrhagic areas were observed which are compatible with systemic repercussion of liver ischemia, in all animals of both groups. Conclusion: NAC does not protect lungs from morphological changes following liver ischemia.
KEY WORDS ¾ Liver. Lung. Ischemia. Reperfusion. Antioxidant. Rats.
Conflito de interesses: nenhum
Fontes de financiamento: nenhuma
Endereço para correspondência:
Cláudio Sérgio Salim
Rua Tiradentes, 1.837, Bl. 12/115
09781-220 ¾ São Bernardo do Campo ¾ SP
e-mail: cssalim.dcir@unifesp.epm.br
Data de recebimento: 18/12/2001
Data de revisão: 15/01/2002
Data de aprovação: 19/02/2002
- 1. Clavien PA, Harvey PRC, Strasberg SM. Preservation and reperfusion injuries in liver allografts. Transplantation 1992;53:957-78.
- 2. Weinbroum A, Nielsen VG, Tan S, Gelman S, Matalon S, Skinner KA, Brandley EJ, Parks DA. Liver isquemia-reperfusion increases pulmonary permeability in rat: role of circulating xanthine oxidase. Am J Physiol 1995;268:G988-66.
- 3. De Leyn P, Lerut T, Schreinemakers H. Adenine nucleotide degradation in ischemic rabbit lung tissue. Am J Physiol 1993;264:1329-37.
- 4. De Leyn P, Lerut T, Flameng W. Pattern of AMP degradation in ischemic rabbit lung tissue. J Invest Surg 1995;8:7-19.
- 5. Abolhoda A, Brooks A, Choudhry M, Kaneda Y, Liu D, Cheng H, Burt M. Characterization of local inflammatory response in an isolated lung perfusion model. Ann Surg Oncol 1998;5:87-92.
- 6. Chang DM, Hsu K, Ding YA, Chiang CH. Interleukin-1 in ischemia-reperfusion acute lung injury. Am J Respir Crit Care Med 1997;154:1230-4.
- 7. Nielsen VG, Tan S, Weinbroum A, Mccammo AT, Samuelson PN, Gelman S, Parks DA. Lung injury after hepatoenteric ischemia-reperfusion: role of xantine oxidase. Am J Respir Crit Care Med 1996;154:1364-9.
- 8. Naka Y, Marsh HC, Scesney SM, Oz MC, Pinsky DJ. Complement activation as a cause for primary graft failure in an isogeneic rat model of hypotermia lung preservation and transplantation. Transplantation 1997;64:1248-55.
- 9. Okada Y, Marchevsky AM, Zuo XJ, Pass JA, Kass RM, Matloff JM, Jordan SC. Accumulation of platelets in rat syngeneic lung transplants: a potential factor responsible for preservation-reperfusion injury. Transplantation 1997;27:801-6.
- 10. Nagasaki H, Nakano H, Boudjema K, Jaeck D, Alexandre E, Baek Y, Yamaguchi M, Kumada K. Efficacy of preconditioning with N-acetylcysteine against reperfusion injury after prolonged cold ischemia in rats liver in which glutathione had been reduced by buthionine sulphoximine. Eur J Surg 1998;164:139-46.
- 11. Singal PK, Kapur N, Dhillon KS, Beamish RE, Dhalla NA. Role of free radicals in catecholamine-induced cardiomyopathy. Can J Physiol Pharmacol 1982;60:1390-7.
- 12. Beckman JS, Beckman TW, Chen J, Marshall PA, Freeman BA. Apparent hydroxyl radical production by peroxynitrite: implications for endothelial injury from nitric oxide and superoxide. Proc Natl Acad Sci USA 1990;87:1620-4.
- 13. Kakreja RC, Kontos HA, Hess ML, Ellis EF. PGH synthase and lipoxygenase generate superoxide in the presence of NADH or NADPH. Circ Res 1986;59:6123-9.
- 14. Klausner JM, Paterson IS, Kobzik L, Valeri CR, Shepro D, Heschtman HB. Oxygen free radicals mediate ischemia-induced lung injury. Surgery 1989;105:192-9.
- 15. Weibroum AA, Rudick V, Bem-Abraham R, Karchevski E. N-acetyl-L-cisteine for preventing lung reperfusion injury after liver ischemia-reperfusion. Transplantation 2000;69:853-9.
- 16. Pringle JH. Notes on the arrest of hepatic hemorrhage due trauma. Ann Surg 1908;48:541-9.
Datas de Publicação
-
Publicação nesta coleção
01 Jul 2002 -
Data do Fascículo
Maio 2002
Histórico
-
Aceito
19 Fev 2002 -
Recebido
18 Dez 2001 -
Revisado
15 Jan 2002