Resumos
OBJETIVO: Investigar efeitos da L-alanil-glutamina nas concentrações musculares de lactato, e nas concentrações sanguíneas de LDH, em pacientes com isquemia crítica dos membros inferiores submetidos à revascularização distal. MÉTODOS: Dezesseis adultos (12-homens/4-mulheres) foram distribuídos em 2 grupos (1-controle/2-estudo). Três horas após injeção endovenosa de 250 ml de L-alanil-glutamina a 20% adicionados a 750 ml de soro fisiológico (Grupo 2), ou 1000 ml de solução salina (Grupo 1), iniciava-se a revascularização, sob raquianestesia. Amostras musculares e de sangue (arterial/venoso) foram coletadas no início do procedimento (TI), no final (TF), e 10 e 20 minutos após isquemia (T1/T2). RESULTADOS: Observou-se redução significante (p<0,05) da concentração de lactato no tecido muscular sadio dos pacientes tratados com L-alanil-glutamina, em comparação ao grupo controle, em todos os tempos estudados. Houve redução significante nas concentrações de LDH no sangue venoso dos pacientes tratados, em todos os tempos (TIV/TFV/T1V/T2V), e no sangue arterial durante a reperfusão (T1A/T2A). CONCLUSÕES: Queda na concentração de lactato no músculo, e redução nas concentrações arteriais e venosas de LDH, em pacientes recipientes de L-alanil-glutamina, sugere maior utilização de piruvato para produção de energia no ciclo de Krebs do que sua conversão para lactato, com prevalência da glicólise aeróbica.
Metabolismo; Isquemia; Reperfusão; Ácido láctico
PURPOSE: Investigate the repercussions of L-alanyl-glutamine in muscular tissue concentrations of lactate, and venous and arterial blood concentrations of LDH, in patients with critical ischemia of the lower limbs submitted to distal revascularization. METHODS: Sixteen adults (12 male/4 female) were distributed in 2 groups (1-Control/2-Experiment). Three hours after the intravenous injection of 250 ml of a 20% solution of L-alanyl-glutamine added to 750 ml of saline solution (Group 2); or 1000 ml of saline solution (Group 1), distal bypass was carried out under spinal anesthesia. Muscle and blood samples (arterial/venous) were collected at the beginning of the surgical procedure (TI), at the end (TF), and 10 and 20 minutes after re-establishment of blood flow. RESULTS: Significant reduction (p<0,05) of lactate concentration was observed in healthy muscle tissue in L-alanyl-glutamine treated patients in comparison to control group, at all times studied. There was a significant reduction (p <0,05) in venous concentrations of LDH in treated patients at all times studied (TI/TFV/T1V/T2V); and in arterial blood during reperfusion (T1A/T2A). CONCLUSIONS: 1. Decreased lactate concentrations in healthy skeletal muscle in patients treated with L-alanyl-glutamine suggests greater utilization of pyruvate for energy production than its conversion to lactate in Krebs cycle boosting aerobic glycolysis. 2. - Drop in venous blood concentrations of LDH in treated patients with L-alanyl-glutamine at all times during ischemia, and 10 and 20 minutes after reperfusion, also suggests augmented utilization of pyruvate for energy production via aerobic glycolysis.
Metabolism; Ischemia; Reperfusion; Lactic acid
ARTIGO ORIGINAL
Repercussões da L-alanil-glutamina sobre as concentrações de lactato e lactato desidrogenase (LDH) em pacientes com isquemia crítica dos membros inferiores submetidos a revascularização distal1 Endereço para correspondência Paulo Roberto Leitão de Vasconcelos Departamento de Cirurgia Rua Prof. Costa Mendes, 1608/3 o andar 60430-140 Fortaleza - Ceará Tel: (85)288-8063 Fax: (85)288-8064 E-mail: mcirur@npd.ufc.br
Repercussions of l-alanyl-glutamine upon the concentrations of lactate and lactate dehydrogenase (LDH) in patients with critical ischemia of lower limbs subjected to distal revascularization
Wellington Forte AlvesI; Sérgio Botelho GuimarãesII; Paulo Roberto Cavalcante de VasconcelosIII; Paulo Roberto Leitão de VasconcelosIV
ICirurgião Vascular e Mestrando em Cirurgia, Programa de Pós-Graduação Stricto Sensu em Cirurgia, Departamento de Cirurgia - Faculdade de Medicina da Universidade Federal do Ceará (UFC), Fortaleza - CE
IIMestre em Cirurgia, Professor Adjunto do Departamento de Cirurgia, Faculdade de Medicina (UFC), Fortaleza - CE
IIIEstudante de Medicina (UFC), Fortaleza - CE
IVProfessor Doutor, Coordenador do Curso de Pós-Graduação Stricto Sensu em Cirurgia da Faculdade de Medicina (UFC), Fortaleza - CE
Endereço para correspondência Endereço para correspondência Paulo Roberto Leitão de Vasconcelos Departamento de Cirurgia Rua Prof. Costa Mendes, 1608/3 o andar 60430-140 Fortaleza - Ceará Tel: (85)288-8063 Fax: (85)288-8064 E-mail: mcirur@npd.ufc.br
RESUMO
OBJETIVO: Investigar efeitos da L-alanil-glutamina nas concentrações musculares de lactato, e nas concentrações sanguíneas de LDH, em pacientes com isquemia crítica dos membros inferiores submetidos à revascularização distal.
MÉTODOS: Dezesseis adultos (12-homens/4-mulheres) foram distribuídos em 2 grupos (1-controle/2estudo). Três horas após injeção endovenosa de 250 ml de L-alanil-glutamina a 20% adicionados a 750 ml de soro fisiológico (Grupo 2), ou 1000 ml de solução salina (Grupo 1), iniciava-se a revascularização, sob raquianestesia. Amostras musculares e de sangue (arterial/venoso) foram coletadas no início do procedimento (TI), no final (TF), e 10 e 20 minutos após isquemia (T1/T2).
RESULTADOS: Observou-se redução significante (p<0,05) da concentração de lactato no tecido muscular sadio dos pacientes tratados com L-alanil-glutamina, em comparação ao grupo controle, em todos os tempos estudados. Houve redução significante nas concentrações de LDH no sangue venoso dos pacientes tratados, em todos os tempos (TIV/TFV/T1V/T2V), e no sangue arterial durante a reperfusão (T1A/T2A).
CONCLUSÕES: Queda na concentração de lactato no músculo, e redução nas concentrações arteriais e venosas de LDH, em pacientes recipientes de L-alanil-glutamina, sugere maior utilização de piruvato para produção de energia no ciclo de Krebs do que sua conversão para lactato, com prevalência da glicólise aeróbica.
Descritores: Metabolismo. Isquemia. Reperfusão. Ácido láctico.
ABSTRACT
PURPOSE: Investigate the repercussions of L-alanyl-glutamine in muscular tissue concentrations of lactate, and venous and arterial blood concentrations of LDH, in patients with critical ischemia of the lower limbs submitted to distal revascularization.
METHODS: Sixteen adults (12 male/4 female) were distributed in 2 groups (1-Control/2-Experiment). Three hours after the intravenous injection of 250 ml of a 20% solution of L-alanyl-glutamine added to 750 ml of saline solution (Group 2); or 1000 ml of saline solution (Group 1), distal bypass was carried out under spinal anesthesia. Muscle and blood samples (arterial/venous) were collected at the beginning of the surgical procedure (TI), at the end (TF), and 10 and 20 minutes after re-establishment of blood flow.
RESULTS: Significant reduction (p<0,05) of lactate concentration was observed in healthy muscle tissue in L-alanyl-glutamine treated patients in comparison to control group, at all times studied. There was a significant reduction (p <0,05) in venous concentrations of LDH in treated patients at all times studied (TI/TFV/T1V/T2V); and in arterial blood during reperfusion (T1A/T2A).
CONCLUSIONS: 1. Decreased lactate concentrations in healthy skeletal muscle in patients treated with L-alanyl-glutamine suggests greater utilization of pyruvate for energy production than its conversion to lactate in Krebs cycle boosting aerobic glycolysis. 2. - Drop in venous blood concentrations of LDH in treated patients with L-alanyl-glutamine at all times during ischemia, and 10 and 20 minutes after reperfusion, also suggests augmented utilization of pyruvate for energy production via aerobic glycolysis.
Key words: Metabolism. Ischemia. Reperfusion. Lactic acid.
Introdução
A aterosclerose obliterante crônica é a principal enfermidade causadora de amputação dos membros inferiores e sua incidência tem aumentado muito em decorrência da maior longevidade da população1. Dados estatísticos publicados em 1991 pelo Ministério da Saúde demonstraram que a aterosclerose é uma das causas mais importantes de óbito no Brasil. Esses números, embora considerem especialmente as regiões sudeste e sul do país, demonstraram que os óbitos decorrentes de aterosclerose são superiores aos decorrentes de neoplasias (2,5 vezes) e doenças infecciosas (3,5 vezes)2.
A doença oclusiva arteriosclerótica, ao comprometer a irrigação dos membros inferiores, determina graus variáveis de obstrução intraluminal, restrição ao fluxo sanguíneo das artérias femoral, poplítea, incluindo seus ramos terminais, individualmente ou em variadas combinações. É uma doença insidiosa, que se inicia cedo na vida adulta e progride lentamente, podendo restringir o fluxo sanguíneo ao membro inferior e até obstruí-lo completamente, afetando uma ou mais artérias situadas abaixo do ligamento inguinal 3.
A manifestação clínica mais comum da oclusão arterial é a claudicação intermitente, traduzida clinicamente por dor em forma de câimbras ou aperto dos músculos da panturrilha, durante a realização de exercícios físicos, cessando ou melhorando a sintomatologia dolorosa com o repouso. Com a evolução do quadro obstrutivo, as manifestações dolorosas se tornam mais freqüentes e o tempo de recuperação gradativamente maior. Finalmente, a dor pode se manifestar no repouso, ser muito intensa e afetar os pododáctilos e o pé, principalmente à noite, quando o membro comprometido repousa em posição horizontal e há queda da temperatura ambiente, por mudanças climáticas. Podem ainda ser observados palidez, hipotermia, cianose e áreas necróticas no membro comprometido, nos casos mais graves 4.
O músculo esquelético representa 70 a 75% de toda a massa dos membros inferiores e apresenta uma tolerância relativa à isquemia, em parte devida a sua baixa taxa metabólica em repouso, seu grande armazenamento de glicogênio e creatina e sua habilidade em manter as funções celulares básicas, na vigência da isquemia, através da glicólise anaeróbica 5. A intensidade das alterações metabólicas no tecido muscular dependerá da rapidez do aparecimento da oclusão e da presença de circulação colateral, desenvolvida pelo organismo na tentativa de assegurar o suprimento sanguíneo adequado ao membro afetado.
A natureza fornece alimentos na forma de carboidratos, lipídios e proteínas. Estes combustíveis metabólicos são utilizados pelas células para manutenção da sua atividade vital. As proteínas podem ser reduzidas a seus aminoácidos constituintes, através de vários mecanismos ou utilizados como reserva energética.
A glutamina é o aminoácido mais comumente encontrado no organismo, correspondendo a 25% dos aminoácidos livres e é classificado como condicionalmente essencial, pois se torna indispensável nas condições de estresse, sendo ativamente transportada e metabolizada em quase todos os tecidos animais 6,7. O músculo esquelético armazena 60% de toda a glutamina existente no organismo humano 8.
O presente trabalho, utiliza a L-alanil-glutamina (um dipeptídeo precursor da glutamina) como eventual opção terapêutica coadjuvante no tratamento da obstrução arterial crítica, na busca de um possível efeito protetor do tecido isquêmico. A inexistência de registros na literatura especializada, estudando esse peptídeo nesta proposta de utilização, motivou esta pesquisa.
Métodos
A pesquisa foi realizada após prévia aprovação do protocolo pelo Comitê de Ética em Pesquisa Clínica do Hospital Geral de Fortaleza (SUS), conforme resolução n.º 01, de 13 de junho de 1988 do Conselho Nacional de Saúde do Ministério da Saúde do Brasil. O estudo foi constituído por 16 pacientes (11 do sexo masculino e 5 do sexo feminino), com idades variando de 52 a 83 anos, distribuídos eqüitativamente em 2 grupos: Grupo 1 (controle) e Grupo 2 (estudo). Os pacientes apresentavam isquemia crítica dos membros inferiores, com dor em repouso, ulceração isquêmica ou necrose envolvendo pododáctilos ou parte do pé, com indicação clínica de revascularização distal (derivação femorotibial ou femoro-fibular), utilizando a veia safena como enxerto. Todos atendiam os seguintes critérios de inclusão :
(a) ser portador de doença oclusiva arterial de origem arteriosclerótica, comprometendo os membros inferiores;
(b) idade inferior a 40 anos;
(c) indicação de revascularização distal por isquemia crítica: dor em repouso, ulceração isquêmica, ferida infectada ou necrose;
(d) existência de veia safena magna apropriada para uso como enxerto vascular;
(e) conhecimento e aceitação em participar do projeto de pesquisa, mediante assinatura do termo de consentimento informado.
Foram excluídos da pesquisa os pacientes que apresentavam incapacidade de deambulação de origem neurológica ou ortopédica, doença sistêmica com limite de sobrevivência inferior a um ano ou infecção sistêmica ativa.
Três horas após a injeção endovenosa de uma solução de 250 ml de L-alanil-glutamina a 20%, adicionados a 750 ml de soro fisiológico (Grupo 2), ou 1000 ml de solução salina (Grupo 1), iniciava-se o processo de revascularização, sob anestesia por bloqueio espinhal subaracnóideo simples (L3-L4) com bupivacaína a 0,5% (15-17mg). Para as derivações (femorofibular, femorotibial anterior ou posterior) utilizou-se a veia safena. (Figuras 1, 2 e 3).
Amostras musculares e de sangue arterial e venoso foram coletadas no início do procedimento cirúrgico, no final do período de isquemia, e 10 e 20 minutos após restabelecimento da perfusão sanguínea. O sangue arterial e venoso (3,0 ml) foi obtido por punção da artéria e da veia femoral comum respectivamente. As amostras de tecido muscular foram padronizadas em 2,0 x 1,0 x 1,0 cm e retiradas da porção proximal e distal do músculo sartório e da musculatura isquêmica distal do músculo gastrocnêmio. Após obtenção as amostras de tecido eram prensadas e mergulhadas em nitrogênio líquido (-190º C), reduzidas a pó e colocadas em tubos de ensaio contendo 5,0 ml de ácido perclórico 0,75M e mantidas em compartimento refrigerado (-20º C).
A concentração de lactato no tecido muscular e de LDH no sangue venoso e arterial foram determinadas por métodos de ensaio enzimático 9,10.
Os resultados foram expressos como Média ± E.P.M. (Erro Padrão da Média). O teste não paramétrico de Mann-Whitney foi utilizado para a análise estatística, fixando-se o valor de significância em 5% (p < 0,05).
Resultados
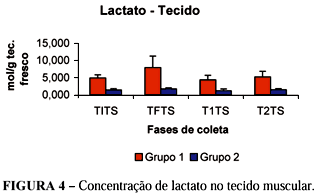
Analisando-se as concentrações de lactato no tecido muscular sadio (porção proximal do músculo sartório) dos pacientes tratados com L-alanil-glutamina, observou-se redução significativa da concentração de lactato tissular em comparação às concentrações aferidas do metabólito no grupo controle, nas fases iniciais e finais do procedimento cirúrgico e 10 e 20 minutos após o início da reperfusão (Tabela 1, Figura 4).
Houve redução estatisticamente significante nas concentrações de LDH aferidas no sangue venoso dos pacientes tratados com l-alanil-glutamina, no inicio e fim do procedimento cirúrgico (TIV e TFV). Nos tempos 10 e 20 minutos após o restabelecimento da perfusão sanguínea, tanto no sangue venoso como no sangue arterial, ocorreu declínio nas concentrações desta enzima no mesmo grupo de pacientes (Tabela 2, Figura 5).
Discussão
Enquanto as células do trato intestinal (enterócitos e colonócitos), medula renal e hemácias sãoconsumidoras de glutamina e possuem alta concentração de glutaminase, o músculo esquelético é um tecido eminentemente produtor de glutamina, sendo rico em glutamina-sintetase11. Pesquisadores demonstraram, em situações de estresse hipóxico, atividade aumentada de glutaminase no músculo esquelético de ratos submetidos a 7, 14 e 21 dias de hipóxia, através de simulação de altitude (7620 m) em câmara hipobárica12. Portanto, é de se esperar que, no presente estudo, o tecido muscular esquelético, submetido a 60 minutos de isquemia, durante a realização da intervenção cirúrgica corretiva (oclusão arterial seletiva) possa vir a apresentar atividade aumentada da referida enzima.
Sorlie et al. (1977) observaram um aumento da lactacemia, durante e após o pinçamento prolongado da artéria femoral, no sangue venoso de 8 pacientes claudicantes que se submeteram à derivação femoropoplítea 13.
O'Donnell e Clower Jr (1977) estudando o metabolismo tecidual do lactato muscular em 35 pacientes com doença arterial crônica, submetidos a revascularização, encontraram altas concentrações deste metabólito nos pacientes que apresentavam isquemia crítica. Entretanto, naqueles pacientes que apresentavam apenas claudicação não foram identificadas alterações nos níveis de lactato no músculo 14.
No presente estudo, a diminuição significante da concentração de lactato no tecido muscular sadio no período inicial (4,916 ± 0,921 versus 1,410 ± 0,339 p < 0,01) e final da isquemia (7,947 ± 3,341 versus 1,720± 0,318 p < 0,01), bem como 10 minutos (4,353 ± 1,299 versus 1,184 ± 0,518 p < 0,05) e 20 minutos (5,188 ± 1,648 versus 1,498 ± 0,279 p < 0,05) após o restabelecimento da circulação sanguínea, pela remoção da pinça vascular oclusiva sugere um efeito benéfico da L-alanil-glutamina na isquemia muscular esquelética, pela ativação da lançadeira malato-aspartato, com maior conversão de piruvato a acetil-CoA do que sua transformação em lactato. A redução na concentração de LDH no sangue venoso em todos os tempos estudados e no sangue arterial 10 e 20 minutos após o início da reperfusão, nos pacientes que receberam L-alanil-glutamina sugere redução na lesão de isquemia/reperfusão com menor metabolismo anaeróbico .
Conclusões
A queda na concentração de lactato em tecido muscular sadio, e a redução nas concentrações arteriais e venosas de LDH, em pacientes recipientes de L-alanil-glutamina, sugere maior conversão de piruvato em acetil-CoA para produção de energia no ciclo de Krebs, do que sua conversão para lactato, com prevalência da glicólise aeróbica.
Data do recebimento: 04/01/2003
Data da revisão: 24/01/2003
Data da aprovação: 18/02/2003
Conflito de interesse: nenhum
Fonte de financiamento: nenhuma
1. Trabalho realizado no Serviço de Cirurgia Vascular do Hospital Geral de Fortaleza (SUS) e no Laboratório de Cirurgia Experimental (LABCEX), Departamento de Cirurgia da Universidade Federal do Ceará (UFC), Fortaleza - CE.
- 1. Weiss NS. Cigarette smoking and aterosclerosis obliterans: an epide-miologic approach. Am J Epidemiol 1990; 95:17-36.
-
2Ministério da Saúde, Estatísticas de Mortalidade, Brasília, 1991.
- 3. Veith FJ, Gupta SK, Wengerter KR, Goldsmith J, Rivers SP, Bakal CW, Dietzek AM, Cynamon J, Sprayregen S, Gliedman ML. Changing arteriosclerotic disease patterns and management strategy in lower limb-threatening ischemia. Ann Surg 1990; 212 (4): 412-4.
- 4. Vollmar J. Cirugía reparadora de las arterias. 2ed. Barcelona: Toray; 1977. p 194-209.
- 5. Quiñones BNJ. The role of fibrinolysis during reperfusion of ischemic skeletal muscles. Microc Endothelium Lynphatics 1989; 5: 299-314.
- 6. Souba WW, Klimberg S, Plumley DA, Salloum RM, Flynn TC, Bland KI, Copeland EM. The role of glutamine in maintaining a healthy gut and supporting the metabolic response to injury and infection. J Surg Res 1990; 48: 383-91.
- 7. Smith MD. Glutamine metabolism and its physiologic importance. J Parent Ent Nutr 1990; 14: 40-4.
- 8. Souba WW. Intestinal glutamine metabolism and nutrition. J Nutr Biochem 1993; 4: 2-9.
- 9. Hohorst apud Vasconcelos PRL. Hepatic metabolism during sepsis [Tese Doutorado]. University of Oxford; 1987.
- 10. Bergmeyer HU. Methods of enzimatic analisys. 3ed. New York: Verlag Chemie; 1983. p 118-25.
- 11. Souba WW, Smith RJ, Wilmore DW. Glutamine metabolism by intestinal tract. J Parent Ent Nutr 1985; 9: 608-17.
- 12. Vats P, Mukherjee AK, Kumria MM, Singh SN, Patil SK, Rangnathan S, Sridharan K. Changes in the activity levels of glutamine synthetase, glutamine and glucagon synthetase in rats subjected to hypoxic stress. Int J Biometereol 1999; 42(4):205-9.
- 13. Sorlie D, Huseby NE, Kluge T. Ischaemia during arterial reconstructive surgery: biochemical changes as reflected in popliteal vein samples. Scand J Thorac Cardiovasc Surg 1977; 8:111-51.
- 14. O'Donnell Jr TF, Clower Jr CHA. A metabolic approach to the evaluation of peripheral vascular disease. Surg Gynecol Obstet 1977; 43:144-51.
Datas de Publicação
-
Publicação nesta coleção
08 Out 2003 -
Data do Fascículo
Jun 2003
Histórico
-
Revisado
24 Jan 2003 -
Recebido
04 Jan 2003 -
Aceito
18 Fev 2003