Resumos
OBJETIVO: Pesquisar a eficácia da submucosa de intestino delgado (SID) porcina como enxerto para reparo de lesões em esôfago cervical de cães. MÉTODOS: Foram operados 10 cães. Ressecou-se parcialmente uma porção da parede anterior do esôfago que foi substituída por um enxerto de SID. Avaliaram-se a resistência tensiométrica, o aspecto macroscópico, a regeneração tecidual e a concentração de colágeno da porção esofágica onde se implantou o enxerto. RESULTADOS: Não houve infecção, fístula ou estenose. Verificou-se ganho semelhante de resistência do esôfago operado em relação ao controle: 31.84N contra 28.60N em média (p=0,593). A macroscopia revelou cicatrização completa com pouca retração tecidual. O estudo anátomo-patológico por HE mostrou re-epitelização completa da mucosa, proliferação vascular discreta a moderada e proliferação fibroblástica intensa. Na análise do colágeno pelo Sirus-red obteve-se em média 54.04% de colágeno tipo I, 16,04% de colágeno tipo III e 71.58% de colágeno total. CONCLUSÃO: A SID mostrou ser, no cão, um enxerto eficaz no reparo de lesões maiores do esôfago, apresentando-se resistente à infecção e à rejeição. A SID deve ser, portanto, considerada opção importante no tratamento destas lesões.
Lesões; Esôfago; Submucosa; Cirurgia experimental
PURPOSE: Study of porcine small intestinal submucosa (SIS) efficiency as a graft in the handling of lesions of the cervical esophagus in dogs. METHODS: Ten dogs were operated. A resection of a portion of the anterior wall of the esophagus was performed, followed by its repair with a SIS graft. The tensiometric resistance, macroscopic appearance regeneration process and collagen contents of the esophagus tissue were evaluated. RESULTS: No cases of fistula, stenosis or infection occured. Tensiometric evaluation showed a similar resistance in the operated esophagus when compared to the control (an average of 31.84N against 28.60N). Macroscopic analysis revealed complete healing with little tissue retraction. Pathology HE study showed complete mucous membrane regeneration, discrete to moderate vascular proliferation and intense fibroblastic proliferation. Collagen analysis by Sirus-red staining found 54.04% of mature collagen, 16,04% of imature collagen as well as 71.58% of total collagen. Conclusion: SIS has proved to be an efficient graft when used in the repairing of canine large esophagus lesions, featuring infection and rejection resistance. Complete regeneration was observed in 100% of the cases. SIS should, therefore, be considered as an important option in treatment of esophageal injuries.
Injuries; Esophagus; Submucosa; Experimental surgery
ARTIGO ORIGINAL
Emprego da submucosa de intestino delgado porcina no reparo de lesões do esôfago cervical. Estudo experimental em cães1 Endereço para correspondência Zacarias Alves de Souza Filho R. Padre Agostinho, 1923/1901 80710-000 Curitiba - PR Tel: (41)336-3445 E-mail: joaorduda@hotmail.com.br
Small intestine submucosa for repair of cervical esophageal lesions in a dog model
Zacarias Alves de Souza FilhoI; Sérgio Ossamu IoshiiII; Fernando Hintz Greca III; Maria de Lourdes Pessole Biondo-SimõesIV; Sérgio Luiz RochaV; João Ricardo DudaVI ; Hélio Rubens de Oliveira FilhoVI
IProf. Titular de Clínica Cirúrgica do CCBS-PUCPR e da Disciplina de Técnica Operatória e Cirurgia Experimental da PUCPR e da UFPR
IIProf. Adjunto de Anatomia Patológica das Faculdades de Medicina da PUCPR e UFPR
IIIProf. Titular e Coordenador da Disciplina de Técnica Operatória e Cirurgia Experimental da PUCPR e Prof. Adjunto da Disciplina de Cirurgia Geral da UFPR
IVProf ª Titular de Técnica Operatória e Cirurgia Experimental e Coordenadora da Disciplina de Metodologia Científica da PUCPR. Prof. Adjunta e Coordenadora da Disciplina de Técnica Cirúrgica e Cirurgia Experimental da UFPR
VProf. Adjunto da Disciplina de Anatomia Médica da PUCPR e UFPR. Prof. Adjunto da Disciplina de Técnica Operatória e Cirurgia Experimental da PUCPR
VIAlunos do Curso de Medicina: Iniciação Científica da Disciplina de Técnica Operatória e Cirurgia Experimental da PUCPR
Endereço para correspondência Endereço para correspondência Zacarias Alves de Souza Filho R. Padre Agostinho, 1923/1901 80710-000 Curitiba - PR Tel: (41)336-3445 E-mail: joaorduda@hotmail.com.br
RESUMO
OBJETIVO: Pesquisar a eficácia da submucosa de intestino delgado (SID) porcina como enxerto para reparo de lesões em esôfago cervical de cães.
MÉTODOS: Foram operados 10 cães. Ressecou-se parcialmente uma porção da parede anterior do esôfago que foi substituída por um enxerto de SID. Avaliaram-se a resistência tensiométrica, o aspecto macroscópico, a regeneração tecidual e a concentração de colágeno da porção esofágica onde se implantou o enxerto.
RESULTADOS: Não houve infecção, fístula ou estenose. Verificou-se ganho semelhante de resistência do esôfago operado em relação ao controle: 31.84N contra 28.60N em média (p=0,593). A macroscopia revelou cicatrização completa com pouca retração tecidual. O estudo anátomo-patológico por HE mostrou re-epitelização completa da mucosa, proliferação vascular discreta a moderada e proliferação fibroblástica intensa. Na análise do colágeno pelo Sirus-red obteve-se em média 54.04% de colágeno tipo I, 16,04% de colágeno tipo III e 71.58% de colágeno total.
CONCLUSÃO: A SID mostrou ser, no cão, um enxerto eficaz no reparo de lesões maiores do esôfago, apresentando-se resistente à infecção e à rejeição. A SID deve ser, portanto, considerada opção importante no tratamento destas lesões.
Descritores: Lesões. Esôfago. Submucosa. Cirurgia experimental.
ABSTRACT
PURPOSE: Study of porcine small intestinal submucosa (SIS) efficiency as a graft in the handling of lesions of the cervical esophagus in dogs.
METHODS: Ten dogs were operated. A resection of a portion of the anterior wall of the esophagus was performed, followed by its repair with a SIS graft. The tensiometric resistance, macroscopic appearance regeneration process and collagen contents of the esophagus tissue were evaluated.
RESULTS: No cases of fistula, stenosis or infection occured. Tensiometric evaluation showed a similar resistance in the operated esophagus when compared to the control (an average of 31.84N against 28.60N). Macroscopic analysis revealed complete healing with little tissue retraction. Pathology HE study showed complete mucous membrane regeneration, discrete to moderate vascular proliferation and intense fibroblastic proliferation. Collagen analysis by Sirus-red staining found 54.04% of mature collagen, 16,04% of imature collagen as well as 71.58% of total collagen. Conclusion: SIS has proved to be an efficient graft when used in the repairing of canine large esophagus lesions, featuring infection and rejection resistance. Complete regeneration was observed in 100% of the cases. SIS should, therefore, be considered as an important option in treatment of esophageal injuries.
Key words: Injuries. Esophagus. Submucosa. Experimental surgery.
Introdução
O esôfago é a porção do trato digestório que comunica a faringe ao estômago. Divide-se em esôfago cervical, torácico e abdominal1. Caracteriza-se por não apresentar serosa2. As perfurações traumáticas são responsáveis por considerável fração das lesões esofágicas e normalmente estão associadas a lesões vasculares, neurológicas e de vias aéreas3,4,5,6. O reparo de lesões esofágicas com perda significante de tecido está associado a grande morbidade e mortalidade3,4. Pequenas lesões detectadas precocemente podem ser tratadas com sutura primária. Podem ser também reforçadas com retalhos de músculos vascularizados, bem como enxertos de pleura parietal, fundo do estômago, aorta porcina descelularizada, entre outros3,4,7,8. Ressecção segmentar e anastomose término-terminal primária são condutas de exceção e requerem extensa dissecção e mobilização do esôfago. A tensão na linha de sutura num órgão sem serosa com freqüência propicia a formação de fístulas e estenoses3,4,5,6 . Em muitas situações o paciente apresenta-se clinicamente instável havendo a necessidade de uma terapêutica rápida e de fácil execução. Em lesões diagnosticadas tardiamente, certo grau de necrose tecidual pode já estar instalado e extenso debridamento pode ser necessário, causando mais perda tecidual3,4. O uso de exclusão esofágica predispõe à necessidade de gastrostomia, esofagostomia e/ou alimentação parenteral e está relacionado a elevado coeficiente de mortalidade3,4,9,10,11. A submucosa de intestino delgado de suínos (SID) é uma matriz colágena extracelular12 que vem sendo utilizada com bons resultados no reparo de tecidos vasculares12, do aparelho urinário13,14, da parede abdominal15 e das cartilagens16, entre outros. Segundo diversos autores, a SID apresenta características próprias que proporcionam a ela vantagens em relação aos demais enxertos biológicos. Dentre elas estão a presença de glicosaminoglicanos que conferem bioatividade a diversas citocinas e fatores de crescimento que atuam na revascularização e cicatrização de ferimentos17. O fator de crescimento do endotélio (VEGF) induz a formação de estruturas similares a capilares fenestrados na matriz de fibrina, promovendo neovascularização local18. O fator de crescimento derivado de plaquetas (PDGF) atua na proliferação fibroblástica19,20 e é suplementado pela imediata deposição de fibronectina, responsável primária pelo recrutamento e pela retenção das células do hospedeiro que povoarão o local da ferida21,22. Com relação à resposta imune da SID, observou-se que esta é restrita aos linfócitos T-helper 2, que ativam interleucinas que produzem anticorpos não ligados a complementos e, conseqüentemente, não há uma rejeição típica do tecido implantado23,24. A resistência à infecção está provavelmente correlacionada ao rico e rápido desenvolvimento de suprimento sangüíneo25. A SID já foi utilizada como enxerto no reparo de lesões esofágicas em cães. Apresentou baixo grau de estenose, epitelização completa, organização das fibras musculares e moderada vascularização26. As promissoras características da membrana submucosa, os bons resultados descritos na literatura em relação à sua aplicação, a morbidade das lesões esofágicas e a ausência de um consenso em relação a seu tratamento nos motivou a pesquisar, experimentalmente, a eficácia da SID porcina como enxerto parcial no reparo de lesões com perda de substância do esôfago cervical em cães.
Métodos
O enxerto de submucosa de intestino delgado de suíno é obtido da seguinte maneira: uma porção do jejuno é removida dentro de 10 minutos após a eutanásia do animal e imediatamente colocada numa solução salina a 0,9%. O segmento inicialmente é invertido e a túnica mucosa é mecanicamente removida; posteriormente é re-invertido e tanto a serosa quanto a túnica muscular são removidas. É então obtido um fino e translúcido tecido composto da submucosa. Irriga-se com solução salina a 0,9% e conserva-se em solução de sulfato de neomicina 10%.
Dez cães mestiços, com peso entre 10 e 20 Kg, foram mantidos no Biotério da PUCPR e o experimento foi realizado no Laboratório de Técnica Operatória e Cirurgia Experimental da PUCPR
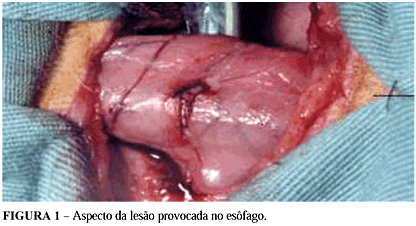
Sob anestesia, realizou-se cervicotomia paratraqueal esquerda de 8 cm Expôs-se o esôfago e de sua parede anterior, ressecou-se uma porção elíptica de aproximadamente 3,5cm de comprimento, correspondendo a um terço da circunferência total do órgão (Figura 1). Realizou-se o reparo da lesão com o enxerto composto de dois folhetos de SID de 3x4cm, que foi fixado à brecha feita no esôfago com sutura contínua entre o enxerto e as camadas mucosa e submucosa do esôfago. Usou-se fio de poliglecaprone 25(Monocryl®)4.0 (Figuras 2 e 3). Fez-se a síntese da pele com fio monofilamentar de náilon 3.0 (Mononylon®), com pontos à Donatti. A lesão foi induzida e corrigida no segmento superior do esôfago cervical. O segmento inferior foi utilizado como controle.
Avaliaram-se os resultados após sessenta dias, quando fez-se a eutanásia aos animais. Analisaram-se os aspectos: macroscópico, microscópico (regeneração tecidual, vascularização, incorporação do enxerto, fibrose, inflamação e colágeno) e tensiométrico. Realizou-se a tensiometria no Laboratório de Análises Destrutivas da PUCPR através do equipamento EMIC®, onde se avaliou a força máxima de ruptura. Analisou-se a força máxima de ruptura da porção superior (esofagoplastia) e da inferior (esôfago normal). Na análise estatística adotou-se o teste não-paramétrico de Wilcoxon27. Um valor de p<0,05 foi considerado estatisticamente significante.
Analisou-se a regeneração epitelial, a vascularização, a fibrose, a inflamação e a incorporação do enxerto em cortes histológicos corados pela Hematoxilina-Eosina, enquanto que a concentração do colágeno, pelo Sirus-Red. Avaliou-se neste último a presença de colágeno tipo I (fibras mais espessas, fortemente birrefringentes e vermelho-alaranjadas) e colágeno tipo III (fibras finas e dispersas, pouco birrefringentes e esverdeadas). As imagens foram capturadas numa câmera Sony CCD 101 e transmitidas para um monitor colorido Trinitron Sony. Utilizou-se o aplicativo Image-Pro® Plus versão 4.5 para Windows® da Media Cibernetics num computador da linha Pentium. Leu-se a porcentagem de colágeno em 3 campos com aumento de 200 vezes, obtendo-se a média de cada corte examinado.
Iniciou-se a alimentação com 24 horas de pós-operatório, com uma dieta pastosa (Sustagemâ ). Este alimento foi instituído durante 5 dias, quando então os cães passaram a ser alimentados com a ração tradicional. Não foi administrada antibioticoterapia.
Resultados
Não houve infecção, fístula ou estenose. Os cães alimentaram-se precocemente. A tensiometria demonstrou ganho de resistência do tecido onde se implantou o enxerto, uma vez que a resistência à ruptura foi semelhante ao controle, com discreta tendência a ser maior. A ruptura ocorreu, em todos os animais, cranialmente ao local de implantação do enxerto. A média da força de ruptura foi de 28,60 N na metade inferior do esôfago cervical (controle) e de 31.84 N na metade superior (com enxerto). (Tabelas 1 e 2) (p=0,593).
O aspecto macroscópico demonstrou o local do enxerto já cicatrizado, com cobertura completa da camada mucosa. Externamente não foi possível identificar cicatriz na camada muscular (Figura 4).
O estudo anátomo-patológico pela coloração HE revelou re-epitelização completa e incorporação do enxerto em todos os casos (Figura 5). A proliferação fibroblástica foi intensa em 80% dos cães e moderada em 20%. Em relação à proliferação neovascular, esta foi moderada em 30% dos casos e discreta, em 70%. A resposta inflamatória por monomorfonucleares foi ausente na maioria dos cães (60%). Em 20% foi discreta e nos outros 20%, moderada. Em 30% dos cães a resposta histológica foi a ideal para todos os parâmetros analisados (re-epitelização completa, incorporação do enxerto, neovascularização, inflamação e proliferação fibroblástica). Nos demais 70% a resposta foi quase a ideal considerando-se os 5 parâmetros avaliados (Tabelas 3 e 4).
A quantificação do colágeno pela coloração Sirus-red demonstrou haver maior porcentagem de colágeno tipo I. em 90% dos esôfagos. A concentração de colágeno tipo I entre 18,02% e 80,89%, com média de 54,04%. A de colágeno tipo III oscilou entre 7,08% e 30,09% (média de 16,04%) e a de colágeno total, entre 39,28% e 93,12% (média de 71,58%) (Tabela 5). Os intervalos de confiança são demonstrados na tabela 6.
Discussão
Grandes lesões esofágicas com significativa perda tecidual são preocupantes e de difícil tratamento3,11. Requerem técnicas inovadoras e apresentam elevada morbidade. Em se tratando de vítimas de feridas traumáticas, as quais normalmente apresentam lesões associadas como dos grandes vasos do pescoço, traquéia e coluna cervical, as chances de sobrevida e qualidade de vida são melhores quando o reparo da lesão é realizado de maneira concreta e definitiva e num menor espaço de tempo. O reparo primário é viável somente em lesões pequenas e recentes, pois, do contrário, as técnicas de exclusão e estomização poderão predispor à posteriores procedimentos de reconstrução, mais extensos, como as interposições gástrica e colônica3,5,6,9,10. Mesmo com o avanço da terapia intensiva e dos antibióticos, que diminuíram os índices de mortalidade, os custos e a morbidade continuam altos.
Bons resultados foram obtidos recentemente com diferentes tipos de enxerto para reparo de lacerações esofágicas, como o uso da própria submucosa de intestino delgado26, o uso de pele humana descelularizada28 e de aorta porcina descelularizada4.
O enxerto que empregamos no reparo de lesões esofágicas cervicais pode ser obtido fácil e rapidamente, com baixo custo. A SID proporciona uma barreira no sítio da lesão enquanto, rapidamente pela matriz colágena, o tecido local cresce e se regenera, tomando seu lugar19-21.
A tensiometria das peças esofágicas demonstrou que aos 60 dias a força necessária para ruptura é semelhante nas áreas com enxerto, à das áreas controle. Isso significa que a resistência do material se apresenta adequada a curto-médio prazo. Badylak (2000) relatou ser o local do enxerto discretamente mais resistente do que o esôfago normal num estudo semelhante26.
A histologia evidenciou proliferação fibroblástica intensa em 80% dos casos19. Isso representa que ocorreu excelente cicatrização do local do enxerto, confirmando o resultado do estudo tensiométrico. Houve re-epitelização completa da mucosa em 100% dos casos26, no entanto, não foi possível avaliar com precisão a regeneração da camada muscular4,21,26; para isto será necessária contagem de células através de imunohistoquímica. Segundo Badylak (2000), há uma organização relativa da camada muscular quando a SID é implantada no esôfago. Quanto a neovascularização, esta foi de discreta a moderada3,7,12,26 . Isto foi considerado bom para um órgão que certamente apresentou desvascularização importante ao ser manuseado e é, naturalmente, pouco angiogênico. A incorporação do enxerto foi completa em 100% dos casos e a resposta inflamatória, aos 60 dias, foi nula na maioria dos animais2,4,19,20,22 .
Os resultados verificados na coloração Sirus-red vieram a confirmar a satisfatória resposta cicatricial apresentada pelo enxerto. Com 60 dias de pós-operatório, a porcentagem de colágeno tipo III foi de 54,04% e de colágeno total de 71,58%, valores considerados suficientes para uma boa cicatrização. Certamente este colágeno conferiu a boa resposta tensiomátrica ao enxerto.
Baseados na experiência de Badylak (2000), não nos dispusemos a substituir uma eventual perda pela ressecção da totalidade da circunferência do esôfago. Segundo o autor, quando executado este procedimento, há elevada morbidade e mortalidade associadas ao elevado grau de estenose instalado26.
Com características de não haver rejeição ou infecção e de neovascularização12,18-26, a matriz colágena extracelular se encaixa como uma base propícia para uma regeneração tecidual, com baixíssimo grau de retração tecidual, sem estenose significante e sem o aparecimento de fístulas.
Conclusão
A submucosa de intestino delgado porcina é um enxerto eficaz no reparo de lesões com perda de substância do esôfago cervical em cães.
3. Banecko RM, Shields TW. Esofageal trauma. Gen Thor Surg 1994;24:1514-25.
Agradecimentos
Profª. Márcia Holanoski (Estatística), Álvaro e Daniel (Técnica Operatória), Indalécio Sutil (Veterinário), Rosana Nunes (Técnica Operatória), Fernando Ubirajara (Biotério).
Data do recebimento: 21/02/2003
Data da revisão: 10/03/2003
Data da aprovação: 24/03/2003
Conflito de interesse: nenhum
Fonte de financiamento: PIBIC-PUCPR
1. Trabalho realizado na Disciplina de Técnica Operatória e Cirurgia Experimental da Pontifícia Universidade Católica do Paraná (PUCPR).
- 1. Gardner E, Gray D, O’Rahhily. Anatomia. 4ed. Rio de Janeiro: Guanabara- Koogan; 1988.
- 2. Di Fiore M, Mancini R, De Robertis E. Novo atlas de histologia. 2ed. Rio de Janeiro: Guanabara-Koogan; 1973.
- 4. Kajitani M, Wadia Y, Hinds M, Teach J, Swartz K, Gregory K. Successful repair of esophageal injury using a elastin based biomaterial patch. Asaio J 2001; 46:342-5.
- 5. Grillo HG, Wilkins EW. Esophageal repair following late diagnosis of intrathoracic perforation. Ann Thorac Surg 1975; 29:387-99.
- 6. Thal AP, Hatafuku T, Kurtzman R. New operation for distal esophageal stricture. Arch Surg 1965; 90:464-72.
- 7. Urschel Jr HC, Razzuk MA, Wood RE. Improved management of esophageal perforations. Thorax 1977; 32:241-9.
- 8. Pass LJ, LeNarz LA, Schreiber JT. Management of esophageal gunshot wounds. Ann Thorac Surg. 1987; 44:253-6.
- 9. Popovski J. Perforation of the esophagus for gunshot wuonds. J Trauma 1984; 24:337-9.
- 10. DeMeester TR: Perforation of the esophagus (editorial). Ann Thorac Surg. 1986.
- 11. Demetríades D, Asensio J, Velmahos G. Problemas complexos no traumatismo cervical penetrante. In: Asensio J, Demetriades D, Berne T. Clinicas irúrgicas da América do Norte: problemas complexos e desafiadores na cirurgia traumatológica. Rio de Janeiro: Interlivros Edições; 1996. p 681-2
- 12. Roeder R, Wolf J, Lianakis N. Compliance, elastic modulus, and burst pressure of small-intestine submucosa (SIS), small-diameter vascular grafts.J Biomed Mater Res 1999;47: 65.
- 13. Vaught JD, Kropp BP, Sawyer BD, Rippy MK, Badylak SF, Shannon HE, Thor, KB. Detrusor regeneration in the rat using porcine small intestine submucosal grafts: functional inervation e receptor expression. J Urol 1996; 155:374-8.
- 14. Badylak SF, Kropp B, McPherson T. Small intestinal submucosa: a rapidly resorbed bioscaffold for argumentation cytoplasty in a dog model. Tissue Eng 1998; 4:379.
- 15. Prevel C, Eppley B, Summerlin DJ, Jackson JR, McCarty M, Badylak SF. Small intestinal submucosa: utilization for repair of rodent abdominal wall defects. Ann Plast Surg 1995; 34:374-80.
- 16. Peel SAF, Chen H, Renlund R, Badylak SF, Kandel RA. Formation of a SIS-cartilage composite graft in vitro and its use in the repair of articular cartilage defects. Tissue Eng 1998; 4:143-55.
- 17. Hodde JP, Badylak SF, Brightman AO, Voyti-Harbin SL. Glycosaminoglycan content of small intestine submucosa: a bioscaffold for tissue replacement. Tissue Eng 1996; 2:209-17.
- 18. Hodde JP, McPherson TB, Savaiano JK, Badylak SF. Vascular endotelial growth factor (VEGF) in SIS. SIS Symp1998; p92.
- 19. Liang, HA. Determination of platelet-derivad growth factor in small intestinal submucosa. SIS Simp 1998; p93.
- 20. Voytik-Harbin SL, Brightman AO, Kraine M, Waisner B, Badylak, SL. Identification of extractable growth factors from small intestinal submucosa. J Cel Bio 1997; 67:478-91.
- 21. McPherson TB, Badylak SF. Characterization of fibronectin derived from porcine small intestinal submucosa. Tissue Eng 1998; 4:75-83.
- 22. McPherson TB, Badylak SF, Hogenesch, H., et al. Efect of local response to xenogeneic ECM on systemic immunity. SIS Symp 1998; p34.
- 23. Metzger DW, McPhersonTB, Merrill LA, Moyad TF, Badylak SF. Immune responses to xenogeneic SIS Implants. SIS Symp 1998; p33.
- 24. Allman AJ, McPherson TB, Timothy B, Badylak SF, Merril LC, Kallakury B, Sherran C, Raeder RH, Metzger DW. Xenogeneic extracellular matrix grafts elicit a th-2-restricted immune response. Transplantation 2001;71: 1631-40.
- 25. Badylak SF, Coffei AC, Lantz GC. Comparison of resistance to infection of small intestinal submucosa arterial autografts versus polytetrafluoroethilene arterial prostheses in a dog model. J Vasc Surg 1994;19:465.
- 26. Badylak SF, Meurlin S, Chen M. Resorbable bioscaffold for esophageal repair in a dog model. J Pediatr Surg 2000;35:1097-103.
- 27. Siegel S. Nonparametric statistics. New York: McGraw-Hill Book Company; 1956.
- 28. Isch JA, Eugum SA, Ruble CA. Patch esophagoplasty using AlloDerm as a tissue scaffold. J Pediatr Surg 2001;36:266-8.
Datas de Publicação
-
Publicação nesta coleção
08 Out 2003 -
Data do Fascículo
Jun 2003
Histórico
-
Aceito
24 Mar 2003 -
Revisado
10 Mar 2003 -
Recebido
21 Fev 2003