Resumos
OBJETIVO: Estudar a ultra-estrutura das vilosidades intestinais de ratos após diferentes tempos de clampeamento total do pedículo hepático. MÉTODOS: Foram utilizados 40 ratos, machos, divididos em quatro grupos de 10 animais cada um. O grupo Sham não foi submetido a isquemia. Os grupos E1, E2 e E3 sofreram isquemia de 10, 20 e 30 minutos, respectivamente. Ao final do experimento, fragmentos do intestino delgado (íleo) foram retirados e processados para microscopia eletrônica de transmissão. RESULTADOS: Nos grupos E1 e E2 observou-se infiltração de leucócitos, dilatação vascular e áreas eletrolúcidas na lâmina própria das vilosidades. Já no grupo E3 observou-se desprendimento do revestimento epitelial, desintegração das microvilosidades e núcleos em apoptose. Na lâmina própria notamos áreas hemorrágicas, vasos sangüíneos e linfáticos dilatados e inúmeros leucócitos. CONCLUSÕES: o clampeamento do pedículo hepático hepático provoca congestão esplâncnica, tempo dependente, sendo que aos 30 minutos se nota desprendimento das células epiteliais, apoptose e hemorragia.
Isquemia; Intestinos; Ratos; Ultra-estrutura
PURPOSE: To study the ultrastructural of rat intestinal villi (ileum) after total hepatic pedicle clumping for different period of time. METHODS: Forty male rats were divided into four groups of ten animals each. The Sham group was not being submitted to ischemia (control). E1, E2 and E3 group were submitted to 10, 20 and 30 minutes of ischemia, respectively. At the end of the experiment fragments of the ileum were taken off and examined by electromicroscope. RESULTS: Leucocyte infiltration, vascular dilation and electrotransparent areas were observed in intestinal villi of lamina propria of E1 and E2 groups. In reference to group E3 desquamation of epithelial layer, desquamation of intestinal villi and signs of apoptosis were observed. Hemorrhagic areas, dilated lymphatics and blood vessels and lots of leucocytes were observed in lamina propria. CONCLUSION: The clumping of hepatic pedicle provokes esplacnic congestion, time dependent, and to the 30 minutes were epithelial cell desquamation, apoptosis signs and hemorrhage.
Ischemia; Intestine; Rats; Ultrastructure
ARTIGO ORIGINAL
Aspectos ultra-estruturais das vilosidades intestinais após o clampeamento do pedículo hepático de ratos1 1 Trabalho realizado no Laboratório de Técnica Operatória e Cirurgia Experimental da Universidade de Cuiabá UNIC e Departamento de Morfologia da Universidade Federal de São Paulo UNIFESP/EPM.
Ultrastructural aspects of the intestinal villi after hepatic pedicle clumping in rats
Lázaro Manoel de CamargoI; Joaquim Evêncio NetoII; Silvio Henrique de FreitasIII; Manuel de Jesus SimõesIV; Paulo de Oliveira GomesV; Abrão Antônio SébeVI
IProfessor do Departamento de Clínica da Faculdade de Medicina Veterinária da Universidade de Cuiabá - UNIC
IIProfessor Adjunto do Departamento de Morfologia e Fisiologia da Universidade Federal Rural de Pernambuco UFRPE
IIIProfessor do Departamento de Cirurgia da Faculdade de Medicina Veterinária da UNIC
IVProfessor Livre Docente do Departamento de Morfologia da UNIFESP/EPM e da UNIC
VProfessor Adjunto do Departamento de Cirurgia da UNIFESP/EPM
VIProfessor Adjunto da Faculdade de Medicina da UNIC
Endereço para correspondência Endereço para correspondência Lázaro Manoel de Camargo Avenida Beira Rio, 3100 78015-480 Cuiabá MT
RESUMO
OBJETIVO: Estudar a ultra-estrutura das vilosidades intestinais de ratos após diferentes tempos de clampeamento total do pedículo hepático.
MÉTODOS: Foram utilizados 40 ratos, machos, divididos em quatro grupos de 10 animais cada um. O grupo Sham não foi submetido a isquemia. Os grupos E1, E2 e E3 sofreram isquemia de 10, 20 e 30 minutos, respectivamente. Ao final do experimento, fragmentos do intestino delgado (íleo) foram retirados e processados para microscopia eletrônica de transmissão.
RESULTADOS: Nos grupos E1 e E2 observou-se infiltração de leucócitos, dilatação vascular e áreas eletrolúcidas na lâmina própria das vilosidades. Já no grupo E3 observou-se desprendimento do revestimento epitelial, desintegração das microvilosidades e núcleos em apoptose. Na lâmina própria notamos áreas hemorrágicas, vasos sangüíneos e linfáticos dilatados e inúmeros leucócitos.
CONCLUSÕES: o clampeamento do pedículo hepático hepático provoca congestão esplâncnica, tempo dependente, sendo que aos 30 minutos se nota desprendimento das células epiteliais, apoptose e hemorragia.
Descritores: Isquemia. Intestinos. Ratos. Ultra-estrutura.
ABSTRACT
PURPOSE: To study the ultrastructural of rat intestinal villi (ileum) after total hepatic pedicle clumping for different period of time.
METHODS: Forty male rats were divided into four groups of ten animals each. The Sham group was not being submitted to ischemia (control). E1, E2 and E3 group were submitted to 10, 20 and 30 minutes of ischemia, respectively. At the end of the experiment fragments of the ileum were taken off and examined by electromicroscope.
RESULTS: Leucocyte infiltration, vascular dilation and electrotransparent areas were observed in intestinal villi of lamina propria of E1 and E2 groups. In reference to group E3 desquamation of epithelial layer, desquamation of intestinal villi and signs of apoptosis were observed. Hemorrhagic areas, dilated lymphatics and blood vessels and lots of leucocytes were observed in lamina propria.
CONCLUSION: The clumping of hepatic pedicle provokes esplacnic congestion, time dependent, and to the 30 minutes were epithelial cell desquamation, apoptosis signs and hemorrhage.
Key Words: Ischemia. Intestine. Rats. Ultrastructure.
Introdução
Com a evolução dos estudos na área dos transplantes hepáticos, modelos experimentais de isquemia hepática têm sido muito difundidos. Além dos transplantes hepáticos, esses modelos podem ser utilizados em inúmeras outras situações, como em ressecções hepáticas, trauma com lesão hepática e choque hemodinâmico.
Os pesquisadores dividem-se em duas grandes linhas: os que trabalham com modelos experimentais de isquemia hepática parcial1, 2, 3, 4, 5, 6 e os que trabalham com modelos de isquemia hepática total acrescida de derivação vascular7, 8, 9, 10. Esses modelos são utilizados, exatamente, para se evitar a congestão esplâncnica, a isquemia intestinal e conseqüente endotoxemia.
Com relação aos estudos experimentais de isquemia hepática total e suas repercussões no intestino, poucos são os trabalhos encontrados. Sébe11 observou que, no modelo de isquemia hepática total sem derivação vascular, o clampeamento total do hilo hepático com pinça vascular (manobra de PRINGLE) por mais de vinte minutos leva a lesões nas organelas dos hepatócitos e congestão nos órgãos que são drenados pela veia porta, tais como o baço e intestino delgado.
Sébe e col. (2000)12, estudando o intestino de ratos após o clampeamento total do hilo hepático, relatam que quanto maior o tempo de clampeamento maior a congestão esplâncnica e, aos 30 minutos, ocorre o desprendimento do revestimento das vilosidades intestinais e hemorragia.
No presente trabalho procurou-se utilizar modelo de isquemia hepática total, sem derivação vascular, para poder-se estudar os eventos que ocorrem no intestino e o tempo para instalar-se as alterações histológicas.
Métodos
Foram utilizados 40 ratos Wistar, machos, com três meses de idade, peso variando entre 200 e 300g, fornecidos pelo Centro de Desenvolvimento de Modelos de Animais de Experimentação (CEDEME) da Universidade Federal de São Paulo. Esses animais foram transportados por via aérea para a Universidade de Cuiabá (UNIC), onde ficaram confinados em gaiolas, em biotério com temperatura e luz controladas e água e alimentação ad libitum. As intervenções cirúrgicas foram realizadas segundo as normas técnicas e direitos internacionais de pesquisa em animais e após aprovação pelo Comitê de Ética em Pesquisa da Universidade Federal de São Paulo (UNIFESP/EPM).
Inicialmente todos os animais foram anestesiados com quetamina (50 mg/Kg) e xilazina (25 mg/kg), via intramuscular. Após anestesia, foi realizada incisão xifo-púbica. Após abertura da cavidade abdominal, foi identificado o pedículo da artéria hepática comum, veia porta e ducto biliar. A seguir, foram distribuidos, ao acaso (sorteio), em quatro grupos iguais. No grupo S (Sham) apenas se abriu a cavidade abdominal; os outros três grupos, dependendo do tempo de duração da isquemia, foram classificados em: E1 - 10 minutos; E2 - 20 minutos e E3 - 30 minutos de clampeamento. Para a realização da isquemia, foi colocada uma pinça de clampeamento vascular envolvendo todo o pedículo hepático, manobra de PRINGLE13. Realizado ou não o clampeamento, todos os animais permaneceram durante 30 minutos no experimento, sob as mesmas condições ambientais. Após esse período, foram dissecados segmentos da porção inicial do íleo e, posteriormente, retirados. Em seguida os animais foram submetidos a eutanásia por aprofundamento do plano anestésico.
Os segmentos intestinais obtidos foram mergulhados em solução de glutaraldeído a 2%, em tampão fosfato (0,1 M), pH 7,2 a 4 oC, durante duas horas e, a seguir, processados para observação em microscópio eletrônico de transmissão Carl Zeiss, modelo EM 900, sob tensão de 80 kV.
Resultados
A análise ultra-estrutural mostrou que as vilosidades intestinais dos animais do grupo Sham apresentavam-se revestidas por enterócitos íntegros com inúmeras interdigitações da membrana celular com as células vizinhas e núcleo elíptico, rico em eucromatina, localizado na porção média da célula. No citoplasma da porção apical dos enterócitos, identificamos mitocôndrias íntegras, vesículas eletrolúcidas e ribossomas. Nessa região identificamos também inúmeras projeções da membrana plasmática formando as microvilosidades (Figura 1). Na região basal encontramos mitocôndrias e polissomas. Na lâmina própria identificamos vasos sangüíneos e vários tipos de células do tecido conjuntivo (Figura 2).
Nos grupos E1 e E2 observou-se basicamente a mesma morfologia do epitélio de revestimento superficial das vilosidades intestinais do grupo Sham, ou seja, os enterócitos possuem inúmeras microvilosidades na porção apical, interdigitações e, no citoplasma, inúmeras mitocôndrias, ribossomas, retículo endoplasmático granular e complexo de Golgi. Na região basal identificamos mitocôndrias e polissomas. No entanto, na lâmina própria das vilosidades, identificamos vasos sanguíneos e linfáticos dilatados, áreas eletrolúcidas e maior concentração de células do tecido conjuntivo, em especial mastócitos, linfócitos e plasmócitos, principalmente no grupo E2 (Figura 3).
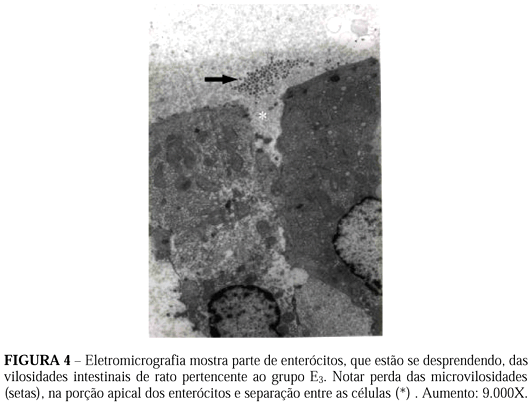
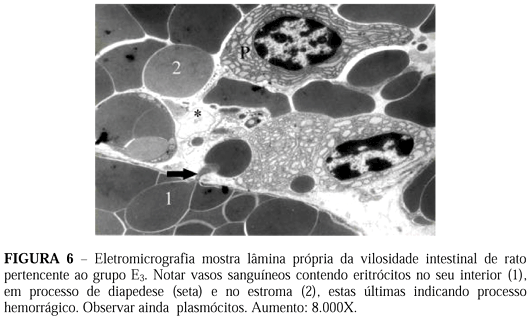
No grupo E3 notamos que as células epiteliais que revestem as vilosidades intestinais estão em processo de despreendimento, ou seja, estão se separando umas das outras e perdendo suas microvilosidades (Figura 4). As células epiteliais que se desprenderam e se encontram na luz do tubo digestivo mostram núcleos com cromatina condensada, localizada abaixo do folheto nuclear interno, formando uma espécie de anel característico da apoptose. Nota-se ainda condensação dos nucléolos (Figura 5). No citoplasma encontramos grande concentração de vesículas rodeadas por membranas. Na lâmina própria das vilosidades identificamos vasos sangüíneos e linfáticos muito dilatados, hemácias fora dos capilares (hemorragia) e grande concentração de plasmócitos (Figura 6).
Discussão
A isquemia hepática parcial ou total em diferentes tempos promove congestão esplâncnica em diferentes graus, levando a congestão intestinal. Na prática de utilização das manobras de clampeamento do pedículo hepático a congestão intestinal ocorre e tem que ser conhecida, pois pode causar o insucesso de procedimentos cirúrgicos, podendo levar até ao óbito. Neste trabalho procuramos utilizar técnica que mais se aproximasse do uso prático diário para determinar se a ligadura do hilo hepático poderia alterar a morfologia do intestino delgado.
A maioria das isquemias hepáticas que foram descritas, utilizando a manobra de PRINGLE, não utilizaram essa manobra como preconizado no trabalho original. Na realidade utilizaram seletivamente, clampeando não o hilo hepático principal mas sim o tronco vascular e ducto de determinado lobo hepático14. Alguns autores como Gonçalves e col. (1979)2 e Frederiks e col. (1982 e 1983)3,4 clampearam a artéria hepática esquerda, veia porta esquerda e ducto biliar esquerdo, causando isquemia no lobo mediano e lobo lateral esquerdo do fígado de ratos. Desta maneira, os autores mantiveram uma parte do fígado funcionando e evitavam a congestão esplâncnica.
Outros autores como Horiuchi e col. (1995)15 e Hardy e col. (1995)16 clampearam o lado direito, ou seja, isquemiaram o lobo lateral direito e o lobo caudado do fígado de ratos.
Devido a essas variações usadas nos diferentes experimentos, os tempos de isquemia descritos como tempos de lesão hepática foram muito variáveis, indo desde 30 minutos9 até 100 minutos6. Possivelmente, esses tempos dilatados podem ser decorrentes da feitura da isquemia hepática parcial ou total com derivações vascular. No nosso experimento, os tempos de isquemia hepática foram menores justamente por se fazer isquemia total sem derivação vascular, para podermos avaliar as possíveis modificações ultra-estruturais que ocorrem nas vilosidades intestinais.
Com relação à microscopia eletrônica percebemos que os grupos Sham e E1 são muito parecidos no que diz respeito a sua morfologia. No grupo E2 as células epiteliais não mostraram alterações dignas de nota. No entanto, na lâmina própria das vilosidades, observamos aumento das áreas eletrolúcidas, o que indica a instalação de um processo edematoso, além de aumento em número das células do tecido conjuntivo, em especial plasmócitos, linfócitos e mastócitos.
Schanaider e col. (1991)17 relatam que a anóxia pode levar a aumento da permeabilidade capilar com conseqüente instalação de edema na lâmina própria do intestino delgado submetido a choque hipovolêmico.
As maiores alterações por nós observadas ocorreram no grupo E3, onde a microscopia eletrônica de transmissão mostrou que as células epiteliais perdem as microvilosiades apicais, o contato com as células laterais e descamam para a luz intestinal. Na lâmina própria foi possível identificar sinais de edema, hemorragia e acentuado aumento de plasmócitos. Essas alterações ultra-estruturais confirmam os achados ao microscópio de luz de Sebe e col. (2000)12. Um achado de extrema importância foi encontrarmos nesse grupo agrupamentos de células mostrando cromatina e nucléolo condensados, sendo que a cromatina está localizada logo abaixo do folheto nuclear interno, com se fosse um anel. A disposição e forma da localização dessa cromatina, indica que essas células estão em processo de apoptose.
Apoptose é a morte celular programada que ocorre por mecanismos bioquímicos intrínsecos ou extrínsecos da célula, sendo responsável pela remoção de células desnecessárias ou com função anormal18. É um processo fisiológico que ocorre em diversos tecidos e atua durante toda a vida celular, tanto na proliferação quanto na diferenciação. Entre os indutores da apoptose, destacamos os ativadores fisiológicos: fator de necrose tumoral (TNF), calmodulina, interleucinas, além de hormônios, radicais livres, glutamato, peróxido de hidrogênio, fatores biológicos como vírus, células T citotóxicas. Podemos ainda citar toxinas (etanol, aflotoxina, acido retinóico); e agentes terapêuticos como glicocorticóides, quimioterápicos, radiação, digoxina, RU 486 (misoprostol) e prostaglandinas19.
Acreditamos que as alterações morfológicas por nós obtidas, devido ao fato da ligadura do pedículo hepático retardar ou mesmo impedir a drenagem, ou mesmo a diminuição do fluxo sangüíneo, levaram a uma menor oxigenação do tubo intestinal, com escassez crescente de oxigênio tissular. Este processo faz com que, progressivamente, as células, principalmente as de revestimento das vilosidades, substituam a respiração aeróbica, pela anaeróbica, que produz menor quantidade de energia, com produção elevada de catabólitos celulares e, dentre estes, os radicais livres de oxigênio20. Esta suposição está baseada no trabalho de Guimarães e col. (2002)21 que notaram que a oxigenação hiperbárica diminui a lesão das vilosidades intestinais em ratos com isquemia local seguida de reperfusão.
Atualmente é considerada como irreversivelmente lesada a célula que apresenta alterações enzimáticas do mecanismo de transporte transmembrana, quer a nível celular ou de organelas; redução da respiração mitocondrial e da produção de energia, e a formação de radicais livres de oxigênio, principalmente no interior das mitocôndrias22.
Os radicais livres de oxigênio (RLO) são moléculas altamente reativas22, que têm afinidade por membranas lipoprotéicas20, com as quais reagem, ativando a cicloxigenase e a lipoxigenase, intermediadas pela fosfolipase A2 ativa, dando origem às prostaglandinas, tromboxanas, prostaciclinas, leucotrienos e outros RLO, responsáveis pela mediação do processo inflamatório.
Desta maneira, os RLO atuam na regulação e modulação do processo inflamatório, funcionando ainda como mensageiros das agressões teciduais, sendo suas ações perfeitamente controláveis, enquanto produzidos em níveis fisiológicos23.
Em quadros de anóxia prolongada, como o realizado nesta pesquisa, é lícito pensar que sempre haverá algum grau de lesão tecidual, como foi notado nos resultados do grupo Sham.
Atualmente, estão sendo estudadas as vias sangüínea e linfática na tentativa de elucidar quais produtos produzidos pelo intestino submetido a isquemia levariam às lesões sistêmicas. A tendência é imputar às duas tal responsabilidade, embora a via linfática possa colaborar com parcela substancialmente importante de participação24.
Nossos resultados mostraram também a presença de células inflamatórias na lâmina própria das vilosidades a partir dos 20 minutos de isquemia. Deste modo, acreditamos que a ativação de produtos tóxicos e células inflamatórias poderia levar à presença do fluxo plasmático através do espaço intersticial e intracelular, captado pelos vasos linfáticos, que podem ser a principal rota de liberação para órgãos distantes de mediadores inflamatórios como as citocinas, o fator de necrose tumoral (TNF), interleucina 6 (IL-6), eicosanóides, fator de ativação plaquetária (PAF), produtos do complemento, endotoxinas e RLO, produzidos no intestino isquêmico.
Espera-se que este trabalho possa fornecer dados e substrato para a prevenção da necrose intestinal durante longas cirurgias hepáticas, como no caso de transplantes. Acreditamos que muito há que se fazer nessa linha de pesquisa e que novos estudos deverão ser realizados, talvez no sentido de se prevenir a formação de radicais livres ou de se ter um período operatório mais longo. Poderemos ainda observar as ocorrências em relação à reperfusão, se há ou não recuperação das células epiteliais intestinais e as possíveis seqüelas ocasionadas pela liberação dos radicais livres durante o estado de congestão.
Conclusão
O clampeamento do pedículo hepático provoca congestão esplâncnica, sendo tempo dependente, pois quanto maior o tempo de clampeamento maior a congestão. Aos 30 minutos, observa-se além da intensa congestão, desprendimento das células epiteliais de revestimento das vilosidades intestinais, apoptose e hemorragia.
Data do recebimento: 17/08/2003
Data da revisão: 03/09/2003
Data da aprovação: 22/09/2003
Conflito de interesse: nenhum
Fonte de financiamento: Universidade de Cuiabá
- 1. Derry CD, Slapak M. Proceedings: a new model for acute failure. Br J Surg. 1973; 60: 901.
- 2. Gonçalez Y, Machado MCC, Gonçalves EL. Isquemia hepática e glicogênio: estudo experimental. Rev. Hosp. Clin Fac Med S Paulo. 1979; 34: 74-9.
- 3 Frederiks WM, James J, Bosch KS, Schrõder MJR, Schuyt HC. A model for provoking ischemic necrosis in rat liver. Parenchyma and its quantitative analysis. Exp Pathol. 1982; 22: 245-52.
- 4. Frederiks WM, Myagkaya GL, Bosch KS, Fronik GM, Veen HV, Vogels IMC, James J. The value of enzyme leakage for the prediction of necrosis in liver ischemia. Histochemistry. 1983; 78: 459-72.
- 5. Frederiks WM, Myagkaya GL, Veen HAV. Biochemical and ultrastructural changes in rat liver plasma membranes after temporary ischemia. Virchows Arch Cell Pathol. 1984; 46: 269-82.
- 6. Asakawa H, Jeppson B, Mack P, Hultberg B, Hãgerstrand I, Bengmark S. Acute ischemic liver failure in the rat: a reproducible model not requiring portal decompression. Eur Surg Res. 1989; 21: 42-8.
- 7. Shibayama YY, Asaka S, Nishijima A. Mechanism of liver injury following ischemia. Exp Mol Pathol. 1991; 55: 251-60.
- 8. Isozaki H, Adam R, Gigou M, Szekely AM, Shen M, Bismuth H. Experimental study of the protective effect of intermittent hepatic pedicle clamping in the rat. Br J Surg. 1992; 79: 310-3.
- 9. Isozaki H, Okajima K, Kobayashi M, Szekely AM, Akimoto H. Experimental study of liver injury after partial hepatectomy with intermittent or continuous hepatic vascular occlusion. Eur Surg Res. 1995; 217: 313-22.
- 10. Gonce ME, Brackett DJ, Squires RA, Gibson DD, Balla AK, Lerner MR, McCay PB, Pennington LR. A new model for inducing total hepatic ischemia while preventing circulatory collapse: secondary to splanchnic vascular congestion. Schock. 1995; 3: 440-6.
- 11. Sébe AA. Efeitos de diferentes tempos de isquemia no fígado de ratos [Tese Doutorado]. Universidade Federal de São Paulo - Escola Paulista de Medicina; 1999.
- 12. Sébe AA, Nigro AJT, Gomes PO, Simões MJ. Efeitos do clampeamento do pedículo hepático nos intestinos. Acta Cir Bras. 2000; 15:4-8.
- 13. Pringle JH. Notes on the arrest of hepatic hemorrhage due to trauma. Ann Surg. 1908; 48: 541-9.
- 14. Silva Jr OC, Beer Jr AA. Modelos experimentais de pesquisa em cirúrgica, São Paulo: Robe; 1998.
- 15. Horiuchi T, Ryusuke M, Tabo T, Uchinami M, Kimura N, Tanigawa N. Optimal cycles of hepatic ischemia and reperfusion for intermittent pedicle clamping during liver surgery. Arch Surg. 1995; 130: 754-8.
- 16. Hardy KJ, Tancheroen S, Shulkes A. Comparison of continuous versus intermittent ischemia- reperfusion during liver resection in an experimental model. J Surg. 1995; 82: 833-6.
- 17. Schanaider A, Perrota U, Madi K. Importância dos radicais livres derivados do oxigênio na fisiopatologia das afecções isquêmicas intestinais. Folha Med. 1991;103(2): 53-8.
- 18. Vinatier D. Apoptosis: a programmed cell death involved in ovarian and uterine physiology. Eur J Obstet Gynecol Reprod Biol. 1997; 67: 85-102.
- 19. Lang CE, Simões MJ, Soares Jr JM, Baracat EC. Apoptose no sistema reprodutor feminino. Femina. 2000; 29: 361-4.
- 20. Marsicano LJ. Los radicales libres. Gen 1994; 48(1): 39-44.
- 21. Guimarães FAG, Taha MO, Simões MJ, Fagundes DJ. Ischemia-reperfusion of the small intestine and hyperbaric oxygen treatment: a morphologic study in rats. Transplant Proc 34: 977-9, 2002.
- 22. Langer B. Radicais livres, isquemia e inflamação. Rev Paul Med 1986; 104 (6): 305-10.
- 23. Lara PF. Radicais livres: atualização. Anais Paul Med Cir. 1992; 119(1): 33-49.
- 24. Upperman JS, Deitch EA, Guo W, Lu Q, Xu D. Post-hemorrhagic shock mesenteric lymph is cytotoxic to endothelial cells and activates neutrophils. Shock. 1998; 10 (6): 407-14.
Datas de Publicação
-
Publicação nesta coleção
19 Abr 2007 -
Data do Fascículo
Dez 2003
Histórico
-
Aceito
22 Set 2003 -
Revisado
03 Set 2003 -
Recebido
17 Ago 2003