RESUMO
Objetivo:
Descrever as características clínicas, demográficas, anatomopatológicas, moleculares e de sobrevida de pacientes portadores de meduloblastoma.
Métodos:
Estudo retrospectivo, no qual as informações dos pacientes foram obtidas pela revisão dos prontuários médicos. Análises de sobrevida global e de sobrevida livre de eventos foram realizadas por meio da construção de curvas de Kaplan-Meier e a comparação entre as curvas foi feita pelo teste log-rank.
Resultados:
Entre os pacientes analisados, 70 pertenciam ao sexo masculino (66%) e a idade ao diagnóstico variou de dois meses a 22 anos. Os sinais e sintomas de maior frequência foram cefaleia (80,8%) e vômitos (75,8%). Em relação ao tratamento, a maioria (63,2%) dos pacientes foi submetida à ressecção cirúrgica total e apresentava como histologia predominante a forma clássica (63,2%). A taxa de sobrevida global em cinco anos foi de 67,9% e, em 10 anos, de 64,2%. Os pacientes com perfil molecular característico do subgrupo wingless (WNT) apresentaram melhor prognóstico, com sobrevida global em cinco anos de 75%.
Conclusões:
As características clínicas, demográficas, anatomopatológicas e moleculares dos pacientes com meduloblastoma descritas no presente estudo foram majoritariamente semelhantes às descritas na literatura. Pacientes submetidos à ressecção completa do tumor tiveram melhor evolução clínica do que aqueles com ressecção incompleta/biópsia. Pacientes estratificados como de alto risco apresentaram pior sobrevida global e livre de eventos do que o grupo standard e a presença de metástases ao diagnóstico se mostrou associada à ocorrência de recidiva da doença.
Palavras-chave:
Meduloblastoma; Neoplasias do sistema nervoso central; Oncologia
ABSTRACT
Objective:
To describe the clinical, demographic, anatomopathological, molecular, and survival characteristics of patients with medulloblastoma.
Methods:
Retrospective study based on patient information obtained from the review of medical records. Overall and event-free survival were analyzed using the Kaplan-Meier estimator, and the curves were compared by the log-rank test.
Results:
Among the patients investigated, 70 were male (66%), and age at diagnosis ranged from 2 months to 22 years. The most frequent signs and symptoms were headache (80.8%) and vomiting (75.8%). Regarding treatment, most patients (63.2%) underwent complete surgical resection, with a predominance of classic histology (63.2%). The 5-year overall survival rate was 67.9%, and the 10-year rate was 64.2%. Patients with molecular profile characteristic of the wingless (WNT) subgroup had a better prognosis, with 5-year overall survival of 75%.
Conclusions:
The clinical, demographic, anatomopathological, and molecular characteristics of patients with medulloblastoma described in the present study were mostly similar to those reported in the literature. Patients submitted to complete tumor resection had better clinical outcomes than those who underwent incomplete resection/biopsy. Patients classified as high-risk showed worse overall and event-free survival than those in the standard-risk group, and the presence of metastasis at diagnosis was associated with recurrence.
Keywords:
Medulloblastoma; Central nervous system neoplasms; Medical oncology
INTRODUÇÃO
As neoplasias do Sistema Nervoso Central (SNC) correspondem ao segundo tipo mais frequente de câncer descrito em crianças e adolescentes.11. Li J, Thompson TD, Miller JW, Pollack LA, Stewart SL. Cancer incidence among children and adolescents in the United States, 2001-2003. Pediatrics. 2008;121:e1470-7. https://doi.org/10.1542/peds.2007-2964
https://doi.org/https://doi.org/10.1542/...
,22. Steliarova-Foucher E, Stiller C, Kaatsch P, Berrino F, Coebergh JW, Lacour B, et al. Geographical patterns and time trends of cancer incidence and survival among children and adolescents in Europe since the 1970s (the ACCISproject): an epidemiological study. Lancet. 2004;364:2097-105. https://doi.org/10.1016/s0140-6736(04)17550-8
https://doi.org/https://doi.org/10.1016/...
Os tumores do SNC representam a maior causa de mortalidade secundária ao câncer. Além disso, as sequelas causadas pelos tumores e pelos tratamentos aos quais as crianças são submetidas resultam em elevada morbidade.33. Chintagumpala MM, Paulino A, Panigraphy A, Hawkins C, Jae A, Parsons DW. Embryonal and pineal region tumors. In: Pizzo PA, Poplack MD, editors. Principles and practice of pediatric oncology. 7th ed. Philadelphia: WoltersKlumer; 2016. p.671-99.,44. Stiller CA, Nectoux J. International incidence of childhood brain and spinal tumours. Int J Epidemiol. 1994;23:458-64. https://doi.org/10.1093/ije/23.3.458
https://doi.org/https://doi.org/10.1093/...
,55. Mulhern RK, Merchant TE, Gajjar A, Reddick WE, Kun LE. Late neurocognitive sequelae in survivors of brain tumours in childhood. Lancet Oncol. 2004;5:399-408. https://doi.org/10.1016/s1470-2045(04)01507-4
https://doi.org/https://doi.org/10.1016/...
O meduloblastoma, tumor neuroectodérmico primitivo originado no cerebelo, é um dos tumores cerebrais malignos mais comuns na infância, representando 20% dos tumores do SNC. É um tumor invasivo, classificado como grau IV pela Organização Mundial da Saúde (OMS),66. Louis DN, Ohgaki H, Wiestler OD, Cavenee WK, Burger PC, Jouvet A, et al. The 2007 WHO classification of tumours of the central nervous system. Acta Neuropathol. 2007;114:97-109. https://doi.org/10.1007/s00401-007-0243-4
https://doi.org/https://doi.org/10.1007/...
cujo prognóstico é especialmente desfavorável em crianças menores de três anos de idade. Em adultos, a incidência é baixa, de 0,5 a 1%.77. Giordana MT, Schiffer P, Lanotte M, Girardi P, Chio A. Epidemiology of adult medulloblastoma. Int J Cancer. 1999;80:689-92. https://doi.org/10.1002/(sici)1097-0215(19990301)80:5%3C689::aid-ijc10%3E3.0.co;2-g
https://doi.org/https://doi.org/10.1002/...
Os pacientes diagnosticados com meduloblastoma são estratificados de acordo com a idade, a extensão da ressecção tumoral e a presença de metástases. Pacientes maiores de três anos de idade com tumores completamente ressecados e sem metástases ao diagnóstico são classificados como de risco standard, enquanto todos os outros casos são classificados como de alto risco. Seguindo esta estratificação e com a moderna terapia multimodal, aproximadamente 70% das crianças com meduloblastoma sobreviverão até a idade adulta.88. Packer RJ, Rood BR, MacDonald TJ. Medulloblastoma: present concepts of stratification into risk groups. Pediatr Neurosurg. 2003;39:60-7. https://doi.org/10.1159/000071316
https://doi.org/https://doi.org/10.1159/...
,99. Eberhart CG, Kratz J, Wang Y, Summers K, Stearns D, Cohen K, et al. Histopathological and molecular prognostic markers in medulloblastoma: c-myc, Nmyc, TrkC, and anaplasia. J Neuropathol Exp Neurol. 2004;63:441-9. https://doi.org/10.1093/jnen/63.5.441
https://doi.org/https://doi.org/10.1093/...
,1010. Gajjar A, Hernan R, Kocak M, Fuller C, Lee Y, McKinnon PJ, et al. Clinical, histopathologic, and molecular markers of prognosis: toward a new disease risk stratification system for medulloblastoma. J Clin Oncol. 2004;22:984-93. https://doi.org/10.1200/jco.2004.06.032
https://doi.org/https://doi.org/10.1200/...
Apesar da relativa melhora na sobrevida dos pacientes, os efeitos colaterais endócrinos e sequelas neurocognitivas resultantes da terapia, particularmente em crianças abaixo de sete anos de idade, constituem um desafio no tratamento do meduloblastoma.55. Mulhern RK, Merchant TE, Gajjar A, Reddick WE, Kun LE. Late neurocognitive sequelae in survivors of brain tumours in childhood. Lancet Oncol. 2004;5:399-408. https://doi.org/10.1016/s1470-2045(04)01507-4
https://doi.org/https://doi.org/10.1016/...
No ano de 2016, a OMS atualizou a Classificação de Tumores do SNC, passando a incluir as seguintes entidades moleculares do meduloblastoma: tumores wingless (WNT), tumores sonic hedgehog (SHH) sem mutação do TP53, tumores SHH com mutação do TP53 e tumores não WNT/não SHH.1111. Louis DN, Perry A, Reifenberger G, Deimling A, Figarella-Branger D, Cavenee WK, et al. The 2016 World Health Organization classification of tumors of the central nervous system: a summary. Acta Neuropathol. 2016;131:803-20. https://doi.org/10.1007/s00401-016-1545-1
https://doi.org/https://doi.org/10.1007/...
O uso da classificação molecular do meduloblastoma deve ajudar a direcionar a estratificação do risco nos futuros protocolos terapêuticos. Pacientes com bom prognóstico (subtipo WNT) devem ser considerados em protocolos com redução da terapia, enquanto aqueles com pior prognóstico (subtipo não WNT/não SHH) devem ser priorizados em terapias experimentais.1212. Ramaswamy V, Northcott PA, Taylor MD. FISH and chips: the recipe for improved prognostication and outcomes for children with medulloblastoma. Cancer Genet. 2011;204:577-88. https://doi.org/10.1016/j.cancergen.2011.11.001
https://doi.org/https://doi.org/10.1016/...
Com a introdução da nova classificação OMS, a estratificação e os novos protocolos terapêuticos baseados em dados moleculares, será possível delinear abordagens mais eficientes para preencher as lacunas do tratamento do meduloblastoma, e para isso é importante avaliarmos os resultados atuais dos pacientes tratados em um centro brasileiro especializado em onco-hematologia pediátrica. O presente estudo objetiva descrever as características clínicas, demográficas, anatomopatológicas, moleculares e a sobrevida de pacientes portadores de meduloblastoma.
MÉTODO
No período do estudo, entre janeiro de 2002 e dezembro de 2017, foram admitidos 4.519 casos oncológicos novos para tratamento em uma única instituição especializada em onco-hematologia pediátrica localizada em Campinas, São Paulo. Deles, 712 (15%) corresponderam a tumores do SNC e, entre esses 712, 120 (2,7% do total; 17% dos tumores do SNC) tiveram diagnóstico de meduloblastoma. Dos 120 pacientes com meduloblastoma, 14 (11,7%) foram excluídos da análise, quatro em razão de perda de seguimento e 10 porque realizaram terapia em outras instituições.
Este foi um estudo de coorte retrospectivo, no qual as informações foram obtidas pela revisão dos prontuários médicos. Os seguintes dados foram coletados: data de nascimento, sexo, idade ao diagnóstico, data do diagnóstico, sintomas, tempo entre a apresentação dos sinais e sintomas e o diagnóstico, cirurgia, histologia, perfil molecular, estadiamento, metástases, radioterapia, quimioterapia, dados de imagem, data da última consulta, status clínico atual, recidiva, sequelas e término da terapia.
A idade dos pacientes foi categorizada em três grupos de importância clínica: crianças menores de três anos de idade (<3); crianças com idade entre ≥3 anos e ≤16 anos; jovens e adultos com mais de 16 anos de idade (>16). Idade e presença ou ausência de metástases foram avaliadas no momento do diagnóstico.
Os tumores foram classificados histologicamente como: clássico, desmoplásico e anaplásico/grandes células (A/GC).66. Louis DN, Ohgaki H, Wiestler OD, Cavenee WK, Burger PC, Jouvet A, et al. The 2007 WHO classification of tumours of the central nervous system. Acta Neuropathol. 2007;114:97-109. https://doi.org/10.1007/s00401-007-0243-4
https://doi.org/https://doi.org/10.1007/...
O grau de ressecção cirúrgica foi categorizado em três grupos: total (ressecção completa ou menos de 1,5 cm2 de tumor residual), parcial (igual ou mais de 1,5 cm2 de tumor residual) e apenas biópsia. A análise quantitativa de remanescente tumoral foi realizada por meio de ressonância magnética (RNM) ou tomografia computadorizada (TC) de encéfalo após a cirurgia.
Os casos foram estratificados em dois grupos de risco:
-
“risco standard”: pacientes com ≥3 anos de idade, com tumores totalmente ressecados e sem doença metastática.
-
“alto risco”: demais casos.
Nos casos em que se realizou avaliação molecular, os tumores foram categorizados em três subgrupos, considerando-se o critério da OMS (2016): WNT, SHH e não WNT/não SHH.1111. Louis DN, Perry A, Reifenberger G, Deimling A, Figarella-Branger D, Cavenee WK, et al. The 2016 World Health Organization classification of tumors of the central nervous system: a summary. Acta Neuropathol. 2016;131:803-20. https://doi.org/10.1007/s00401-016-1545-1
https://doi.org/https://doi.org/10.1007/...
A determinação dos subtipos moleculares foi realizada por exame de reação em cadeia da polimerase (PCR) quantitativo para análise da expressão de genes diferencialmente expressos em cada grupo.
Na análise estatística, para as variáveis qualitativas, calcularam-se as frequências e porcentagens. Foi testada a associação entre variáveis qualitativas pelo teste exato de Fisher. Para a análise de sobrevida global, consideraram-se como data inicial a do diagnóstico e como data final a do óbito ou da última informação obtida em avaliação em janeiro de 2019. Para a análise de sobrevida livre de eventos, foi adotada como data inicial a do diagnóstico e como data final a da recidiva ou a do óbito, o que tivesse ocorrido primeiramente. A recidiva foi definida como o reaparecimento de lesão tumoral visualizada no exame de imagem no local do tumor original ou em qualquer outro local ou a presença de células neoplásicas no liquor. Análises de sobrevida global e sobrevida livre de eventos foram conduzidas por intermédio de curvas de Kaplan-Meier, e a comparação entre as curvas foi feita pelo teste log-rank. Para todas as análises, considerou-se o nível de significância de 5% e utilizou-se o software IBM SPSS Statistics, versão 25.
A pesquisa foi aprovada pelo Comitê de Ética em Pesquisa do Centro Infantil Boldrini (CIB) (Certificado de Apresentação para Apreciação Ética [CAAE] nº 51995415.5.5.0000.5376). Foram obtidas as assinaturas do termo de consentimento livre e esclarecido dos responsáveis pelos pacientes que continuam em seguimento e solicitou-se, para o Comitê de Ética em Pesquisa, a dispensa da sua aplicação para aqueles que faleceram ou não fazem mais acompanhamento no serviço, a qual foi concedida.
RESULTADOS
Entre os 106 pacientes analisados, 70 (66%) eram do sexo masculino e 36 (34%) do feminino, na razão masculino: feminino de 1,94:1. A idade ao diagnóstico variou de dois meses e dois dias a 22 anos e um mês com média de sete anos e quatro meses e mediana de sete anos. O tempo entre o surgimento dos sintomas e o diagnóstico variou de três dias a três anos e teve média de 3,2 meses e mediana de dois meses. Os sinais e sintomas observados com maior frequência foram vômitos (80,8%), cefaleia (75,8%) e déficit motor (58,3%).
Ao longo de todo o período do estudo, os pacientes receberam o mesmo protocolo de tratamento. Aqueles com doença risco standard receberam quimioterapia e radioterapia em todo o cérebro e coluna com 23,4 Gy, com boost na fossa posterior de 30,6 Gy. Os pacientes de alto risco com três anos de idade ou mais receberam quimioterapia e radioterapia em neuro eixo com 36 Gy, com boost na fossa posterior de 18 Gy; e aqueles de alto risco com menos de três anos de idade apenas realizaram quimioterapia. Toda a quimioterapia foi baseada em protocolos, com o uso dos seguintes fármacos: cisplatina/carboplatina, vincristina, ifosfamida/ciclofosfamida e etoposide.
Vinte e quatro pacientes não apresentaram sequelas relacionadas ao tratamento; os demais apresentaram pelo menos uma sequela, sendo os déficits motores/ataxia e alterações endócrinas as mais frequentes. Não se evidenciaram segundas neoplasias. As características gerais dos pacientes são apresentadas na Tabela 1.
Características clínicas e demográficas de pacientes pediátricos portadores de meduloblastoma de um centro de referência brasileiro (n=106), Campinas, São Paulo.
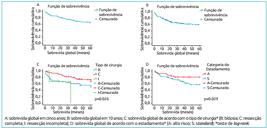
A frequência dos sexos masculino e feminino nos pacientes com idade igual ou maior de três anos apresentou relação de 1,67:1. No entanto, entre os pacientes abaixo de três anos, a relação foi de 6,5:1 (p=0,117). Houve predomínio da forma clássica na faixa etária de três a 16 anos, e da desmoplásica em menores de três anos (p=0,021). Nenhum dos quatro pacientes com mais de 16 anos apresentou metástases, enquanto 4/15 menores de três anos e 38/87 entre três e 16 anos eram metastáticos (p=0,109). Não houve associação estatística entre a incidência de recidiva e a faixa etária (p=1).
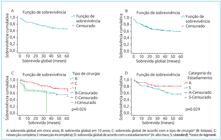
Os pacientes incluídos no estudo foram acompanhados em média por 45,9 meses, com amplitude de dois dias a 238 meses. A taxa de sobrevida global em cinco anos correspondeu a 67,9% (Figura 1A) e, em 10 anos, a 64,2% (Figura 1B). A Figura 1C representa a comparação da sobrevida global dos pacientes de acordo com o tipo de cirurgia a que foram submetidos. A sobrevida global dos pacientes estratificados em cada um dos grupos de risco está representada na Figura 1D. Pacientes estratificados de como alto risco e aqueles submetidos a apenas biópsia tumoral apresentaram sobrevida global em cinco anos mais desfavorável em relação aos demais (Figuras 1C e 1D). A sobrevida livre de eventos em cinco anos correspondeu a 60,4% e, em 10 anos, a 57,5%. A associação entre as variáveis demográficas e clínicas com a sobrevida global e livre de eventos está representada na Tabela 2.
Entre os 106 pacientes analisados, 28 (26,4%) apresentaram recidiva da doença, dos quais nove pertenciam ao grupo standard. Dos 28 casos recidivados, 22 evoluíram para óbito por doença, um paciente estava vivo com doença e cinco estavam vivos sem doença, resultando na sobrevida global em cinco anos de 21,4%. Na Figura 2, está representada a comparação da sobrevida global em cinco anos dos pacientes que recidivaram com a dos que não recidivaram (p<0,001). A presença de metástase ao diagnóstico se mostrou estatisticamente associada à ocorrência de recidiva da doença no grupo analisado (p=0,049).
Curva de sobrevida global dos pacientes com meduloblastoma de acordo com a presença (SIM; n=28) ou ausência de recidiva (NÃO; n=78).
Apenas 49 dos 106 casos de meduloblastoma analisados tiveram seu perfil molecular determinado. O subgrupo não WNT/não SHH constituiu-se no maior grupo, com 49% (24/49) dos casos, seguido pelo SHH com 34,7% (17/49) deles. O grupo WNT foi composto de 16,3% (8/49) dos casos e constituiu o menor subgrupo. Quanto à estratificação, 75% dos não WNT/não SHH e 68,8% dos SHH foram considerados de alto risco, enquanto 62,5% dos WNT foram estratificados como de risco standard. A integração dos dados moleculares com variáveis demográficas e clínicas está demonstrada na Tabela 3, bem como as análises de sobrevida global e livre de eventos.
Sete dos 49 pacientes apresentaram mutação no gene TP53. A presença de mutações nesse gene não se mostrou associada ao prognóstico dos pacientes durante o tempo de seguimento do estudo. A sobrevida global em cinco anos observada no grupo com mutação de TP53 foi de 57%, versus 61% no grupo sem mutação (p=0,408).
DISCUSSÃO
O presente estudo analisou 106 casos de meduloblastoma tratados em uma única instituição especializada em onco-hematologia pediátrica na cidade de Campinas, São Paulo. As características clínicas, demográficas, anatomopatológicas e moleculares dos pacientes com meduloblastoma descritas no presente estudo foram majoritariamente semelhantes às descritas na literatura.
A frequência do meduloblastoma na casuística analisada foi maior nas crianças entre três e 16 anos de idade (87 casos), com pico entre sete e nove anos de idade. Entre os 106 casos, 96,2% ocorreram antes dos 16 anos de idade, frequência maior do que a descrita em estudos da OMS.66. Louis DN, Ohgaki H, Wiestler OD, Cavenee WK, Burger PC, Jouvet A, et al. The 2007 WHO classification of tumours of the central nervous system. Acta Neuropathol. 2007;114:97-109. https://doi.org/10.1007/s00401-007-0243-4
https://doi.org/https://doi.org/10.1007/...
,1313. Giangaspero F, Eberhart CG, Haapasalo H, Pietsch T, Wiestler OD, Ellison DW. Medulloblastoma. In: Louis DN, Ohgaki H, Wiestler OD, Cavenee WK, editors. WHO classification of tumours of the central nervous system. Lyon: International Agency for Research on Cancer; 2007. p.132-40.
A relação entre os sexos masculino e feminino foi de 1,94:1, concordando com achados demográficos observados em outras séries de pacientes com meduloblastoma pediátrico e com dados da OMS66. Louis DN, Ohgaki H, Wiestler OD, Cavenee WK, Burger PC, Jouvet A, et al. The 2007 WHO classification of tumours of the central nervous system. Acta Neuropathol. 2007;114:97-109. https://doi.org/10.1007/s00401-007-0243-4
https://doi.org/https://doi.org/10.1007/...
,1414. Kool M, Korshunov A, Remke M, Jones DT, Schlanstein M, Northcott PA, et al. Molecular subgroups of medulloblastoma: an international meta-analysis of transcriptome, genetic aberrations, and clinical data of WNT, SHH, Group 3, and Group 4 medulloblastomas. Acta Neuropathol. 2012;123:473-84. https://doi.org/10.1007/s00401-012-0958-8
https://doi.org/https://doi.org/10.1007/...
,1515. Northcott PA, Korshunov A, Witt H, Hielscher T, Eberhart CG, Mack S, et al. Medulloblastoma comprises four distinct molecular variants. J Clin Oncol. 2011;29:1408-14. https://doi.org/10.1200/jco.2009.27.4324
https://doi.org/https://doi.org/10.1200/...
No entanto, em menores de três anos, a relação foi de 6,5:1. Essa diferença não foi significativa quando comparada com a distribuição entre os sexos nas outras faixas etárias.
A presença de tumor residual no pós-operatório é um importante fator prognóstico.88. Packer RJ, Rood BR, MacDonald TJ. Medulloblastoma: present concepts of stratification into risk groups. Pediatr Neurosurg. 2003;39:60-7. https://doi.org/10.1159/000071316
https://doi.org/https://doi.org/10.1159/...
Dados concordantes com a literatura foram encontrados em nosso estudo, no qual o grupo submetido a ressecção tumoral completa apresentou melhor sobrevida, o que destaca a importância da ressecção cirúrgica segura e especializada para o desfecho clínico do paciente oncológico.
A classificação de tumores cerebrais da OMS divide o meduloblastoma, com base em critérios histopatológicos, nas formas clássica (mais frequente), desmoplásica e A/GC.1111. Louis DN, Perry A, Reifenberger G, Deimling A, Figarella-Branger D, Cavenee WK, et al. The 2016 World Health Organization classification of tumors of the central nervous system: a summary. Acta Neuropathol. 2016;131:803-20. https://doi.org/10.1007/s00401-016-1545-1
https://doi.org/https://doi.org/10.1007/...
,1313. Giangaspero F, Eberhart CG, Haapasalo H, Pietsch T, Wiestler OD, Ellison DW. Medulloblastoma. In: Louis DN, Ohgaki H, Wiestler OD, Cavenee WK, editors. WHO classification of tumours of the central nervous system. Lyon: International Agency for Research on Cancer; 2007. p.132-40.,1616. Bouffet E, Frappaz D, Carrie C, Freycon F, Brunat-Mentigny M. Medulloblastoma. Pediatrie. 1991;46:71-8.,1717. Rutkowski S, Bueren A, von Hoff K, Hartmann W, Shalaby T, Deinlein F, et al. Prognostic relevance of clinical and biological risk factors in childhood medulloblastoma: results of patients treated in the prospective multicenter trial HIT’91. Clin Cancer Res. 2007;13:2651-7. https://doi.org/10.1158/1078-0432.ccr-06-1779
https://doi.org/https://doi.org/10.1158/...
,1818. Ellison DW, Kocak M, Dalton J, Megahed H, Lusher ME, Ryan SL, et al. Definition of disease-risk stratification groups in childhood medulloblastoma using combined clinical, pathologic, and molecular variables. J Clin Oncol. 2011;29:1400-7. https://doi.org/10.1200/jco.2010.30.2810
https://doi.org/https://doi.org/10.1200/...
Na casuística avaliada, o tumor clássico foi o mais frequente (63,2%), seguido pelo desmoplásico (27,3%) e pelo A/GC (9,5%). Em comparação com a maioria dos estudos publicados, a frequência dos tumores desmoplásicos e A/GC foi maior no presente estudo, uma vez que, na literatura, são descritas frequências de 20 e 5%, respectivamente.1919. Kim W, Choy W, Dye J, Nagasawa D, Safaee M, Fong B, et al. The tumor biology and molecular characteristics of medulloblastoma identifying prognostic factors associated with survival outcomes and prognosis. J Clin Neurosci. 2011;18:886-90. https://doi.org/10.1016/j.jocn.2011.01.001
https://doi.org/https://doi.org/10.1016/...
Dados da literatura referem que os pacientes com tumor desmoplásico apresentam melhor prognóstico e os com A/GC, o pior.1717. Rutkowski S, Bueren A, von Hoff K, Hartmann W, Shalaby T, Deinlein F, et al. Prognostic relevance of clinical and biological risk factors in childhood medulloblastoma: results of patients treated in the prospective multicenter trial HIT’91. Clin Cancer Res. 2007;13:2651-7. https://doi.org/10.1158/1078-0432.ccr-06-1779
https://doi.org/https://doi.org/10.1158/...
,2020. Ellison DW, Dalton J, Kocak M, Nicholson SL, Fraga C, Neale G, et al. Medulloblastoma: clinicopathological correlates of SHH, WNT, and non-SHH/WNT molecular subgroups. Acta Neuropathol. 2011;121:381-96. https://doi.org/10.1007/s00401-011-0800-8
https://doi.org/https://doi.org/10.1007/...
Neste estudo, a forma do tumor desmoplásico apresentou a maior sobrevida global (86,2%) e a forma A/GC a menor (60%). Embora essas diferenças sejam importantes, não encontramos significância estatística. Em menores de três anos, houve apenas um caso de A/GC. A maioria dos casos desmoplásicos compreendiam menores de 16 anos de idade, corroborando as sugestões prévias de que meduloblastomas desmoplásicos são mais comuns em lactentes e crianças mais novas.2121. Ellison DW. Childhood medulloblastoma: novel approaches to the classification of a heterogeneous disease. Acta Neuropathol. 2010;120:305-16. https://doi.org/10.1007/s00401-010-0726-6
https://doi.org/https://doi.org/10.1007/...
A sobrevida global para as crianças menores de três anos foi a pior de todas (60%). Isso pode ser explicado pelo fato de que crianças dessa faixa etária são consideradas de “alto risco” e esse grupo de risco apresentou prognóstico pior comparado ao de risco standard. Nessas crianças, a imaturidade do SNC é fator impeditivo para que recebam a mesma dose de radioterapia oferecida às maiores, por causa do maior risco de sequelas neurológicas, endócrinas e psicossociais. Tomados em conjunto, os dados sugerem que o tratamento proposto para crianças com menos de três anos de idade pode ser desproporcional à agressividade da neoplasia, o que explicaria a menor sobrevida.1717. Rutkowski S, Bueren A, von Hoff K, Hartmann W, Shalaby T, Deinlein F, et al. Prognostic relevance of clinical and biological risk factors in childhood medulloblastoma: results of patients treated in the prospective multicenter trial HIT’91. Clin Cancer Res. 2007;13:2651-7. https://doi.org/10.1158/1078-0432.ccr-06-1779
https://doi.org/https://doi.org/10.1158/...
Cada componente do tratamento pode causar complicações tardias que têm efeito profundo na qualidade de vida e na longevidade dos sobreviventes do meduloblastoma.1818. Ellison DW, Kocak M, Dalton J, Megahed H, Lusher ME, Ryan SL, et al. Definition of disease-risk stratification groups in childhood medulloblastoma using combined clinical, pathologic, and molecular variables. J Clin Oncol. 2011;29:1400-7. https://doi.org/10.1200/jco.2010.30.2810
https://doi.org/https://doi.org/10.1200/...
Embora os efeitos tardios do tratamento na qualidade de vida sejam frequentemente atribuídos à irradiação cranioespinhal, a quimioterapia tem papel significativo no agravamento dos efeitos adversos da radioterapia.2222. Grill J, Sainte-Rose C, Jouvet A, Gentet JC, Lejars O, Frappaz D, et al. Treatment of medulloblastoma with postoperative chemotherapy alone: an SFOP prospective trial in young children. Lancet Oncol. 2005;6:573-80. https://doi.org/10.1016/s1470-2045(05)70252-7
https://doi.org/https://doi.org/10.1016/...
,2323. Bull KS, Spoudeas HA, Yadegarfar G, Kennedy CR, CCLG. Reduction of health status 7 years after addition of chemotherapy to craniospinal irradiation for medulloblastoma: a follow-up study in PNET 3 trial survivors on behalf of the CCLG (formerly UKCCSG). J Clin Oncol. 2007;25:4239-45. https://doi.org/10.1200/jco.2006.08.7684
https://doi.org/https://doi.org/10.1200/...
Os principais efeitos tardios são: comprometimento neurocognitivo, alterações motoras, anormalidades endócrinas e segundas malignidades. Sequelas semelhantes foram encontradas na nossa casuística, com exceção de segundas neoplasias.
Um terço dos meduloblastomas pode metastatizar para qualquer região do SNC seguindo as vias do liquor.88. Packer RJ, Rood BR, MacDonald TJ. Medulloblastoma: present concepts of stratification into risk groups. Pediatr Neurosurg. 2003;39:60-7. https://doi.org/10.1159/000071316
https://doi.org/https://doi.org/10.1159/...
,2424. Miralbell R, Bieri S, Huguenin P, Feldges A, Morin AM, Garcia E, et al. Prognostic value of cerebrospinal fluid cytology in pediatric medulloblastoma. Swiss Pediatric Oncology Group. Ann Oncol. 1999;10:239-41. https://doi.org/10.1023/a:1008363422189
https://doi.org/https://doi.org/10.1023/...
Na nossa casuística, 42 (39,63%) pacientes tinham metástases ao diagnóstico, e conforme esperado a presença de metástase se mostrou associada à tendência de pior evolução clínica, pois a sobrevida em cinco anos foi de 59,5%, enquanto a dos não portadores de metástases foi de 73,4%, apesar de não termos encontrado significância estatística. A presença/ausência de metástase ao diagnóstico se mostrou um fator importante associado à ocorrência de recidiva da doença.
O atual esquema de estratificação do risco é baseado em variáveis como idade, extensão da ressecção tumoral e presença de metástases, e esta apresentou relevante correlação com a sobrevida global e a sobrevida livre de eventos dos pacientes com meduloblastoma. Contudo, cabe destacar que 21% (9/42) dos pacientes classificados como de risco standard apresentaram recidiva da doença. Esse achado sugere que o atual esquema de estratificação não prevê adequadamente a variabilidade do prognóstico nos pacientes alocados em cada um dos grupos. Muitas crianças classificadas como de risco standard e com prognóstico favorável podem atualmente estar sendo tratadas em excesso. É o caso dos pacientes com tumor do subtipo molecular WNT, que apresenta bom desfecho clínico e raramente metastatiza. Por outro lado, pacientes que recaem nesse grupo podem estar sendo subtratados. Por essa razão, o uso da classificação molecular do meduloblastoma é fundamental para direcionar a estratificação do risco nos futuros protocolos terapêuticos. Pacientes com bom prognóstico (subtipo WNT) devem ser considerados em protocolos com redução da terapia, enquanto aqueles com pior prognóstico (subtipo não WNT/não SHH) devem ser priorizados em terapias experimentais.1212. Ramaswamy V, Northcott PA, Taylor MD. FISH and chips: the recipe for improved prognostication and outcomes for children with medulloblastoma. Cancer Genet. 2011;204:577-88. https://doi.org/10.1016/j.cancergen.2011.11.001
https://doi.org/https://doi.org/10.1016/...
Dos 49 casos em que foi possível a determinação do subtipo molecular, oito foram classificados como pertencendo ao subgrupo WNT (16,3%), 17 ao SHH (34,7%) e 24 ao não WNT/não SHH (49%). As frequências absolutas que encontramos entre os subgrupos foram diferentes das descritas na literatura, porém a distribuição da proporção entre os casos é similar, sendo os tumores não WNT/não SHH os mais frequentes, seguidos pelo SHH e pelo WNT.1515. Northcott PA, Korshunov A, Witt H, Hielscher T, Eberhart CG, Mack S, et al. Medulloblastoma comprises four distinct molecular variants. J Clin Oncol. 2011;29:1408-14. https://doi.org/10.1200/jco.2009.27.4324
https://doi.org/https://doi.org/10.1200/...
,2525. Taylor MD, Northcott PA, Korshunov A, Remke M, Cho YJ, Clifford SC, et al. Molecular subgroups of medulloblastoma: the current consensus. Acta Neuropathol. 2012;123:465-72. https://doi.org/10.1007/s00401-011-0922-z
https://doi.org/https://doi.org/10.1007/...
Os dados obtidos mostraram que o comportamento clínico e demográfico do grupo WNT é bastante similar ao observado em outras séries de pacientes, em que se verificam bom prognóstico e razão masculino:feminino de 1:1. O grupo SHH teve incidência de 34,7%, comparado aos 28% descritos na literatura. Também no grupo SHH houve alta proporção masculino:feminino (3,2:1), quando comparada com a de outros estudos.1515. Northcott PA, Korshunov A, Witt H, Hielscher T, Eberhart CG, Mack S, et al. Medulloblastoma comprises four distinct molecular variants. J Clin Oncol. 2011;29:1408-14. https://doi.org/10.1200/jco.2009.27.4324
https://doi.org/https://doi.org/10.1200/...
,2525. Taylor MD, Northcott PA, Korshunov A, Remke M, Cho YJ, Clifford SC, et al. Molecular subgroups of medulloblastoma: the current consensus. Acta Neuropathol. 2012;123:465-72. https://doi.org/10.1007/s00401-011-0922-z
https://doi.org/https://doi.org/10.1007/...
,2626. Kool M, Koster J, Bunt J, Hasselt NE, Lakeman A, van Sluis P, et al. Integrated genomics identifies five medulloblastoma subtypes with distinct genetic profiles, pathway signatures and clinicopathological features. PLoS One. 2008;3:e3088. https://doi.org/10.1371/journal.pone.0003088
https://doi.org/https://doi.org/10.1371/...
Essas diferenças podem ser explicadas pela casuística relativamente pequena e, portanto, seria importante ampliar o número de pacientes classificados pelo seu perfil molecular. Para fins de comparação, analisamos conjuntamente os resultados do presente estudo com os apresentados em uma metanálise internacional que incluiu 550 pacientes de sete estudos independentes1414. Kool M, Korshunov A, Remke M, Jones DT, Schlanstein M, Northcott PA, et al. Molecular subgroups of medulloblastoma: an international meta-analysis of transcriptome, genetic aberrations, and clinical data of WNT, SHH, Group 3, and Group 4 medulloblastomas. Acta Neuropathol. 2012;123:473-84. https://doi.org/10.1007/s00401-012-0958-8
https://doi.org/https://doi.org/10.1007/...
e com o atual consenso dos subgrupos moleculares do meduloblastoma.2525. Taylor MD, Northcott PA, Korshunov A, Remke M, Cho YJ, Clifford SC, et al. Molecular subgroups of medulloblastoma: the current consensus. Acta Neuropathol. 2012;123:465-72. https://doi.org/10.1007/s00401-011-0922-z
https://doi.org/https://doi.org/10.1007/...
A Tabela 4 apresenta um resumo comparativo desses estudos quanto às frequências estimadas para cada subtipo, bem como as variáveis demográficas, histológicas e clínicas descritas para cada um deles.
Mutações no gene TP53 são descritas em aproximadamente 10% dos pacientes com meduloblastoma.1414. Kool M, Korshunov A, Remke M, Jones DT, Schlanstein M, Northcott PA, et al. Molecular subgroups of medulloblastoma: an international meta-analysis of transcriptome, genetic aberrations, and clinical data of WNT, SHH, Group 3, and Group 4 medulloblastomas. Acta Neuropathol. 2012;123:473-84. https://doi.org/10.1007/s00401-012-0958-8
https://doi.org/https://doi.org/10.1007/...
Na presente pesquisa, identificamos 14% dos pacientes analisados com mutações nesse gene (n=7/49). A presença dessas mutações não se mostrou associada à tendência de pior evolução clínica, em oposição ao descrito em outras séries de pacientes na literatura. Entretanto, cabe ressaltar que o número de pacientes com mutação é pequeno (n=7) e, portanto, seria relevante o aumento no número de casos avaliados para se obterem informações mais conclusivas.
Como o meduloblastoma é uma doença relativamente rara, o estudo de uma coorte com 106 pacientes tratados apenas em uma instituição é muito relevante, porém insuficiente para determinadas análises comparativas, destacando-se a necessidade de estudos multicêntricos. As características clínicas, demográficas, anatomopatológicas e moleculares dos pacientes pediátricos com meduloblastoma descritas no presente estudo foram majoritariamente semelhantes às apresentadas na literatura. Essas informações e a contínua busca da validação das evidências globais com respeito aos problemas locais viabiliza a participação de instituições brasileiras em protocolos multicêntricos internacionais para o tratamento do meduloblastoma, o que pode melhorar significativamente os resultados clínicos alcançados.2727. Kravitz RL, Duan N, Braslow J. Evidence-based medicine, heterogeneity of treatment effects, and the trouble with averages. Milbank Q. 2004;82:661-87. https://doi.org/10.1111/j.0887-378x.2004.00327.x
https://doi.org/https://doi.org/10.1111/...
O conhecimento sistemático da biologia molecular do meduloblastoma é de grande importância, pois possibilitará o surgimento de novas modalidades terapêuticas personalizadas que objetivem alvos moleculares, visando ao aumento da sobrevida e à redução das morbidades relacionadas ao tratamento.
REFERENCES
-
1Li J, Thompson TD, Miller JW, Pollack LA, Stewart SL. Cancer incidence among children and adolescents in the United States, 2001-2003. Pediatrics. 2008;121:e1470-7. https://doi.org/10.1542/peds.2007-2964
» https://doi.org/https://doi.org/10.1542/peds.2007-2964 -
2Steliarova-Foucher E, Stiller C, Kaatsch P, Berrino F, Coebergh JW, Lacour B, et al. Geographical patterns and time trends of cancer incidence and survival among children and adolescents in Europe since the 1970s (the ACCISproject): an epidemiological study. Lancet. 2004;364:2097-105. https://doi.org/10.1016/s0140-6736(04)17550-8
» https://doi.org/https://doi.org/10.1016/s0140-6736(04)17550-8 -
3Chintagumpala MM, Paulino A, Panigraphy A, Hawkins C, Jae A, Parsons DW. Embryonal and pineal region tumors. In: Pizzo PA, Poplack MD, editors. Principles and practice of pediatric oncology. 7th ed. Philadelphia: WoltersKlumer; 2016. p.671-99.
-
4Stiller CA, Nectoux J. International incidence of childhood brain and spinal tumours. Int J Epidemiol. 1994;23:458-64. https://doi.org/10.1093/ije/23.3.458
» https://doi.org/https://doi.org/10.1093/ije/23.3.458 -
5Mulhern RK, Merchant TE, Gajjar A, Reddick WE, Kun LE. Late neurocognitive sequelae in survivors of brain tumours in childhood. Lancet Oncol. 2004;5:399-408. https://doi.org/10.1016/s1470-2045(04)01507-4
» https://doi.org/https://doi.org/10.1016/s1470-2045(04)01507-4 -
6Louis DN, Ohgaki H, Wiestler OD, Cavenee WK, Burger PC, Jouvet A, et al. The 2007 WHO classification of tumours of the central nervous system. Acta Neuropathol. 2007;114:97-109. https://doi.org/10.1007/s00401-007-0243-4
» https://doi.org/https://doi.org/10.1007/s00401-007-0243-4 -
7Giordana MT, Schiffer P, Lanotte M, Girardi P, Chio A. Epidemiology of adult medulloblastoma. Int J Cancer. 1999;80:689-92. https://doi.org/10.1002/(sici)1097-0215(19990301)80:5%3C689::aid-ijc10%3E3.0.co;2-g
» https://doi.org/https://doi.org/10.1002/(sici)1097-0215(19990301)80:5%3C689::aid-ijc10%3E3.0.co;2-g -
8Packer RJ, Rood BR, MacDonald TJ. Medulloblastoma: present concepts of stratification into risk groups. Pediatr Neurosurg. 2003;39:60-7. https://doi.org/10.1159/000071316
» https://doi.org/https://doi.org/10.1159/000071316 -
9Eberhart CG, Kratz J, Wang Y, Summers K, Stearns D, Cohen K, et al. Histopathological and molecular prognostic markers in medulloblastoma: c-myc, Nmyc, TrkC, and anaplasia. J Neuropathol Exp Neurol. 2004;63:441-9. https://doi.org/10.1093/jnen/63.5.441
» https://doi.org/https://doi.org/10.1093/jnen/63.5.441 -
10Gajjar A, Hernan R, Kocak M, Fuller C, Lee Y, McKinnon PJ, et al. Clinical, histopathologic, and molecular markers of prognosis: toward a new disease risk stratification system for medulloblastoma. J Clin Oncol. 2004;22:984-93. https://doi.org/10.1200/jco.2004.06.032
» https://doi.org/https://doi.org/10.1200/jco.2004.06.032 -
11Louis DN, Perry A, Reifenberger G, Deimling A, Figarella-Branger D, Cavenee WK, et al. The 2016 World Health Organization classification of tumors of the central nervous system: a summary. Acta Neuropathol. 2016;131:803-20. https://doi.org/10.1007/s00401-016-1545-1
» https://doi.org/https://doi.org/10.1007/s00401-016-1545-1 -
12Ramaswamy V, Northcott PA, Taylor MD. FISH and chips: the recipe for improved prognostication and outcomes for children with medulloblastoma. Cancer Genet. 2011;204:577-88. https://doi.org/10.1016/j.cancergen.2011.11.001
» https://doi.org/https://doi.org/10.1016/j.cancergen.2011.11.001 -
13Giangaspero F, Eberhart CG, Haapasalo H, Pietsch T, Wiestler OD, Ellison DW. Medulloblastoma. In: Louis DN, Ohgaki H, Wiestler OD, Cavenee WK, editors. WHO classification of tumours of the central nervous system. Lyon: International Agency for Research on Cancer; 2007. p.132-40.
-
14Kool M, Korshunov A, Remke M, Jones DT, Schlanstein M, Northcott PA, et al. Molecular subgroups of medulloblastoma: an international meta-analysis of transcriptome, genetic aberrations, and clinical data of WNT, SHH, Group 3, and Group 4 medulloblastomas. Acta Neuropathol. 2012;123:473-84. https://doi.org/10.1007/s00401-012-0958-8
» https://doi.org/https://doi.org/10.1007/s00401-012-0958-8 -
15Northcott PA, Korshunov A, Witt H, Hielscher T, Eberhart CG, Mack S, et al. Medulloblastoma comprises four distinct molecular variants. J Clin Oncol. 2011;29:1408-14. https://doi.org/10.1200/jco.2009.27.4324
» https://doi.org/https://doi.org/10.1200/jco.2009.27.4324 -
16Bouffet E, Frappaz D, Carrie C, Freycon F, Brunat-Mentigny M. Medulloblastoma. Pediatrie. 1991;46:71-8.
-
17Rutkowski S, Bueren A, von Hoff K, Hartmann W, Shalaby T, Deinlein F, et al. Prognostic relevance of clinical and biological risk factors in childhood medulloblastoma: results of patients treated in the prospective multicenter trial HIT’91. Clin Cancer Res. 2007;13:2651-7. https://doi.org/10.1158/1078-0432.ccr-06-1779
» https://doi.org/https://doi.org/10.1158/1078-0432.ccr-06-1779 -
18Ellison DW, Kocak M, Dalton J, Megahed H, Lusher ME, Ryan SL, et al. Definition of disease-risk stratification groups in childhood medulloblastoma using combined clinical, pathologic, and molecular variables. J Clin Oncol. 2011;29:1400-7. https://doi.org/10.1200/jco.2010.30.2810
» https://doi.org/https://doi.org/10.1200/jco.2010.30.2810 -
19Kim W, Choy W, Dye J, Nagasawa D, Safaee M, Fong B, et al. The tumor biology and molecular characteristics of medulloblastoma identifying prognostic factors associated with survival outcomes and prognosis. J Clin Neurosci. 2011;18:886-90. https://doi.org/10.1016/j.jocn.2011.01.001
» https://doi.org/https://doi.org/10.1016/j.jocn.2011.01.001 -
20Ellison DW, Dalton J, Kocak M, Nicholson SL, Fraga C, Neale G, et al. Medulloblastoma: clinicopathological correlates of SHH, WNT, and non-SHH/WNT molecular subgroups. Acta Neuropathol. 2011;121:381-96. https://doi.org/10.1007/s00401-011-0800-8
» https://doi.org/https://doi.org/10.1007/s00401-011-0800-8 -
21Ellison DW. Childhood medulloblastoma: novel approaches to the classification of a heterogeneous disease. Acta Neuropathol. 2010;120:305-16. https://doi.org/10.1007/s00401-010-0726-6
» https://doi.org/https://doi.org/10.1007/s00401-010-0726-6 -
22Grill J, Sainte-Rose C, Jouvet A, Gentet JC, Lejars O, Frappaz D, et al. Treatment of medulloblastoma with postoperative chemotherapy alone: an SFOP prospective trial in young children. Lancet Oncol. 2005;6:573-80. https://doi.org/10.1016/s1470-2045(05)70252-7
» https://doi.org/https://doi.org/10.1016/s1470-2045(05)70252-7 -
23Bull KS, Spoudeas HA, Yadegarfar G, Kennedy CR, CCLG. Reduction of health status 7 years after addition of chemotherapy to craniospinal irradiation for medulloblastoma: a follow-up study in PNET 3 trial survivors on behalf of the CCLG (formerly UKCCSG). J Clin Oncol. 2007;25:4239-45. https://doi.org/10.1200/jco.2006.08.7684
» https://doi.org/https://doi.org/10.1200/jco.2006.08.7684 -
24Miralbell R, Bieri S, Huguenin P, Feldges A, Morin AM, Garcia E, et al. Prognostic value of cerebrospinal fluid cytology in pediatric medulloblastoma. Swiss Pediatric Oncology Group. Ann Oncol. 1999;10:239-41. https://doi.org/10.1023/a:1008363422189
» https://doi.org/https://doi.org/10.1023/a:1008363422189 -
25Taylor MD, Northcott PA, Korshunov A, Remke M, Cho YJ, Clifford SC, et al. Molecular subgroups of medulloblastoma: the current consensus. Acta Neuropathol. 2012;123:465-72. https://doi.org/10.1007/s00401-011-0922-z
» https://doi.org/https://doi.org/10.1007/s00401-011-0922-z -
26Kool M, Koster J, Bunt J, Hasselt NE, Lakeman A, van Sluis P, et al. Integrated genomics identifies five medulloblastoma subtypes with distinct genetic profiles, pathway signatures and clinicopathological features. PLoS One. 2008;3:e3088. https://doi.org/10.1371/journal.pone.0003088
» https://doi.org/https://doi.org/10.1371/journal.pone.0003088 -
27Kravitz RL, Duan N, Braslow J. Evidence-based medicine, heterogeneity of treatment effects, and the trouble with averages. Milbank Q. 2004;82:661-87. https://doi.org/10.1111/j.0887-378x.2004.00327.x
» https://doi.org/https://doi.org/10.1111/j.0887-378x.2004.00327.x
Financiamento
-
Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), Brasil, Processo nº 456077/2014-6.
-
ERRATA
http://dx.doi.org/10.1590/1984-0462/2021/39/2019298erratumNo artigo “Achados clínicos, demográficos, anatomopatológicos e moleculares de portadores de meduloblastoma tratados em uma única instituição”, DOI: http://dx.doi.org/10.1590/1984-0462/2021/39/2019298, publicado no periódico Rev. Paul. pediatr. [Internet]. 2020;39:e2019298. Epub November 11, na página 4.Onde se lia:Leia-se:
Datas de Publicação
-
Publicação nesta coleção
16 Nov 2020 -
Data do Fascículo
2021
Histórico
-
Recebido
21 Ago 2019 -
Aceito
15 Nov 2019 -
Publicado
11 Nov 2020




 Thumbnail
Thumbnail
 Thumbnail
Thumbnail





