Resumos
Avaliou-se o efeito de concentrações crescentes de Cu no crescimento, teores e translocação de metais pesados e nutrientes no eucalipto em solução nutritiva. Mudas de Eucalyptus maculata e Eucalyptus urophylla foram crescidas em vasos de 2L contendo solução nutritiva de Clark, adicionando-se 0, 32, 64, 128 e 192 m M de Cu fornecido como CuSO4. Após cinco semanas de exposição aos tratamentos, as plantas exibiram sintomas típicos de toxidez de Cu como manchas aquosas foliares, clorose e necrose internerval, além do escurecimento das raízes e inibição do crescimento mesmo nas menores concentrações do elemento. A concentração crítica de Cu na solução para reduzir em 10% a matéria seca da parte aérea foi de 8,3 miM e 3,3 miM para E. urophylla e E. maculata, respectivamente. O nível crítico de toxidez na matéria seca da parte aérea foi muito baixo, entre 12 e 13 mg Kg-1 para ambas espécies. E. urophylla mostrou-se menos sensível do que E. maculata, sendo isso relacionado à capacidade dessa em restringir a translocação do Cu das raízes para a parte aérea. Além disso, E. urophylla absorveu mais Fe na presença do excesso de Cu. A translocação de Fe das raízes para a parte aérea foi reduzida, independentemente da espécie, de 27% no controle para apenas 12% na concentração de 192 m M Cu, evidenciando a alta interferência do Cu na translocação do Fe, podendo ser uma das causas da fitotoxidez do Cu para o eucalipto. Altas concentrações de Cu não causaram redução na absorção e translocação de P, K, S, Ca e Mg, não representando, portanto, mecanismo de fitotoxidez desse metal pesado para essas espécies.
Metal pesado; eucalipto; níveis críticos de toxidez; árvores florestais; absorção; translocação
The effects of increasing concentrations of Cu in nutrient solution on growth, content and translocation of heavy metals and mineral nutrients in eucalyptus were evaluated. Seedlings of Eucalyptus maculata and Eucalypts urophylla were grown in pots containing 2 L of Clark’s nutrient solution, amended with 0, 32, 64, 128 and 192 m M Cu supplied as CuSO4. After five weeks of growth in the treatments, plants exhibited typical symptoms of Cu toxicity characterized by aqueous stains, interveinal leaf chlorosis and tissue necrosis. In addition to inhibition of growth, roots were dark even at lower Cu concentrations. The critical Cu toxicity concentrations which decreased shoot dry matter by 10%, were 8,3 muM and 3,3 muM for E. urophylla and E. maculata, respectively, whereas plant tissue critical toxicity concentration was between 12 and 13 mg kg-1 for both species, therefore indicating the high sensitivity of the Eucalyptus spp. to Cu. E. urophylla was less sensitive to Cu than E. maculata and this was related to the capacity of this species to restrict Cu translocation to shoots. Fe translocation was reduced by increasing Cu in both species. Translocation index was, on average, 27% in the control and 12% with 192 muM Cu in nutrient solution. However, E. urophylla exhibited higher Fe uptake under excessive Cu. This effect could be one of the causes of the eucalypts sensitivity to Cu. Toxic concentrations of Cu did not reduce uptake or translocation of P, K, S, Ca e Mg. Therefore reduced nutrient uptake does not account for the Cu toxicity effects observed.
Heavy metals; eucalypts; critical toxic levels; forest tree; mineral uptake; translocation
CRESCIMENTO E NUTRIÇÃO MINERAL DE Eucalyptus maculata E Eucalyptus urophylla EM SOLUÇÃO NUTRITIVA COM CONCENTRAÇÃO CRESCENTE DE COBRE1 1 Recebido: 6/4/2000 Aceito: 13/10/2000 . Parte da dissertação apresentada por CRFSS à Universidade Federal de Lavras/UFLA para obtenção do título de MS. Trabalho financiado pelo convênio CMM/FAEPE e FAPEMIG. 2 . Engenheiro Agrônomo, MS, crfsousa@ufla.br. Bolsista CAPES. 3 . Professor Titular, PhD, Departamento de Ciência do Solo/UFLA, Caixa Postal 37, 37.200-000, Lavras - MG. Bolsista do CNPq. 4 . Engenheiro Agrônomo, Dr. Sc. grazziot@ufla.br. Bolsista do CNPq.
CLÁUDIO ROBERTO FONSÊCA SOUSA SOARES2 1 Recebido: 6/4/2000 Aceito: 13/10/2000 . Parte da dissertação apresentada por CRFSS à Universidade Federal de Lavras/UFLA para obtenção do título de MS. Trabalho financiado pelo convênio CMM/FAEPE e FAPEMIG. 2 . Engenheiro Agrônomo, MS, crfsousa@ufla.br. Bolsista CAPES. 3 . Professor Titular, PhD, Departamento de Ciência do Solo/UFLA, Caixa Postal 37, 37.200-000, Lavras - MG. Bolsista do CNPq. 4 . Engenheiro Agrônomo, Dr. Sc. grazziot@ufla.br. Bolsista do CNPq. , JOSÉ OSWALDO SIQUEIRA3 1 Recebido: 6/4/2000 Aceito: 13/10/2000 . Parte da dissertação apresentada por CRFSS à Universidade Federal de Lavras/UFLA para obtenção do título de MS. Trabalho financiado pelo convênio CMM/FAEPE e FAPEMIG. 2 . Engenheiro Agrônomo, MS, crfsousa@ufla.br. Bolsista CAPES. 3 . Professor Titular, PhD, Departamento de Ciência do Solo/UFLA, Caixa Postal 37, 37.200-000, Lavras - MG. Bolsista do CNPq. 4 . Engenheiro Agrônomo, Dr. Sc. grazziot@ufla.br. Bolsista do CNPq. , JANICE GUEDES DE CARVALHO3 1 Recebido: 6/4/2000 Aceito: 13/10/2000 . Parte da dissertação apresentada por CRFSS à Universidade Federal de Lavras/UFLA para obtenção do título de MS. Trabalho financiado pelo convênio CMM/FAEPE e FAPEMIG. 2 . Engenheiro Agrônomo, MS, crfsousa@ufla.br. Bolsista CAPES. 3 . Professor Titular, PhD, Departamento de Ciência do Solo/UFLA, Caixa Postal 37, 37.200-000, Lavras - MG. Bolsista do CNPq. 4 . Engenheiro Agrônomo, Dr. Sc. grazziot@ufla.br. Bolsista do CNPq. , FÁTIMA MARIA SOUZA MOREIRA3 1 Recebido: 6/4/2000 Aceito: 13/10/2000 . Parte da dissertação apresentada por CRFSS à Universidade Federal de Lavras/UFLA para obtenção do título de MS. Trabalho financiado pelo convênio CMM/FAEPE e FAPEMIG. 2 . Engenheiro Agrônomo, MS, crfsousa@ufla.br. Bolsista CAPES. 3 . Professor Titular, PhD, Departamento de Ciência do Solo/UFLA, Caixa Postal 37, 37.200-000, Lavras - MG. Bolsista do CNPq. 4 . Engenheiro Agrônomo, Dr. Sc. grazziot@ufla.br. Bolsista do CNPq. , E PAULO HENRIQUE GRAZZIOTTI4 1 Recebido: 6/4/2000 Aceito: 13/10/2000 . Parte da dissertação apresentada por CRFSS à Universidade Federal de Lavras/UFLA para obtenção do título de MS. Trabalho financiado pelo convênio CMM/FAEPE e FAPEMIG. 2 . Engenheiro Agrônomo, MS, crfsousa@ufla.br. Bolsista CAPES. 3 . Professor Titular, PhD, Departamento de Ciência do Solo/UFLA, Caixa Postal 37, 37.200-000, Lavras - MG. Bolsista do CNPq. 4 . Engenheiro Agrônomo, Dr. Sc. grazziot@ufla.br. Bolsista do CNPq.
Departamento de Ciência do Solo, Universidade Federal de Lavras, Caixa Postal 37, Lavras, MG, 37200-000.
RESUMO - Avaliou-se o efeito de concentrações crescentes de Cu no crescimento, teores e translocação de metais pesados e nutrientes no eucalipto em solução nutritiva. Mudas de Eucalyptus maculata e Eucalyptus urophylla foram crescidas em vasos de 2L contendo solução nutritiva de Clark, adicionando-se 0, 32, 64, 128 e 192 m M de Cu fornecido como CuSO4. Após cinco semanas de exposição aos tratamentos, as plantas exibiram sintomas típicos de toxidez de Cu como manchas aquosas foliares, clorose e necrose internerval, além do escurecimento das raízes e inibição do crescimento mesmo nas menores concentrações do elemento. A concentração crítica de Cu na solução para reduzir em 10% a matéria seca da parte aérea foi de 8,3 mM e 3,3 mM para E. urophylla e E. maculata, respectivamente. O nível crítico de toxidez na matéria seca da parte aérea foi muito baixo, entre 12 e 13 mg Kg-1 para ambas espécies. E. urophylla mostrou-se menos sensível do que E. maculata, sendo isso relacionado à capacidade dessa em restringir a translocação do Cu das raízes para a parte aérea. Além disso, E. urophylla absorveu mais Fe na presença do excesso de Cu. A translocação de Fe das raízes para a parte aérea foi reduzida, independentemente da espécie, de 27% no controle para apenas 12% na concentração de 192 m M Cu, evidenciando a alta interferência do Cu na translocação do Fe, podendo ser uma das causas da fitotoxidez do Cu para o eucalipto. Altas concentrações de Cu não causaram redução na absorção e translocação de P, K, S, Ca e Mg, não representando, portanto, mecanismo de fitotoxidez desse metal pesado para essas espécies.
TERMOS ADICIONAIS PARA INDEXAÇÃO: Metal pesado, eucalipto, níveis críticos de toxidez, árvores florestais, absorção e translocação.
GROWTH AND MINERAL NUTRITION OF Eucalyptus maculata AND Eucalypts urophylla IN NUTRIENT SOLUTION WITH INCREASING CONCENTRATION OF COPPER
ABSTRACT - The effects of increasing concentrations of Cu in nutrient solution on growth, content and translocation of heavy metals and mineral nutrients in eucalyptus were evaluated. Seedlings of Eucalyptus maculata and Eucalypts urophylla were grown in pots containing 2 L of Clarks nutrient solution, amended with 0, 32, 64, 128 and 192 m M Cu supplied as CuSO4. After five weeks of growth in the treatments, plants exhibited typical symptoms of Cu toxicity characterized by aqueous stains, interveinal leaf chlorosis and tissue necrosis. In addition to inhibition of growth, roots were dark even at lower Cu concentrations. The critical Cu toxicity concentrations which decreased shoot dry matter by 10%, were 8,3 mM and 3,3 mM for E. urophylla and E. maculata, respectively, whereas plant tissue critical toxicity concentration was between 12 and 13 mg kg-1 for both species, therefore indicating the high sensitivity of the Eucalyptus spp. to Cu. E. urophylla was less sensitive to Cu than E. maculata and this was related to the capacity of this species to restrict Cu translocation to shoots. Fe translocation was reduced by increasing Cu in both species. Translocation index was, on average, 27% in the control and 12% with 192 mM Cu in nutrient solution. However, E. urophylla exhibited higher Fe uptake under excessive Cu. This effect could be one of the causes of the eucalypts sensitivity to Cu. Toxic concentrations of Cu did not reduce uptake or translocation of P, K, S, Ca e Mg. Therefore reduced nutrient uptake does not account for the Cu toxicity effects observed.
ADDITICIONAL INDEX TERMS: Heavy metals, eucalypts, critical toxic levels, forest tree, mineral uptake and translocation
INTRODUÇÃO
O crescente emprego de fertilizantes e pesticidas no solo, aliado ao aumento das atividades industriais e de mineração, são os principais responsáveis pela contaminação do solo, cursos de água e lençol freático por metais pesados (Malavolta, 1994). O destino de metais pesados adicionados ao solo, incluindo sua mobilidade e reações no solo, e sua subseqüente absorção pelas plantas e impacto na vegetação, são cruciais para a saúde humana (Cotrim, 1995). No caso de espécies arbóreas, o conhecimento dos padrões de absorção, translocação e acúmulo de íons metálicos, os limites de tolerância e os sintomas de fitotoxidez permitem o desenvolvimento de tecnologias para a fitorremediação de áreas contaminadas por tais elementos (Kahle, 1993). Isso tem sido bastante estudado em espécies arbóreas de clima temperado, porém, raramente naquelas nos trópicos. No caso do eucalipto são encontrados apenas estudos tratando de deficiência nutricional dos metais (Dell e Robinson, 1993; Dell, Malajczuk e Grove, 1995), havendo carência de estudos que tratam da fitotoxidez desses elementos no crescimento e nutrição mineral destas plantas. As características de rápido crescimento, sistema radicular bastante desenvolvido e facilidade de aclimatação tornam o eucalipto uma espécie com potencial para emprego em programas de recuperação de áreas degradadas pela deposição de metais pesados.
O cobre é, há muito, conhecido como um elemento mineral essencial para o crescimento das plantas, exercendo funções na síntese de proteínas, no metabolismo de carboidratos e na fixação simbiótica de N2 (Marschner, 1995). No entanto, concentrações desse elemento entre 20-100 mg Kg-1 na matéria seca da parte aérea são consideradas tóxicas para um grande número de espécies (Kabata-Pendias e Pendias, 1985) manifestadas pelo menor desenvolvimento das raízes com reflexos na absorção de água e nutrientes (Mengel e Kirkby, 1979). Os níveis críticos de toxidez e os sintomas de fitotoxidez de Cu para o eucalipto são desconhecidos. Os sintomas de toxidez apresentados por algumas espécies arbóreas como Acer rubrum, Cornus stolonifera, Lonicera tatarica e Pinus resinosa são, principalmente, a ocorrência de clorose foliar que evolui da base para a ponta das folhas ao longo da nervura principal e o aparecimento de manchas aquosas amareladas na lâmina com posterior queda das folhas (Heale e Ormrod, 1982). Esses sintomas resultam da menor absorção ou translocação de Fe e/ou menor teor de Fe nos cloroplastos. No entanto, ainda não é conhecido o mecanismo responsável pela redução do teor de Fe nos cloroplastos, podendo o Cu inibir o transporte de Fe e elétrons em plastídios e proteínas, respectivamente (Woolhouse, 1983). A toxidez de Cu nas raízes de espécies arbóreas manifesta-se pela ausência de formação de raízes secundárias e do escurecimento das mesmas, que se tornam mais finas e quebradiças, atribuindo-se essa resposta típica a danos nas extremidades das raízes que podem reduzir a capacidade da planta de se fixar no substrato e de absorver nutrientes (Kahle, 1993). Segundo esse mesmo autor, esse tipo de alteração pode ser conseqüência da deficiência induzida de Ca.
Neste trabalho, avaliou-se a toxidez de Cu no crescimento e nutrição mineral de Eucalyptus maculata e Eucalyptus urophylla em solução nutritiva contendo concentrações crescentes desse elemento.
MATERIAL E MÉTODOS
O estudo foi desenvolvido em casa-de-vegetação no Departamento de Ciência do Solo da Universidade Federal de Lavras, no período de março a maio de 1997. Mudas de Eucalyptus maculata Hook e Eucalyptus urophylla S.T. Blake foram produzidas em substrato contendo areia + vermiculita (50% v/v), irrigadas semanalmente com solução nutritiva de Clark (1975) meia força preparada com reagentes PA, a qual continha 7,26 mM N NO3-; 0,90 mM N NH4+; 0,07 mM P; 1,80 mM K; 2,60 mM Ca; 0,60 mM Mg; 0,50 mM S; 7,0 m M Mn; 2 mM Zn; 0,5 mM Cu; 19 mM B; 0,60 mM Mo e 38 mM Fe complexado com Na2-EDTA. Duas semanas após a emergência do primeiro par de folhas, as mudas foram transplantadas para bandejas coletivas com capacidade para 30L contendo a mesma solução nutritiva, com aeração constante e pH mantido em 5,5 pela adição de NaOH ou HCl 0,1N, onde permaneceram por 15 dias. Em seguida, a solução foi substituída pela mesma solução à 100%, permanecendo nessa por mais 15 dias, quando atingiram altura média de 20 cm. As mudas foram padronizadas quanto à altura e vigor e transplantadas duas plantas por vaso de 2 L, que constituiu a parcela experimental dispostos em esquema fatorial 2x5: duas espécies de eucalipto e cinco concentrações adicionais de Cu à solução descrita anteriormente (0, 32, 64, 128 e 192 m M Cu fornecido como CuSO4), em delineamento blocos casualizados com quatro repetições. As concentrações de Cu utilizadas foram definidas com base em ensaios preliminares (resultados não publicados), sendo as soluções renovadas semanalmente e o pH mantido em 5,5 pela adição de NaOH ou HCl 0,1N.
Após cinco semanas de exposição ao Cu nessas condições, procedeu-se à colheita das plantas, separando-as em parte aérea e raízes, sendo determinados área foliar por meio do emprego do Transparent Belt Conveyer mod. LI3050A (LICOR, inc. LincolnUSA) e comprimento de raízes por meio do Comair Root Lenght Scanner mod. TM 001 (Hawker de Havilland Victoria Limited, Port MelbourneAustrália). Após essas avaliações, as plantas foram secas em estufa com circulação de ar a 65ºC até peso constante, pesadas e moídas em moinho tipo Willey equipado com peneira com malha de 0,38 mm. Além do peso de matéria seca da parte aérea (caule + folha) e raízes, foram calculadas a razão entre a matéria seca de raiz e da parte aérea (R/PA) e a razão comprimento de raiz e matéria seca de raiz (C/MSR). Para determinação dos teores de nutrientes, efetuou-se a digestão nítrico-perclórica do material seco e moído, obtendo-se extratos para determinação dos teores de P pelo método colorimétrico, K por fotometria de chama, Ca e Mg por espectrofotometria de absorção atômica. Os teores de Cu, Zn, Mn e Fe também foram determinados por espectrofotometria de absorção atômica. O conteúdo de P, K, S, Ca, Mg, Cu, Zn, Mn e Fe foram calculados com base nas concentrações e produção de matéria seca. Por meio do acúmulo de nutrientes, calcularam-se os índices de translocação (IT) desses elementos pela razão entre a quantidade acumulada na parte aérea e a quantidade acumulada na planta (Abichequer e Bohnen, 1998).
Os resultados foram submetidos à análise de variância por meio do uso do programa estatístico SAEG (Euclydes, 1983). As equações de regressão foram determinadas pelo programa Table Curve 2D for Windows v. 2.03 (Jandel Corporation) e Fcalc32 for Windows v. 1.1 (Moura Filho e Cruz, 1996). As concentrações críticas de toxidez de Cu na solução para redução da produção de parte aérea e raízes (concentração do elemento na solução nutritiva que reduz em 10% a matéria seca da parte aérea e raízes) e os níveis críticos de toxidez na planta (teor foliar de Cu requerido para inibir em 10% a produção de matéria seca da parte aérea) foram estimados com base nas equações de regressão obtidas para cada espécie em resposta às concentrações do elemento em solução.
RESULTADOS E DISCUSSÃO
Sintomas de fitotoxidez e crescimento das plantas.
A ocorrência de sintomas de fitotoxidez em ambas as espécies foi observada já aos cinco dias após a transferência para os vasos com os tratamentos de Cu. Mesmo nas concentrações mais baixas (32 e 64 mM), verificou-se a presença de manchas aquosas que se tornavam necróticas nas folhas de E. urophylla. Esse sintoma de fitotoxidez, segundo Malavolta (1980), resulta do deslocamento do Fe dos citocromos, ferrodoxina e peroxidase pelo Cu. No E. maculata, as concentrações acima de 32 mM promoveram murchamento e clorose internerval nas folhas mais novas, sintoma típico de deficiência induzida de Fe. A ocorrência de clorose e necrose pode resultar em deficiências múltiplas de vários elementos que participam da formação, multiplicação e funcionamento de cloroplastos, ou na síntese de clorofila (Barceló e Poschenrieder, 1992). A inibição competitiva entre Cu e Fe (Woolhouse, 1983) altera a absorção de nutrientes, principalmente do Fe. Ausência de raízes secundárias e escurecimento das raízes que se tornaram mais finas e quebradiças foram os sintomas observados em ambas as espécies, mesmo na concentração mais baixa de Cu em solução (32 m M). Esses sintomas foram semelhantes ao observado em raízes de Acer rubrum e Pinus resinosa sob estresse de Ni e Cu por Heale e Ormrod (1982).
O aumento da concentração de Cu na solução também exerceu efeito negativo e diferenciado no crescimento das espécies estudadas (Figura 1). No E. urophylla não foi encontrado ajuste polinomial para matéria seca da parte aérea e área foliar, observando-se redução acentuada apenas em concentrações maiores que 32 mM Cu. E. maculata mostrou resposta quadrática com acentuado decréscimo de 66 e 72% nessas variáveis, respectivamente, na concentração de 32 mM Cu. Para as raízes de E. urophylla, houve aumento no comprimento total e pouco efeito na produção de matéria seca na concentração de 32 mM Cu, ao passo que em 64 mM Cu houve redução drástica desses parâmetros. Já no E. maculata, a concentração mais baixa de Cu (32 mM) reduziu em 56% a matéria seca de raiz e em 45% o comprimento de raiz, indicando alta sensibilidade dessa espécie ao Cu. As razões R/PA e C/MSR também foram afetadas pelo aumento das concentrações de Cu em solução. Houve pequeno incremento da R/PA com 32 mM Cu, decrescendo nas concentrações superiores, indicando que o efeito do Cu na produção de massa seca das raízes é mais prejudicial nas concentrações acima de 64 mM. A razão C/MSR de E. urophylla aumentou progressivamente com a elevação das concentrações de Cu, enquanto no E. maculata não houve efeito desse elemento. Com isso, Cu exerce maior efeito na matéria seca das raízes de E. urophylla que no seu comprimento de raiz, enquanto em E. maculata houve decréscimo proporcional entre a produção de matéria seca e comprimento de raízes, indicando resposta diferenciada dessas espécies ao Cu.
As concentrações críticas da toxidez de Cu em solução, determinadas com base nas respostas em crescimento relativo, encontram-se na Tabela 1. Para a matéria seca da parte aérea, estas foram de 8,3 mM e 3,3 mM para E. urophylla e E. maculata, respectivamente. Esses valores são menores que a concentração crítica de toxidez para Hordeum vulgare (63 mM Cu) encontrados por Davis, Beckett e Wollan (1978), indicando a baixa tolerância do eucalipto em relação a essa espécie. A concentração necessária para inibir em 50% a matéria seca da parte aérea foi de 38,5 m M para E. urophylla e 21,8 m M para E. maculata. Isso corresponde a concentrações 4,6 e 6,6 vezes maiores que aquelas requeridas para inibir 10% a produção de matéria seca da parte aérea. Portanto, E. urophylla é menos sensível que E. maculata em concentrações moderadas de Cu. A menor sensibilidade apresentada por E. urophylla está de conformidade com os resultados dos parâmetros de crescimento, em que essa espécie é pouco afetada na concentração mais baixa de Cu (32 mM). Nas duas espécies, as concentrações críticas de toxidez para as raízes foram superiores que aquelas da parte aérea, indicando a alta susceptibilidade da parte aérea dessas plantas ao Cu.
Teores e translocação de metais pesados e nutrientes
O aumento da concentração de Cu em solução influenciou os teores de Cu, Fe, Mn e Zn nas plantas (Figura 2). Observou-se acentuado aumento nos teores de Cu na matéria seca da parte aérea a partir de 64 mM Cu. O teor de Cu nas raízes também aumentou com a concentração desse elemento na solução e apresentou efeito diferenciado entre as espécies, sendo seus valores maiores do que o encontrado para a parte aérea como também relatados por Heale e Ormrod, (1982) para árvores de clima temperado. E. urophylla atingiu teor máximo de Cu na matéria seca das raízes de 13650 mg Kg-1, enquanto E. maculata atingiu apenas 6250 mg Kg-1. Apesar do elevado teor de Cu nas raízes, E. urophylla transloca pouco desse metal para a parte aérea, e essa característica pode explicar a sua menor sensibilidade ao Cu. De fato, a maior tolerância das plantas ao excesso de Cu está associada a um favorecimento da acumulação desse nas raízes e a uma restrição do seu transporte para a parte aérea (Reilly e Reilly, 1973). O nível crítico de toxidez de Cu na parte aérea não diferiu entre as espécies, situando-se entre 12 e 13 mg Kg-1, de matéria seca. Esses valores encontram-se abaixo da faixa de 20-100 mg Kg-1 considerada tóxica para o crescimento de várias espécies por Kabata-Pendias e Pendias (1985). Isso sugere baixa tolerância dessas espécies de eucalipto ao Cu. As concentrações de Cu em solução promoveram aumentos lineares no teor de Zn na parte aérea de E. urophylla e pequena redução no E. maculata na concentração de 32 m M Cu, com posterior elevação nas concentrações mais altas (Figura 2). Essa redução no teor de Zn na parte aérea pode ser devida ao efeito da inibição do processo de absorção, como confirmada pelo decréscimo de 65% no teor de Zn nas raízes de E.maculata na concentração de 32 mM. Sabe-se que íons de mesma valência podem competir por sítios de absorção, limitando assim a absorção de um ao outro (Gussarsson et al., 1995). Em ambas as espécies, houve aumento linear do teor de Mn na matéria seca da parte aérea e decréscimo de até 55% nas raízes, atingindo-se o mínimo de 17,29 mg Kg-1 na concentração de 131 mM Cu, evidenciando o antagonismo entre Cu e Mn no processo de absorção, não impedindo, entretanto, a translocação do Mn (Figura 3). O teor de Fe na parte aérea não apresentou ajuste de regressão, observando-se valores médios de 125,54 mg Kg-1 e 91,38 mg Kg-1 para E. urophylla e E. maculata, respectivamente (Figura 2). Nas raízes houve acentuado aumento do teor de Fe, havendo maior incremento em E. urophylla (1083%) do que E. maculata (471%). Por esses resultados, constata-se a maior capacidade de absorção de Fe por E. urophylla, mesmo nas concentrações mais altas de Cu. Como o Cu inibe a absorção do Fe (Woolhouse, 1983; Marschner, 1995), é possível que a maior tolerância de E. urophylla seja, pelo menos em parte, conseqüência da maior capacidade dessa espécie de absorver Fe, minimizando os efeitos tóxicos do Cu. A translocação do Fe foi reduzida de 27% no controle para apenas 12% com 192 mM Cu, independentemente da espécie (Figura 3). Portanto, apesar de os teores de Fe nas raízes e na parte aérea terem sido elevados pelo excesso de Cu em solução, esse exerceu alta interferência na translocação do Fe, podendo ser uma das possíveis causas da toxidez do Cu para o eucalipto. O efeito fitotóxico do Cu sobre a translocação de Fe também foi observado em espécies de Plantago em estudo realizado por Schmidt et al. (1997).
As concentrações de Cu em solução influenciaram de maneira diferente a translocação de Cu, Zn e Mn (Figura 3). O índice de translocação (IT) de Cu não apresentou comportamento diferenciado entre as espécies. Houve uma queda acentuada do IT de Cu, de 55% no tratamento sem adição de Cu para um máximo de 25% nos tratamentos na presença desse elemento. Isso indica que as raízes são uma barreira efetiva para a translocação para a parte aérea do Cu absorvido (Alloway, 1993; Arduini et al., 1996). Os índices de translocação de Zn e Mn aumentaram em resposta à elevação das concentrações de Cu, verificando-se comportamento diferenciado das espécies apenas para o Zn.
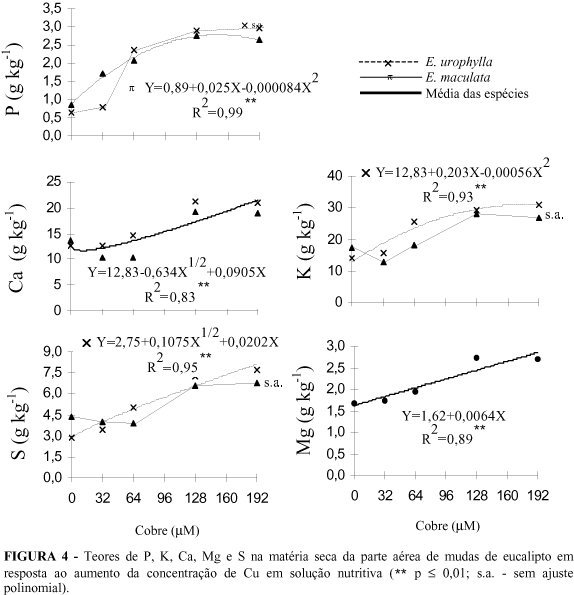
Os teores de nutrientes na matéria seca da parte aérea das plantas foram influenciados (P £ 0,01) pelas concentrações de Cu em solução (Figura 4). Observou-se em ambas espécies, incremento dos teores de P em função do aumento das concentrações de Cu, em virtude devido, provavelmente, do efeito de concentração, uma vez que houve redução no crescimento das plantas (Figura 1). Por causa da E. urophylla ser pouco afetada na concentração de 32 mM Cu, essa espécie não apresentou ajuste polinomial para o teor de P na parte aérea, observando efeito do Cu apenas nas concentrações mais elevadas desse elemento. Houve incremento nos teores de K, Ca e Mg na parte aérea das espécies em resposta ao aumento das concentrações de Cu em solução (Figura 4). Apesar de íons de mesma valência competirem por sítios de absorção (Gussarsson et al., 1995), verifica-se que altas concentrações de Cu em solução não impedem a translocação de K, Ca e Mg para o eucalipto. Assim como observado para o P, K, Ca e Mg, as concentrações mais altas de Cu proporcionaram aumento nos teores de S na parte aérea. Apesar dessa resposta poder estar relacionada com o efeito de concentração, sabe-se que plantas sob estresse de metais pesados podem apresentar mecanismos de tolerância pela produção de fitoquelatinas, que são compostos ricos em grupamentos SH (Meharg, 1994). As concentrações de Cu influenciaram a translocação P, K, Ca, Mg e S nas espécies de eucalipto (Figura 5). De maneira geral, observou-se incremento na translocação desses nutrientes nas concentrações mais elevadas de Cu, não havendo efeito diferenciado entre espécies para K e S. Esse comportamento pode ser atribuído ao efeito do Cu na perda de seletividade de membrana, causando influxo passivo de nutrientes para a parte aérea (Barceló e Poschenrieder, 1992). Portanto, não houve evidências de que altas concentrações de Cu em solução causam redução na absorção e translocação de nutrientes, exceto para a translocação de Fe. Os efeitos adversos do excesso de Cu para o eucalipto parecem resultar da ação tóxica direta desse elemento para a planta.
CONCLUSÕES
1. E. maculata e E. urophylla mostraram-se sensíveis ao excesso de Cu em solução, exibindo como sintomas, manchas aquosas foliares, clorose e necrose foliar internerval, escurecimento das raízes e inibição do crescimento. No entanto, E. urophylla apresentou concentrações críticas de Cu em solução e níveis críticos de toxidez na planta mais elevados que E. maculata sendo, portanto, menos sensível a esse elemento.
2. Mesmo em altas concentrações, o Cu não causou redução na absorção e translocação de P, K, S, Ca e Mg em E. maculata e E. urophylla, ao contrário da translocação de Fe, que foi reduzida pelo excesso de Cu, podendo ser uma das causas da fitotoxidez desse elemento para o eucalipto.
3. A menor sensibilidade apresentada por E. urophylla relacionou-se com a capacidade dessa espécie em restringir a translocação do Cu absorvido e pela maior capacidade de absorver Fe.
REFERÊNCIAS
- ABICHEQUER, A.D. & BOHNEN, H. Eficiência de absorção, translocação e utilização de fósforo por variedades de trigo. Revista Brasileira de Ciência do Solo, 22:2126, 1998.
- ALLOWAY, B.J. Heavy metals in soils New York: John Willey, 1993. 339p.
- ARDUINI, I.; GODBOLD, D.L. & ONNIS, A. Cadmium and copper uptake and in Mediterranean tree seedlings. Physiologia Plantarum, 97:111117, 1996.
- BARCELÓ, J. & POSCHENRIEDER, Ch. Respuestas de las plantas a la contaminacion por metales pesados. Suelo y Planta, 2:345361, 1992.
- CLARK, R.B. Characterization of phosphates in intact maize roots. Journal Agricultural Food Chemistry, 23:458460, 1975.
- COTRIM, A. R. Metais pesados na agricultura, conseqüências das elevadas concentrações de mercúrio, cádmio e chumbo no solo Instituto de Química-UNICAMP, Campinas, 1995. 48p.
- DAVIS, R.D. ; BECKETT, P.H.T. & WOLLAN, E. Critical levels of twenty potentially toxic elements in young spring barley. Plant and Soil, 49:394408, 1978.
- DELL, B.; MALAJCZUK, N. & GROVE, T.S. Nutrient disorders in plantation eucalypts Canberra, BPD Graphic Associates, 1995.104p.
- DELL, B. & ROBINSON, J.M. Symptoms of mineral nutrient deficiencies and the nutrient concentration ranges in seedlings of Eucalyptus maculata Hook. Plant and Soil, 156:255261, 1993.
- EUCLYDES, R.F. Manual de Utilização do Programa SAEG (Sistema para Análises Estatísticas e Genética) Viçosa: Universidade Federal de Viçosa. 1983, 59p.
- GUSSARSSON, M.; ADALSTEINSSON, P.J. & ASP, H. Cadmium and copper interactions on the accumulation and distribution of Cd and Cu in birch (Betula Pendula Roth) seedlings. Plant and Soil, 171:185187, 1995.
- HEALE, E.L. & ORMROD D.P. Effects of nickel and copper on Acer rubrum, Cornus stolonifera, Lonicera tatarica and Pinus resinosa Canadian Journal of Botany, 60:26742681, 1982.
- KABATA-PENDIAS, A. & PENDIAS, H. Trace elements in soils and plants Boca Raton: cRc Press, 1985. 315p.
- KAHLE, H. Response of roots of trees to heavy metals. Environmental and Experimental Botany, Great Britain, 33:99119, 1993.
- MALAVOLTA, E. Elementos de nutrição mineral de plantas. São Paulo: ed. Agronômica Ceres, 1980. 251p.
- MALAVOLTA, E. Fertilizantes e seu impacto ambiental: micronutrientes e metais pesados, mitos, mistificações e fatos. São Paulo: ProduQuímica, 1994. 153p.
- MARSCHNER, H. Mineral Nutrition of Higher Plants 2nd edn. Academic press Inc., San Diego, CA, USA, 1995, 902 p.
- MEHARG, A.A. Integrated tolerance mechanisms: constitutive and adaptive plant responses to elevated metal concentrations in the environment. Plant, Cell and Environmental, 17:989993, 1994.
- MENGEL, K. & KIRKBY, E.A. Principles of plant nutrition 2nd ed. Switzerland, Worblanfen-Bern: International Potash Institute, 1979. 593p.
- MOURA FILHO, G. & CRUZ, C.D. Fcalc for Windows v. 1.1 Programa para cálculo do F corrigido em análises de regressão: Teste dos coeficientes, Universidade Federal de Viçosa, 1996
- REILLY, A. & REILLY, C. Zinc, lead and copper tolerance in the grass Stereochlaena cameronii (Stapf) Clayton, New Phytologist, 72:1041, 1973.
- SCHMIDT, W.; BARTELS, M.; TITTEL, J. & FUHNER, C. Physiological effects of copper on iron acquisition processes in Plantago New Phytologist, 135:659666, 1997.
- WOOLHOUSE, H.W. Toxicity and tolerance in the responses of plant to metals. In: O.L. Lange; P.S. Nobel; C.B. Osmond; H. Ziegler (Ed.). Encyclopedia of Plant Physiology, Berlin, New Series, v.12C, p.245-300, 1983.
Datas de Publicação
-
Publicação nesta coleção
11 Jun 2003 -
Data do Fascículo
2000
Histórico
-
Aceito
13 Out 2000 -
Recebido
06 Abr 2000