RESUMO
Objetivo:
Avaliar a acurácia dos níveis de interleucina 3 para predizer prognóstico em pacientes sépticos.
Métodos:
Conduzimos uma coorte prospectiva que incluiu pacientes adultos internados em unidade de terapia intensiva, que apresentassem sepse ou choque séptico iniciados há até 48 horas. Mediram-se os níveis séricos de interleucina 3 quando da inclusão (dia 1) e nos dias 3 e 7. O desfecho primário analisado foi a mortalidade hospitalar por qualquer causa.
Resultados:
Foram incluídos 120 pacientes. Os níveis séricos de interleucina 3 dosados à inclusão foram significativamente mais elevados em pacientes que faleceram em comparação aos que sobreviveram à internação hospitalar (91,2pg/mL versus 36pg/mL; p = 0,024). Em modelo de sobrevivência de Cox com inclusão de idade e valores sequenciais de SOFA, os níveis de interleucina 3 mensurados na inclusão mantiveram-se independentemente associados à mortalidade hospitalar (HR 1,032; IC95% 1,010 - 1,055; p = 0,005). Em curva Característica de Operação do Receptor construída para investigação adicional da acurácia da interleucina 3 na predição do prognóstico, encontrou-se área sob a curva de 0,62 (IC95% 0,51 - 0,73; p = 0,024) para mortalidade hospitalar. Valores iniciais de interleucina 3 acima de 127,5pg/mL mostraram-se significativamente associados à mortalidade hospitalar (p = 0,019; OR = 2,97; IC95% 1,27 - 6,97; p = 0,019), entretanto com baixo desempenho (especificidade de 82%, sensibilidade de 39%, valor preditivo positivo de 53%, valor preditivo negativo de 72%, razão de verossimilhança negativa de 0,73 e razão de verossimilhança positiva de 2,16).
Conclusão:
Níveis elevados de interleucina 3 mostraram-se independentemente associados à mortalidade hospitalar em pacientes sépticos, entretanto com baixo desempenho clínico.
Descritores:
Interleucina-3; Sepse; Choque séptico; Biomarcadores
ABSTRACT
Objective:
To evaluate the accuracy of IL-3 to predict the outcome of septic patients.
Methods:
Prospective cohort study with adult patients in an intensive care unit with sepsis or septic shock diagnosed within the previous 48 hours. Circulating IL-3 levels were measured upon inclusion (day 1) and on days 3 and 7. The primary outcome was hospital mortality.
Results:
One hundred and twenty patients were included. Serum levels of IL-3 on day 1 were significantly higher among patients who died than among patients who survived the hospital stay (91.2pg/mL versus 36pg/mL, p = 0.024). In a Cox survival model considering the IL-3 levels at inclusion, age and sequential SOFA, IL-3 values remained independently associated with mortality (HR 1.032; 95%CI 1.010 - 1.055; p = 0.005). An receiver operating characteristic curve was built to further investigate the accuracy of IL-3, with an area under the curve of 0.62 (95%CI 0.51 - 0.73; p = 0.024) for hospital mortality. A cutoff initial IL-3 value above 127.5pg/mL was associated with hospital mortality (OR 2.97; 95%CI: 1.27 - 6.97; p = 0.0019) but with a low performance (82% for specificity, 39% for sensibility, 53% for the positive predictive value, 72% for the negative predictive value, 0.73 for the negative likelihood and 2.16 for the positive likelihood ratio).
Conclusion:
Higher levels of IL-3 are shown to be independently associated with hospital mortality in septic patients but with poor clinical performance.
Keywords:
Interleukin-3; Sepsis; Septic shock; Biomarkers
INTRODUÇÃO
Sepse representa uma importante questão de saúde pública e se faz presente em 30% dos pacientes que passam pelas unidades de terapia intensiva (UTIs).(11 Vincent JL, Marshall JC, Namendys-Silva SA, François B, Martin-Loeches I, Lipman J, Reinhart K, Antonelli M, Pickkers P, Njimi H, Jimenez E, Sakr Y; ICON investigators. Assessment of the worldwide burden of critical illness: the intensive care over nations (ICON) audit. Lancet Respir Med. 2014;2(5):380-6.) Apesar dos recentes avanços terapêuticos, as taxas de mortalidade por sepse continuam elevadas e chegam a atingir 50% nos casos mais graves.(11 Vincent JL, Marshall JC, Namendys-Silva SA, François B, Martin-Loeches I, Lipman J, Reinhart K, Antonelli M, Pickkers P, Njimi H, Jimenez E, Sakr Y; ICON investigators. Assessment of the worldwide burden of critical illness: the intensive care over nations (ICON) audit. Lancet Respir Med. 2014;2(5):380-6.,22 Martim GS, Mannino DM, Eaton S, Moss M. The epidemiology of sepsis in the United States from 1979 through 2000. N Engl J Med. 2003;348(16):1546-54.) Dentre os sobreviventes, taxas elevadas de readmissão ao hospital e declínio funcional aumentam o ônus social e econômico desta síndrome.(33 Goodwin AJ, Rice DA, Simpson KN, Ford DW. Frequency, cost, and risk factors of readmissions among severe sepsis survivors. Crit Care Med. 2015;43(4):738-46.,44 Iwashyna TJ, Ely EW, Smith DM, Langa KM. Long-term cognitive impairment and functional disability among survivors of severe sepsis. JAMA. 2010;304(16):1787-94.)
Muitos dos aspectos fisiopatológicos da sepse ainda permanecem por ser elucidados.(55 van der Poll T, Opal SM. Host-pathogen interactions in sepsis. Lancet Infect Dis. 2008;8(1):32-43.) Os papéis desempenhados pelas citocinas pró-inflamatórias e pela resposta inflamatória exacerbada à lesão e morte tissular foram bem estabelecidos nos anos recentes.(55 van der Poll T, Opal SM. Host-pathogen interactions in sepsis. Lancet Infect Dis. 2008;8(1):32-43.
6 Heumann D, Roger T. Initial responses to endotoxins and Gram-negative bactéria. Clin Chim Acta. 2002;323(1-2):59-72.-77 Casey LC, Balk RA, Bone RC. Plasma cytokine and endotoxin levels correlate with survival in patients with the sepsis syndrome. Ann Intern Med. 1993;119(8):771-8.) Contudo, os ensaios clínicos conduzidos para avaliar a resposta a terapêuticas anti-inflamatórias proporcionaram resultados predominantemente desfavoráveis.(88 Eichacker PQ, Parent C, Kalil A, Esposito C, Cui X, Banks SM, et al. Risk and the efficacy of antiinflammatory agentes: retrospective and confirmatory studies of sepsis. Am J Respir Crit Care Med. 2002;166(9):1197-205.)
Por esta razão, encontram-se atualmente em curso estudos sobre novas fases da cascata inflamatória. Weber et al. demonstraram o papel da interleucina (IL) 3 no incremento da mielopoiese após indução de sepse em um modelo em murídeos.(99 Weber GF, Chousterman BG, He S, Fenn AM, Nairz M, Anzai A, et al. Interleukin-3 amplifies acute inflammation and is a potential therapeutic target in sepsis. Science. 2015;347(6227):1260-5.) A citocina se revelou responsável pela mobilização e pela proliferação de células mieloides, instigando a liberação excessiva de citocinas pró-inflamatórias e, consequentemente, a inflamação sistêmica, a disfunção orgânica e o óbito. Nesse estudo, os autores identificaram uma associação entre níveis mais elevados de IL-3 e mortalidade em duas pequenas coortes de pacientes sépticos.(99 Weber GF, Chousterman BG, He S, Fenn AM, Nairz M, Anzai A, et al. Interleukin-3 amplifies acute inflammation and is a potential therapeutic target in sepsis. Science. 2015;347(6227):1260-5.)
O objetivo do presente estudo foi avaliar a acurácia da IL-3 em prever o desfecho de pacientes sépticos, levando em consideração a mortalidade hospitalar como desfecho primário. Como parâmetro secundário, avaliamos a mortalidade aos 28 dias e a mortalidade em unidade de terapia intensiva, assim como correlação dos níveis de IL-3 com níveis de outros biomarcadores tradicionais de sepse.
MÉTODOS
Foi conduzida uma coorte prospectiva de pacientes sépticos, internados em UTI com 18 leitos pertencente ao Hospital das Clínicas da Universidade Federal de Minas Gerais (UFMG), em Belo Horizonte, MG.
Como a condução do presente estudo precedeu a publicação das novas definições propostas pelo Third International Consensus Definitions for Sepsis and Septic Shock,(1010 Singer M, Deutschman CS, Seymour CW, Shankar-Hari M, Annane D, Bauer M, et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA. 2016;315(8):801-10.) adotamos as definições publicadas em 1992 e revisadas em 2002.(1111 Bone RC, Balk RA, Cerra FB, Dellinger RP, Fein AM, Knaus WA, et al. Definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis. The ACCP/SCCM Consensus Conference Committee. American College of Chest Physicians/Society of Critical Care Medicine. Chest. 1992;101(6):1644-55.,1212 Levy MM, Fink MP, Marshall JC, Abraham E, Angus D, Cook D, Cohen J, Opal SM, Vincent JL, Ramsay G; SCCM/ESICM/ACCP/ATS/SIS. 2001 SCCM/ESICM/ACCP/ATS/SIS International Sepsis Definitions Conference. Crit Care Med. 2003;31(4):1250-6.) Consideraram-se para inclusão todos os pacientes adultos (idade igual ou superior a 18 anos) admitidos com confirmação ou suspeita de sepse grave (infecção mais síndrome de resposta inflamatória sistêmica - SRIS - e mais, no mínimo, uma nova disfunção orgânica relacionada à infecção) ou com choque séptico (infecção mais SRIS mais hipotensão com necessidade de utilizar vasopressores), com o diagnóstico firmado dentro das últimas 48 horas. Os critérios para exclusão foram: utilização de terapêutica antibiótica contra o presente processo infeccioso por mais de 48 horas; pacientes submetidos a tratamento exclusivamente paliativo; pacientes com óbito previsto dentro das próximas 24 horas; gravemente imunodeprimidos (infecção por HIV com níveis de linfócitos CD4+ inferiores a 200/mm3, neutropenia grave abaixo de 500/mL, após transplante de órgãos sólidos ou de medula óssea, submetidos à terapêutica esteroide com dose imunossupressora - equivalente a 10mg de prednisona por 30 dias ou mais ou 40mg de prednisona por 10 dias ou mais -, em utilização de agentes quimioterápicos dentro dos últimos 28 dias); e politraumatizados ou submetidos à cirurgia de grande porte nos últimos dias (exceto em caso de cirurgias para controle do foco infeccioso).
O estudo foi aprovado pelo Comitê de Ética da UFMG, sob o número de protocolo 0319.0.203.000-11, e todas as inclusões demandaram a assinatura de um Termo de Consentimento Livre e Esclarecido pelo paciente ou um representante habilitado.
Os pacientes foram avaliados quanto à potencial inclusão por ocasião da admissão à UTI, ou imediatamente após o diagnóstico de sepse, caso já se encontrassem internados na UTI. Colheram-se os dados clínicos de forma prospectiva, registrando-se as seguintes variáveis: idade, sexo, comorbidades, tipo e foco de infecção, dados microbiológicos, lactato sérico arterial, proteína C-reativa (PCR), creatinina, ureia, hemoglobina, hematócrito, plaquetas, leucócitos, bilirrubina, pH arterial, tempo de protrombina e tempo de protrombina parcial ativada (TTPa), além dos escores de severidade Acute Physiology and Chronic Health Evaluation (APACHE II)(1313 Knaus WA, Draper EA, Wagner DP, Zimmerman JE. APACHE II: a severity of disease classification system. Crit Care Med. 1985;13(10):818-29.) e Sepsis Organ Failure Assessment (SOFA).(1414 Vincent JL, Moreno R, Takala J, Willatts S, De Mendonça A, Bruining H, et al. The SOFA (Sepsis-related Organ Failure Assessment) score to describe organ dysfunction/failure. On behalf of the Working Group on Sepsis-Related Problems of the European Society of Intensive Care Medicine. Intensive Care Med. 1996;22(7):707-10.,1515 Ferreira FL, Bota DP, Bross A, Mélot C, Vincent JL. Serial evaluation of the SOFA score to predict outcome in critically ill patients. JAMA. 2001;286(14):1754-8.) Registraram-se também a duração e a classe da terapêutica antibiótica, o tempo de permanência no hospital, o tempo de permanência em terapia intensiva e, ainda, a mortalidade por qualquer causa registrada na UTI, no hospital e aos 28 dias após o estudo.
Analisaram-se os níveis circulantes de IL-3 em relação à mortalidade hospitalar (desfecho primário) e aos seguintes parâmetros: mortalidade aos 28 dias, mortalidade na UTI, ocorrência de choque séptico, ocorrência de disfunções específicas de órgãos, hemoculturas positivas e tempo de permanência tanto no hospital quanto na UTI.
Obtiveram-se amostras de sangue por ocasião da inclusão e, depois, novamente no terceiro e no sétimo dias de seguimento. As amostras de soro foram obtidas a partir de sangue colhido para exames de rotina da terapia intensiva. O soro foi armazenado congelado em freezer a -80ºC até a análise. As mensurações séricas de IL-3 foram ensaiadas juntas, em uma única vez, após a conclusão do estudo. Para tal, utilizou-se o kit Human IL-3 DuoSet ELISA (R&D Systems, Minneapolis, MN, EUA), segundo as instruções fornecidas pelo fabricante. Avaliaram-se também, nas amostras colhidas por ocasião da inclusão, os perfis de citocinas inflamatórias dos pacientes. Mediram-se os perfis de T helper tipos 1, 2 e 17 (Th1, Th2 e Th17), com perfis de citocinas de resposta (IL-2, IL-4, IL-6, IL-10, fator de necrose tumoral - TNF -, interferon gama - IFN - e IL-17), utilizando-se o método Cytometric Bead Array (CBA), conforme as instruções fornecidas pelo fabricante (BD Bioscience, San Diego, CA, EUA).
Análise estatística
A determinação do tamanho da amostra é descrita detalhadamente no Material suplementar. As variáveis categóricas são apresentadas em termos de frequência absoluta e relativa. Utilizaram-se médias e desvios padrão para descrever as variáveis contínuas de distribuição normal, e as medianas com respectivas variações interquartis para as variáveis contínuas com distribuição não normal. As comparações entre as variáveis categóricas foram obtidas por meio do teste do qui-quadrado ou do teste exato de Fisher. As variáveis contínuas foram comparadas com utilização do teste t de Student ou do teste U de Mann-Whitney. As correlações entre as variáveis contínuas foram conduzidas com utilização do coeficiente de correlação de Spearman. Construíram-se curvas Característica de Operação do Receptor (COR) para estabelecer a precisão das moléculas analisadas na predição dos desfechos avaliados. Os fatores prognósticos com influência nos desfechos avaliados foram inicialmente avaliados por meio de modelos de análise univariada, e aqueles com valor de p inferior a 10% foram, então, submetidos à análise multivariada. Aplicaram-se modelos de regressão logística para os desfechos categóricos, regressão linear para variáveis contínuas e análise proporcional de risco de Cox para variáveis dependentes do tempo. Os modelos de predição foram comparados com utilização de medidas de desfecho (correlação entre classes, coeficiente de determinação e critérios de informação de Akaike - AIC).
Os testes foram bicaudais, estabelecendo-se valor de significância para p de 0,05 para todas as análises. Os dados foram analisados com utilização do Statistical Package for Social Science (SPPS) versão 20.1 (SPSS, Chicago, IL, EUA) e do programa R versão 3.1.1 (R Foundation for Statistical Computing, Viena, Áustria).
RESULTADOS
Triamos um total de 199 pacientes quanto à potencial elegibilidade. Desse total, 127 (63,8%) foram considerados elegíveis, dos quais sete foram excluídos. Assim, a análise final incluiu 120 pacientes (Figura 1).
As características principais dos pacientes incluídos no estudo se encontram detalhadas na tabela 1. As taxas de mortalidade aos 28 dias, na UTI e no hospital foram, respectivamente de 24%, 22,5% e 34%. A média de idade da população foi de 55 anos, com desvio padrão (DP) de ± 18 anos, porém, entre os pacientes que faleceram, a média era mais elevada. As comorbidades mais frequentes foram hipertensão arterial, diabetes mellitus e neoplasia sólida. Dentre as comorbidades avaliadas, apenas nefropatia crônica não dialítica teve correlação significante com o desfecho primário, ou seja, mortalidade no hospital. Os valores medianos dos escores de severidade APACHE II e SOFA quando da inclusão eram significantemente mais altos entre os pacientes que morreram do que entre os sobreviveram à permanência no hospital (Tabela 1).
Episódios de sepse e prognóstico
Os dados relativos aos aspectos dos episódios de sepse e sua evolução se encontram na tabela 2. A maioria dos pacientes já se apresentou com choque séptico (83%). Obteve-se confirmação microbiológica de sepse para 75 (63%) dos pacientes, dos quais 51 (42,5%) tiveram hemoculturas positivas. As ocorrências de choque séptico, uso de ventilação mecânica, terapia de substituição renal e uso de inotrópicos foram significantemente correlacionadas com óbito durante a permanência no hospital. Dentre os exames laboratoriais avaliados na rotina clínica, os níveis de lactato e de PCR, quando da inclusão, também se associaram com a mortalidade hospitalar (Tabela 2).
Características clínicas e laboratoriais dos episódios de sepse como função da mortalidade hospitalar
Interleucina 3 e desfecho primário
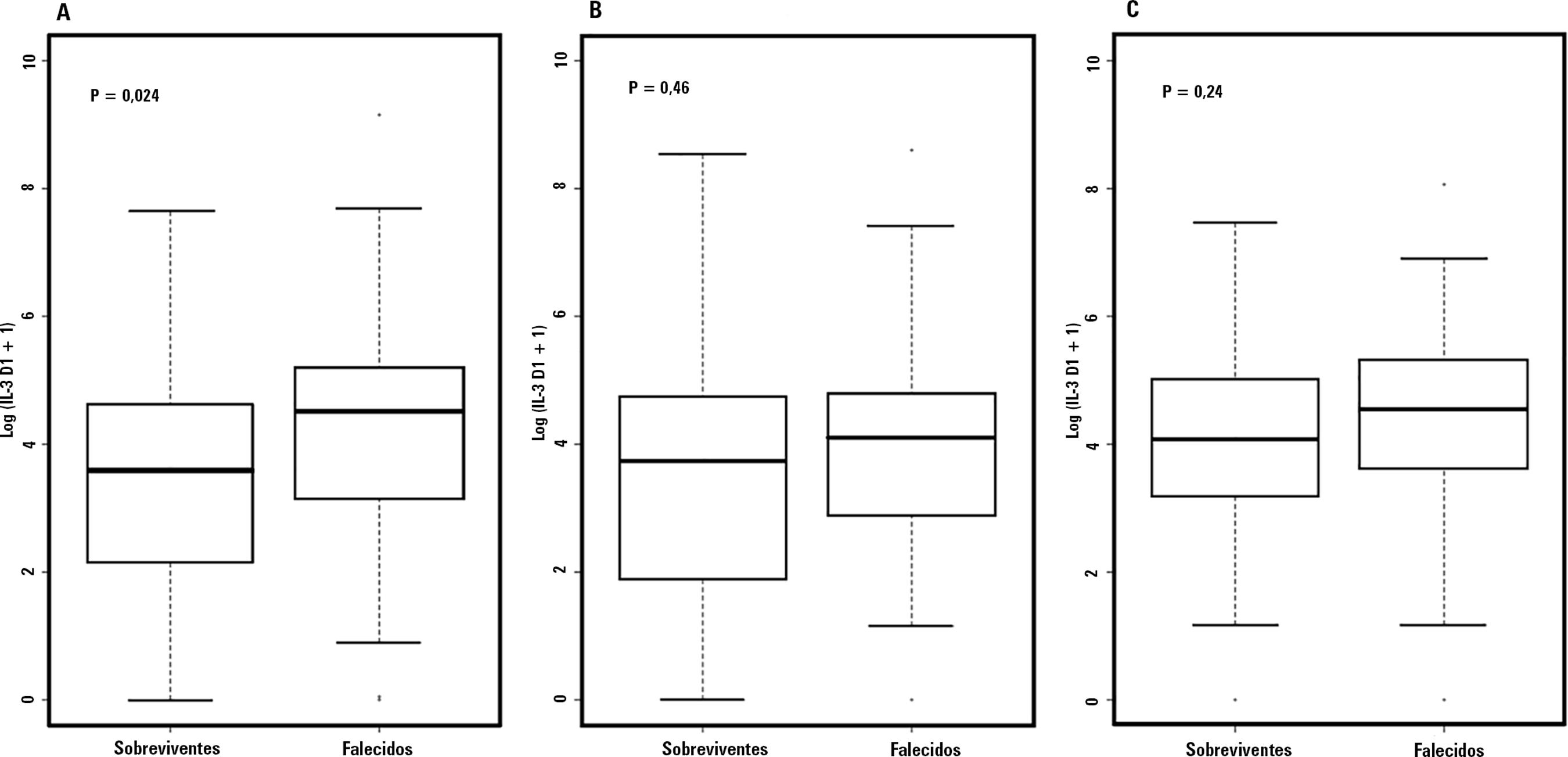
Os níveis de IL-3 foram medidos por ocasião da inclusão (dia 1) em amostras de soro de todos os pacientes admitidos ao estudo e, novamente, no dia 3, em 110 pacientes (92%) e, no dia 7, em 103 deles (86%) (Tabela 3). Os níveis medianos de IL-3 no soro medidos quando da inclusão revelaram-se na análise estatística como significantemente mais altos nos pacientes que morreram do que nos pacientes que sobreviveram à permanência no hospital, respectivamente com valores de 91,2pg/mL (21,7 - 182,6pg/mL) em comparação a 36pg/mL (7,0 - 101,8pg/mL), com p = 0,024, conforme mostra a tabela 3. A mortalidade hospitalar não se associou com os níveis de IL-3 medidos nos dias 3 e 7 (Figura 2 e Figura 1S - Material suplementar). Os níveis de IL-3 tiveram comportamento errático durante os episódios de sepse (Figura 3), não se identificando diferenças estatisticamente significantes, em termos de tendência a decréscimo dos valores do biomarcador e à sobrevivência à internação (p = 0,185 para a tendência entre o dia 1 e o dia 3, e p = 0,169 para a tendência entre o dia 1 e o dia 7).
Níveis circulantes de interleucina 3 nos dias 1, 3 e 7, segundo sobrevivência no hospital. As caixas mostram os níveis medianos de interleucina 3, variações interquartis e o 10º e 90º percentis nos dias 1 (A), 3 (B) e 7 (C). Níveis de interleucina 3 expressos em formato logarítmico. IL-3 - interleucina 3.
Comportamento sequencial dos níveis de interleucina 3 nos dias 1, 3 e 7, segundo sobrevivência no hospital. IL-3 - interleucina 3; D1 - dia 1; D3 - dia 3; D7 - dia 7. Níveis de interleucina-3 apresentados em formato logarítmico.
Em um modelo de sobrevivência de Cox, que utilizou mortalidade como variável dependente, os valores de IL-3 medidos na inclusão permaneceram independentemente associados com o prognóstico após ajuste quanto à idade dos pacientes e valores sequenciais do SOFA nos dias 1, 3 e 7 (HR 1,032; IC95%: 1,010 - 1,055; p = 0,005) (Tabela 1S - Material suplementar).
Para melhor investigar a acurácia dos níveis de IL-3 para predizer o desfecho de pacientes sépticos, construímos uma curva COR e identificamos uma área sob a curva COR de 0,62 (IC95% 0,51 - 0,73; p = 0,024) para mortalidade hospitalar (Figura 4). Um nível de corte inicial de concentração de IL-3 acima de 127,5pg/mL se associou com mortalidade hospitalar (OR 2,97; IC95% 1,27 - 6,97; p = 0,0019), porém com desempenho fraco, como segue: 82% para especificidade, 39% para sensibilidade, 53% para valor preditivo positivo, 72% para valor preditivo negativo, 0,73 para a razão de verossimilhança negativa e 2,16 para razão de verossimilhança positiva, levando a uma pequena variação na predição pós-teste, em comparação ao pré-teste.
Curva Característica de Operação do Receptor dos biomarcadores e escores clínicos. Desfecho: mortalidade hospitalar por todas as causas. IL - interleucina; SOFA - Sepsis Organ Failure Assessment; APACHE - Acute Physiology and Chronic Health Evaluation; D1 - dia 1.
Apesar da baixa precisão dos níveis de IL-3 para predizer o desfecho da sepse, avaliamos adicionalmente se os níveis de IL-3 poderiam acrescentar algo às informações prognósticas fornecidas pelo SOFA. Para isto, conduzimos uma medição de desempenhos de modelos de predição de mortalidade hospitalar construídos com e sem os níveis de IL-3. Empregaram-se correlação interclasse, coeficiente de determinação (R2) e medidas de AIC. Ao comparar o modelo construído com os valores sequenciais do SOFA e a idade com o modelo com utilização destas mesmas variáveis mais os níveis de IL-3 no dia 1, os três critérios aplicados concordaram que o modelo com inclusão dos dados relativos aos valores de IL-3 foi superior (Tabela 2S - Material suplementar), porém com variações pequenas que não mostraram relevância clínica.
Interleucina 3 e desfechos secundários
Não se identificaram diferenças nos níveis de IL-3 quando da inclusão entre pacientes com sepse e choque séptico. Além disto, os níveis de IL-3 não se associaram com disfunções orgânicas específicas, inclusive no choque séptico - nem com a mortalidade na UTI ou aos 28 dias. Mais ainda, os níveis séricos de IL-3 medidos nos dias 1, 3 ou 7 não se mostraram associados com hemocultura positiva. Entretanto, entre os pacientes com hemocultura positiva (n = 51), os níveis de IL-3 medidos por ocasião da inclusão mostraram-se mais elevados de forma estatisticamente significante nos pacientes que morreram na UTI (p = 0,007) e durante a permanência no hospital (p = 0,024). Não se identificaram diferenças estatisticamente significantes nos níveis de IL-3 entre pacientes que receberam ou deixaram de receber corticosteroides nas primeiras 72 horas. Não se encontraram correlações entre os níveis de IL-3 e o tempo de permanência na UTI ou no hospital, nem com os escores de severidade e outros biomarcadores.
Outras citocinas e desfechos
Os níveis de IL-2, IL-4, IL-6, IL-10, TNF, IFN e IL-17 foram medidos quando da inclusão (Tabela 3). Os níveis das citocinas IL-6 e IL-10 se mostraram associados com o prognóstico de sepse, já que eram mais elevados no grupo de pacientes que morreram durante a permanência no hospital. Em análise de correlação, os níveis de IL-6 e IL-10 por ocasião da inclusão tiveram forte correlação entre si, com r = 0,772 e p < 0,001. Estas citocinas também tiveram correlação positiva com os resultados do SOFA por ocasião da inclusão, com r = 0,359 (p < 0,001) e 0,375 (p < 0,001), respectivamente. Não se identificou qualquer correlação entre os níveis destes marcadores e os de outras citocinas avaliadas, inclusive IL-3. Finalmente, a dosagem de IL-3 não acrescentou qualquer valor prognóstico ao das demais citocinas testadas neste estudo (dados não apresentados).
DISCUSSÃO
Neste estudo, as concentrações séricas de IL-3 associaram-se de forma independente com mortalidade hospitalar por qualquer causa em pacientes sépticos admitidos à unidade de terapia intensiva. Entretanto, a precisão dos níveis de IL-3 para predizer este desfecho se comprovou fraca, o que torna a dosagem dos níveis de IL-3 um marcador de pouca utilidade na prática clínica.
Os níveis de IL-3 surgiram recentemente como marcador prognóstico plausível na sepse. Com a utilização de um modelo em camundongos, Weber et al.(99 Weber GF, Chousterman BG, He S, Fenn AM, Nairz M, Anzai A, et al. Interleukin-3 amplifies acute inflammation and is a potential therapeutic target in sepsis. Science. 2015;347(6227):1260-5.) demonstraram de forma elegante um papel fundamental desta molécula na fisiopatologia da sepse, notavelmente por meio da indução de mielopoiese de monócitos Ly-6C e neutrófilos, e incremento dos níveis de citocinas. Os autores adicionalmente testaram o papel prognóstico da IL-3 em duas pequenas coortes de seres humanos com sepse e identificaram que os níveis plasmáticos de IL-3 se associaram com mortalidade elevada, mesmo após ajuste quanto à severidade da doença.
Apesar de sua associação estatística com o prognóstico da sepse, como no estudo de Weber et al., o desempenho dos níveis de IL-3 que encontramos não foi superior ao dos biomarcadores previamente estudados(1616 Lobo SM, Lobo FR, Bota DP, Lopes-Ferreira F, Soliman HM, Mélot C, et al. C-reactive protein levels correlate with mortality and organ failure in critically ill patients. Chest. 2003;123(6):2043-9.
17 Jensen JU, Heslet L, Jensen TH, Espersen K, Steffensen P, Tvede M. Procalcitonin increase in early identification of critically ill patients at high risk of mortality. Crit Care Med. 2006;34(10):2596-602.
18 Pierrakos C, Vincent JL. Sepsis biomarkers: a review. Crit Care. 2010;14(1):R15.
19 Pettilä V, Hynninen M, Takkunen O, Kuusela P, Valtonen M. Predictive value of procalcitonin and interleukin 6 in critically ill patients with suspected sepsis. Intensive Care Med. 2002;28(9):1220-5.
20 Garnacho-Montero J, Huici-Moreno MJ, Gutiérrez-Pizarraya A, López I, Márquez-Vácaro JA, Macher H, et al. Prognostic and diagnostic value of eosinopenia, C-reactive protein, procalcitonin, and circulating cell-free DNA in critically ill patients admitted with suspicion of sepsis. Crit Care. 2014;18(3):R116.-2121 Jones AE, Shapiro NI, Trzeciak S, Arnold RC, Claremont HA, Kline JA; Emergency Medicine Shock Research Network (EMShockNet) Investigators. Lactate clearance vs central venous oxygen saturation as goals of early sepsis therapy: a randomized clinical trial. JAMA. 2010;303(8):739-46.) e dos escores clínicos.(2222 Seymour CW, Liu VX, Iwashyna TJ, Brunkhorst FM, Rea TD, Scherag A, et al. Assessment of Clinical Criteria for Sepsis: For the Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA. 2016;315(8):762-74.,2323 Giamarellos-Bourboulis EJ, Norrby-Teglund A, Mylona V, Savva A, Tsangaris I, Dimopoulou I, et al. Risk assessment in sepsis: a new prognostication rule by APACHE II score and serum soluble urokinase plasminogen activator receptor. Crit Care. 2012;16(4):R149.) O desempenho dos níveis de IL-3 demonstrado por meio da área sob a curva foi fraco, assim como aquele apresentado por outros biomarcadores tradicionalmente estudados, revelando a dificuldade de se obter informação prognóstica relevante sobre a sepse com o uso isolado de marcadores ou dados clínicos.
As diferenças entre os resultados obtidos por este estudo e por Weber et al. podem ser explicadas pelas diversas características dos pacientes. Weber et al. avaliaram população de 97 pacientes originários de duas coortes distintas, uma das quais retrospectiva. Os pacientes eram, em média, mais idosos (média de 65,8 ± 13,6 anos) e aparentemente tinham enfermidade mais grave (escores de severidade e mortalidade mais elevados) do que os pacientes incluídos no presente estudo. Além disto, a dosagem inicial de IL-3 no estudo de Weber et al. foi realizada nas primeiras 24 horas de evolução da sepse, em contraste com a janela de 48 horas que adotamos em nosso estudo.
Acrescente-se que, em seu estudo, apesar de testar a associação independente entre os níveis plasmáticos de IL-3 e a mortalidade por sepse, Weber et al. não exploraram a precisão deste marcador para a predição do desfecho.(99 Weber GF, Chousterman BG, He S, Fenn AM, Nairz M, Anzai A, et al. Interleukin-3 amplifies acute inflammation and is a potential therapeutic target in sepsis. Science. 2015;347(6227):1260-5.) Outros fatores que potencialmente poderiam explicar as diferenças encontradas entre os estudos se relacionam a variações genéticas entre as populações estudadas.(2424 David VL, Ercisli MF, Rogobete AF, Boia ES, Horhat R, Nitu R, et al. Early prediction of sepsis incidence in critically ill patients using specific genetic polymorphisms. Biochem Genet. 2017;55(3):193-203.,2525 Scherag A, Schöneweck F, Kesselmeier M, Taudien S, Platzer M, Felder M, et al. Genetic Factors of the Disease Course after Sepsis: A Genome-Wide Study for 28Day Mortality. EBioMedicine. 2016;12:239-46.)
Prevíamos que o comportamento dos níveis séricos de IL-3 durante a evolução do tratamento da sepse poderia ser útil para avaliar a resposta à antibioticoterapia. Entretanto, em contraste com marcadores de inflamação como PCR(2626 Lisboa T, Seligman R, Diaz E, Rodriguez A, Teixeira PJ, Rello J. C-reactive protein correlates with bacterial load and appropriate antibiotic therapy in suspected ventilator-associated pneumonia. Crit Care Med. 2008;36(1):166-71.) e procalcitonina,(2727 Seligman R, Meisner M, Lisboa TC, Hertz FT, Filippin TB, Fachel JM, et al. Decreases in procalcitonin and C-reactive protein are strong predictors of survival in ventilator-associated pneumonia. Crit Care. 2006;10(5):R125.,2828 Karlsson S, Heikkinen M, Pettilä V, Alila S, Väisänen S, Pulkki K, Kolho E, Ruokonen E; Finnsepsis Study Group. Predictive value of procalcitonin decrease in patients with severe sepsis: a prospective observational study. Crit Care. 2010;14(6):R205.) a IL-3 teve um comportamento acentuadamente errático. Além disto, a fraca ou ausente sincronia entre os níveis de IL-3 e os níveis de outros biomarcadores classicamente estudados, assim como com os valores dos escores de severidade e a ausência de associações entre os níveis de IL-3 e os desfechos secundários, indicam a necessidade de conduzir mais investigações a respeito do comportamento e da utilidade dessa citocina em pacientes sépticos.
Embora a análise dos valores de IL-3 não tenha mostrado qualquer utilidade particular neste caso, uma abordagem individualizada, com caracterização imunológica e da condição inflamatória dos pacientes, por meio de dados clínicos e biomarcadores, e de painéis de citocinas, pode proporcionar melhor manejo da sepse.(2929 Boomer JS, Green JM, Hotchkiss RS. The changing immune system in sepsis: is individualized immuno-modulatory therapy the answer? Virulence. 2014;5(1):45-56.
30 Osuchowski MF, Welch K, Yang H, Siddiqui J, Remick DG. Chronic sepsis mortality characterized by an individualized inflammatory response. J Immunol. 2007;179(1):623-30.-3131 Monneret G, Venet F. Sepsis-induced immune alterations monitoring by flow cytometry as a promising tool for individualized therapy. Cytometry B Clin Cytom. 2016;90(4):376-86.) Como exemplo deste tipo de abordagem, duas metanálises revelaram uso putativo benéfico de corticoides em pacientes admitidos com pneumonia adquirida na comunidade (PAC).(3232 Wan YD, Sun TW, Liu ZQ, Zhang SG, Wang LX, Kan QC. Efficacy and safety of corticosteroids for community-acquired pneumonia: a systematic review and meta-analysis. Chest. 2016;149(1):209-19.,3333 Siemieniuk RA, Meade MO, Alonso-Coello P, Briel M, Evaniew N, Prasad M, et al. Corticosteroid therapy for patients hospitalized with community-acquired pneumonia: a systematic review and meta-analysis. Ann Intern Med. 2015;163(7):519-28.) Contudo, a evidência sugere que o grupo de pacientes com PAC grave associada com resposta inflamatória exacerbada (caracterizada por níveis mais elevados de PCR) mostraria a melhor resposta com esta terapia.(3434 Torres A, Sibila O, Ferrer M, Polverino E, Menendez R, Mensa J, et al. Effect of corticosteroids on treatment failure among hospitalized patients with severe community-acquired pneumonia and high inflammatory response: a randomized clinical trial. JAMA. 2015;313(7):677-86.) Neste sentido, a dosagem de IL-3, acrescentada a um painel de biomarcadores, obtidos através de técnica simples e reprodutível, poderia ser capaz de ajudar a identificar um subgrupo de pacientes com prognóstico pior, que seriam, por exemplo, potenciais candidatos a uma terapia anti-inflamatória. Entretanto, este aspecto demanda a realização de estudos adicionais e direcionados.
Com relação a outras citocinas avaliadas neste estudo, os níveis de IL-6 e IL-10 se revelaram significantemente elevados em pacientes que morreram durante a permanência no hospital, em concordância com dados previamente publicados,(55 van der Poll T, Opal SM. Host-pathogen interactions in sepsis. Lancet Infect Dis. 2008;8(1):32-43.,1919 Pettilä V, Hynninen M, Takkunen O, Kuusela P, Valtonen M. Predictive value of procalcitonin and interleukin 6 in critically ill patients with suspected sepsis. Intensive Care Med. 2002;28(9):1220-5.,3535 Pinsky MR, Vincent JL, Deviere J, Alegre M, Kahn RJ, Dupont E. Serum cytokine levels in human septic shock. Relation to multiple-system organ failure and mortality. Chest. 1993;103(2):565-75.
36 Rose WE, Eickhoff JC, Shukla SK, Pantrangi M, Rooijakkers S, Cosgrove SE, et al. Elevated serum interleukin-10 at time of hospital admission is predictive of mortality in patients with Staphylococcus aureus bacteremia. J Infect Dis. 2012;206(10):1604-11.
37 Gogos CA, Drosou E, Bassaris HP, Skoutelis A. Pro-versus anti-inflammatory cytokine profile in patients with severe sepsis: a marker for prognosis and future therapeutic options. J Infect Dis. 2000;181(1):176-80.-3838 Kellum JA, Kong L, Fink MP, Weissfeld LA, Yealy DM, Pinsky MR, Fine J, Krichevsky A, Delude RL, Angus DC; GenIMS Investigators. Understanding the inflammatory cytokine response in pneumonia and sepsis: results of the Genetic and Inflammatory Markers of Sepsis (GenIMS) Study. Arch Intern Med. 2007;167(15):1655-63.) o que sugere que tanto o incremento da inflamação quanto a imunossupressão relacionada a sepse são fatores definidores de prognóstico sombrio. Por último, ao contrário do que esperávamos com base nos dados previamente publicados,(99 Weber GF, Chousterman BG, He S, Fenn AM, Nairz M, Anzai A, et al. Interleukin-3 amplifies acute inflammation and is a potential therapeutic target in sepsis. Science. 2015;347(6227):1260-5.) em nosso estudo não conseguimos encontrar qualquer correlação entre a concentração de IL-3 e os níveis de outras citocinas inflamatórias, ou com as contagens de leucócitos e neutrófilos.
Nosso estudo tem uma série de limitações. Foi um ensaio conduzido em um único centro, com amostra relativamente pequena de pacientes, o que limita o poder da análise estatística e a extrapolação de nossos achados. Não houve grupo controle para os níveis de IL-3 ou de outras citocinas em pacientes saudáveis ou em pacientes críticos sem sepse. Entretanto, como as mensurações de citocinas já se encontram bem padronizadas e o objetivo primário do estudo era avaliar o impacto dos níveis destas moléculas nos desfechos clínicos de uma população específica, esta dosagem não era obrigatória. A ocasião da coleta de soro pode também ser um fator limitante, quando se considera a janela de 48 horas para inclusão dos pacientes no estudo. Além desta janela de tempo permitir possível heterogeneidade da amostra, as mensurações em amostras de soro colhidas tardiamente podem não refletir de forma confiável os níveis de IL-3 durante o início da cascata inflamatória, em razão da curta meia-vida deste biomarcador.(3939 Guba SC, Stella G, Turka LA, June CH, Thompson CB, Emerson SG. Regulation of interleukin 3 gene induction in normal human T cells. J Clin Invest. 1989;84(6):1701-6.)
CONCLUSÃO
Níveis séricos elevados de interleucina 3 tiveram associação independente com a mortalidade hospitalar em pacientes sépticos em uma unidade de terapia intensiva, porém com baixo desempenho clínico. Os resultados obtidos com a utilização isolada desta citocina não foram superiores aos de outros biomarcadores e escores clínicos classicamente utilizados como preditores do desfecho em sepse. O benefício da utilização dos níveis de interleucina 3 como marcador isolado ou como parte de um painel de biomarcadores para caracterização do prognóstico e estratificação do risco em pacientes sépticos deve ser avaliado em futuras investigações.
AGRADECIMENTOS
Aos pacientes e à equipe médica, de enfermagem e do laboratório do Hospital das Clínicas da Universidade Federal de Minas Gerais. Ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) pelo suporte financeiro concedido a este trabalho.
REFERÊNCIAS
-
1Vincent JL, Marshall JC, Namendys-Silva SA, François B, Martin-Loeches I, Lipman J, Reinhart K, Antonelli M, Pickkers P, Njimi H, Jimenez E, Sakr Y; ICON investigators. Assessment of the worldwide burden of critical illness: the intensive care over nations (ICON) audit. Lancet Respir Med. 2014;2(5):380-6.
-
2Martim GS, Mannino DM, Eaton S, Moss M. The epidemiology of sepsis in the United States from 1979 through 2000. N Engl J Med. 2003;348(16):1546-54.
-
3Goodwin AJ, Rice DA, Simpson KN, Ford DW. Frequency, cost, and risk factors of readmissions among severe sepsis survivors. Crit Care Med. 2015;43(4):738-46.
-
4Iwashyna TJ, Ely EW, Smith DM, Langa KM. Long-term cognitive impairment and functional disability among survivors of severe sepsis. JAMA. 2010;304(16):1787-94.
-
5van der Poll T, Opal SM. Host-pathogen interactions in sepsis. Lancet Infect Dis. 2008;8(1):32-43.
-
6Heumann D, Roger T. Initial responses to endotoxins and Gram-negative bactéria. Clin Chim Acta. 2002;323(1-2):59-72.
-
7Casey LC, Balk RA, Bone RC. Plasma cytokine and endotoxin levels correlate with survival in patients with the sepsis syndrome. Ann Intern Med. 1993;119(8):771-8.
-
8Eichacker PQ, Parent C, Kalil A, Esposito C, Cui X, Banks SM, et al. Risk and the efficacy of antiinflammatory agentes: retrospective and confirmatory studies of sepsis. Am J Respir Crit Care Med. 2002;166(9):1197-205.
-
9Weber GF, Chousterman BG, He S, Fenn AM, Nairz M, Anzai A, et al. Interleukin-3 amplifies acute inflammation and is a potential therapeutic target in sepsis. Science. 2015;347(6227):1260-5.
-
10Singer M, Deutschman CS, Seymour CW, Shankar-Hari M, Annane D, Bauer M, et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA. 2016;315(8):801-10.
-
11Bone RC, Balk RA, Cerra FB, Dellinger RP, Fein AM, Knaus WA, et al. Definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis. The ACCP/SCCM Consensus Conference Committee. American College of Chest Physicians/Society of Critical Care Medicine. Chest. 1992;101(6):1644-55.
-
12Levy MM, Fink MP, Marshall JC, Abraham E, Angus D, Cook D, Cohen J, Opal SM, Vincent JL, Ramsay G; SCCM/ESICM/ACCP/ATS/SIS. 2001 SCCM/ESICM/ACCP/ATS/SIS International Sepsis Definitions Conference. Crit Care Med. 2003;31(4):1250-6.
-
13Knaus WA, Draper EA, Wagner DP, Zimmerman JE. APACHE II: a severity of disease classification system. Crit Care Med. 1985;13(10):818-29.
-
14Vincent JL, Moreno R, Takala J, Willatts S, De Mendonça A, Bruining H, et al. The SOFA (Sepsis-related Organ Failure Assessment) score to describe organ dysfunction/failure. On behalf of the Working Group on Sepsis-Related Problems of the European Society of Intensive Care Medicine. Intensive Care Med. 1996;22(7):707-10.
-
15Ferreira FL, Bota DP, Bross A, Mélot C, Vincent JL. Serial evaluation of the SOFA score to predict outcome in critically ill patients. JAMA. 2001;286(14):1754-8.
-
16Lobo SM, Lobo FR, Bota DP, Lopes-Ferreira F, Soliman HM, Mélot C, et al. C-reactive protein levels correlate with mortality and organ failure in critically ill patients. Chest. 2003;123(6):2043-9.
-
17Jensen JU, Heslet L, Jensen TH, Espersen K, Steffensen P, Tvede M. Procalcitonin increase in early identification of critically ill patients at high risk of mortality. Crit Care Med. 2006;34(10):2596-602.
-
18Pierrakos C, Vincent JL. Sepsis biomarkers: a review. Crit Care. 2010;14(1):R15.
-
19Pettilä V, Hynninen M, Takkunen O, Kuusela P, Valtonen M. Predictive value of procalcitonin and interleukin 6 in critically ill patients with suspected sepsis. Intensive Care Med. 2002;28(9):1220-5.
-
20Garnacho-Montero J, Huici-Moreno MJ, Gutiérrez-Pizarraya A, López I, Márquez-Vácaro JA, Macher H, et al. Prognostic and diagnostic value of eosinopenia, C-reactive protein, procalcitonin, and circulating cell-free DNA in critically ill patients admitted with suspicion of sepsis. Crit Care. 2014;18(3):R116.
-
21Jones AE, Shapiro NI, Trzeciak S, Arnold RC, Claremont HA, Kline JA; Emergency Medicine Shock Research Network (EMShockNet) Investigators. Lactate clearance vs central venous oxygen saturation as goals of early sepsis therapy: a randomized clinical trial. JAMA. 2010;303(8):739-46.
-
22Seymour CW, Liu VX, Iwashyna TJ, Brunkhorst FM, Rea TD, Scherag A, et al. Assessment of Clinical Criteria for Sepsis: For the Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA. 2016;315(8):762-74.
-
23Giamarellos-Bourboulis EJ, Norrby-Teglund A, Mylona V, Savva A, Tsangaris I, Dimopoulou I, et al. Risk assessment in sepsis: a new prognostication rule by APACHE II score and serum soluble urokinase plasminogen activator receptor. Crit Care. 2012;16(4):R149.
-
24David VL, Ercisli MF, Rogobete AF, Boia ES, Horhat R, Nitu R, et al. Early prediction of sepsis incidence in critically ill patients using specific genetic polymorphisms. Biochem Genet. 2017;55(3):193-203.
-
25Scherag A, Schöneweck F, Kesselmeier M, Taudien S, Platzer M, Felder M, et al. Genetic Factors of the Disease Course after Sepsis: A Genome-Wide Study for 28Day Mortality. EBioMedicine. 2016;12:239-46.
-
26Lisboa T, Seligman R, Diaz E, Rodriguez A, Teixeira PJ, Rello J. C-reactive protein correlates with bacterial load and appropriate antibiotic therapy in suspected ventilator-associated pneumonia. Crit Care Med. 2008;36(1):166-71.
-
27Seligman R, Meisner M, Lisboa TC, Hertz FT, Filippin TB, Fachel JM, et al. Decreases in procalcitonin and C-reactive protein are strong predictors of survival in ventilator-associated pneumonia. Crit Care. 2006;10(5):R125.
-
28Karlsson S, Heikkinen M, Pettilä V, Alila S, Väisänen S, Pulkki K, Kolho E, Ruokonen E; Finnsepsis Study Group. Predictive value of procalcitonin decrease in patients with severe sepsis: a prospective observational study. Crit Care. 2010;14(6):R205.
-
29Boomer JS, Green JM, Hotchkiss RS. The changing immune system in sepsis: is individualized immuno-modulatory therapy the answer? Virulence. 2014;5(1):45-56.
-
30Osuchowski MF, Welch K, Yang H, Siddiqui J, Remick DG. Chronic sepsis mortality characterized by an individualized inflammatory response. J Immunol. 2007;179(1):623-30.
-
31Monneret G, Venet F. Sepsis-induced immune alterations monitoring by flow cytometry as a promising tool for individualized therapy. Cytometry B Clin Cytom. 2016;90(4):376-86.
-
32Wan YD, Sun TW, Liu ZQ, Zhang SG, Wang LX, Kan QC. Efficacy and safety of corticosteroids for community-acquired pneumonia: a systematic review and meta-analysis. Chest. 2016;149(1):209-19.
-
33Siemieniuk RA, Meade MO, Alonso-Coello P, Briel M, Evaniew N, Prasad M, et al. Corticosteroid therapy for patients hospitalized with community-acquired pneumonia: a systematic review and meta-analysis. Ann Intern Med. 2015;163(7):519-28.
-
34Torres A, Sibila O, Ferrer M, Polverino E, Menendez R, Mensa J, et al. Effect of corticosteroids on treatment failure among hospitalized patients with severe community-acquired pneumonia and high inflammatory response: a randomized clinical trial. JAMA. 2015;313(7):677-86.
-
35Pinsky MR, Vincent JL, Deviere J, Alegre M, Kahn RJ, Dupont E. Serum cytokine levels in human septic shock. Relation to multiple-system organ failure and mortality. Chest. 1993;103(2):565-75.
-
36Rose WE, Eickhoff JC, Shukla SK, Pantrangi M, Rooijakkers S, Cosgrove SE, et al. Elevated serum interleukin-10 at time of hospital admission is predictive of mortality in patients with Staphylococcus aureus bacteremia. J Infect Dis. 2012;206(10):1604-11.
-
37Gogos CA, Drosou E, Bassaris HP, Skoutelis A. Pro-versus anti-inflammatory cytokine profile in patients with severe sepsis: a marker for prognosis and future therapeutic options. J Infect Dis. 2000;181(1):176-80.
-
38Kellum JA, Kong L, Fink MP, Weissfeld LA, Yealy DM, Pinsky MR, Fine J, Krichevsky A, Delude RL, Angus DC; GenIMS Investigators. Understanding the inflammatory cytokine response in pneumonia and sepsis: results of the Genetic and Inflammatory Markers of Sepsis (GenIMS) Study. Arch Intern Med. 2007;167(15):1655-63.
-
39Guba SC, Stella G, Turka LA, June CH, Thompson CB, Emerson SG. Regulation of interleukin 3 gene induction in normal human T cells. J Clin Invest. 1989;84(6):1701-6.
Editado por
Datas de Publicação
-
Publicação nesta coleção
10 Jan 2019 -
Data do Fascículo
Oct-Dec 2018
Histórico
-
Recebido
05 Mar 2018 -
Aceito
04 Jul 2018