Resumos
Um bovino esplenectomizado foi inoculado com os agentes da Tristeza Parasitária e observado, durante 40 dias, quanto à temperatura corporal, hematócrito e quadro clínico. Amostras de sangue, com e sem anticoagulante, foram coletadas da jugular nos 8°, 10°, 12°, 22°, 24° e 26° dias pós-inoculação, confeccionando-se lâminas de sangue através das técnicas de Distensão Fina, Distensão de Gota de Coágulo e Esfregaço de Fragmento de Coágulo. O corante de Giemsa puro e diluído foi utilizado para coloração das lâminas. A parasitemia por Anaplasma marginale foi mensurada através de percentagem em todas as lâminas e utilizada para a avaliação do desempenho das técnicas. Os resultados obtidos foram satisfatórios, principalmente quando utilizado o corante diluído, recomendando-se as 3 técnicas para pesquisa de Anaplasma para casos de comprovação de diagnóstico.
distensão; gota de coágulo; fragmento de coágulo; giemsa; hemozoários
A 6-month-old splenectomized calf was inoculated with blood from a cattle with Tick Fever. The clinical signs, rectal temperature and packed cell volume were observed between the 0 and 40th days. Blood and blood clot samples were collected from the calf on the 8th, 10th, 22th, 24th and 26th days. The following techniques were evaluated by the Anaplasma marginale parasitemia: thin blood smear of blood clot fragment and smear of a drop of blood clot. The slides were stained by the dilute and pure Giemsa methods. The results were acceptable and the authors propose the use of the three techniques to confirm an Anaplasma diagnosis.
blood smear; clot smear; clot impression smear; hematozoan; giemsa
DIAGNÓSTICO DE Anaplasma marginale UTILIZANDO-SE SANGUE COAGULADO PARA A DETERMINAÇÃO DA PARASITEMIA1 1 Trabalho apresentado como um dos requisitos para obtenção do grau de mestre em Medicina Veterinária pela Universidade Federal do Rio Grande do Sul, financiado pela Universidade Federal do Rio Grande do Sul.
DIAGNOSIS OF Anaplasma marginale USING BLOOD CLOT FOR THE DETECTION OF PARASITEMIA
Neusa Saltiél Stobbe3 1 Trabalho apresentado como um dos requisitos para obtenção do grau de mestre em Medicina Veterinária pela Universidade Federal do Rio Grande do Sul, financiado pela Universidade Federal do Rio Grande do Sul. Elinor Fortes4 1 Trabalho apresentado como um dos requisitos para obtenção do grau de mestre em Medicina Veterinária pela Universidade Federal do Rio Grande do Sul, financiado pela Universidade Federal do Rio Grande do Sul. Nilton Rogério Santos da Silva3 1 Trabalho apresentado como um dos requisitos para obtenção do grau de mestre em Medicina Veterinária pela Universidade Federal do Rio Grande do Sul, financiado pela Universidade Federal do Rio Grande do Sul. Eunice Leonora Chaplin3 1 Trabalho apresentado como um dos requisitos para obtenção do grau de mestre em Medicina Veterinária pela Universidade Federal do Rio Grande do Sul, financiado pela Universidade Federal do Rio Grande do Sul. Maria de Graça de Souza Paiva2 1 Trabalho apresentado como um dos requisitos para obtenção do grau de mestre em Medicina Veterinária pela Universidade Federal do Rio Grande do Sul, financiado pela Universidade Federal do Rio Grande do Sul. Flávio Antônio Pacheco de Araújo3 1 Trabalho apresentado como um dos requisitos para obtenção do grau de mestre em Medicina Veterinária pela Universidade Federal do Rio Grande do Sul, financiado pela Universidade Federal do Rio Grande do Sul.
RESUMO
Um bovino esplenectomizado foi inoculado com os agentes da Tristeza Parasitária e observado, durante 40 dias, quanto à temperatura corporal, hematócrito e quadro clínico. Amostras de sangue, com e sem anticoagulante, foram coletadas da jugular nos 8°, 10°, 12°, 22°, 24° e 26° dias pós-inoculação, confeccionando-se lâminas de sangue através das técnicas de Distensão Fina, Distensão de Gota de Coágulo e Esfregaço de Fragmento de Coágulo. O corante de Giemsa puro e diluído foi utilizado para coloração das lâminas. A parasitemia por Anaplasma marginale foi mensurada através de percentagem em todas as lâminas e utilizada para a avaliação do desempenho das técnicas. Os resultados obtidos foram satisfatórios, principalmente quando utilizado o corante diluído, recomendando-se as 3 técnicas para pesquisa de Anaplasma para casos de comprovação de diagnóstico.
Palavras-chave: distensão, gota de coágulo, fragmento de coágulo, giemsa, hemozoários.
SUMMARY
A 6-month-old splenectomized calf was inoculated with blood from a cattle with Tick Fever. The clinical signs, rectal temperature and packed cell volume were observed between the 0 and 40th days. Blood and blood clot samples were collected from the calf on the 8th, 10th, 22th, 24th and 26th days. The following techniques were evaluated by the Anaplasma marginale parasitemia: thin blood smear of blood clot fragment and smear of a drop of blood clot. The slides were stained by the dilute and pure Giemsa methods. The results were acceptable and the authors propose the use of the three techniques to confirm an Anaplasma diagnosis.
Key Words: blood smear, clot smear, clot impression smear, hematozoan, giemsa.
INTRODUÇÃO
A riquétsia Anaplasma marginale é o agente responsável pela anaplasmose, uma parte da síndrome dos bovinos, conhecida, em nosso meio como Tristeza Parasitária. São poucos os dados referentes à prevalência da anaplasmose no Brasil, sendo que MADRUGA et al (1983) em levantamentos sorológicos, encontraram uma taxa de 7,95% na Região do Cerrado do Mato Grosso do Sul, enquanto RIBEIRO e REIS (1981) encontraram taxas superiores a 80% nas regiões de Minas Gerais.
As formas clínicas de anaplasmose podem ser de leve a superaguda, sendo normalmente leve em animais com até um ano de idade. Os sinais mais comuns são anemia, fraqueza, inapetência, febre, desidratação e constipação (RISTIC, 1977). Alguns fatores agravantes da anaplasmose são a permanência da condição de portador, em ausência de reinfecções, por até 5 anos; a formação de anticorpos contra componentes eritrocíticos de membrana (RISTIC et al, 1972); a condição intraeritrocítica do agente, que o protege contra ação direta de anticorpos (RISTIC, 1977); a possibilidade de transmissão transplacentária no último terço da gestação (BRINTON & PAUMER, 1976; ZAUGG & KUTTLER, 1984); e um nível nutricional muito elevado que agravaria o quadro clínico por haver maior disponibilidade de nutrientes também para a população parasitária (AJAYI et al, 1978).
Após a inoculação, o corpúsculo de Anaplasma invade o eritrócito, multiplica-se por divisão e forma o corpúsculo marginal (ERP & FAHRNEY, 1975), sendo que a passagem dos corpúsculos, de um eritrócito para outro, ocorre sem danos à membrana da célula hospedeira (RISTIC, 1977). Os primeiros corpúsculos iniciais podem ser encontrados no sangue já no 6° dia, porém a predominância dos corpúsculos marginais ocorre entre 19° e 34° dias (RISTIC & WATRACH, 1963). As alterações mais severas ocorrem após o pico parasitêmico, embora quadros clínicos semelhantes, mas menos graves, possam ocorrer em picos secundários e terciários. A afinidade do Anaplasma por fosfolipídeos eritrocíticos determinaria a necessidade de uma nova população celular, com valores normais destes elementos, para ocorrerem novas parasitemias (DIMOPOULLOS & BEDELL, 1962).
A técnica de distensão fina para exame de sangue vem sendo usada desde o início do século até os dias de hoje (FONSECA & BRAGA, 1924; VARELA, 1942; INSTITUTO INTERAMERICANO DE COOPERACIÓN PARA LA AGRICULTURA, 1985) e continua sendo o instrumento mais útil para o veterinário de campo no diagnóstico de anaplasmose e babesiose (RISTIC & LEVY, 1981). Para manter as condições ideais de exame é necessário que a amostra de sangue não sofra agitação, não seja exposta a altas temperaturas (DUKES, 1969) e que a lâmina seja confeccionada em uma a duas horas após a coleta de sangue (JAIN, 1986).
Baseando-se no limite de tempo após a coleta do sangue em que a distensão deve ser confeccionada e no diagnóstico de protozoários através de esfregaços de órgãos, CHAPLIN et al, (1987/88) desenvolveram a técnica de esfregaço de fragmentos de coágulo com resultados satisfatórios. A partir desta técnica, STOBBE et al (1988) desenvolveram uma técnica alternativa que utiliza uma gota de coágulo de sangue, obtendo boa vizualização dos elementos figurados.
Para a coloração do Anaplasma pode ser utilizado o laranja de acridina (GAINER, 1961), o azul de toluidina (ROGERS & WALLACE, 1966) e outros corantes, porém o mais utilizado, para hemocitozoários, é o Giemsa, diluído em água destilada, que permite coloração intensa em pouco tempo (PINTO, 1938; LANGERON, 1942; INSTITUTO INTERAMERICANO DE COOPERACIÓN PARA LA AGRICULTURA, 1985). Alguns erros de coloração que podem ser apontados são variação do pH da superfície da lâmina, coloração ou lavagem longas ou insuficientes, e evaporação do corante (JAIN, 1986).
Na formação do coágulo, o fibrinogênio é ativado em fibrina (KOLB, 1976) e produtos intermediários (GOODGER et al,1980), ficando presos os elementos corpusculares na rede de fibrina (KOLB, 1976; HAM, 1977; JAIN, 1986). Durante esse processo de organização do coágulo os leucócitos e os eritrócitos parasitados tendem a se localizar na superfície antes do término da coagulação, devido ao seu maior tamanho e menor peso específico (KOLD, 1976; HAM, 1977; JAIN, 1986) sendo que podem extravasar para o soro (DUKES, 1969). Baseado nesses dados FUJISAKI et al (1989) desenvolveu um processo de resgate de eritrócitos parasitados através de pressão sobre o coágulo.
O presente trabalho compara as técnicas de distensão fina de sangue, esfregaços de fragmento de coágulo e distensão de gota de coágulo de sangue, coradas com Giemsa puro e diluído, no diagnóstico de Anaplasma marginale com o objetivo de incorporar ou não as técnicas de coágulo às rotinas laboratoriais.
MATERIAL E MÉTODOS
O experimento teve lugar nos laboratórios e estábulo do Setor de Protozoologia da Faculdade de Veterinária da Universidade Federal do Rio Grande do Sul, Porto Alegre.
Foram estabelecidos 3 grupos de técnicas de exame de sangue - Distensão Fina de Sangue (DISTENSÃO), Esfregaço de Fragmento de coágulo de sangue (FRAGMENTO) , Distensão de Gota de Coágulo de sangue (GOTA) - e dois subgrupos de coloração - com solução - mãe de Giemsa (PURO) e método de Giemsa tradicional (DILUÍDO) .
Um bovino esplenectomizado, de origem européia, com aproximadamente 6 meses de idade, negativo para Babesia bovis, pelo teste e imunofluorescência indireta, foi utilizado como doador das amostras de sangue. O animal foi inoculado subcutaneamente no dia zero, com 5ml de sangue de outro bovino, comprovadamente portador dos agentes da Tristeza Parasitária. O monitoramento do animal foi feito através da observação diária de seu comportamento a partir do dia zero, da verificação de temperatura diária e duas vezes ao dia do 5° ao 40° dias, e da medição de hematócrito nos dias de coleta de sangue.
O animal foi medicado quando apresentou prostração, anorexia, queda de hematócrito e temperatura elevada, da seguinte forma: - no 13° dia com 1ml/20kg de peso de diaceturato de 4,4 diazoaminobenzamidina a 7%a, via intramuscular; -no 14° dia com o mesmo tratamento do 13° dia mais 10mg de dexametasonab, via intramuscular, 10ml de complexo vitamínicoc via intraperitoneal, 20 ml de antitóxicod, via intraperitoneal, 500ml de soro hidratantee, via intraperitoneal;
- no 27° dia com 450mg de cloridrato de tetraciclinaf, via intramuscular:
- no 28° dia com 10mg de dexametasona via intramuscular e 2,5ml/100kg de dipropionato de imidocarb a 12%g, via intramuscular.
As amostras de sangue foram coletadas sem e com anticoagulanteh da jugular, nos 8°, 10°, 12°, 22°, 24° e 26° dias de inoculação. As amostras sem anticoagulante foram deixadas coagular em repouso e em temperatura ambiente por uma hora, após o que foram refrigeradas até o seu processamento.
Um total de 72 lâminas das 6 coletas foram processadas e distribuídas nos grupos e subgrupos como segue.
As 6 amostras de sangue com anticoagulante foram processadas em até uma hora após a coleta e, de cada uma, confeccionou-se 4 distensões finas de sangue de acordo com LANGERON (1942).
As 6 amostras de coágulo de sangue foram processadas no mesmo dia da coleta, com exceção da amostra do 26° dia que foi processada 24 horas depois.
De cada amostra de coágulo confeccionou-se 4 distensões de gota de coágulo de sangue (STOBBE et al, 1988) e 4 esfregaços de fragmento de coágulo (CHAPLIN et al, 1987/88).
Utilizou-se as colorações pelo método de Giemsa diluído (PINTO, 1938; LANGERON, 1942) e pelo método de Giemsa puroi.
Cada coloração foi aplicada em 2 lâminas de cada amostra em todos os grupos. Utilizou-se um aumento de 1000 vezes a observação microscópica das lâminas.
A determinação da parasitemia foi feita de acordo com INSTITUTO INTERAMERICANO DO COOPERACIÓN PARA LA AGRICULTURA (1985).
Os dados foram submetidos à análise de variância e teste de Tukey aos níveis de significância de 5% e 1%.
RESULTADOS
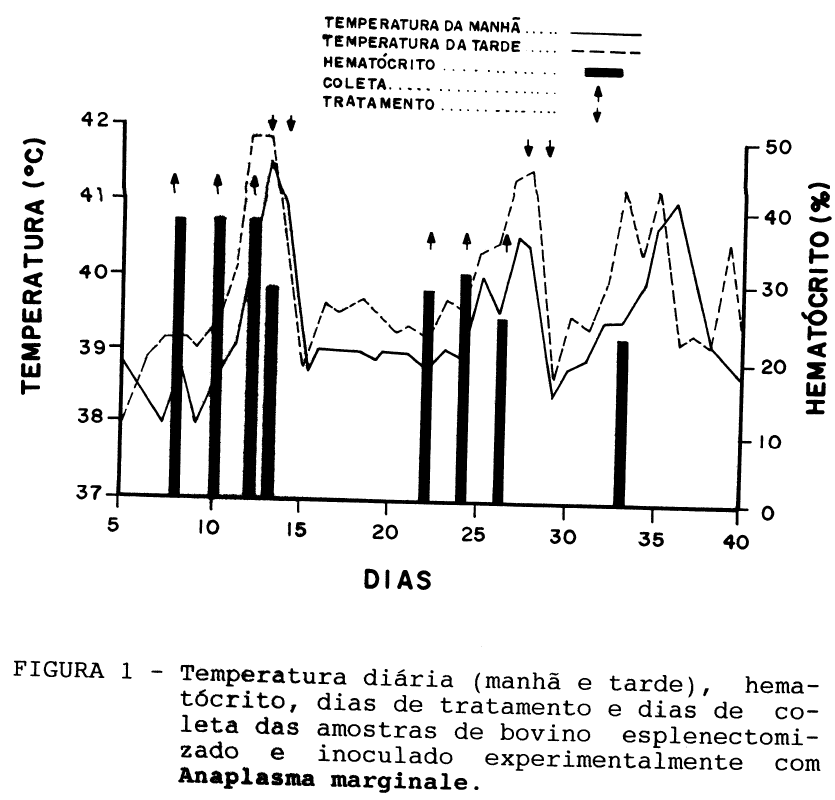
A observação clínica do animal teve os seguintes resultados: entre os dias 0-11°, 15-26°, 29-40° da inoculação não houve alterações de comportamento.
O bovino manifestou prostração entre os dias 12-14° com elevação brusca de temperatura no 12° dia e queda de hematócrito de 33% para 27% entre a manhã e a tarde do 13° dia (Figura 1); prostração, anorexia e taquipnéia nos 27-28° dias. Após os tratamentos específicos, nos 13-14° e 27-28° dias houve sensível recuperação com retorno de apetite e atitudes normais.
Os resultados obtidos em relação à parasitemia de Anaplasma marginale (Tabela 1) apresentaram diferenças entre grupos, subgrupos e tempo como segue:
- a média da parasitemia dos 3 grupos foi maior no 26° dia com significância estatística de 5%;
- o grupo GOTA detectou maior parasitemia que os grupos DISTENSÃO e FRAGMENTO, no 24° dia, mas sem diferença estatística;
- o grupo FRAGMENTO detectou maior parasitemia que o grupo GOTA e este maior que o grupo DISTENSÃO, no 26° com corante DILUÍDO, sendo as diferenças significativas a 5% e 1%.
- o subgrupo DILUÍDO detectou maior parasitemia que o PURO nos 3 grupos de técnicas com significância estatística a 5%.
- o grupo FRAGMENTO com corante PURO apresentou filmes nublados nos 8° e 12° dias, impossibilitando a vizualização. O bovino manifestou prostração entre os dias 12-14° com elevação brusca de temperatura no 12° dia e queda de hematócrito de 33% para 27% entre a manhã e a tarde do 13° dia (Figura 1); prostração, anorexia e taquipnéia nos 27-28° dias. Após os tratamentos específicos, nos 13-14° e 27-28° dias houve sensível recuperação com retorno de apetite e atitudes normais.
Os resultados obtidos em relação à parasitemia de Anaplasma marginale (Tabela 1) apresentaram diferenças entre grupos, subgrupos e tempo como segue:
- a média da parasitemia dos 3 grupos foi maior no 26° dia com significância estatística de 5%;
- o grupo GOTA detectou maior parasitemia que os grupos DISTENSÃO e FRAGMENTO, no 24° dia, mas sem diferença estatística;
- o grupo FRAGMENTO detectou maior parasitemia que o grupo GOTA e este maior que o grupo DISTENSÃO, no 26° com corante DILUÍDO, sendo as diferenças significativas a 5% e 1%.
- o subgrupo DILUÍDO detectou maior parasitemia que o PURO nos 3 grupos de técnicas com significância estatística a 5%.
- o grupo FRAGMENTO com corante PURO apresentou filmes nublados nos 8° e 12° dias, impossibilitando a vizualização.
DISCUSSÃO
Os melhores desempenhos na quantificação de Anaplasma marginale, nas técnicas de gota e de fragmento, podem ser atribuídos ao local do coágulo sanguíneo em que foram coletadas as amostras de sangue, uma vez que o eritrócito parasitado se localiza na superfície do coágulo (DUKES, 1969; KOLB, 1976; HAM, 1977; JAIN, 1986) e à pressão no coágulo exercida pela lâmina tanto para a captura da gota como também no ato de pressionar o fragmento de sangue (FUJISAK et al, 1989). Apesar do excelente resultado na quantificação de Anaplasma, apresentado pelo grupo Fragmento, é necessário considerar-se as dificuldades de vizualização que esta técnica pode apresentar (STOBBE, 1990) e que ocorreram nos 8° e 12° dias do experimento.
O melhor desempenho do subgrupo DILUÍDO em relação ao subgrupo PURO pode ser atribuído ao seu tempo de atuação, que é mais longo, e que permitiria coloração mais intensa dos parasitos, facilitando sua identificação e quantificação. No entanto, muitas vezes, encontra-se dificuldades da diferenciação do Anaplasma de outros corpúsculos intraeritrocíticos quando se utiliza o corante de Giemsa, sendo necessário pesquisar-se outros corantes que sejam específicos para riquétsias.
A média de parasitemia entre os 3 grupos, que foi maior no 26° dia, e o quadro clínico apresentado pelo animal nos 27° e 28° dias estão de acordo com RISTIC & WATRACH (1963) e RISTIC (1971). As alterações de temperatura e queda de hematócrito, do 12° e 14° dias foi atribuído à Babesia spp. e as demais relacionadas ao Anaplasma. Essas manifestações diversas à moda do agente, podem estar relacionadas com a ausência de baço; com picos secundários e terciários de Anaplasma com manifestação clínica leve, associados aos níveis intraeritrocíticos de fosfolipídeos (DIMOPOULLOS & BEDELL, 1962); com o processo auto-imune (RISTIC et al, 1972); com a condição intraeritricítica do agente que o protege da ação direta de anticorpos (RISTIC, 1977) e até mesmo com o elevado nível nutricional do animal 9AJAYI et al, 1978).
Esses dados têm importância em relação ao desenvolvimento ou não da imunidade e a conseqüente necessidade de repetição de tratamento que, no experimento, foram feitos em função do agravamento do quadro clínico e da ausência do baço, que poderiam implicar na perda do animal.
CONCLUSÕES
- é possível diagnosticar-se Anaplasma marginale através das técnicas que utilizam coágulo de sangue;
- a técnica de FRAGMENTO e de GOTA apresentaram melhor desempenho na quantificação de Anaplasma que a técnica de DISTENSÃO;
- o corante de Giemsa DILUÍDO teve melhor desempenho que o PURO na coloração de Anaplasma marginale;
- o local do coágulo utilizado na confecção dos filmes demonstrou-se satisfatório.
AGRADECIMENTOS
O nosso muito obrigado aos companheiros do Setor de Parasitologia do Instituto de Pesquisas Veterinárias Desidério Finamor e ao técnico Agnelo Ribeiro, desta Faculdade, por toda colaboração que recebemos.
FONTES DE AQUISIÇÃO
a - Ganaseg: Squibb Indústria Química: Av. João Dias, 1084 - Santo Amaro, SP.
b - Azium: Schering: Produtos Veterinários Ltda. Estrada dos Bandeirantes, 3091. Rio de Janeiro, RJ.
c - Potenay: Indústrias Farmacêuticas Fontoura-Wyeth S/A. Av. Rangel Pestana, 1105. São Paulo, SP.
d - Toxifim, Boehringer - Ingelheim: Alameda dos Quinimuros, 187 - 04068 São Paulo, SP.
e - Ringer lactato: Hiplex S/A: Rua Francisco Pereira Coutinho, 347 - Campinas, SP.
f - Terramicina L.A., Pfizer: Rodovia Presidente Dutra, Km 225 - Guarulhos, SP.
g - Imizol, Wellcome S/A. Rodovia Raposo Tavares, Km 26,9 - Caixa Postal 503 -Cotia, SP.
h - Ácido etilinodiaminotetracético na concentração de 1,4mg/ml de sangue: BECTON, DICKINSON INDÚSTRIAS CIRÚRGICAS LTDA. Rua Ciro Correia Pereira, 550 - Curitiba, PR.
i - SANTOS, Virgínio dos. Comunicação pessoal. Santa Maria, 1979.
2Médico Veterinário, mestranda em Medicina Veterinária, bolsista do CNPQ. Av. Bento Gonçalves 9090, Porto Alegre, RS. CEP 91.500.
3Prof. da Faculdade de Veterinária da Universidade Federal do Rio Grande do Sul.
4Professor do Instituto de Biociências da Universidade Federal do Rio Grande do Sul.
Aprovado para publicação em 11.03.92.
- AJAYI, J.A., WILSON, A.J., CAMPBELL, R.S.F. Experimental bovine anaplasmosis, clinical-pathological and nutritional studies. Res Vet Sci, London, V. 25, p. 76-81, 1978.
- BRINTON, L.S., PAUMER, R.J. Vertical transmission of Anaplasma marginale in cattle. Theriogenology, Los Altos, v. 6, n. 5, p. 515, 1976.
- CHAPLIN, E.L., STOBBE, N.S., ARAÚJO, F.A.P., et al. Diagnóstico laboratorial de hemocitozoários através de esfregaço de sangue coagulado (Nota Prévia). Arq Fac Vet UFRGS, Porto Alegre, v. 15/16, p. 65, 1987/88.
- DIMOPOULLOS, G.T., BEDELL, D.M. Studies of bovine erythrocytes in anaplasmosis. II. Role of chemical and physical changes in erythrocytes in the mechanism of anemia in splenectomised calves. Am J Vet Res, Schaumburg, v. 23, n. 95, p. 813-820, 1962.
- DUKES, H.J. Fisiologia de los animales domesticos 3. ed. Madrid: Aguilar, 1969. 1864 p.
- ERP, E., FAHRNEY, D. Exit of Anaplasma marginale from bovine red blood cells. Am J Vet Res, Schaumburg, v. 36, n. 5, p. 707-709, 1975.
- FONSECA, A., BRAGA, A. Noções Sobre a Tristeza Parasitária dos Bovinos Rio de Janeiro: Ministério da Agricultura, 1924, 216 p.
- FUJISAKI, K., KAMIO, T., NAKAMURA, Y., et al. Theileria sergenti: A simple method for isolation of piroplasms from erythrocytes. Jpn J Vet Sci, Tokyo, v. 51, n. 2, p. 457-459, 1989.
- GAINER, J.H. Demonstration of Anaplasma marginale with the fluorescent dye Acridine Orange: Comparison with the Complemente-Fixation test and Wrighf's Stain. Am J Vet Res, Schaumburg, v. 22, p. 882-886, 1961.
- GOODGER, B.V., WRIGHT, I.G., MAHONEY, D.F. Babesia bovis (argentina): Analysis of paracoagulation proteins in acutly infected cattle. AJEBAK, v. 58, n. 2, p. 179-188, 1980.
- HAM, A.W. Histologia 7. ed., Rio de Janeiro: Guanabara Koogan, 1977. 756 p.
- INSTITUTO INTERAMERICANO DE COOPERACIÓN PARA LA AGRICULTURA. Técnicas para el Diagnostico de Babesiosis y Anaplasmosis Bovina San José, 1985. 79 p.
- JAIN, N.C. Schalms Veterinary Hematology 4. ed. Philadelphia: Lea & Febiger, 1986. 1221 p.
- KOLB, E. Fisiologia Veterinária 2. ed. Zaragoza: Acribia, 1976. 1115 p.
- LANGERON, M. Précis de Microscopie 6. ed. Paris: Masson, 1942. 1340 p.
- MADRUGA, C.R., AYCARDI, E., PUTT, N. Epidemiologia da Anaplasmose de Babesiose em bovinos da região do Cerrado do Estado do Mato Grosso do Sul. I. Prevalência. Arq Bras Med Vet Zoot, Niterói, v. 35, n. 5, p. 631-640, 1983.
- PINTO, C. Zooparasitos de interesse Médico e Veterinário Rio de Janeiro: Pimenta de Mello, 1938. 369 p.
- RIBEIRO, M.F.B., REIS, R. Prevalência de Anaplasmose em 4 regiões do Estado de Minas Gerais. Arq Esc Vet UFMG, Belo Horizonte, v. 33, n. 1, p. 57-62, 1981.
- RISTIC, M. Parasitic Protozoa New York: Academic Press, 1977, v. 4, Bovine Anaplasmosis, p. 235-249.
- RISTIC, M., WATRACH, A.M. Anaplasmosis. VI. Studies and a hypothesis concerning the cycle of development of the causative agent. Am J Vet Res, Schaumburg, v. 24, n. 99, p. 267-277, 1963.
- ROGERS, T.E., WALLACE, W.R. A Rapid staining technique for Anaplasma Am J Vet Res, Schaumburg, v. 27, n. 119, p. 1127-1128, 1966.
- STOBBE, N.S. Coágulo de sangue no diagnóstico de hematozoários. Desenvolvimento e comparação entre técnicas. Porto Alegre, UFRGS, 1990. 59 p. Dissertação (Mestrado em Doenças Parasitárias). Curso de Pós-Graduação em Medicina Veterinária, UFRGS, 1990.
- STOBBE, N.S., CHAPLIN, E.L., PAIVA, M.G.S., et al. Diagnóstico laboratorial de hemocitozoários através da distensão de gota de coágulo de Sangue (Nota Prévia). In: CONGRESSO ESTADUAL DE MEDICINA VETERINÁRIA, 1988. Porto Alegre, RS. Anais Porto Alegre, SOVERGS, 1988, 122 P. P. 61.
- VARELA, M.E. Lecciones de Hematologia e. ed. Buenos Aires: El Ateneo, 1942. 382 p.
- ZAUGG, J.L., KUTTLER, K.L. Bovine Anaplasmosis: In utero transmission and the imunologic significance of ingested colostral antibodies. Am J Vet Res, Schaumburg, v. 45, n. 3, p. 440, 1984.
Datas de Publicação
-
Publicação nesta coleção
25 Set 2014 -
Data do Fascículo
Dez 1991
Histórico
-
Aceito
11 Mar 1992