Resumos
RESUMO Plantas de feijão foram regeneradas via organogêse, a partir de sementes da cultivar FT 83-120 germinadas em meio MS acrescido de vitaminas B5. Explantes caulinares contendo 3/4 do nó-cotiledonar foram submetidos a três cultivos sucessivos, com intervalos de 21 dias cada um, em três concentrações de BAP (Benzil-aminopurina). A formação de brotos ocorreu entre o sexto e o oitavo dia de cultivo, a partir do eixo embrionário, sendo influenciado pelo tempo de cultivo e pelas concentrações de BAP. Os brotos foram enraizados em meio MS acrescido de 2µM/I de ANA (Ácido Naftaleno Acético) e 0,5µM/I de GA3 (Ácido Giberélico). As plantas obtidas foram transferidas para o solo e aclimatadas em casa de vegetação, onde cresceram até o amadurecimento.
Phaseolus vulgaris; nó-cotiledonar; regeneração; cultura de tecidos; organogênese
SUMMARY Plants were regenerated via organogenesis from blackbean seeds, cultivar FT 83-120, germinated on MS medium supplemented with B5 vitamins. Caulinar explants containing 3/4 of cotyledonary node were subcultured three times with twenty-one days interval each in three concentrations of BAP (Benzyl aminopurine). Shoot formation occured between the sixth and the eighth day after cultivation from ring meristematic tissue and was influenced by the time of cultivation and concentration of BAP. The shoots were rooted in MS medium supplemented with 2µM/I of NAA (Naphthalene Acetic Acid) and 0,5µM/I of GA3 (Gibberelic Acid). The plantlets were transferred to soil and acdimated in greenhouse where they were grown untill maturation.
Phaseolus vulgaris; cotyledonary node; regeneration; tissue cultuy; organogenesis
REGENERAÇÃO DE PLANTAS DE FEIJÃO (Phaseolus vulgaris)VIA ORGANOGÊNESE
PLANT REGENERATION OF BLACKBEAN (Phaseolus vulgaris)VIA ORGANOGENESIS
Liane Terezinha Dorneles1 1 Engenheiro Agrônomo, MSc, Bolsista RHAE/CNPq, Departamento de Fitotecnia, Universidade Federal de Santa Maria (UFSM), 97119-900, Santa Maria, RS. Antônio Costa de Oliveira2 1 Engenheiro Agrônomo, MSc, Bolsista RHAE/CNPq, Departamento de Fitotecnia, Universidade Federal de Santa Maria (UFSM), 97119-900, Santa Maria, RS. Susana Cristine Siebeneichler3 1 Engenheiro Agrônomo, MSc, Bolsista RHAE/CNPq, Departamento de Fitotecnia, Universidade Federal de Santa Maria (UFSM), 97119-900, Santa Maria, RS.
RESUMO
Plantas de feijão foram regeneradas via organogêse, a partir de sementes da cultivar FT 83-120 germinadas em meio MS acrescido de vitaminas B5. Explantes caulinares contendo 3/4 do nó-cotiledonar foram submetidos a três cultivos sucessivos, com intervalos de 21 dias cada um, em três concentrações de BAP (Benzil-aminopurina). A formação de brotos ocorreu entre o sexto e o oitavo dia de cultivo, a partir do eixo embrionário, sendo influenciado pelo tempo de cultivo e pelas concentrações de BAP. Os brotos foram enraizados em meio MS acrescido de 2 µM/I de ANA (Ácido Naftaleno Acético) e 0,5µM/I de GA3 (Ácido Giberélico). As plantas obtidas foram transferidas para o solo e aclimatadas em casa de vegetação, onde cresceram até o amadurecimento.
Palavras-chave: Phaseolus vulgaris, nó-cotiledonar, regeneração, cultura de tecidos, organogênese.
SUMMARY
Plants were regenerated via organogenesis from blackbean seeds, cultivar FT 83-120, germinated on MS medium supplemented with B5 vitamins. Caulinar explants containing 3/4 of cotyledonary node were subcultured three times with twenty-one days interval each in three concentrations of BAP (Benzyl aminopurine). Shoot formation occured between the sixth and the eighth day after cultivation from ring meristematic tissue and was influenced by the time of cultivation and concentration of BAP. The shoots were rooted in MS medium supplemented with 2µM/I of NAA (Naphthalene Acetic Acid) and 0,5µM/I of GA3 (Gibberelic Acid). The plantlets were transferred to soil and acdimated in greenhouse where they were grown untill maturation.
Key words: Phaseolus vulgaris, cotyledonary node, regeneration, tissue cultuy. organogenesis.
INTRODUÇÃO
Estudos sobre a transformação genética em plantas leguminosas são raramente relatados, devido estas apresentarem-se recalcitrantes em suas respostas ao cultivo in vitro (SCHENK & HILDEBRANDT, 1972; EVANS et al., 1981; GULATI & JAIWAL, 1990).
A carência de um eficiente sistema de regeneração para leguminosas tem retardado o melhoramento destas espécies por seleção e transformação de plantas via cultura de tecidos. Segundo FRANKLIN et al. (1991), o feijão tem sido usado como um sistema modelo para o estudo de mecanismos moleculares básicos, os quais possibilitam a decodificação dos sistemas de defesa da planta. Diante disso, buscou-se através do cultivo in vitro de nós-cotiledonares a obtenção de um sistema eficiente para a regeneração organogênica de feijão.
MATERIAL E MÉTODOS
Foram utilizadas sementes de feijão (phaseolus vulgaris L.) da cultivar FT 83-120 proveniente do Ensaio Estadual do Feijão do Departamento de Fitotecnia/UFSM.
Para minimizar a variação, foram selecionadas sementes de tamanho uniforme, cujo tegumento apresentava-se intacto.
As sementes foram submetidas a um processo de desinfecção que constou de: imersão em ácido sulfúrico concentrado por um minuto; etanol 95% por um minuto; e, hipoclorito de sódio (20% do produto comercial) por vinte minutos. Posteriormente foram lavadas cinco vezes com água destilada esterilizada.
O meio de cultura utiizado foi o MS de MURASCHIGE & SKOOG (1962), acrescido de vitaminas do meio B5 (GAMBORG et al., 1968), 100mg/l de mio-inositol, 3% de sacarose e 0,8% de ágar (Reagem), com pH ajustado de 5,8 ± 0,1 com KOH 0,1M.
Foram utilizadas cinco sementes por frasco (60mm de diâmetro x 100mm de altura) com 20ml de meio de cultura cada. A germinação ocorreu em câmara de crescimento com fotoperíodo de 16 horas e temperatura de 25°C ± 1°C por um período de seis a oito dias.
Os explantes foram obtidos em câmara asséptica. A preparação consistiu da remoção de 1/3 do nó-cotiledonar e epicótilo e hipocótilo a partir de 1mm da região nodal (Figura 1).
Os explantes foram tranferidos para o meio de Indução de gemas contendo sais MS acrescido das vitaminas do B5, BAP nas doses de 2,5µM/I; 5,0µM/I e 10µM/I, 3% de sacarose e 0,8% de ágar (Reagen), pH idêntico ao meio de germinação.
Após 21 dias de incubação os brotos com mais de 2,5cm foram removidos e transferidos para meio de enraizamento contendo sais e vitaminas do meio MS suplementado com 100 mg/l de mio-inositol, 3% de sacarose, 2µM/I de ANA, 0,5µM/I de GA3 e 0,8% de ágar (Reagem), ph idêntico aos meios anteriores.
O remanescente do explante foi subcultivado em meio de indução de brotos, fresco, mais duas vezes, por um período de 21 dias cada um, para a formação de novas porções apicais. Após o enraizamento as plantas foram aclimatadas e transferidas para vasos em casa de vegetação, onde cresceram até a maturidade. As avaliações foram realizadas no momento da transferência das gemas. Foram avaliados os seguintes parâmetros: sobrevivência dos nós-cotiledonares e percentagem de formação de gemas em cada tratamento nas três épocas de cultivo.
RESULTADOS E DISCUSSÃO
Uma alta percentagem de sobrevivência dos nós-cotiledonares foi obtido no primeiro cultivo, bem como nos dois subcultivos subseqüentes (Figura 2).
Não ocorreu diferença significativa entre o primeiro cultivo e os subcultivos na sobrevivência dos explantes com relação às diferentes doses de BAP, entretanto o segundo subcultivo evidenciou que o aumento das doses propiciou um aumento na sua sobrevivência. Para FRANKLIN et al. (1991), a diminuição do potencial de sobrevivência do segundo subcultivo estaria provavelmente relacionada com a queda das reservas existentes no nó. A sobrevivência dos mesmos poderia estar vinculada ao aumento das doses de citocinina. GALTON & DAVIES (1969), sugeriram que embora as citocininas não aluassem diretamente no mecanismo de sobrevivência, elas deveriam estar presentes no estágio inicial do desenvolvimento dos brotos, impedindo desta forma a reversão do processo ocasionado pela falta de reservas endógenas do nó.
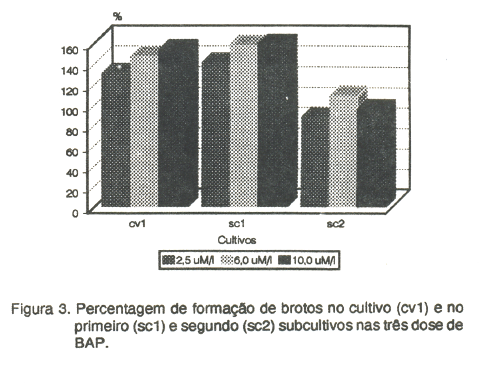
A adição de BAP em todos os tratamentos induziu a formação de calos na base do explante, aproximadamente sete dias a partir do início do cultivo. Paralelamente, entre o sexto e oitavo dias, ocorreu o desenvolvimento das gemas localizados principalmente no eixo embrionário (Figura 3). A percentagem de formação de brotos no cultivo e primeiro subcultivo esteve relacionada com a concentração de BAP no meio de cultura, enquanto que no segundo subcultivo a percentagem de brotos foi menor em relação aos anteriores. O aumento das doses de BAP não se refletiu no aumento da formação dos mesmos, provavelmente devido às alterações metabólicas ocorridas durante o processo, como compostos fenólicos liberados no corte do explante e idade. Resultados semelhantes também foram encontrados por MAcCLEAN & GRAFTON (1989) e GULATI & JAIMAL (1990) que demonstraram que a habilidade dos nós produzirem gemas não está relacionada à concentração de BAP no meio de cultura. Entretanto, os últimos autores também afirmaram que a freqüência de regeneração, bem como o número de brotos por explante varia com o genótipo, embora esta variação também possa ser atribuída ao estado fisiológico do explante, devido a maior mobilização das reservas cotiledonares encontradas no eixo embrionário, conforme o avanço dos estágios de germinação. Isto provavelmente explique o aumento no número de gemas no primeiro subcuttivo.
CONCLUSÕES
Os resultados obtidos impossibilitaram o estabelecimento definitivo de um protocolo para a regeneração de plantas de feijão. No entanto, verificou-se que a percentagem de sobrevivência é maior na dose de 5,0µM/I de BAP no cultivo e no primeiro subcultivo, enquanto que no segundo subcultivo esta carcterística é dependente do aumento da dose. A formação de brotos é crescente com o aumento das concentrações de BAP para o cultivo e primeiro subcultivo.
2Engenheiro Agrônomo, MSc, Professor Assistente, Departamento de Fitotecnia (UFSM). 97119-900 Santa Maria, RS.
3Aluno do Curso de Agronomia (UFSM), Bolsista RHAE/CNPq.
Recebido para publicação em 26.02.93. Aprovado em 01.03.94.
- EVANS, DA., SHARP, W.R., FLICK, C.E. Growth and behavior of cell cultures embryogenesisand organogenesis. In: THORPE, T.A. Plant tissue culture: methods and applications in agriculture New York: Academic Press, 1981. Cap. 3, p. 43-113.
- FRANKLIN, C.I., TRIEU, T.N., GONZALES, R.A. et al. Plant regeneration from seedling explants of green bean (Phaseolus vulgaris L.) via organogenesis. Plant Cell, Tissue and Organ Culture Netherlands, v. 24, p.199-206, 1991.
- GALTON, A.W. DAVIES, P.J. Hormonal regulation in higher plants. Science, Washington, v.163, p.1288-1297, 1969.
- GAMBORG, O.L, MILLER, R.A., OJIMA, K. Nutrient requirements for suspenslon cultures of soybean root cells. Experimental Cell Research, Sweden, v.50, p.151-158, 1968.
- GULATI, A.. JAIWAL. P.K. Culture conditions effecting plant regeneration from cotytedons of Vigna radiata (L.) Wilczek. Plant Cell, Tissue and Organ Culture, Netherlands, v .23. p.1-7, 1990.
- MAcCLEAN, P., GRAFTON, K.F.Regeneration of bean (Phaseolus vulgaris L.) via organogenesis. Plant Science, Ireland, v. 60, p. 117-122, 1989.
- MURASHIGE, T., SKOOG, F.A. A revised medium for rapid growth and bioassays with tobaco tissue cultures. Physiologia Plantarum, Copenhagen, v. 15, p. 473-497,1962. p 199-204 1972.
- SCHENK, R.U., HILDEBRANDT, A.C. Medium and techniques for induction and growth of monocotyledonous and dicotyledonous plant cell cultures. Canadian Journal of Botany, Canadá, v. 50, p. 199-204, 1972.
Datas de Publicação
-
Publicação nesta coleção
29 Ago 2014 -
Data do Fascículo
1994
Histórico
-
Recebido
26 Fev 1993 -
Aceito
01 Mar 1994