Resumos
As larvas da Dermatobia hominis provocam lesões ulcerativas, danificando o tecido subcutâneo e conseqüentemente a pele do hospedeiro. O couro é o subproduto que sofre maior depreciação, o que, muitas vezes, impossibilita seu aproveitamento na industrialização. Atualmente o controle químico é utilizado como forma de combate à dermatobiose, entretanto, leva ao acúmulo de substâncias tóxicas nos animais e no ambiente. No presente trabalho, foram avaliadas as respostas imune-humoral e celular de bovinos imunizados com extrato antigênico preparado com larvas de D. hominis. Três grupos de oito bezerras da raça Nelore com 10 meses de idade foram usados, tendo o primeiro grupo (A) recebido aplicação de extrato imunogênico de larvas de D. hominis, com intervalos de quinze dias; o grupo (B), utilizado como controle, não recebendo nenhum tipo de tratamento; e o grupo (C) recebendo o tratamento ectoparasiticida à base de Dichlorvos associado a Cypermetrina. Neste mesmo período, foram avaliados o leucograma e os níveis de IgG contra D. hominis pela técnica de enzimoimunoensaio-ELISA. Quanto à avaliação da imunidade humoral, verificou-se que os animais do grupo A apresentaram maior produção de IgG contra D. hominis, com níveis máximos de anticorpos circulantes aos 45 dias após a primeira imunização. Estes animais também apresentaram maior produção de neutrófilos, eosinófilos e monócitos que os dos grupos B e C. O número de nódulos de larvas encontrado nos animais do grupo C foi 148,3% maior que nos animais dos grupos A e B. A comprovação da resposta imune celular e humoral, parcialmente caracterizadas, bem como a redução do número de nódulos, são indicadores que a imunização contra D. hominis foi parcialmente protetora para os bovinos imunizados.
Dermatobia hominis; imunidade humoral; imunidade celular; extrato de larvas
Dermatobia hominis larvae cause ulcerative lesions and damage to subcutaneous tissue and skin of the host. Leather is the subproduct which undergoes major depreciation, making it difficult to industrial use. Nowadays, the chemical control is utilized against dermatobiosis, therefore it leads to rising toxic chemicals in the animals and environment. The immunological challenge with D. hominis larval extract may represent an important altervative for this parasitosis control. Humoral and cellular immune responses were tested in bovine using an antigenic extract prepared with D. hominis larvae. Three groups of 10 months old Nelore females were used. The first group (A) received immunogenic larval extract of D. hominis with fifteen-days interval between injections; the group (B) was the control and has not received any sort of treatment; and the group (C) received an ectoparasitecide treatment based on Dichlorvos associated to Cypermetrina. Aditionally, leucogram and levels of IgG against D. hominis by immunoassay technique were evaluated. As for the humoral immunity, animals from group A presented higher IgG production against D. hominis with maximum levels of circulating antibodies at the 45th day after the first injection. These animals also showed higher production of neutrophils, eosinophils and monocytes than those from groups B and C. The number of D. hominis larvae nodules observed in animals from the group C was 148.3% larger than those from group A and B. The evidence concerning both cellular and humoral immune responses as well as the reduction on nodules number are an indication that the immunization against D. hominis was partially protective for the immunized bovines.
Dermatobia hominis; humoral immunity; cellular immunity; larval extract
ARTIGOS CIENTÍFICOS
PARASITOLOGIA
Resposta imune-humoral e celular em bovinos da raça Nelore imunizados com extrato de larvas (L2 e L3) de Dermatobia hominis (Linnaeus Jr., 1781)
Immune humoral and cellular response of nelore bovines immunized with larvae extract (L2 and L3) of Dermatobia hominis (Linnaeus Jr., 1781)
Nelson Luis Mello FernandesI,1 1 Autor para correspondência. ; Vanete Thomaz SocolII; Simone Benghi PintoIII; João Carlos MinozzoIV; Carlos Antonio Lopes de OliveiraV
IPrograma de Pós-graduação em Processos Biotecnológicos, área de concentração Saúde Humana e Animal, Setor de Tecnologia, Universidade Federal do Paraná (UFPR), Curitiba, PR, Brasil. E-mail: nelson@ufpr.br
IIDepartamento de Patologia Básica, Setor de Ciências Biológicas, UFPR, Curitiba, PR, Brasil
IIIUFPR, Campus Palotina, PR, Brasil
IVCentro de Pesquisa e Produção de Imunobiológicos
VUniversidade Estadual do Mato Grosso do Sul, Unidade Universitária de Aquidauana, MS, Brasil
RESUMO
As larvas da Dermatobia hominis provocam lesões ulcerativas, danificando o tecido subcutâneo e conseqüentemente a pele do hospedeiro. O couro é o subproduto que sofre maior depreciação, o que, muitas vezes, impossibilita seu aproveitamento na industrialização. Atualmente o controle químico é utilizado como forma de combate à dermatobiose, entretanto, leva ao acúmulo de substâncias tóxicas nos animais e no ambiente. No presente trabalho, foram avaliadas as respostas imune-humoral e celular de bovinos imunizados com extrato antigênico preparado com larvas de D. hominis. Três grupos de oito bezerras da raça Nelore com 10 meses de idade foram usados, tendo o primeiro grupo (A) recebido aplicação de extrato imunogênico de larvas de D. hominis, com intervalos de quinze dias; o grupo (B), utilizado como controle, não recebendo nenhum tipo de tratamento; e o grupo (C) recebendo o tratamento ectoparasiticida à base de Dichlorvos associado a Cypermetrina. Neste mesmo período, foram avaliados o leucograma e os níveis de IgG contra D. hominis pela técnica de enzimoimunoensaio-ELISA. Quanto à avaliação da imunidade humoral, verificou-se que os animais do grupo A apresentaram maior produção de IgG contra D. hominis, com níveis máximos de anticorpos circulantes aos 45 dias após a primeira imunização. Estes animais também apresentaram maior produção de neutrófilos, eosinófilos e monócitos que os dos grupos B e C. O número de nódulos de larvas encontrado nos animais do grupo C foi 148,3% maior que nos animais dos grupos A e B. A comprovação da resposta imune celular e humoral, parcialmente caracterizadas, bem como a redução do número de nódulos, são indicadores que a imunização contra D. hominis foi parcialmente protetora para os bovinos imunizados.
Palavras-chave:Dermatobia hominis, imunidade humoral, imunidade celular, extrato de larvas.
ABSTRACT
Dermatobia hominis larvae cause ulcerative lesions and damage to subcutaneous tissue and skin of the host. Leather is the subproduct which undergoes major depreciation, making it difficult to industrial use. Nowadays, the chemical control is utilized against dermatobiosis, therefore it leads to rising toxic chemicals in the animals and environment. The immunological challenge with D. hominis larval extract may represent an important altervative for this parasitosis control. Humoral and cellular immune responses were tested in bovine using an antigenic extract prepared with D. hominis larvae. Three groups of 10 months old Nelore females were used. The first group (A) received immunogenic larval extract of D. hominis with fifteen-days interval between injections; the group (B) was the control and has not received any sort of treatment; and the group (C) received an ectoparasitecide treatment based on Dichlorvos associated to Cypermetrina. Aditionally, leucogram and levels of IgG against D. hominis by immunoassay technique were evaluated. As for the humoral immunity, animals from group A presented higher IgG production against D. hominis with maximum levels of circulating antibodies at the 45th day after the first injection. These animals also showed higher production of neutrophils, eosinophils and monocytes than those from groups B and C. The number of D. hominis larvae nodules observed in animals from the group C was 148.3% larger than those from group A and B. The evidence concerning both cellular and humoral immune responses as well as the reduction on nodules number are an indication that the immunization against D. hominis was partially protective for the immunized bovines.
Key words:Dermatobia hominis, humoral immunity, cellular immunity, larval extract.
INTRODUÇÃO
No Brasil, a dermatobiose (Dermatobia hominis, Linnaeus Jr., 1781) é um fator limitante para a produção e o desenvolvimento da bovinocultura (HORN & ARTECHE, 1985; PINTO et al., 2002). Os danos causados abrangem desde o custo com medicamentos antiparasitários, equipamentos e mão-de-obra, a queda no desempenho zootécnico e reprodutivo dos animais, até a diminuição da qualidade dos subprodutos, como o couro. No Brasil, cerca de 70% do couro é de 2a ou 3a categoria, obrigando o país com o maior rebanho comercial do mundo a importar este subproduto (GRISI et al., 2002).
Para controle da dermatobiose, são empregados ectoparasiticidas, entretanto, o dano ao couro já foi causado, tendo a necessidade de buscar alternativas para melhorar a qualidade do couro e evitar o acúmulo de resíduos químicos nos produtos de origem animal e no meio ambiente. A resposta imune estimulada por ectoparasitos tem recebido atenção crescente, entretanto, na literatura, poucos trabalhos são encontrados referindo-se a D. hominis. Os estudos imunológicos iniciam-se na década de 80 com MOTA et al. (1980), que estudaram a formação de anticorpos circulantes em coelhos imunizados por via subcutânea e intravenosa, com antígenos obtidos de larvas L2 e L3 de D. hominis. SANAVRIA et al. (1987) e OLIVEIRA-SEQUEIRA et al. (1996) analisaram a reação histopatológica e imunológica de animais contra a larva de D. hominis. LELLO et al. (1980) e PINTO et al. (2003), ao estudarem a reação inflamatória causada pelo berne, em coelhos imunizados, descrevem a importante ação eosinofílica decorrente da formação do complexo antígeno-anticorpo. Os eosinófilos são responsáveis pela mediação de um tipo especial de citotoxidade mediada por células anticorpo-dependentes, utilizando sua degranulação contra alvos que não podem ser fagocitados. Também, FONSECA (1989) e BARBOSA et al. (2000) observaram a formação de anticorpos contra os diferentes estágios larvais de D. hominis, em bovinos experimentalmente infestados. Em trabalho subseqüente, BARBOSA et al. (2002) infestaram artificialmente bezerros com larvas L1 e observaram que a resposta imune-celular apresentou neutrofilia e linfocitose significativas em relação ao grupo controle. A resposta imunológica também foi estudada por PINTO et al. (2003), comprovando que a presença de larvas é capaz de provocar reação anamnésica em coelhos imunizados com extratos antigênicos. Visando a ampliar o conhecimento da resposta imunológica do hospedeiro contra a dermatobiose, o presente trabalho tem como objetivo avaliar a resposta leucocitária, a cinética da produção de anticorpos e o número de nódulos de larvas de D. hominis no tecido cutâneo de bovinos imunizados e não-imunizados com o extrato de larvas.
MATERIAL E MÉTODOS
Foram utilizadas 24 fêmeas da raça Nelore com idade aproximada de 10 meses, formando-se três grupos, de oito animais: grupo A - animais imunizados com o extrato de larvas; grupo B - animais que não receberam nenhum tipo de tratamento, e grupo C - animais que receberam tratamento antiparasitário, empregado na propriedade. O tratamento consistiu de banhos por aspersão, utilizando-se como princípio ativo o Dichlorvos associado à Cypermetrina. Todos os animais permaneceram sob as mesmas condições de exposição às larvas de D. hominis durante todo o período experimental.
A preparação do antígeno (extratos de larvas L2 e L3) de D. hominis foi realizada segundo o método descrito por PINTO et al. (2002). As larvas de D. hominis utilizadas para o preparo do extrato antigênico foram obtidas por compressão manual dos nódulos de bovinos naturalmente infestados.
Vinte gramas de larvas, sendo 14g de larvas L2 e 6g de larvas L3, foram lavadas cinco vezes em soro fisiológico. A seguir, foram colocadas em frasco contendo 100mL de solução salina tamponada (NaCl 0,15 M: fosfato de sódio monobásico 0,01 M: pH 7,2), trituradas em macerador de tecido e homogeneizadas durante 20 minutos. Após filtração, o extrato foi submetido ao ultra-som (sonicador de 35 Khz, 2,60 mA 460/H Elma® ) por um período de 30 segundos, por quatro vezes, com intervalos de 30 segundos, mantido em banho de gelo. O material obtido foi distribuído em tubos previamente resfriados e submetido à centrifugação (Hermle® Z 513K) a 4°C, por 40 minutos, a 10.000rpm. O produto final foi submetido à filtração com microfiltro de 0,22µm. Do produto obtido, foi dosada a proteína pelo método de BRADFORD (1976) e, em seguida, foi determinada a massa molecular das frações protéicas no extrato antigênico pela eletroforese em gel de poliacrilamida na presença de duodecil sulfato de sódio (SDS-PAGE), modificada por MINOZZO (2003). O gel foi preparado a uma concentração de 15% de acrilamida e bisacrilamida e as amostras diluídas em presença de b-mercaptoetanol, sendo a migração em tampão de corrida pH 8,3, submetidas a uma corrente fixa de 20mA.
Os animais do grupo A receberam a primeira dose (2,0mL) do extrato solúvel de larvas (L2 e L3) de D. hominis, acrescida de partes iguais do adjuvante completo de Freund (Sigma Chemical Company), por via subcutânea. Após 15 dias, os animais receberam uma segunda imunização, composta do antígeno (2,0mL) e do adjuvante (2,0mL) incompleto de Freund (Sigma Chemical Company), por via subcutânea. A terceira imunização foi repetida 15 dias após a segunda dose, sendo idêntica a esta última. Cento e quarenta e dois dias após a primeira imunização, os animais receberam uma quarta dose, com a mesma constituição das segunda e terceira doses.
Os animais que não receberam o extrato imunogênico (grupos B e C) receberam como placebo 2,0mL de solução fisiológica acrescida de partes iguais dos adjuvantes, seguindo-se o mesmo esquema de aplicação adotado para os animais imunizados (grupo A). Todas as vezes que os animais pertencentes ao grupo C receberam tratamento químico contra ectoparasitos, os demais animais também foram banhados utilizando-se água como placebo.
A resposta celular foi avaliada por meio de leucogramas, obtidos mensalmente e comparados com o número de nódulos cutâneos encontrados nos animais. Os leucogramas foram realizados pela contagem dos leucócitos totais em câmara de Neubauer e o diferencial obtido pela leitura dos esfregaços sangüíneos, corados pelo método de Wright, segundo GARCIA-NAVARRO & PACHALY (1994).
Para avaliação da resposta humoral (IgG contra D. hominis), foi padronizada a técnica de enzimoimunoensaio (ELISA), com amostras de soros colhidas a cada 15 dias. A concentração de antígenos que permitiu discriminação entre os soros positivos e negativos foi de 5063ng/pocinho. As diluições estabelecidas como as ideais para os soros e o conjugado foram de 1:50 e 1:1250, respectivamente. Como controle positivo da reação, foi usado pool de soros obtido de animais naturalmente infestados e que apresentaram um grande número de nódulos cutâneos de D. hominis. Para controle negativo, foi utilizado um pool de soros obtido de bezerros com aproximadamente 70 dias de idade, sem contato prévio com a D. hominis. Para avaliação do número de larvas de D. hominis, foram contados, a cada 30 dias, o número de nódulos cutâneos (PINTO et al., 2002).
A metodologia empregada para a análise dos dados foi a de modelos lineares generalizados, sendo adotado como ferramenta o programa estatístico ASREML (GILMOUR et al., 2002).
RESULTADOS E DISCUSSÃO
A concentração protéica do extrato antigênico produzido foi de 10,02mg mL-1. Este valor foi superior ao descrito por MOTA et al. (1980) e PINTO et al. (2003), que encontraram 8,0 e 8,3mg mL-1, respectivamente. BARBOSA et al. (2000) prepararam extratos antigênicos com diferentes estádios larvais e obtiveram uma maior concentração protéica no extrato de larvas L2; portanto, a diferença dos níveis protéicos obtidos no presente trabalho se deve à maior proporção de L2:L3 (70% de larvas L2 e 30% de larvas L3). Por outro lado, MOTA et al. (1980) e PINTO et al. (2003) trabalharam com proporções iguais de L2 e L3.
O antígeno produzido com os extratos de larva de D. hominis revelou oito frações protéicas representadas pela eletroforese em gel de poliacrilamida (SDS-PAGE) com as massas moleculares variando de 97 a 60 Kda. No único relato sobre eletroforese de extrato preparado com larvas L2 e L3, MOTA et al. (1980) observaram apenas uma fração protéica. Todavia, o suporte para eletroforese empregado foi o inoágar no 2, a 1%, justificando a diferença observada.
Os anticorpos produzidos pelos animais do grupo A apresentaram diferença significativa (P<0,05) quando comparados aos grupos B e C. Nos animais imunizados, a produção de anticorpos foi progressiva, atingindo pico máximo aos 45 dias (4ª semana) após o primeiro tratamento, e seguiu com declínio atingindo seu ponto mínimo aos 135 dias (9ª semana). Este comportamento demonstra que a cinética de produção de anticorpos nos bovinos imunizados (grupo A) mostrou-se crescente e mais intensa do que nos bovinos não-imunizados. Os animais infestados pelo berne, e submetidos a tratamento químico ou não apresentam respostas imunes, todavia de memória menos intensa e/ou menos protetoras, demonstradas pelo ponto de corte (cut-off) das reações do teste imunoenzimático, estabelecido em 0,190 de absorbância (Figura 1).
O número de leucócitos totais em relação ao número de nódulos de D. hominis foi similar e crescente nos três grupos de animais, apresentando diferença significativa (P<0,05) (Figura 2). Apesar da semelhança dos dados obtidos, animais do grupo A apresentaram um aumento de leucócitos mais significativo.
Quanto ao número de neutrófilos segmentados, o comportamento observado foi significativamente diferente (P<0,05) para os três grupos de animais (Figura 3). Os grupos A e B apresentaram comportamento da resposta semelhante, porém mais expressiva pelos animais imunizados, que atingiram maiores valores mesmo com um menor número de nódulos.
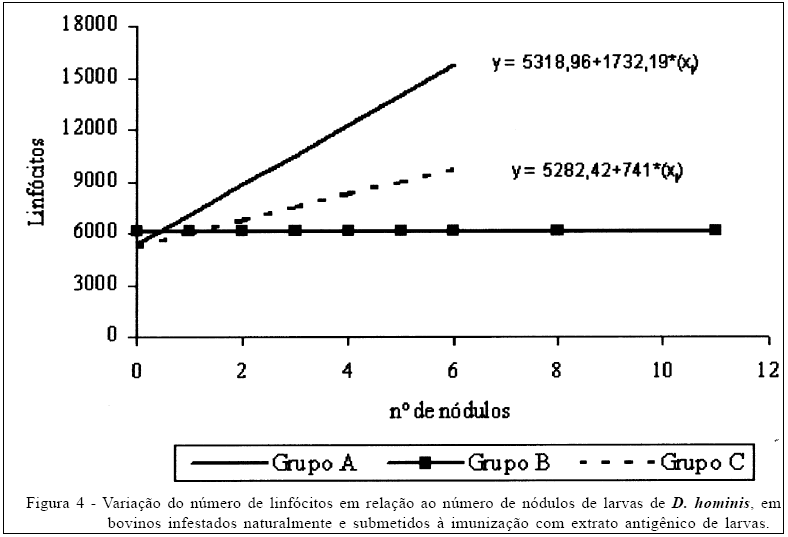
Quanto à variação do número de linfócitos, houve diferença significativa (P<0,05) entre os grupos; entretanto, o comportamento da resposta foi similar entre os grupos A e C. Nos animais do grupo B, não foi observado nenhum efeito do número de linfócitos em relação ao número de nódulos encontrados (Figura 4). Assim como no número de neutrófilos segmentados, o grupo de animais imunizados também apresentou uma resposta mais efetiva quanto à produção de linfócitos.
Em relação ao número de eosinófilos, constatou-se diferença estatística (P<0,05) entre os três grupos de tratamento (Figura 5). A resposta imunológica obtida pelos animais que receberam o extrato de larvas foi estimulada, constatado pelo menor número de nódulos em comparação com os animais do grupo controle. Os dados obtidos indicam que a intensidade de resposta celular está diretamente relacionada com o estímulo antigênico.
O número de monócitos apresentou um comportamento distinto entre os três grupos de animais. Entretanto, os animais do grupo B não apresentaram variação no número de células em função do número de nódulos durante o período experimental.
A resposta imunomediada por células, demonstrada pelo aumento de leucócitos totais, ocorreu principalmente em função do aumento de neutrófilos, eosinófilos e monócitos. BARBOSA et al. (1997) observaram aumento da média global do número de neutrófilos, eosinófilos e linfócitos em animais infestados experimentalmente, porém sem diferença significativa em relação ao grupo controle (animais não-infestados).
Durante todo o experimento, nas avaliações clínicas periódicas realizadas, os animais não demonstraram alterações dos parâmetros fisiológicos, ou seja, as alterações do leucograma se devem à infestação por larvas de D. hominis, dados também constatados por BARBOSA et al. (2002), ao avaliarem as alterações clínicas em bovinos experimentalmente infestados com larvas L1 de D. hominis.
Hemogramas de animais infestados experimentalmente com larvas L1 de D. hominis não apresentaram diferença significativa em relação aos dos animais do grupo controle. Estes dados também foram observados por BARBOSA et al., (2003).
LELLO et al. (1980), ao estudarem a reação inflamatória causada pelo berne, em coelhos imunizados, relataram a intensa reação inflamatória eosinofílica. No presente trabalho, a resposta celular eosinofílica no grupo de animais imunizados ocorreu mais rapidamente e com mais intensidade quando comparada com os demais grupos. O grupo (B) apresentou uma resposta inicial satisfatória, entretanto, não se manteve e foi inferior ao grupo imunizado (grupo A). O grupo (C) apresentou declínio acentuado da resposta celular, após o tratamento quimioterápico. Já os animais do grupo A mantiveram a produção de eosinófilos crescente.
Quanto ao número médio de nódulos cutâneos contados, verificou-se maior incidência nos animais do grupo B, com diferença significativa (P<0,05) em relação aos grupos A e C (Tabela 1).
Nos animais do grupo A, ocorreu uma oscilação quanto ao número de nódulos, obedecendo a um comportamento similar ao do grupo C, não existindo diferença significativa entre os mesmos. Os animais imunizados adquiriram uma maior resistência ao parasitismo quando comparados aos animais do grupo controle, uma vez que a infestação deste último foi 148,3% maior que nos animais imunizados.
CONCLUSÕES
A aplicação de extratos de larvas de D. hominis se mostrou eficaz como estímulo antigênico já que foi capaz de produzir proteção parcial aos animais naturalmente infectados. A comprovação da resposta imunológica dos animais, obtida no presente trabalho, cria novas perspectivas para a área de biotecnologia de vacinas.
Recebido para publicação 05.01.06
Aprovado em 18.10.06
- BARBOSA, C.G. et al. Fase Parasitária e alterações clínicas em bovinos infestados experimentalmente com larvas de Dermatobia hominis (Diptera: Cuterebridae). Parasitologia Latinoamericana, Santiago, v.57, p.15-20, 2002.
- BARBOSA, C.G. et al. Alterações hematológicas em bovinos infestados experimentalmente com larvas de Dermatobia hominis (Diptera: Cuterebridae). Revista Brasileira de Parasitologia Veterinária, Rio de Janeiro, v.12, n.2, p.61-67, 2003.
- BARBOSA, C.G. et al. Dermatobiose bovina experimentalmente causada por larvas de Dermatobia hominis: aspectos clínicos, hematológicos e imunológicos. Revista Brasileira de Medicina Veterinária, Rio de Janeiro, v.6, p.62-66, 1997.
- BARBOSA, C.G. et al. Humoral immune response in cattle experimentally infested with larvae of Dermatobia hominis Ciência Rural, Santa Maria, v.30, n.3, p.449-453, 2000.
- BRADFORD, M.M. A rapid and sensitive method for the quantitation of protein utilizing the protein-dye binding. Analytical Biochemistry, Orlando, v.72, p.248-254, 1976.
- FONSECA, A.J.C. Aspectos imunológicos, atividade antibacteriana e efeito de várias doses de ivermectina sobre larvas de Dermatobia hominis (Linnaeus Jr., 1781) (Diptera: Cuterebridae) 1989. 23f. Dissertação (Mestrado em Medicina Veterinária) Instituto de Biologia, Universidade Federal do Rio de Janeiro.
- GARCIA-NAVARRO, C.E.K.; PACHALY, J.R. Manual de hematologia veterinária São Paulo: Varela, 1994. 169p.
- GILMOUR, A.R. et al. ASRemL user guide release 1.0 Hemel Hempstead, United Kingdom, 2002.
- GRISI,L. et al. Impacto econômico das principais ectoparasitoses em bovinos no Brasil. A Hora Veterinária, Porto Alegre, v.6, n.125, p.8-10, 2002.
- HORN, S.C.; ARTECHE, C.C.P. Situação parasitária da pecuária no Brasil. A Hora Veterinária Porto Alegre, v.4, n.23, p.12-32, 1985.
- LELLO, E. et al. Reação inflamatória causada pelo berne em coelhos imunizados ou não, com extrato antigênico de Dermatobia hominis (Díptera: Cuteribridae). Ciência e Cultura, São Paulo, v.32, p.458-461, 1980.
- MINOZZO, J.C. Imunoeletrotransferência e enzimoimunoensaio como ferramentas para o imunodiagnóstico da neurocisticercose 2003. 114f. Tese (Doutorado em Processos Biotecnológicos) Setor de Tecnologia, Universidade Federal do Paraná.
- MOTA, N.G.S. et al. Anticorpos circulantes em coelhos imunizados com antígenos obtidos de larvas de Dermatobia hominis Lin. (Díptera: Cuterebridae). Ciência e Cultura São Paulo, v.32, n.4, p.453-457, 1980.
- OLIVEIRA-SEQUEIRA, T.C.G. et al. Histological and immunological reaction of cattle skin to first-instar larvae of Dermatobia hominis Medical and Veterinary Entomology, Oxford, v.10, p.323-330, 1996.
- PINTO, S.B et al. Bioecologia de Dermatobia hominis (Linnaeus Jr., 1781) em Palotina, Paraná, Brasil. Ciência Rural, Santa Maria, v.32, n.5, p.821-827, 2002.
- PINTO, S.B. et al. Resposta imune humoral de coelhos frente a extratos de larvas de Dermatobia hominis Archives of Veterinary Science, Curitiba, v.8, n.2, p.19-25, 2003.
- SANAVRIA, A. et al. Histologia da pele de bovino na infecção experimental por Dermatobia hominis Arquivos da Universidade Federal Rural do Rio de Janeiro, Itaguaí, v.10, p.9-23, 1987.
Datas de Publicação
-
Publicação nesta coleção
07 Maio 2007 -
Data do Fascículo
Jun 2007
Histórico
-
Aceito
18 Out 2006 -
Recebido
05 Jan 2006