Resumos
A ressonância magnética é a propriedade física exibida por núcleos de determinados elementos que, quando submetidos a um campo magnético forte e excitados por ondas de rádio em determinada freqüência (Freqüência de Larmor), emitem rádio sinal, o qual pode ser captado por uma antena e transformado em imagem. A imagem por ressonância magnética (IRM) é o método de diagnóstico por imagem não-invasivo mais sensível para avaliar partes moles, particularmente o encéfalo, porém trata-se de uma técnica onerosa. Ela apresenta grande potencial diagnóstico, poucos efeitos deletérios e muitos benefícios a serem obtidos com o seu uso. Além disso, a IRM fornece informações anatômicas acuradas, imagens em qualquer plano do corpo, bom contraste e resolução espacial e por si só pode sugerir um diagnóstico. Porém, não permite um diagnóstico histológico específico e deve ser interpretada em contexto com outros achados clínicos e patológicos. Esta revisão teve como objetivos mostrar as bases físicas da ressonância magnética e propiciar mais conhecimento aos veterinários.
física da ressonância magnética; IRM
Magnetic resonance is the physical propriety exhibited by the atomic nucleus of determined elements when they are submitted to a strong magnetic field and excited with radio waves in determined frequency (Larmor's Frequency). These originate a radio frequency signal, which can be captured by a receptive antenna and transformed in images. Although expensive, magnetic resonance is the most sensitive method of imaging to evaluate soft tissues, mainly the brain. Extensive diagnostic potential, few hazard effects, accurate anatomic information, images in any plain of the body, good contrast and spacial resolution are some advantages of this method. However, it does not allow a specific histological diagnosis and must be interpreted in context with others clinical and pathological findings. This review had the aim to show the physical bases of magnetic resonance to bring more knowledge to veterinarians.
physics of magnetic resonance; MRI
REVISÃO BIBLIOGRÁFICA
CLÍNICA E CIRURGIA
Imagem por ressonância magnética: princípios básicos
Magnetic resonance imaging basics
Maria Cristina Ferrarini Nunes Soares HageI,1 1 Autor para correspondência. ; Masao IwasakiII
IDepartamento de Veterinária (DVT), Centro de Ciências Biológicas e da Saúde (CCB), Universidade Federal de Viçosa (UFV). Av. P. H. Rolfs, s/n, 36570-000, Viçosa, MG, Brasil. E-mail:crishage@ufv.br
IIUniversidade de São Paulo (USP), São Paulo, SP, Brasil
RESUMO
A ressonância magnética é a propriedade física exibida por núcleos de determinados elementos que, quando submetidos a um campo magnético forte e excitados por ondas de rádio em determinada freqüência (Freqüência de Larmor), emitem rádio sinal, o qual pode ser captado por uma antena e transformado em imagem. A imagem por ressonância magnética (IRM) é o método de diagnóstico por imagem não-invasivo mais sensível para avaliar partes moles, particularmente o encéfalo, porém trata-se de uma técnica onerosa. Ela apresenta grande potencial diagnóstico, poucos efeitos deletérios e muitos benefícios a serem obtidos com o seu uso. Além disso, a IRM fornece informações anatômicas acuradas, imagens em qualquer plano do corpo, bom contraste e resolução espacial e por si só pode sugerir um diagnóstico. Porém, não permite um diagnóstico histológico específico e deve ser interpretada em contexto com outros achados clínicos e patológicos. Esta revisão teve como objetivos mostrar as bases físicas da ressonância magnética e propiciar mais conhecimento aos veterinários.
Palavras-chave: física da ressonância magnética, IRM.
ABSTRACT
Magnetic resonance is the physical propriety exhibited by the atomic nucleus of determined elements when they are submitted to a strong magnetic field and excited with radio waves in determined frequency (Larmor's Frequency). These originate a radio frequency signal, which can be captured by a receptive antenna and transformed in images. Although expensive, magnetic resonance is the most sensitive method of imaging to evaluate soft tissues, mainly the brain. Extensive diagnostic potential, few hazard effects, accurate anatomic information, images in any plain of the body, good contrast and spacial resolution are some advantages of this method. However, it does not allow a specific histological diagnosis and must be interpreted in context with others clinical and pathological findings. This review had the aim to show the physical bases of magnetic resonance to bring more knowledge to veterinarians.
Key words: physics of magnetic resonance, MRI.
INTRODUÇÃO
Os primeiros estudos em ressonância magnética (RM) foram realizados em 1946 por dois grupos independentes: Purcell em Harvard, que estudava os sólidos e Bloch em Stanford, que estudava os líquidos (BLOCH et al., 1946; PURCELL et al., 1946). Nessas primeiras experiências, a RM era usada para realizar a análise química das estruturas, conhecida como espectroscopia. No final dos anos 60, Raymond Damadian demonstrou in vitro que T1 era maior em tumores do que em tecido normal e começou a trabalhar no desenvolvimento de um aparelho. Em 1972, Lauterbour, da Universidade de Illinois, obteve as primeiras imagens com a RM, as quais foram publicadas na Revista Nature (LAUTERBUR, 1973). Em 1976, Mansfield, da Universidade de Nottinghan, produziu as primeiras imagens de uma parte do corpo: um dedo. Em 2003, pelos avanços proporcionados pela aplicação da técnica de imagem por ressonância magnética (IRM), Paul Lauterbour e Peter Mansfield receberam o prêmio Nobel de Medicina. O primeiro exame de IRM na América Latina foi realizado no Hospital Israelita Albert Einstein em 1986, em São Paulo, Brasil.
Apesar de o estudo da física da ressonância magnética ser um assunto árido e difícil, ele é de fundamental importância na interpretação das imagens e por isso é preciso que os seus princípios básicos sejam entendidos. Esta revisão teve como objetivos mostrar as bases físicas da RM e propiciar mais conhecimento aos veterinários.
DESENVOLVIMENTO
Por definição, a RM é a propriedade física exibida por núcleos de determinados elementos que, quando submetidos a um campo magnético forte e excitados por ondas de rádio (RF) em determinada freqüência (Freqüência de Larmor), emitem rádio sinal, o qual pode ser captado por uma antena e transformado em imagem (BLOCH et al., 1946; PURCELL et al., 1946; PYKETT et al., 1982; VILLAFANA, 1988; ÁVILA, 2001).
O núcleo mais simples é o do hidrogênio, o qual consiste em um único próton. Os prótons e os nêutrons têm uma propriedade chamada spin ou momento angular que nada mais é do que uma rotação similar à rotação da Terra sob o seu próprio eixo. Em adição ao seu spin, o próton tem também um momento magnético, o que significa que ele se comporta como um magneto (PYKETT et al., 1982; SMITH & RANALLO, 1989; ASSHEUER & SAGER, 1997). As razões pelas quais o próton pode se comportar como pequeníssimo magneto são duas: o próton tem carga elétrica e ele gira sobre o seu próprio eixo num movimento chamado spin. Qualquer objeto carregado eletricamente que se mover circundará a si mesmo com um campo magnético e, quando o movimento é de spin, o objeto é referido como um dipolo magnético. Um próton é, portanto, um dipolo magnético (PYKETT et al., 1982; SMITH & RANALLO, 1989; ASSHEUER & SAGER, 1997). Um dipolo magnético não somente produz um campo magnético, mas também responde à presença de qualquer campo magnético de outras fontes (SMITH & RANALLO, 1989). O núcleo do hidrogênio consiste em um único próton, portanto possui spin e momento magnético. Como tal é o mais apropriado para obtenção de imagens por RM devido a sua abundância no corpo e à capacidade de produzir o maior rádio sinal de todos os núcleos estáveis (SMITH & RANALLO, 1989). Em conseqüência de sua maior concentração nos tecidos e de seu maior momento magnético, o sinal que pode ser obtido do hidrogênio é superior a 1000 vezes em relação a qualquer outro elemento presente nos tecidos do corpo de animais. Por essa razão o hidrogênio é utilizado como fonte de sinal na maioria dos exames de ressonância magnética (MENDONÇA et al., 1996).
Na RM, observa-se um sinal produzido pelo momento magnético do próton. Esse sinal é uma corrente elétrica induzida em uma bobina receptora pelo momento magnético. O momento magnético de um único próton é, entretanto, muito pequeno para induzir uma corrente detectável em uma bobina: portanto, os prótons devem ser alinhados para produzirem um momento magnético grande e detectável no corpo (SLICHTER, 1989; SMITH & RANALLO, 1989). Normalmente, os prótons no corpo têm uma orientação completamente aleatória. Seus pequeníssimos vetores de momento magnético apontam em todas as direções e se cancelam de forma que nenhum momento magnético é produzido (PYKETT et al., 1982; VILLAFANA, 1988; SMITH & RANALLO, 1989; ASSHEUER & SAGER, 1997) (Figura 1A). Porém, se colocados em um campo magnético externo (Bo) poderoso, os spins se alinham na mesma direção do campo magnético, no mesmo sentido do seu vetor ou em sentido contrário. Um número um pouco maior de spins se alinha no mesmo sentido (em um estado de menor energia) do que em sentido oposto (estado de maior energia). Esse predomínio cria uma pequena magnetização resultante de equilíbrio (Mo) no tecido. É esse pequeno, mas constante desequilíbrio, ou magnetização resultante, que torna possível a RM (PYKETT et al.; 1982; VILLAFANA, 1988; SLICHTER, 1989; MENDONÇA et al., 1996) (Figura 1B).
Se um tecido é colocado em um campo magnético (Bo) e deixado por tempo suficiente (cinco a 10 segundos), a magnetização tissular resultante atinge um valor de equilíbrio Mo, que é proporcional em intensidade ao campo magnético externo (Bo). Mo aponta na mesma direção e no mesmo sentido do campo magnético principal, que é referido como eixo longitudinal ou eixo z. É importante compreender também que os prótons não se alinham precisamente ao longo do eixo z, mas sim se movimentam em torno deste, de forma análoga a um pião, que gira em torno do seu eixo gravitacional, movimento conhecido como precessão (Figura 1C). A rapidez ou a freqüência de precessão do núcleo do hidrogênio depende somente da intensidade do campo magnético, quanto maior o campo magnético, maior será a freqüência de precessão do spin, também conhecida como freqüência de Larmor (MENDONÇA et al., 1996; ASSHEUER & SAGER, 1997).
A magnetização tissular intrínseca resultante (Mo) é somente uma fração ínfima do campo magnético principal externo (Bo) e assim, enquanto Mo estiver alinhada a Bo no eixo longitudinal ou z, é extremamente difícil de ser medida. Entretanto, a ínfima (Mo) pode ser medida se for rodada ou desviada da direção do plano longitudinal para o plano perpendicular, o plano transverso (xy). Quando a magnetização tissular intrínseca resultante é desviada para o plano transverso, é denominada (Mxy). Consegue-se desviar (Mo) para o plano transverso por meio de um pulso de radiação eletromagnética oscilando na freqüência de Larmor do hidrogênio. Esse pulso de radiofreqüência de Larmor, denominado pulso de 90 graus, é aplicado por tempo suficiente para desviar a magnetização longitudinal (Mo) exatamente 90 graus no plano transverso onde ela pode ser medida e reconstruída para se obter uma imagem (MENDONÇA et al., 1996). O pulso de radiofreqüência consegue desviar o vetor de magnetização para o plano transverso, pois, além de fazer alguns dos spins passarem para o nível de maior energia, também muda a fase dos prótons, de modo que eles estejam coerentes (agrupados) (Figura 2). Só é possível detectar-se um sinal com as bobinas receptoras de radiofreqüência quando os prótons estão precessando em fase, ou seja, circundando agrupados o eixo longitudinal (z) (VILLAFANA, 1988; LUFKIN, 1999).
O processo por meio do qual o núcleo excitado retorna ao equilíbrio devido à liberação de energia para o ambiente é conhecido como relaxação. Ela ocorre por meio da relaxação spin-lattice e da relaxação spin-spin, as quais são definidas por duas constantes exponenciais de tempo T1 e T2 respectivamente (THOMSON et al., 1993).
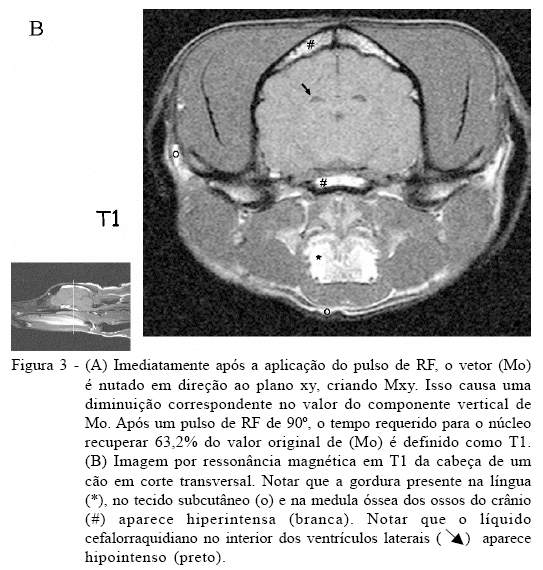
Imediatamente após a aplicação do pulso de RF, o vetor (Mo) é nutado em direção ao plano xy, criando Mxy. Isso causa uma diminuição correspondente no valor do componente vertical de Mo. Após um pulso de RF de 90 graus, o tempo requerido para o núcleo recuperar 63,2% do valor original de (Mo) é definido como T1. À medida que a excitação é perdida, a magnetização longitudinal é gradualmente recuperada, por isso ela é conhecida como relaxação longitudinal. Como a relaxação longitudinal envolve troca de energia entre os spins nucleares excitados e o ambiente (lattice) molecular não-ressonante, ela é também referida como tempo de relaxação spin-lattice ou spin-rede (PYKETT et al., 1982; THOMSON et al., 1993) (Figura 3A). O valor de T1 é dependente da natureza física e química do ambiente que envolve o núcleo excitado. Em geral, moléculas menores, incluindo a água, relaxam muito mais lentamente do que moléculas de tamanho médio como os lipídeos. O valor de T1 da água ligada à proteína é consideravelmente mais curto do que o da água livre. Portanto, a liberação da água ligada em tumores ou em outras lesões pode aumentar os valores de T1. Por exemplo, o valor de T1 para a água pura é de aproximadamente três segundos, enquanto aquele da gordura é geralmente umas poucas centenas de milissegundos. Quando um tecido com T1 curto é examinado usando uma seqüência com um tempo de repetição (TR) do pulso de RF de 90 graus relativamente mais longo, o sinal oriundo desse tecido é intenso. Se o tempo de repetição (TR) for mais curto do que o T1 do tecido, o núcleo não retornará ao equilíbrio antes do próximo pulso de RF, e o tecido é dito como estando saturado (sem sinal). Dessa forma, a intensidade do sinal aumenta à medida que o tempo de relaxação do tecido diminui (THOMSON et al., 1993) (Figura 3B).
A relaxação spin-spin (T2) ocorre por meio da interação de prótons com os campos magnéticos de outros núcleos e por causa das inomogeneidades inerentes a (Bo). Após a aplicação de um pulso de RF, o núcleo excitado inicialmente precessa em fase em relação aos outros núcleos, resultando em um valor alto de Mxy. Entretanto, a coerência de fase é rapidamente perdida, uma vez que cada um dos núcleos tem seu próprio campo magnético diminuto que interfere nos outros (relaxação spin-spin). A interação spin-spin transfere energia entre os núcleos envolvidos, de forma que a freqüência de precessão de alguns esteja atrasada e a freqüência de outros esteja acelerada. Dessa forma, a coerência de fase é perdida. A constante de tempo para essa forma de relaxação, chamada de T2, é o período de tempo durante o qual 63,2% do sinal é perdido (THOMSON et al., 1993) (Figura 4A). Os valores de T2 da maioria dos tecidos biológicos estão entre 50 e 100msec, enquanto o valor do líquor é de 250msec. Como em T1, a taxa de água livre versus água ligada é o principal determinante de T2 nas lesões. A liberação da água ligada aumenta os valores de T2. Como a relaxação spin-spin (T2) ocorre no plano transverso, ela é conhecida como relaxação transversal. Valores longos estão associados com sinal mais intenso, uma vez que o núcleo não perde a coerência de fase tão rapidamente (Figura 4B). Isso contrasta com a relaxação spin-rede (T1), na qual um valor de T1 mais longo está associado com a atenuação do sinal (THOMSON et al., 1993).
Grande parte da capacidade de contraste na RM pode ser entendida analisando-se uma forma da equação da seqüência de pulso spin-eco: I = N . f(v). (e -(TE/T2 )). (1- e -(TR/T1)), em que I = intensidade de imagem (brilho do pixel); N = densidade de prótons (do tecido); f(v) = função de fluxo (do tecido); TE = tempo de eco (fixado no aparelho); TR = tempo de repetição (fixado no aparelho); T1 = tempo de relaxação longitudinal (do tecido); T2 = tempo de relaxação transversal (do tecido) e e = 2,7182... (constante). Ao contrário dos complexos termos exponenciais que descrevem os efeitos de T1 e T2, o termo densidade de prótons (N) é simplesmente um multiplicador. Embora haja prótons em todos os átomos do corpo, os prótons de interesse para a RM são apenas aqueles que constituem o núcleo do átomo do hidrogênio. De fato, os únicos prótons que contribuem significativamente para o sinal da RM são os núcleos de átomos de hidrogênio em moléculas de água ou em alguns grupos de moléculas lipídicas, também conhecidos como prótons móveis (LUFKIN, 1999). Na presença de um grande número de prótons móveis, ocorrerá um sinal forte. Esse sinal forte será então afetado pelos outros termos na equação, como T1 e T2, produzindo um sinal mais forte ou mais fraco, dependendo desse outro grupo de fatores. Os materiais com elevada densidade de prótons incluem o tecido adiposo, o líquido cefalorraquidiano (LCR), o sangue e outros líquidos (LUFKIN, 1999). Por outro lado, na presença de relativamente poucos prótons móveis no tecido, haverá um valor zero ou muito pequeno para o N na equação. Como toda a equação será multiplicada por esse termo zero, os efeitos de T1 e T2 e dos outros parâmetros serão anulados. Por isso, independentemente de como a seqüência de pulso é alterada, na presença de poucos prótons móveis, a imagem terá um sinal de pequena intensidade. Materiais de baixa densidade de prótons geralmente têm um sinal baixo em todas as seqüências. São exemplos o ar, as calcificações, a cortical óssea densa, o tecido fibroso, o plástico e outros materiais implantados. Algumas seqüências de pulso à IRM são designadas como imagens de densidade de prótons ou imagens de densidade de spin. Elas são produzidas empregando-se combinações de TR relativamente longo e de TE curto. Isso tem o efeito de diminuir as ponderações em T1 e T2, o que acarreta maior contribuição da densidade de spin ou de prótons ao contraste. Tem também o efeito de aumentar muito a razão sinal-ruído da imagem (LUFKIN, 1999) (Figura 5).
Os efeitos de relaxação spin-rede (T1) e spin-spin (T2) proporcionam resolução notavelmente superior do contraste das partes moles na RM em comparação à tomografia computadorizada (TC). Isso ocorre porque muitas substâncias com densidade de prótons semelhante produzem ainda sinais de intensidade diferentes na RM devido às acentuadas diferenças nos valores de T1 e de T2 dos tecidos (LUFKIN, 1999).
Considerando-se os dois grandes grupos de prótons no organismo - lipídeos e água - é possível serem feitas algumas observações sobre os tempos de relaxação e o comportamento do contraste na RM (LUFKIN, 1999). A água é constituída de pequenas moléculas que têm uma elevada freqüência de movimento molecular. Esses movimentos de rotação ou translação ocorrem muito rapidamente e se devem a efeitos térmicos (movimento browniano). Por outro lado, o colesterol é um exemplo de uma grande molécula lipídica. Os prótons móveis nessas grandes moléculas têm um movimento molecular muito mais lento devido à maior inércia da molécula maior (LUFKIN, 1999). A rapidez da relação spin-rede (T1) depende da eficiência com que a energia é distribuída novamente ao retículo bioquímico. Para adicionar energia ao sistema de maneira ótima, o campo de RF deve oscilar à freqüência de ressonância do sistema. Assim, também, a energia pode ser redistribuída mais eficientemente quando os campos magnéticos do retículo estão flutuando à freqüência ressonante ou próxima disso (LUFKIN, 1999). Quando há uma correlação estreita entre a freqüência de Larmor e a freqüência de oscilação do ambiente devido ao movimento molecular, há uma transferência de energia muito eficiente e, portanto, um tempo de T1 curto. Moléculas pequenas como a água tem uma razão de movimento molecular muito acima da freqüência de Larmor em qualquer dos instrumentos de RM atuais (alto ou baixo campo). Elas são, então, ineficientes na transferência de energia ao retículo e têm um longo tempo de relaxação de T1 (BLOEMBERGEN et al., 1948; HEBEL & SLICHER, 1959; CALLAGHAN, 1994; LUFKIN, 1999). Os prótons em moléculas de tamanho médio, como o colesterol, de movimento molecular mais lento, estão mais próximos dessa faixa e são, portanto, mais eficientes na relação spin-rede (T1). Moléculas maiores, como os ácidos graxos de cadeia longa, oscilam com freqüências bem abaixo da freqüência ressonante. Contudo, a rotação dos grupos terminais dos ácidos graxos a freqüências mais altas possibilita uma relaxação spin-rede (T1) eficiente também para esses lipídeos (LUFKIN, 1999).
Além do tamanho molecular, outros fatores (efeitos de ligação de proteínas) afetam a rapidez do movimento molecular e, portanto, a eficiência de transferência de energia de volta ao retículo, o que determina o tempo de relaxação (LUFKIN, 1999). Líquidos puros como a água tendem a ter uma freqüência elevada de movimento molecular e, portanto, um longo tempo de relaxação T1. No corpo, porém, a maior parte da água não está em estado puro, mas sim presente em soluções de proteínas e outras macromoléculas. Isso ocorre não apenas na célula, mas também nas grandes coleções líquidas extracelulares (LUFKIN, 1999). A água pura tem uma freqüência elevada de movimento molecular e um T1 muito longo devido à ineficiente transferência de energia ao retículo, pelas razões citadas anteriormente. Contudo, à medida que são adicionadas à solução, a água livre em movimento rápido torna-se estruturada (alterada em seus movimentos, mas não ligada efetivamente) em torno da macromolécula. Finalmente, a água ligada é aquela que apresenta efetivamente uma ligação por ponte de hidrogênio a um local polar ou iônico fixo na macromolécula. Todas as moléculas de água que são afetadas por macromoléculas (água ligada e estruturada) são designadas como a água da camada de hidratação. Esse processo torna mais lento o movimento molecular, trazendo-o assim mais próximo da freqüência de Larmor do sistema e afetando a eficiência da relaxação (LUFKIN, 1999). Assim sendo, a presença da água numa camada de hidratação em torno das macromoléculas leva a uma diminuição do tempo de relaxação de T1. Por esse mecanismo, soluções de água de elevado conteúdo protéico ou com uma grande quantidade de restos celulares podem ter um tempo de relaxação de T1 semelhante ao do colesterol ou outros lipídeos. Esse é um aspecto importante da interpretação da RM: os líquidos podem ter aparências diversas com base em seu conteúdo protéico (LUFKIN, 1999).
Para se obter o máximo de contraste em T1, que é a diferença na intensidade do sinal com base nos tempos T1 teciduais, o tempo TR na seqüência de pulso é reduzido. Isso leva a uma imagem ponderada em T1. Com um TR mais longo, os tecidos já recuperaram integralmente sua magnetização longitudinal e têm intensidade de sinal semelhante e pouco contraste (LUFKIN, 1999). Uma seqüência de TR curto aumentará ao máximo o contraste T1, mas isso também afetará outros aspectos da qualidade da imagem. A razão sinal-ruído global diminui com o TR curto, embora o contraste aumente (LUFKIN, 1999). Para se ter uma diferença máxima na intensidade do sinal com base nos tempos T2, o tempo TE na seqüência de pulso é aumentado. Isso leva a uma imagem ponderada em T2. Os tecidos têm intensidade de sinal semelhante e pouco contraste com um TE mais curto. Isso ocorre por não ter transcorrido um tempo suficiente para que as diferenças de T2 causem a defasagem dos spins (LUFKIN, 1999). Uma seqüência de TE longo, portanto, obterá um contraste em T2 máximo à custa da qualidade de imagem. A razão sinal-ruído global diminui ao aumentar o TE, ainda que o contraste em T2 aumente (LUFKIN, 1999). Para se produzir uma imagem fortemente ponderada em T1, usa-se um TR curto para se obter um contraste T1 máximo e usa-se um TE curto para um contraste T2 mínimo. Assim, também, para se produzir uma imagem fortemente ponderada em T2, usa-se um TE longo para se obter um contraste T2 máximo e um TR longo para um contraste T1 mínimo (LUFKIN, 1999). Finalmente, uma seqüência de TE curto e TR longo obteria o máximo de relação sinal-ruído na imagem. Isso é feito à custa do contraste T1 e T2. Devido à ausência de um contraste T1 ou T2 forte, essas imagens de elevada relação sinal-ruído são designadas imagens de densidade de prótons (LUFKIN, 1999).
Todas as partes moles podem ser visibilizadas na RM. Entretanto, a cortical óssea e o ar não produzem sinal nas imagens por causa da inabilidade dos prótons relaxarem na matriz óssea densa e da relativa falta de núcleos de hidrogênio no ar. Por possuírem baixa densidade de prótons móveis as lentes não apresentam sinal em qualquer seqüência utilizada. Todas as outras estruturas são visibilizadas em vários graus de cinza ao branco por causa das variações da intensidade do sinal (TUCKER & GAVIN, 1996).
A diferenciação de contraste entre dois tecidos adjacentes (por exemplo, entre um tumor cerebral e substância branca normal) depende das diferenças entre as densidades de prótons, os T1 e T2 dos dois tecidos. A assim chamada conspicuidade (sinal da lesão versus sinal do tecido adjacente) pode ainda ser maximizada pela manipulação adequada dos parâmetros selecionáveis pelo operador (MENDONÇA et al., 1996). Seqüências de pulso inadequadas podem diminuir a diferença entre a lesão e o tecido circundante, tornando difícil a detecção das lesões (MENDONÇA et al., 1996). Os parâmetros que podem afetar o contraste das imagens e que estão sob o controle do operador incluem a escolha da seqüência de pulso, ângulo de excitação do pulso de RF (flip angle), espessura do corte, campo de visão, tamanho da matriz e uso de agentes de contraste exógeno (MENDONÇA et al., 1996). A seqüência de pulso mais comumente utilizada em RM é a seqüência spin-eco. Nessa seqüência, simplesmente variando TR e TE é possível obter uma imagem que seja predominantemente ponderada em T1, T2 ou na densidade de prótons (MENDONÇA et al., 1996).
De uma forma resumida, a aquisição de imagens por RM é constituída das seguintes etapas: o paciente é colocado no interior do magneto do equipamento; os núcleos atômicos do paciente se alinham ao longo do campo magnético aplicado, gerando um vetor de magnetização; gradientes de campo magnético seqüenciais são aplicados para a localização espacial dos sinais a serem adquiridos; os pulsos de excitação são aplicados e os núcleos absorvem energia; após os pulsos, passam a ocorrer os fenômenos de relaxação; os núcleos passam a induzir o sinal de RM nas bobinas receptoras; o sinal de RM é adquirido; o sinal de RM é processado por meio da transformada de Fourier; a imagem é formada ponto a ponto numa matriz (MAGALHÃES, 1999).
CONCLUSÃO
A imagem por ressonância magnética promoveu um grande avanço na medicina no que diz respeito a imagens encefálicas devido ao alto contraste de tecidos moles e à possibilidade de cortes em qualquer plano escolhido. Esta revisão mostrou as bases físicas dessa modalidade de imagem de forma assimilável proporcionando mais conhecimento aos veterinários.
AGRADECIMENTOS
À Fundação de Amparo à Pesquisa do Estado de São Paulo (FAPESP), pelo auxílio financeiro (Projeto 2002/10.484-0). À Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES), pela bolsa de doutorado da primeira autora. Aos colaboradores Said Rahnamaye Rabbani, Lilian Kamikawa, Jean Louis Shinohara, Hernan Joel Rodriguez Cervantes, Carla Aparecida Batista Lorigados, Hildebrando Gomes Benedicto, Franklin de Almeida Sterman, Maria Concéption Garcia Otaduy e Pedro Primo Bombonato.
Recebido para publicação 09.09.08
Aprovado em 21.11.08
- ASSHEUER, J.; SAGER, M. Mri and ct atlas of the dog Oxford: Blackwell Science, 1997. 482p.
- ÁVILA, L.F. Física em ressonância magnética Parte A. São Paulo: Videoteca da Sociedade Brasileira de Radiologia, 2001. [Fita de Vídeo].
- BLOCH, F. et al. The nuclear induction experiment. Physical Review, New York, v.70, n.7-8, p.474-485, 1946. Disponível em: http://prola.aps.org/abstract/PR/v70/i7-8/p474_1 Doi: 10.1103/PhysRev.70.474.
- BLOEMBERGEN, N. et al. Relaxation effects in nuclear magnetic resonance absorption. Physical Review, New York, v.73, n.7, p. 679-712, 1948. Disponível em: http://prola.aps.org/abstract/PR/v73/i7/p679_1 Doi: 10.1103/PhysRev.73.679.
- CALLAGHAN, P. Principles of nuclear magnetic resonance microscopy Oxford: Oxford University, 1994. 516p.
- HEBEL, L.C.; SLICHTER, C.P. Nuclear spin relaxation in normal and superconducting aluminum. Physical Review, New York, v.113, n.6, p.1504-1519, 1959. Disponível em: http://prola.aps.org/abstract/PR/v113/i6/p1504_1 Doi: 10.1103/PhysRev.113.1504.
- LAUTERBUR, P.C. Image formation by induced local interactions: examples employing nuclear magnetic resonance. Nature, v.242, n.16, p.190-191, 1973. Disponível em: http://www.nature.com/nature/journal/v242/n5394/abs/242190a0.html Doi: 10.1038/242190a0.
- LUFKIN, R.L. Manual de ressonância magnética Rio de Janeiro: Guanabara Koogan, 1999. 338p.
- MAGALHÃES, A.C.A. Ressonância magnética do sistema nervoso central São Paulo: Atheneu, 1999. p.1-26.
- MANSFIELD, P.; GRANNELL, P.K. NMR "diffraction" in solids? Journal of Physics Chemistry: Solid State Physics, Boston, v.6, n.22, p.L422-L426, 1973.
- MENDONÇA, R. et al. Fundamentos da ressonância magnética 1996. [p. 29]. Apostila.
- PURCELL, E.M. et al. Resonance absorption by nuclear magnetic moments in a solid. Physical Review, New York, v.69, n.1-2, p.37-38, 1946.
- PYKETT, I.L. et al. Principles of nuclear magnetic resonance imaging. Radiology, Illinois, v.143, p.157-168, 1982.
- SLICHTER, C.P. Principles of magnetic resonance: Springer series in solid states sciences. Berlin: Springer-Verlag Berlin, 1989. V.1. 666p.
- SMITH, H.; RANALLO, F.N. A non-mathematical approach to basic mri Wisconsin: Medical Physics, 1989. 203p.
- THOMSON, C.E. et al. Magnetic resonance imaging - a general overview of principles and examples in veterinary neurodiagnosis. Veterinary Radiology & Ultrasound, Raleigh, v.34, n.1, p.2-17, 1993.
- TUCKER, R.L.; GAVIN, P.R. Brain imaging. Veterinary clinics of north america: small animal practice, Philadelphia, v.26, n.4, p.735-758, 1996.
- VILLAFANA, T. Fundamental physics of magnetic resonance imaging. Radiologic Clinics of North America, Philadelphia, v.26, n.4, p.701-715, 1988.
Datas de Publicação
-
Publicação nesta coleção
27 Mar 2009 -
Data do Fascículo
Jul 2009
Histórico
-
Aceito
21 Nov 2008 -
Recebido
09 Set 2008