Resumos
O objetivo deste trabalho foi avaliar os efeitos do espaçamento entre plantas na linha e da aplicação ou não de cama-de-frango em cobertura no solo, na atividade antioxidante, teor total de fenóis e flavonóides em extrato etanólico e extrato aquoso quente de folhas de rosela (Hibiscus sabdariffa L.). Os tratamentos consistiram de cinco espaçamentos entre plantas (0,30; 0,35; 0,40; 0,45 e 0,50m) e do uso ou não de cama-de-frango em cobertura do solo, na dose de 10t ha-1, arranjados como fatorial 5x2, no delineamento blocos casualizados, com quatro repetições. Os teores de flavonóides e fenóis totais aumentaram no extrato etanólico (18% e 11%, respectivamente) e no extrato aquoso quente (16% e 11%, respectivamente) entre a aplicação ou não de cama-de-frango em cobertura no solo. A atividade antioxidante foi influenciada significativamente pelo método de obtenção dos extratos, sendo no extrato etanólico 263% maior que o resultado obtido para o extrato aquoso quente.
Hibiscus sabdariffa L.; antocianina; fenóis
The purpose of this paper was to analyze the effects of plant spacing within rows by means of applying or not applying chicken-manure to the soil cover in the antioxidant activity, total phenolic and flavonoids in ethanolic leaves extract and hot aqueous extract of roselle. The treatments consisted of five different spaces between plants (0.30, 0.35, 0.40, 0.45 and 0.50m) and the use or non-use of chicken litter broadcasted on soil surface at 10 ton ha-1, in a 5x2 factorial arrangement in a randomized block design with four replications. The flavonoids levels and total phenolic increased on ethanolic leaves extract (18% and 11%, respectively) and hot aqueous extract (16% and 11%, respectively) between applying or not applying chicken-manure to the soil cover. Antioxidant activity was significantly influenced by the way of obtaining extracts, being the ethanolic extract 263% higher than the results obtained by the hot aqueous extract.
Hibiscus sabdariffa L.; anthocyanins; phenolic
Atividade antioxidante de Hibiscus sabdariffa L. em função do espaçamento entre plantas e da adubação orgânica
Antioxidant activity of Hibiscus sabdariffa L. in function of spacing between plants and organic fertilization
Diovany Doffinger RamosI,1 1 Autor para correspondência. ; Maria do Carmo VieiraI; Anelise Samara Nazari FormagioII; Claudia Andrea Lima CardosoII; Dayana Doffinger RamosIII; Thiago de Oliveira CarnevaliI
IUniversidade Federal da Grande Dourados (UFGD), 79825-070, Dourados, MS, Brasil. E-mail: diovany3@hotmail.com
IIDepartamento de Química, Universidade Estadual Mato Grosso do Sul, Dourados, MS, Brasil
IIIDepartamento de Química, Universidade Federal Mato Grosso do Sul, Campo Grande, MS, Brasil
RESUMO
O objetivo deste trabalho foi avaliar os efeitos do espaçamento entre plantas na linha e da aplicação ou não de cama-de-frango em cobertura no solo, na atividade antioxidante, teor total de fenóis e flavonóides em extrato etanólico e extrato aquoso quente de folhas de rosela (Hibiscus sabdariffa L.). Os tratamentos consistiram de cinco espaçamentos entre plantas (0,30; 0,35; 0,40; 0,45 e 0,50m) e do uso ou não de cama-de-frango em cobertura do solo, na dose de 10t ha-1, arranjados como fatorial 5x2, no delineamento blocos casualizados, com quatro repetições. Os teores de flavonóides e fenóis totais aumentaram no extrato etanólico (18% e 11%, respectivamente) e no extrato aquoso quente (16% e 11%, respectivamente) entre a aplicação ou não de cama-de-frango em cobertura no solo. A atividade antioxidante foi influenciada significativamente pelo método de obtenção dos extratos, sendo no extrato etanólico 263% maior que o resultado obtido para o extrato aquoso quente.
Palavras-chave:Hibiscus sabdariffa L., antocianina, fenóis.
ABSTRACT
The purpose of this paper was to analyze the effects of plant spacing within rows by means of applying or not applying chicken-manure to the soil cover in the antioxidant activity, total phenolic and flavonoids in ethanolic leaves extract and hot aqueous extract of roselle. The treatments consisted of five different spaces between plants (0.30, 0.35, 0.40, 0.45 and 0.50m) and the use or non-use of chicken litter broadcasted on soil surface at 10 ton ha-1, in a 5x2 factorial arrangement in a randomized block design with four replications. The flavonoids levels and total phenolic increased on ethanolic leaves extract (18% and 11%, respectively) and hot aqueous extract (16% and 11%, respectively) between applying or not applying chicken-manure to the soil cover. Antioxidant activity was significantly influenced by the way of obtaining extracts, being the ethanolic extract 263% higher than the results obtained by the hot aqueous extract.
Key words:Hibiscus sabdariffa L., anthocyanins, phenolic.
INTRODUÇÃO
Hibiscus sabdariffa L. (Malvaceae) é uma importante planta medicinal, originária da Índia, do Sudão e da Malásia, sendo posteriormente levada para a África, Sudeste da Ásia e América central. É conhecida como "azedinha, azeda-da-guiné, caruru-azedo, caruru-da-guiné, cha-da-jamaica, pampolha, pampulha, papoula, papoula-de-duas-cores, quiabeiro-azedo, quiabo-azedo, quiabo-de-angola, quiabo-róseo, quiabo-roxo, rosélia e vinagreira". É um arbusto perene, que pode atingir cerca de 2 a 3m de altura, sendo cultivada devido ao interesse em suas folhas, cálices, sementes e fibras, que são utilizados na alimentação de animais, como fonte de fibras para a indústria de tecido e papel e para preparar bebidas com objetivos culinários e medicinais (MUKHTAR, 2007). Na medicina tradicional, é utilizada como diurético, para tratamento de desordem gastrointesinal, infecções hepáticas, febre e hipertensão (MONROY-ORTIZ & CASTILLO-ESPANA, 2007).
Ensaios farmacológicos têm demonstrado uma gama de efeitos terapêuticos, como hepatoprotetor, antibacteriana (LIU, 2006), antioxidante (OLATUNDE & FAKOYA, 2005; RAMAKRISHNA et al., 2008), anticolesterol (LIN, 2007), anticâncer (OLVERA-GARCIA, 2008), antihipertensivo (HERRERA-ARELLANO, 2007), dentre outros. Estudos realizados com H. sabdariffa têm reportado a presença de compostos fenólicos, ácidos orgânicos, esteróides, terpenóides, polissacarídeos e alguns minerais. Os compostos fenólicos consistem principalmente de antocianinas glicosiladas e têm sido consideradas como um dos principais constituintes biologicamente ativos (ALI, 2005).
Nos últimos anos, um grande interesse no estudo de antioxidantes tem ocorrido devido, principalmente, às descobertas sobre o efeito dos radicais livres e outros agentes oxidantes no organismo. Os radicais livres são moléculas instáveis e muito reativas, que são precursores de muitas doenças degenerativas associadas ao envelhecimento, como câncer, doenças cardiovasculares, cataratas, declínio do sistema imune e disfunções cerebrais (AMES et al., 1993).
A ação dos radicais livres pode ser bloqueada ou retardada por substâncias antioxidantes, as quais podem ser naturais e sintéticas. Nas sintéticas, estão incluídos o BHA (butil-hidroxi-anisol), BHT (butil-hidroxi-tolueno) e terc-hidroxi-quinona (TBHQ), comumente utilizados em alimentos contendo lipídios, porém apresentam problemas de segurança e toxicidade. Sendo assim, as pesquisas têm-se voltado no sentido de encontrar produtos naturais com potencial ação antioxidante que possam substituí-los ou ser usados em associação (BURDA & OLESZEK, 2001).
Pesquisas relataram a atividade antioxidante do extrato das flores de rosela e determinaram que a fração solúvel em acetato de etila apresentou poderosa atividade antioxidante sobre radicais livres gerados por 1,1-difenil-2-picril-hidrazil (TSENG, 1997). Estudos determinaram a relação entre antocianina e a capacidade antioxidante em extrato aquoso de pétalas de flores de rosela. Os resultados demonstraram que a antocianina foi responsável por 51% da capacidade antioxidante do extrato (TSAI, 2002).
A eficácia da ação antioxidante dos componentes bioativos depende de sua estrutura química e da concentração desses fitoconstituintes. Por sua vez, o teor desses fitoquímicos em vegetais é amplamente influenciado por fatores genéticos, adubação, condições ambientais, além do grau de maturação e variedade da planta, entre outros. A nutrição das plantas é afetada diretamente pela composição do substrato utilizado, pelos níveis de nutrientes disponíveis e conforme a quantidade de adubo adicionado.
Este artigo relata a avaliação da atividade antioxidante, teor total de fenóis e flavonóides dos extratos etanólicos e do extrato aquoso quente de H. sabdariffa em função do cultivo com diferentes espaçamentos entre plantas e em solo sem e com cobertura de cama-de-frango semidecomposta.
MATERIAL E MÉTODOS
O experimento foi conduzido de setembro de 2006 a março de 2007 no Horto de Plantas Medicinais - HPM da Universidade Federal da Grande Dourados - UFGD, em Dourados-MS. A área localiza-se ao Sul do Estado de Mato Grosso do Sul, com altitude média de 452m; latitude de 22°13'16"S e longitude de 54°17'0,1"W. O clima, segundo a classificação de Köppen é Mesotérmico Úmido do tipo Cwa. As temperaturas médias máximas e mínimas e a precipitação total durante o período do experimento foram 30,8oC, 19,5oC e 1.361mm. O solo, originalmente sob vegetação de cerrado, é Latossolo Vermelho distroférrico, de textura argilosa, pesada, de topografia plana.
A propagação foi feita por semeadura indireta, em 24 de setembro de 2007, utilizando sementes colhidas de plantas cultivadas no HPM da UFGD. As mudas foram produzidas em bandejas de poliestireno de 128 células, com substrato Plantmax®, mantidas em ambiente protegido com sombrite® 50%, com irrigações diárias. Quando as plântulas atingiram cerca de 10cm, aos 25 dias, foram transplantadas ao local definitivo sob cinco espaçamentos entre plantas na linha (0,30; 0,35; 0,40; 0,45 e 0,50m) e em solo sem e com cobertura de cama-de-frango semidecomposta, na dose de 10t ha-1. Os tratamentos foram arranjados como fatorial 5x2, no delineamento experimental blocos casualizados, com quatro repetições.
No florescimento, as folhas foram colhidas aos 88 dias após o transplantio - DAT e, posteriormente, foram seccionadas e colocadas em estufa com circulação forçada de ar, a 60±5°C, até a massa constante. As amostras foram preparadas em função dos tratamentos, empregando-se 0,250g de massa seca moída de folhas em 25mL de etanol 95% para obtenção do extrato etanólico pelo processo de maceração. Para o extrato aquoso quente, empregou-se 0,250g de massa fresca de folhas em 25mL de água pelo processo de infusão. O tempo total de extração foi de 48 horas. Após a extração, as amostras foram filtradas com papel filtro e reconstituídas em balão volumétrico de 25mL com o mesmo solvente extrator.
Avaliação da atividade antioxidante
A investigação da atividade antioxidante do extrato etanólico e do chá foi realizada pelo método fotocolorimétrico in vitro do radical livre estável 2,2-difeniL-1-picril-hidrazila (DPPH), utilizando como controle positivo a quercetina. O método consiste no monitoramento do consumo do radical livre DPPH. pelas amostras, através do decréscimo da medida de absorbância. Alíquotas de 1mL das amostras foram adicionadas a 2mL da solução de DPPH 0,004% e incubada na temperatura ambiente por 30 minutos. A leitura da absorbância de cada amostra foi realizada no espectrofômetro a 517nm (BLOIS, 1958). Todas as análises foram realizadas em triplicata. A porcentagem de inibição (% I) foi calculada pela fórmula: % I=(A0-A)/A0)x100, em que A0 é a absorbância do DPPH (controle) e A é a absorbância da amostra mais DPPH.
Teste de fenóis
Para determinação de fenóis, foi utilizado o método de Folin-Ciocalteu (MEDA et al., 2005). A cada 100 L de amostra, adicionou-se 1,5mL de solução aquosa de carbonato de sódio 2%, 0,5mL de reagente Folin-Ciocalteau (1:10v/v) e 1mL de água destilada, os quais reagiram por 30 minutos. A leitura foi realizada no espectrofotômetro comprimento de onda de 760nm. O mesmo procedimento foi empregado na análise do branco, sendo substituído 100µL de amostra por 100µL de metanol (DJERIDANE et al., 2006). Para calcular a concentração de fenóis, foi preparada uma curva analítica (1,0; 5,0; 10,0; 15,0; 30,0 e 40,0µg) empregando o ácido gálico como padrão e as respectivas absorbâncias foram lidas. O procedimento experimental realizado com o padrão foi o mesmo utilizado para as amostras. Com esses dados, foi feita a regressão linear e obtida a equação da reta, a qual teve seus dados empregados no cálculo das amostras reais. O resultado foi expresso em mg equivalente de ácido gálico por g de extrato. Todos os testes foram realizados em triplicata.
Teste de flavonóides
A cada 500µL das amostras, adicionaram-se 1,50mL de álcool etílico 95%, 0,10mL de cloreto de alumínio 10% (AlCl3.6H2O), 0,10mL de acetato de sódio (NaC2H3O2.3H2O) (1mol L-1) e 2,80mL de água destilada. Deixou-se reagir à temperatura ambiente por 40 minutos. Fez-se a leitura no espectrofotômetro num comprimento de onda de 415nm. O mesmo procedimento foi empregado na análise do branco (LIN & TANG, 2007). Para calcular a concentração de flavonóides, foi preparada uma curva analítica (2,5; 5,0; 10,0; 20,0; 25,0; 50,0; 100,0 e 125,0µg) empregando a quercetina como padrão e as respectivas absorbâncias foram lidas. Com esses dados, foi feita a regressão linear e a equação da reta foi obtida, a qual teve seus dados empregados no cálculo das amostras reais. O resultado foi expresso em mg equivalente de quercetina por g de extrato. Todos os testes foram realizados em triplicata.
As médias dos dados obtidos foram submetidas à análise de variância e as médias comparadas por Tukey a 5% de probabilidade. Todas as análises foram realizadas usando o programa estatístico SAEG (RIBEIRO JUNIOR, 2001).
RESULTADOS E DISCUSSÃO
Os teores de flavonóides no extrato etanólico e extrato aquoso quente das folhas de rosela não foram influenciados significativamente pelos espaçamentos entre as plantas, mas sim pela adição de cama-de-frango no cultivo do vegetal. Em média, houve um aumento de 18% no extrato aquoso quente e de 16% no extrato etanólico entre os dados obtidos sem e com cama-de-frango (Figura 1).
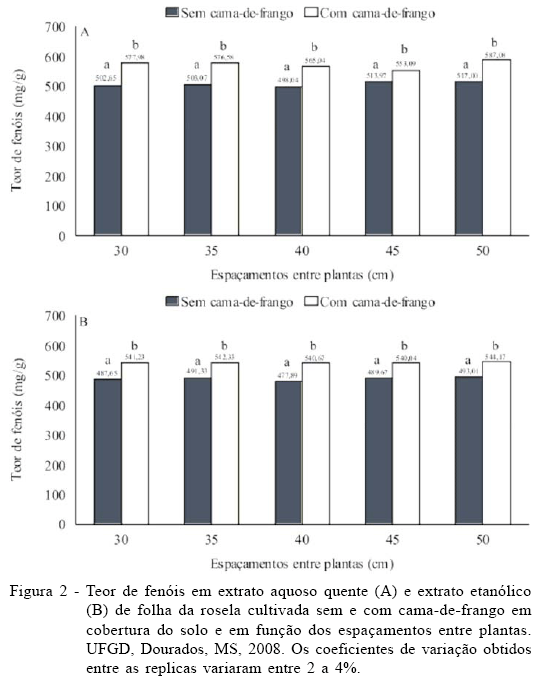
Com relação aos fenóis, em média, ocorreu um aumento de 11% tanto nos extratos aquosos quentes quanto nos extratos etanólicos obtidos do tratamento com cama-de-frango (Figura 2). Os valores obtidos para flavonóides e fenóis nas duas formas de preparo foram similares, mostrando que ambos são fonte desses fitoconstituintes.
O tratamento com cama-de-frango potencializou o teor tanto de fenóis quanto de flavonóides independente do extrato analisado.
Esses resultados mostram que a adubação orgânica está diretamente relacionada à produção dos metabólitos secundários avaliados. A adubação orgânica aumenta a capacidade de troca catiônica do solo, elevando o pH e reduzindo o teor de alumínio trocável, aumenta a disponibilidade de nutrientes aplicados por meio de fertilizantes minerais e contribui para a sanidade do vegetal, por diversificar a produção de substâncias ativas como fenóis e de antibióticos por bactérias (KIEHL, 2008).
Com relação à atividade antioxidante, os resultados obtidos com cama-de-frango foram similares aos obtidos sem adição desta. Os espaçamentos também não influenciaram na atividade antioxidante tanto nos extratos etanólicos quanto nos extratos aquosos quentes obtidos com as folhas do vegetal. O tipo de extrato analisado influenciou significativamente a atividade antioxidante, sendo que na mesma concentração o extrato etanólico apresentou 263% da resposta obtida para o extrato aquoso quente (Figura 3). Isso pode ser explicado pelo fato de o solvente utilizado ter possibilitado a extração de maior quantidade de compostos bioativos.
A composição química e a estrutura do componente ativo do extrato são fatores importantes que influenciam na eficácia do antioxidante natural. Acredita-se que o que contribui marcadamente para a habilidade dos flavonóides é o número de hidroxilas fenólicas, a presença do sistema orto-dihidroxilação do anel B, uma ligação dupla C2 - C3 conjugada com a função 4-oxo no anel C ou de um grupo hidroxila no C-3 (BURDA & OLESZEK, 2001).
Antocianinas, um subgrupo de flavonóides, são os principais constituintes de H. sabdariffa (STRACK & WRAY, 1986; MAZZA & MINIATI, 1993; TSAI, 2002) e apresentam os critérios estruturais citados. Embora essas substâncias sejam encontradas nos cálices, provavelmente estão presentes nas folhas, além de outros compostos fenólicos bioativos, justificando assim a atividade antioxidante relatada.
CONCLUSÃO
Os espaçamentos não influenciaram nas respostas obtidas nos testes de fenóis e flavonóides, mas a adição de cama-de-frango potencializou as respostas tanto no extrato aquoso quente quanto no extrato etanólico. No teste da atividade antioxidante, o que alterou as respostas foi a forma de preparo dos extratos, sendo que os extrato etanólico apresentou uma resposta superior à obtida pelo extrato aquoso quente.
Recebido para publicação 04.02.10
Aprovado em 02.07.11
Devolvido pelo autor 18.07.11
CR-3113
- ALI, B.H. et al. Phytochemical, pharmacological and toxicological aspects of Hibiscus sabdariffa L.: a review. Phytotheraphy Research, v.19, p.369-375, 2005. Disponível em: <http://onlinelibrary.wiley.com.ez50.periodicos.capes.gov.br/doi/10.1002/ptr.1628/pdf>. Acesso em: 12 dez. 2009. doi:10.1002/ptr.1628.
- AMES, B.N. et al. Oxidants, antioxidants, and the degenerative diseases of aging. Proceedings of the National Academy of Sciences of the United States of America, v.90, p.7915-7922, 1993. Disponível em: <http://www.pnas.org/content/90/17/7915.full.pdf+html>. Acesso em: 12 dez. 2009.
- BLOIS, M.S. Antioxidant determinations by the use of a stable free radical. Nature, v.181, p.1199-880, 1958.
- BURDA, S.; OLESZEK, W. Antioxidant and antiradical activities of flavonoids. Journal of Agriculture and Food Chemistry, v.49, p.2774, 2001. Disponível em: <http://pubs.acs.org/doi/pdfplus/10.1021/jf001413m>. Acesso em: 5 dez. 2009. doi: 10.1021/jf001413m.
- DJERIDANE, A. et al. Antioxidant activity of some algerian medicinal plants extracts containing phenolic compounds. Food Chemistry, v.97, p.654-660, 2006. Disponível em: <http://www.sciencedirect.com/science/article/pii/S030881460500422X>. Acesso em: 7 dez. 2009. doi: 10.1016/j.foodchem.2005.04.028.
- HERRERA-ARELLANO, A. et al. Clinical effects produced by a standarized herbal medicinal product of Hibiscus sabdariffa on patients with hypertension. A randomized, double-blind, lisinopril-controlled clinical trial. Planta Medica, v.73, p.6-12, 2007.
- KIEHL, E.J. Adubação orgânica - 500 perguntas e respostas Piracicaba: Degaspari, 2008. 227p.
- LIN, J.Y.; TANG, C.Y. Determination of total phenolic and flavonoid contents in selected fruits and vegetables, as well as their stimulatory effects on mouse splenocyte proliferation. Food Chemistry, v.101, p.140, 2007. Disponível em: <http://www.sciencedirect.com/science/article/pii/S0308814606000665>. Acesso em: 5 dez. 2009. doi: 10.1016/j.foodchem. 2006.01.014.
- LIN, T.L. et al. Hibiscus sabdariffa extract reduces serum cholesterol in men and women. Nutrition Research, v.27, p.140-145, 2007. Disponível em: <http://www.sciencedirect.com/science/article/pii/S0271531707000280>. Acesso em: 02 fev. 2010. doi: 10.1016/j.nutres.2007.01.007.
- LIU, J.Y. et al. The protective effects of Hibiscus sabdariffa extract on CCl4-induced liver ?brosis in rats. Food and Chemical Toxicology, v.44, p.336-343, 2006. Disponível em: http://www.sciencedirect.com/science/article/pii/S0278691505002462 Acesso em: 02 fev. 2010. doi: 10.1016/j.fct.2005.08.003.
- MAZZA, G.; MINIATI, E. Anthocyanins in fruits, vegetables, and grains Boca Raton, Flórida: CRC, 1993. 362p.
- MEDA, A. et al. Determination of the total phenolic, flavonoid and proline contents in burkina fasan honey, as well as their radical scavenging activity. Food Chemintry, v.91, p.571, 2005. Disponível em: <http://www.sciencedirect.com/science/article/pii/S0308814604007186>. Acesso em: 25 nov. 2009. doi: 10.1016/j.foodchem.2004.10.006.
- MONROY-ORTIZ, C.; CASTILLO-ESPANA, P. Plantas medicinales utilizadas en el estado de morelos México: Uaem, 2007. 405p.
- MUKHTAR, M.A. The effect of feeding rosella (Hibiscus sabdariffa) seed on broiler chicks performance. Research Journal Animal and Veterinary Science, v.2, p.21-23, 2007. Disponível em: <http://www.insipub.com/rjavs/2007/21-23.pdf>. Acesso em: 02 fev. 2010.
- OLATUNDE, F.E.; FAKOYA, A. Free radical scavenging and antigenotoxic activities of natural phenolic compounds in dried flowers of Hibiscus sabdariffa L. Molecular Nutrition and Food Research, v.49, p.1120-1128, 2005. Disponível em: <http://onlinelibrary.wiley.com.ez50.periodicos.capes.gov.br/doi/10.1002/mnfr.200500084/pdf>. Acesso em: 02 fev. 2010. doi: 10.1002/mnfr.200500084.
- OLVERA-GARCIA, V. et al. Hibiscus sabdariffa L. extracts inhibit themutagenicity inmicrosuspension assay and the prolifetarion of HeLa cells. Journal of Food Science, v.73, p.75-81, 2008. Disponível em: <http://onlinelibrary.wiley.com.ez50.periodicos.capes.gov.br/>. Acesso em: 17 nov. 2009. doi:10.1111/j.1750-3841.2008.00781.x.
- RAMAKRISHNA, B.V. et al. Antioxidant activities of roselle (Hibiscus sabdariffa) calyces and fruit extracts. Journal of Food Science and Technology, v.45, p.223-227, 2008.
- RIBEIRO JÚNIOR, J.I. Análises estatísticas no SAEG Viçosa: UFV, 2001. 301p.
- STRACK, D.; WRAY, V. The anthocyanins. In: HARBORNE, J.B. The Flavonoids: advance in research since London: Chapman & Hall, 1986. 22p.
- TSAI, P.J. et al. Anthocyanin and antioxidant capacity in roselle (Hibiscus sabdariffa L.) extract. Food Research International, v.35, p.351, 2002. Disponível em: <http://www.sciencedirect.com/science/article/pii/S0963996901001296>. Acesso em: 15 jan. 2010. doi: 10.1016/S0963-9969(01)00129-6.
- TSENG, T.H. et al. Protective effects of dried flower extracts of Hibiscus sabdariffa L. Against oxidative stress in rat primary hepatocytes. Food and Chemical Toxicology, v.35, p.1159-1164, 1997. Disponível em: <http://www.sciencedirect.com/science/article/pii/S0278691597854683>. Acesso em: 02 fev. 2010. doi: 10.1016/S0278-6915(97)85468-3.
Datas de Publicação
-
Publicação nesta coleção
12 Ago 2011 -
Data do Fascículo
Ago 2011
Histórico
-
Recebido
04 Fev 2010 -
Aceito
02 Jul 2011