Resumos
O objetivo deste estudo foi comparar os efeitos clínicos da indução com propofol em nanoemulsão e em emulsão lipídica em gatas, após repetidas administrações. Utilizaram-se 12 gatas, hígidas, SRD, com peso médio de 2,9±0,6kg, distribuídas aleatoriamente em dois grupos: NANO (n=6) e EMU (n=6), que receberam propofol em nanoemulsão na dose de 9,5mg kg-1 e em emulsão lipídica na dose de 10mg kg-1, respectivamente, ambos pela via intravenosa, durante cinco dias consecutivos. Hemograma e função renal e hepática foram realizados a cada 24 horas e até 168 horas após a primeira indução. Os parâmetros clínicos de frequência cardíaca (FC) e respiratória (f) e temperatura retal (TR) foram avaliados antes dos tratamentos e 5, 10, 20 e 30 minutos após a administração de propofol. Em relação aos valores basais, observou-se diminuição da FC no EMU até o 3° dia e da f e TR em ambos os grupos até o último dia, sem diferença entre os dias. As enzimas ALT e FA diminuíram após 24 a 96 horas e 48 a 144 horas, respectivamente, no grupo EMU. Os valores de eritrograma diminuíram até o quinto dia em ambos os grupos. Os tempos para hipnose, extubação e para decúbito esternal não diferiram entre grupos e entre os dias. O tempo para recuperação total do grupo EMU foi maior no 4° e 5° dias em relação ao 1°. Conclui-se que a indução com propofol é segura e que o propofol em emulsão lipídica apresenta maior efeito cumulativo após repetidas administrações em gatas.
anestesia; efeito cumulativo; gatas; nanoemulsão; propofol
The aim this study was to compare the clinical effects of induction with propofol in lipid emulsion and nanoemulsion in cats after repeated administrations. Twelve healthy mongrel cats, with an average weight of 2.9±0.6kg, were randomly distributed into two groups: NANO (n=6) and EMU (n=6), who received propofol in nanoemulsion at dose of 9.5mg kg-1 and in lipid emulsion at a dose of 10mg kg-1, respectively, both intravenously for five consecutive days. Blood count and kidney and liver function were performed every 24 hours until 168 hours after the first induction. The clinical parameters of heart rate (HR), respiratory rate (RR) and rectal temperature (RT) were evaluated before treatment and 5, 10, 20 and 30 minutes after administration of propofol. At baseline, there was a decrease in HR in the EMU until the 3rd day and RR and RT in both groups until the last day, with no difference between days. The enzymes ALT and ALP decreased after 24 to 96 hours and 48 to 144 hours, respectively in EMU group. The values of blood count decreased until the fifth day in both groups. The times of hypnosis, extubation and sternal recumbency did not differ between groups and between days. The total recovery time of EMU group was higher in the 4th and 5th day in relation to the 1st. Concludes that the induction with propofol is safe and that propofol in lipid emulsion has a higher cumulative effect after repeated administration in cats.
anesthesia; cumulative effect; cats; nanoemulsion; propofol
ARTIGOS CIENTÍFICO
CLÍNICA E CIRURGIA
Indução anestésica com nanoemulsão ou emulsão lipídica de propofol durante dias consecutivos em gatas
Anesthetic induction with nanoemulsion or lipid emulsion of propofol during consecutive days in cats
Gabriela Oliveira GallI; Martielo Ivan GehrckeI; Renato Batista TamanhoI; Marcos Paulo Antunes de LimaI; Nilson OleskoviczI,11 Autor para correspondência.
IDepartamento de Medicina Veterinária, Centro de Ciências Agroveterinárias (CAV), Universidade do Estado de Santa Catarina (UDESC), Av. Luiz de Camões, 2090, 88520-000, Lages, SC, Brasil. E-mail: a2no@cav.udesc.br
RESUMOO objetivo deste estudo foi comparar os efeitos clínicos da indução com propofol em nanoemulsão e em emulsão lipídica em gatas, após repetidas administrações. Utilizaram-se 12 gatas, hígidas, SRD, com peso médio de 2,9±0,6kg, distribuídas aleatoriamente em dois grupos: NANO (n=6) e EMU (n=6), que receberam propofol em nanoemulsão na dose de 9,5mg kg-1 e em emulsão lipídica na dose de 10mg kg-1, respectivamente, ambos pela via intravenosa, durante cinco dias consecutivos. Hemograma e função renal e hepática foram realizados a cada 24 horas e até 168 horas após a primeira indução. Os parâmetros clínicos de frequência cardíaca (FC) e respiratória (f) e temperatura retal (TR) foram avaliados antes dos tratamentos e 5, 10, 20 e 30 minutos após a administração de propofol. Em relação aos valores basais, observou-se diminuição da FC no EMU até o 3° dia e da f e TR em ambos os grupos até o último dia, sem diferença entre os dias. As enzimas ALT e FA diminuíram após 24 a 96 horas e 48 a 144 horas, respectivamente, no grupo EMU. Os valores de eritrograma diminuíram até o quinto dia em ambos os grupos. Os tempos para hipnose, extubação e para decúbito esternal não diferiram entre grupos e entre os dias. O tempo para recuperação total do grupo EMU foi maior no 4° e 5° dias em relação ao 1°. Conclui-se que a indução com propofol é segura e que o propofol em emulsão lipídica apresenta maior efeito cumulativo após repetidas administrações em gatas.
Palavras-chave: anestesia, efeito cumulativo, gatas, nanoemulsão, propofol.
ABSTRACTThe aim this study was to compare the clinical effects of induction with propofol in lipid emulsion and nanoemulsion in cats after repeated administrations. Twelve healthy mongrel cats, with an average weight of 2.9±0.6kg, were randomly distributed into two groups: NANO (n=6) and EMU (n=6), who received propofol in nanoemulsion at dose of 9.5mg kg-1 and in lipid emulsion at a dose of 10mg kg-1, respectively, both intravenously for five consecutive days. Blood count and kidney and liver function were performed every 24 hours until 168 hours after the first induction. The clinical parameters of heart rate (HR), respiratory rate (RR) and rectal temperature (RT) were evaluated before treatment and 5, 10, 20 and 30 minutes after administration of propofol. At baseline, there was a decrease in HR in the EMU until the 3rd day and RR and RT in both groups until the last day, with no difference between days. The enzymes ALT and ALP decreased after 24 to 96 hours and 48 to 144 hours, respectively in EMU group. The values of blood count decreased until the fifth day in both groups. The times of hypnosis, extubation and sternal recumbency did not differ between groups and between days. The total recovery time of EMU group was higher in the 4th and 5th day in relation to the 1st. Concludes that the induction with propofol is safe and that propofol in lipid emulsion has a higher cumulative effect after repeated administration in cats.
Key words: anesthesia, cumulative effect, cats, nanoemulsion, propofol.
INTRODUÇÃO
Diversas situações requerem sedações ou anestesias repetidas em pacientes veterinários como exames diagnósticos, limpeza de feridas, quimioterapias, troca de bandagens, entre outros (ANDRESS et al., 1995). Assim, o propofol representa uma excelente opção anestésica para estes procedimentos, pois apresenta rápida indução e recuperação com mínimas alterações hemodinâmicas, mesmo quando comparado aos agentes inalatórios (LIEHMANN et al., 2006).
No entanto, sabe-se da maior sensibilidade dos felinos ao propofol, devido a sua dificuldade de metabolização por glucuronidação (COURT & GREENBLATT, 2000), o que acarreta em uma maior meia vida de eliminação com possível efeito cumulativo no organismo (PASCOE et al., 2006). Soma-se a isso, a ocorrência de lipemia, hemólise e atraso na recuperação em gatos após repetidas administrações de propofol (ANDRESS et al., 1995; MATTHEWS et al., 2004; BLEY et al., 2007).
As nanoemulsões são tecnologias desenvolvidas para eliminar a necessidade de veículos e preservativos que possibilitam maior estabilidade, ausência de crescimento bacteriano e, no caso do propofol, ausência do veículo lipídico que pode levar a incidência de dor à aplicação, lipemia e embolismo (BAKER & NAGUIB, 2005; DATE & NAGARSENKE, 2008). Entretanto, devido às diferentes tecnologias utilizadas na confecção das nanoemulsões, estas podem apresentar efeitos variados na farmacocinética do propofol quando comparada a formulação original (DUTTA & EBLING, 1998; LEE et al., 2009).
Em felinos, um estudo desenvolvido por CLEALE et al. (2009), avaliou os efeitos clínicos e a farmacocinética de uma nanoemulsão a base de 8% de polaxamer; 188,3% de polietilienoglicol; 400,1% de propilenoglicol; 0,2% de ácido cítrico; 0,18% de metilparaben e 0,02% de propilparaben, após administração em bolus. Os autores não encontraram diferenças significativas entre as formulações, a não ser por um menor tempo de eliminação da nanoemulsão, porém, clinicamente irrelevante após administração única. TAMANHO (2010) avaliou, em felinos, após indução seguida de infusão contínua, uma nova nanoemulsão que emprega como único componente o Solutol HS 15 e encontrou uma maior depressão hemodinâmica com a emulsão comercial, embora, devido à variabilidade dos animais, não tenha verificado diferença entre os tempos de recuperação destes.
Nesse sentido, o objetivo deste estudo foi verificar os efeitos da administração repetida de propofol em gatas e comparar as formulações em emulsão lipídica e em nanoemulsão a base, exclusivamente, de Solutol HS 15, quanto aos efeitos cumulativo, hematológicos, renais, hepáticos e na recuperação pós-anestésica.
MATERIAL E MÉTODOS
Foram utilizadas 12 gatas sem raça definida (SRD), com idade entre 1 e 5 anos, peso médio de 2,9±0,6kg e consideradas hígidas após exame clínico e laboratorial (hemograma, funções renal e hepática). Os animais foram mantidos em gaiolas individuais por um período de 30 dias para ambientação e condicionamento, recebendo água ad libitum e ração comercial duas vezes ao dia. Estes foram distribuídos aleatoriamente em dois grupos: NANO (n=6), os quais receberam como agente indutor propofol em nanoemulsão (Propovet®, Ouro Fino Saúde Animal Ltda, Lote Piloto 001/2009, 10mg mL-1), a base de Solutol HS 15 e glicerol, na dose de 9,5mg kg-1; e EMU (n=6), que receberam propofol em emulsão lipídica (Propovan®, Cristália Produtos Químicos Farmacêuticos Ltda, 10mg ml-1), na dose de 10mg kg-1. As doses e fármacos utilizados foram as mesmas utilizadas previamente por TAMANHO (2010). Anteriormente ao estudo, foram realizadas as tricotomias nas regiões das veias cefálicas direita e esquerda para acesso venoso com cateter 24G para administração dos tratamentos e instituição de fluidoterapia na taxa de 5 ml kg-1 h-1.
No momento basal (M0), realizou-se coleta de sangue, através de punção venosa jugular, para a realização de exames complementares: hemograma e funções hepática (glicose, colesterol, albumina, gama glutamiltransferase [GGT], fosfatase alcalina [FA] e alanina aminotransferase [ALT]) e renal (uréia e creatinina). O hemograma foi repetido nos cinco dias seguintes, correspondentes a 24 (M24), 48 (M48), 72 (M72), 96 (M96) e 120 (M120) horas após a primeira indução de propofol. Os exames de bioquímica sérica se estenderam por mais dois dias, incluindo os momentos M144 e M168. Ainda no momento basal, avaliaram-se: frequência cardíaca (FC); frequência respiratória (f) e temperatura retal (TR), os quais foram novamente mensurados aos 5, 10, 20 e 30 minutos após indução com propofol, correspondentes a M5, M10, M20 e M30, respectivamente. Todas as variáveis descritas foram avaliadas durante os cinco dias do estudo.
Os animais foram anestesiados com propofol, administrando-se a dose do fármaco em bolus pela via intravenosa, na respectiva formulação e dose proposta, durante cinco dias consecutivos, com intervalo de 24 horas entre cada aplicação. A velocidade de injeção do fármaco foi padronizada em 30 segundos e, após a indução anestésica, os animais eram intubados, mantidos com oxigênio à 100% e sobre colchão térmico.
Após a indução, avaliaram-se: presença de dor durante a administração, através do reflexo de retirada do membro ou desconforto à administração; qualidade de indução e intubação, através da ocorrência de excitação na indução e dificuldade para intubação; grau de sialorreia (0 = normal, 1= leve, 2= moderado ou 3= intenso); qualidade de recuperação (0 = ruim, 1 = boa ou 2 = ótima), com base na presença de excitação ou ocorrência de efeitos adversos na recuperação; e presença ou ausência de efeitos adversos (opistótono, apneia, movimentos de pedalagem, mioclonias ou nistagmo). Além disso, avaliaram-se os tempos: total de hipnose (período de tempo decorrido da administração de propofol até o término do período que os gatos permaneciam imóveis, em decúbito lateral e sem resposta a estímulos táteis e com ausência de reflexos oculares); para extubação (tempo para manifestar o reflexo de deglutição); para decúbito esternal; para deambulação e para recuperação total (considerado o momento em que os animais permaneciam em posição quadrupedal sem ataxia).
Para análise dos valores médios dentro de cada grupo, entre os tempos, utilizou-se a análise de variância de uma via com repetições múltiplas (ANOVA RM). Os dados foram então submetidos ao teste de Student-Newman-Keuls (SNK) (P≤0,05). Para determinação das diferenças estatísticas entre grupos, foi utilizado o Teste t-Student (P≤0,05).
RESULTADOS E DISCUSSÃO
A indução foi considerada rápida e livre de efeitos adversos em ambos os grupos. Nos tempos de M0 a M30 e na recuperação anestésica, o grupo NANO teve maior prevalência de efeitos como opstótono e mioclonias, porém estes não foram relevantes, já que são citados na literatura em ambas as formulações (TAMANHO, 2010).
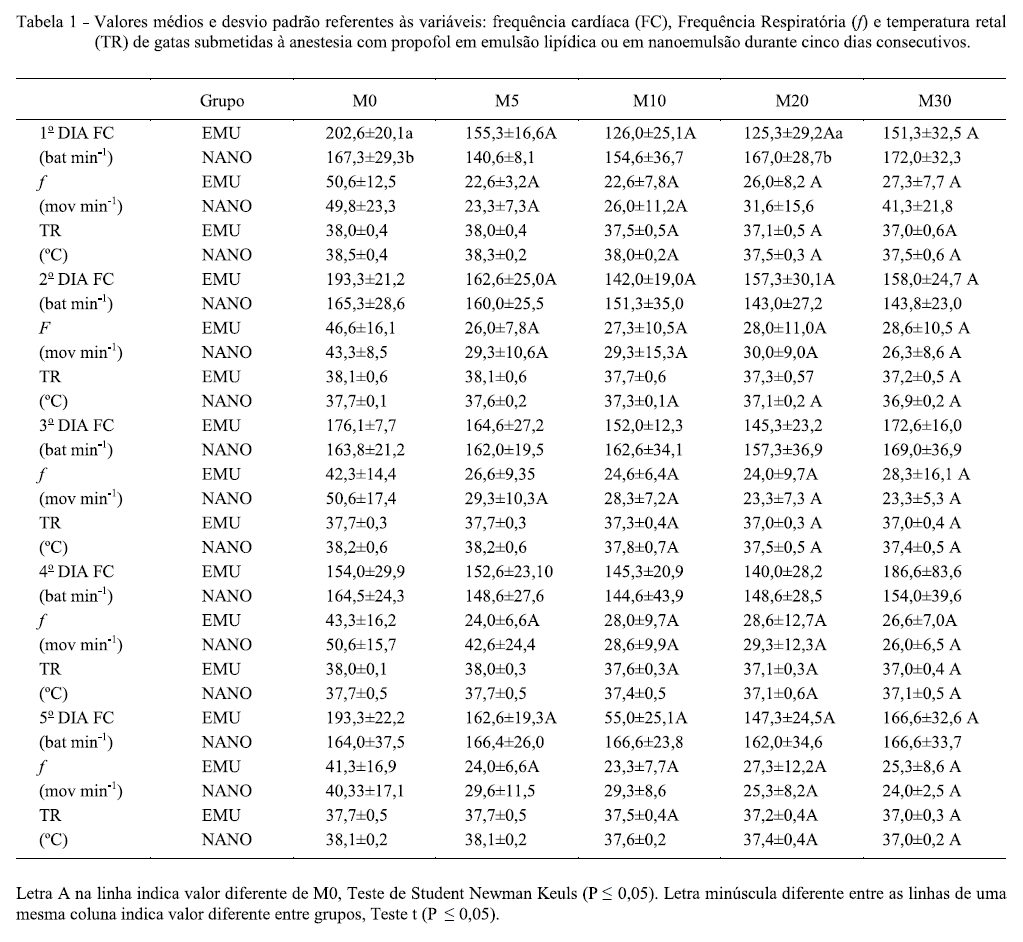
A FC diminuiu em quase todos os momentos após a indução, em relação aos valores basais no grupo EMU no primeiro, segundo e quinto dia de administração. No grupo NANO, esse parâmetro permaneceu sem alterações (Tabela 1). Os efeitos depressores do propofol sobre a FC são bem descritos na literatura, entretanto, essas alterações não são consideradas significativas em gatos hígidos (LIEHMANN et al., 2006). A diferença encontrada entre as formulações também é descrita por TAMANHO (2010), que observou maior estabilidade hemodinâmica em gatos após administração de propofol em nanoemulsão, comparada à emulsão lipídica. O autor atribuiu essa diferença aos componentes da formulação lipídica que poderiam acarretar maior depressão cardiovascular, já que a nanoemulsão do presente estudo é livre de veículos lipídicos, empregando como único surfactante o Solutol HS15.
A f diminuiu quando comparada a M0 em ambos os grupos, durante todos os dias do estudo. Em procedimentos anestésicos utilizando propofol, observa-se depressão respiratória dependente da dose e da velocidade de administração. CLEALE et al. (2009) e TAMANHO (2010) demonstraram redução da f em gatas anestesiadas com esse fármaco, tanto em emulsão lipídica quanto em nanoemulsão, porém sem a ocorrência de apnéia. No presente estudo, acredita-se que a depressão respiratória não seja significativa em animais hígidos, embora não se tenha dados de hemogasometria.
A TR dos animais reduziu a partir de M10 em relação aos valores basais, entretanto, os valores permaneceram acima de 37°C e sem diferença entre os grupos devido a utilização de colchão térmico. A redução na temperatura ocorre devido a uma depressão no centro termorregulador no sistema nervoso central (SNC), ao relaxamento muscular e consequente incapacidade de produção de calor através de tremores, vasodilatação periférica e redução do metabolismo como um todo (FANTONI & CORTOPASSI, 2010).
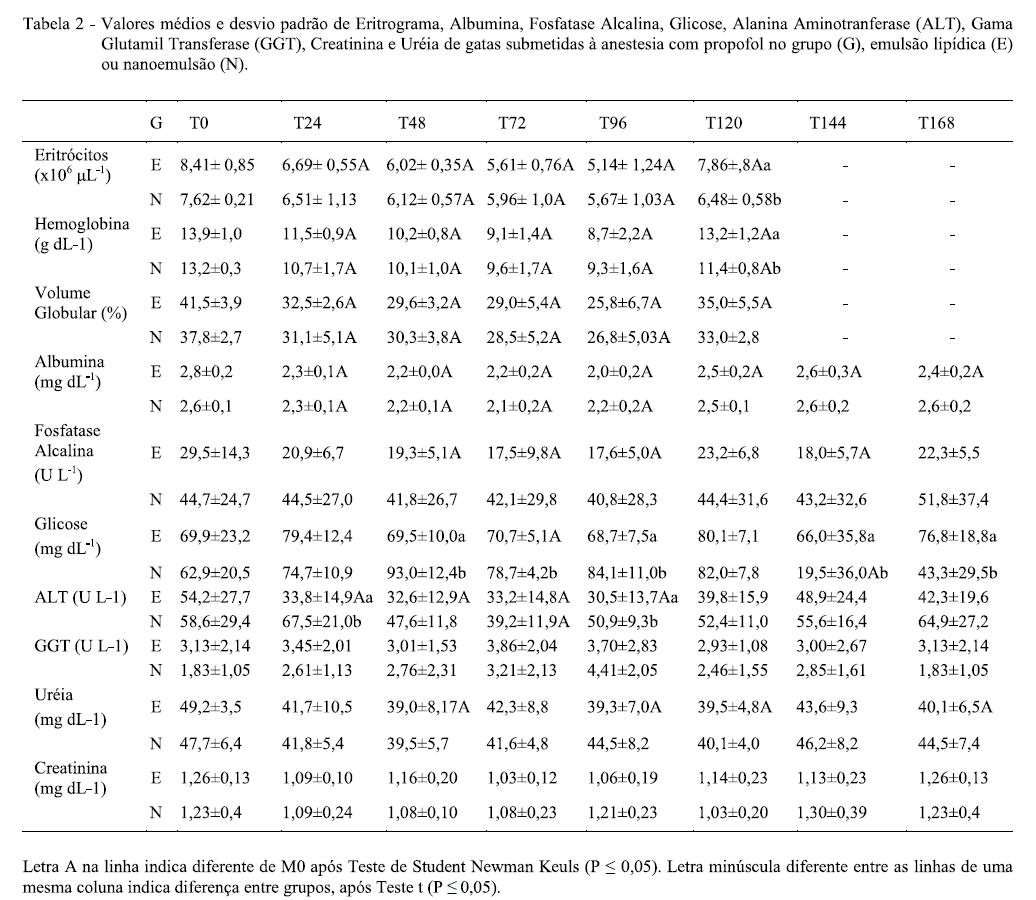
Quanto ao eritrograma, os valores médios de eritrócitos, hemoglobina, volume globular e proteína plasmática total diminuíram em todos os momentos, quando comparadas a M0 (basal) em ambos os grupos (Tabela 2). Esta diminuição pode ser resultante das consecutivas coletas de sangue, no entanto, os valores mantiveram-se dentro da referência para a espécie (KANEKO, 2008). Ressalta-se ainda que em todas as amostras sanguíneas do EMU foi observada a presença de lipemia em decorrência da formulação.
O propofol é descrito como um fármaco com risco potencial para induzir lesões oxidativas nos eritrócitos de felinos, principalmente quando administrado durante vários dias consecutivos, o que leva à formação de metahemoglobina e corpúsculos de Heiz, uma vez que a hemoglobina felina é mais susceptível a esse tipo de injúria (SOUZA, 2002). Todavia, MATTHEWS et al. (2004) observaram que a administração de propofol em bolus em gatas durante três dias consecutivos produzia aumento não significativo dos corpúsculos de Heinz. No presente estudo esse parâmetro não foi avaliado, pois a literatura disponível suporta que a lesão eritrocitária é freqüente em felinos devido ao estresse e a sensibilidade dos eritrócitos à fármacos e que esta não acarreta em alterações clínicas significativas (ANDRESS et al., 1995; MATTHEWS et al., 2004, KANEKO, 2008; TAMANHO, 2010). Os demais parâmetros como contagem de plaquetas e valores de leucograma não apresentaram diferença tanto entre os dias quanto entre os grupos (Tabela 2).
No EMU, houve diminuição dos valores de FA e ALT em diferentes momentos em relação à M0, e com diferenças entre os grupos apenas nos valores de ALT que foram menores no EMU em M24 e M72 (Tabela 2). Os resultados obtidos para GGT estão de acordo com o fisiológico para gatos (KANEKO, 2008) em todos os momentos avaliados (Tabela 2). TAMANHO (2010), em seu estudo com infusão contínua de propofol em gatos, observou também valores semelhantes para essas enzimas e sugere, juntamente com KANEKO (2008), que existe vantagem na dosagem sérica de GGT frente à avaliação de FA, em razão da maior especificidade da GGT como enzima hepática e do fato da meia vida da FA em gatos ser relativamente curta. Assim, pode-se inferir que não houve lesão hepática após os cinco dias de administração de ambas as formulações. As pequenas alterações nos valores de albumina e glicose (Tabela 2) são resultantes do jejum prévio as análises e em dias consecutivos.
Na avaliação da função renal, observou-se discreta diminuição dos valores de uréia no EMU em M48, M96, M120 e M168 (Tabela 2) em relação a M0. No entanto, alterações nos resultados de uréia podem ser atribuídas a características individuais dos animais ou em decorrência de alimentação (KANEKO, 2008). Ainda, os valores de creatinina permaneceram dentro dos valores fisiológicos para espécie, não indicando lesão renal (KANEKO, 2008).
Não foram observadas diferenças nos valores referentes aos tempos total de hipnose, para extubação e para decúbito esternal entre os cinco dias do estudo, nem entre grupos (Tabela 3). A qualidade de recuperação foi considerada boa ou ótima na maioria dos animais com ambas as formulações, sendo que apenas dois animais do NANO e um do EMU apresentaram-se agitados e reagindo de forma exacerbada aos estímulos externos no primeiro dia. Estas alterações refletem a não utilização de medicação pré-anestésica e presença de estresse durante a indução anestésica (FANTONI & CORTOPASSI, 2010; TAMANHO, 2010).
A análise estatística dos dias consecutivos em relação ao primeiro denota apenas um aumento no tempo para deambulação no 4° dia no NANO, e aumento no tempo de recuperação total no 4° e 5° dias no EMU (Tabela 3). Os felinos têm dificuldade em metabolizar compostos por glicuronidação (COURT & GREENBLATT, 2000) e em razão dessa alteração, o propofol apresenta uma maior meia vida de eliminação no gato em relação a outras espécies (BESTER, 2009). PASCOE et al. (2006) demonstraram que o aumento no tempo de infusão do propofol em felinos ocasiona um aumento no tempo de recuperação anestésica. ANDRESS et al. (1995) utilizaram um protocolo de indução seguida de infusão contínua de propofol por 30 minutos durante 10 dias e observaram um aumento nos tempos de recuperação em relação ao primeiro dia, sugerindo efeito cumulativo do fármaco.
Por outro lado, MATTHEWS et al. (2004) não verificaram diferenças após três dias de administração consecutiva de propofol em bolus nas doses de 6 e 10mg kg-1., sugerindo que alterações significativas no tempo de recuperação não ocorrem em anestesias de curta duração. TAMANHO (2010) avaliou os efeitos clínicos e laboratoriais da administração de propofol em nanoemulsão e em emulsão lipídica após indução seguida de 90 minutos de infusão contínua em gatos, sendo que não evidenciou diferenças estatísticas nos tempos de recuperação total, comparando as mesmas formulações do presente estudo. Porém, atribuiu estes resultados ao grande desvio padrão entre os animais, já que os valores de tempo de recuperação total foram de 233,1±60,6 minutos para a emulsão lipídica e de 169,1±55,4 para a nanoemulsão. Ainda, CLEALE et al. (2009) determinaram a farmacocinética do propofol em nanoemulsão e em emulsão lipídica em gatos e não verificaram diferenças entre as formulações, se não um menor tempo de meia vida de eliminação terminal com a nanoemulsão. Todavia, a diferença encontrada é clinicamente indiferente para administrações em bolus único, e não se sabe ao certo se esta interferiria no tempo de recuperação após administrações repetidas. Cabe ressaltar que as nanoemulsões utilizadas pelos diferentes autores possuem diferentes tecnologias que podem acarretar em alterações farmacocinéticas importantes (DUTTA & EBLING, 1998; LEE et al., 2009).
A presente nanoemulsão já é patenteada e aprovada para uso em humanos (RODRIGUES et al., 2012), sendo que não se verificam diferenças farmacocinéticas e clínicas com a formulação em emulsão lipídica. Em Medicina Veterinária, esta já está com seus estudos clínicos e de eficácia realizados e, atualmente, está em vias finais de aprovação para comercialização, sendo que logo estará disponível para utilização na rotina hospitalar.
CONCLUSÃO
A administração consecutiva de propofol em ambas as formulações em gatas é segura, uma vez que não produziu efeitos adversos nem alterações hematológicas, hepáticas ou renais significativas. A administração consecutiva de propofol em emulsão lipídica apresenta maior tempo de recuperação total a partir do 4° dia de administração, sugerindo um efeito cumulativo maior em relação à nanoemulsão.
COMITÊ DE ÉTICA E BIOSSEGURANÇA
Aprovado pela Instituição de Origem (Protocolo 1.10/10).
Aprovado 26.10.12
Devolvido pelo autor 30.08.13
CR-2012-0086.R1
- ANDRESS, J.L. et al. The effects of consecutive day propofol anesthesia on feline red blood cells. Veterinary Surgery, v.24, p.277-282, 1995. Disponível em: <http://onlinelibrary.wiley.com/doi/10.1111/j.1532-950X.1995.tb01331.x/abstract>. Acesso em: 20 abr. 2011. doi: 10.1111/j.1532-950X.1995.tb01331.x
- BAKER, M.T.; NAGUIB, M. Propofol: the challenges of formulation. Anesthesiology, v.103, p.860-876, 2005. Disponível em: <http://journals.lww.com/anesthesiology/Abstract/2005/10000/Propofol__The_Challenges_of_Formulation.26.aspx>. Acesso em: 23 jul. 2011.
- BESTER, L. Pharmacokinetics of propofol in cats 2009. 72f. Tese (Doctor in Department of Companion Animal Clinical Studies) - Faculty of Veterinary Science University of Pretoria, Pretoria, South Africa.
- BLEY et al. Clinical assessment of repeated propofol associated anesthesia in cats. Journal of the American Veterinary Medical Association, v.231, p.1347-1353, 2007. Disponível em: <http://avmajournals.avma.org/doi/abs/10.2460/javma.231.9.1347?journalCode=javma>. Acesso em: 23 jul. 2011. doi: 10.2460/javma.231.9.1347.
- CLEALE, M.R. et al. Pharmacokinetic and pharmacodynamic evaluation of Propofol administered to cats in a novel, aqueous, nano-droplet formulation or as an oil-inwater macroemulsion. Journal Veterinary Pharmacology Theraphy, v.32, p.436-445, 2009.
- COURT, M.H.; GREENBLATT, D.J. Molecular genetic basis for deficient acetaminophen glucuronidation by cats: UGT1A6 is a pseudogene, and evidence for reduced diversity of expressed hepatic UGT1A isoforms. Pharmacogenetics, v.10, p.355-369, 2000.
- DATE, A.A.; NAGARSENKE M.S. Parenteral microemulsions: an overview. International Journal of Pharmaceutics, v.355, p.19-30, 2008. Disponível em: <http://dx.doi.org/10.1016/j.ijpharm.2008.01.004>. Acesso em: 08 ago. 2012.
- DUTTA, S.; EBLING, W.F. Formulation-dependent pharmacokinetics and pharmacodynamics of propofol in rats. Journal of Pharmacy and Pharmacology, v.50, p.37-42, 1998. Disponível em: <http://onlinelibrary.wiley.com/doi/10.1111/j.2042-7158.1998.tb03302.x/abstract>. Acesso em: 20 jul. 2011. doi: 10.1111/j.2042-7158.1998.tb03302.x.
- FANTONI, D.T.; CORTOPASSI, S.R.G. Anestesia em cães e gatos 2.ed. São Paulo: Rocca, 2010, 632p.
- KANEKO, J. J.; HARVEY, J. W.; BRUSS, M. L. Clinical biochemistry of domestic animals 6 ed. London: Academic Press, 2008, 928p.
- LEE, S.H. et al. Pharmacokinetics and pharmacodynamics of a new reformulated microemulsion and the long-chain triglyceride emulsion of propofol in beagle dogs. British Journal of Pharmacology, v.158, p.1982-1995, 2009. Disponível em: <http://onlinelibrary.wiley.com.ez74.periodicos.capes.gov.br/doi/10.1111/j.1476-5381.2009.00509.x>. Acesso em: 2 ago. 2011.
- LIEHMANN, L. et al. Comparison of cardiorespiratory variables during isoflurane-fentanyl and propofol-fentanyl anaesthesia for surgery in injured cats. Veterinary Anaesthesia and Analgesia, v.33, p.158-168, 2006.
- MATTHEWS, N.S. et al. Repetitive propofol administration in dogs and cats. Journal of American Animal Hospital Association, v.40, p.255-260, 2004. Disponível em: <http://www.jaaha.org/content/40/4/255.abstract>. Acesso em: 2 ago 2011.
- PASCOE, P.J. et al. The effect of the duration of propofol administration on recovery from anesthesia in cats. Veterinary Anaesthesia and Analgesia v.33, p.2-7, 2006.
- RODRIGUES, A.T. et al. Estudo Comparativo entre propofol em nanoemulsão não lipídica com solutol e em emulsão com lecitina. Revista Brasileira de Anestesiologia, v.62, p.330-334, 2012. Disponível em: <http://www.scielo.br/pdf/rba/v62n3/v62n3a05.pdf>. Acesso em: 8 ago. 2012.
- SOUZA, H.J.M. Terapêutica felina - Cuidado com o uso de drogas em gatos. In: ANDRADE, S. F. Manual de terapêutica veterinária 2.ed. São Paulo: Roca, 2002, Cap.22, p.557-568.
- TAMANHO, R.B. Efeitos cardiorespiratórios e metabólicos do propofol nas formulações em emulsão lipídica e nanoemulsão em felinos 2010. 120f. Dissertação (Mestrado em que Ciência Animal) - Centro de Ciências Agroveterinárias, Universidade do Estado de Santa Catarina, Lages, SC.
Datas de Publicação
-
Publicação nesta coleção
01 Nov 2013 -
Data do Fascículo
Nov 2013
Histórico
-
Recebido
30 Abr 2012 -
Aceito
26 Out 2012