Resumos
A quitosana é um polissacarídeo linear obtido da desacetilação da quitina. As propriedades físico-químicas da quitosana são função do grau médio de acetilacão <img border=0 id="_x0000_i1026" src="../../../../img/revistas/po/v13n4/19880x1.gif" align=absmiddle>e da massa molar média (<img border=0 id="_x0000_i1027" src="../../../../img/revistas/po/v13n4/19880x2.gif" align=absmiddle>). Várias aplicações da quitosana foram propostas na literatura, principalmente no tratamento de águas, produção de cosméticos, drogas e medicamentos, aditivos alimentícios, membranas semipermeáveis e no desenvolvimento de biomateriais. Neste trabalho, três diferentes tipos de quitosanas comerciais foram caracterizados por ressonância magnética nuclear de hidrogênio (RMN ¹H), espectroscopia de absorção na região do infravermelho (IV), titulação condutimétrica e análise térmica (TG e DSC) com o objetivo de comparar as características de quitosanas provenientes de diferentes fornecedores. A massa molar média das amostras foi determinada a partir de medidas de viscosidade intrínseca. Os resultados obtidos por estas técnicas mostraram diferenças quanto ao grau médio de acetilação (ou desacetilação), em função da procedência do material. Os resultados obtidos da análise térmica permitiram acompanhar os processos de desidratação, decomposição e a temperatura de transição vítrea (Tg).
Quitosana; grau médio de acetilação; termogravimetria; DSC
Chitosan is a linear polysaccharide obtained from the deacetylation of chitin. The physico-chemical properties of chitosan dependent on the average degree of acetylation (<img border=0 id="_x0000_i1029" src="../../../../img/revistas/po/v13n4/19880x8.gif" align=absmiddle>) and of the average molar mass (<img border=0 id="_x0000_i1030" src="../../../../img/revistas/po/v13n4/19880x2.gif" align=absmiddle>). Several applications of chitosan have been proposed in the literature, mainly in water treatment, cosmetic and drug manufacturing, food additives, semipermeable membranes and development of biomaterials. In this work, three commercial chitosan samples were characterized by proton nuclear magnetic resonance (¹H NMR), infrared spectroscopy (IR), conductimetric titration and thermal analysis (TG and DSC) in order to compare commercial chitosans from different supplies. The average viscosimetric molecular weight Mv was estimated from the intrinsic viscosity. The results confirmed remarkable differences in relation to the mean degree of acetylation (<img border=0 id="_x0000_i1031" src="../../../../img/revistas/po/v13n4/19880x8.gif" align=absmiddle>) (or desacetylation, <img border=0 id="_x0000_i1032" src="../../../../img/revistas/po/v13n4/19880x3.gif" align=absmiddle>). The thermal analysis data permitted to follow the dehydration, decomposition, and glass transition temperature (Tg).
Chitosan; medium degree of acetylation; thermogravimetry; DSC
ARTIGO TÉCNICO CIENTÍFICO
Caracterização de quitosanas comerciais de diferentes origens
Characterization of commercial chitosan from different suppliers
José E. dos SantosI; João da P. SoaresI; Edward R. DockalI; Sérgio P. Campana FilhoII; Éder T. G. CavalheiroII
IDepartamento de Química, UFSCar
IIInstituto de Química de São Carlos, USP
Endereço para correspondência E ndereço para correspondência Éder Tadeu Gomes Cavalheiro IQSC-USP Caixa Postal 780 CEP: 13.560-970, São Carlos, SP E-mail: cavalheiro@iqsc.sc.usp.br
RESUMO
A quitosana é um polissacarídeo linear obtido da desacetilação da quitina. As propriedades físico-químicas da quitosana são função do grau médio de acetilacão  e da massa molar média (
e da massa molar média ( ). Várias aplicações da quitosana foram propostas na literatura, principalmente no tratamento de águas, produção de cosméticos, drogas e medicamentos, aditivos alimentícios, membranas semipermeáveis e no desenvolvimento de biomateriais. Neste trabalho, três diferentes tipos de quitosanas comerciais foram caracterizados por ressonância magnética nuclear de hidrogênio (RMN 1H), espectroscopia de absorção na região do infravermelho (IV), titulação condutimétrica e análise térmica (TG e DSC) com o objetivo de comparar as características de quitosanas provenientes de diferentes fornecedores. A massa molar média das amostras foi determinada a partir de medidas de viscosidade intrínseca. Os resultados obtidos por estas técnicas mostraram diferenças quanto ao grau médio de acetilação (ou desacetilação), em função da procedência do material. Os resultados obtidos da análise térmica permitiram acompanhar os processos de desidratação, decomposição e a temperatura de transição vítrea (Tg).
). Várias aplicações da quitosana foram propostas na literatura, principalmente no tratamento de águas, produção de cosméticos, drogas e medicamentos, aditivos alimentícios, membranas semipermeáveis e no desenvolvimento de biomateriais. Neste trabalho, três diferentes tipos de quitosanas comerciais foram caracterizados por ressonância magnética nuclear de hidrogênio (RMN 1H), espectroscopia de absorção na região do infravermelho (IV), titulação condutimétrica e análise térmica (TG e DSC) com o objetivo de comparar as características de quitosanas provenientes de diferentes fornecedores. A massa molar média das amostras foi determinada a partir de medidas de viscosidade intrínseca. Os resultados obtidos por estas técnicas mostraram diferenças quanto ao grau médio de acetilação (ou desacetilação), em função da procedência do material. Os resultados obtidos da análise térmica permitiram acompanhar os processos de desidratação, decomposição e a temperatura de transição vítrea (Tg).
Palavras-chave: Quitosana, grau médio de acetilação, termogravimetria, DSC.
ABSTRACT
Chitosan is a linear polysaccharide obtained from the deacetylation of chitin. The physico-chemical properties of chitosan dependent on the average degree of acetylation ( ) and of the average molar mass (
) and of the average molar mass ( ). Several applications of chitosan have been proposed in the literature, mainly in water treatment, cosmetic and drug manufacturing, food additives, semipermeable membranes and development of biomaterials. In this work, three commercial chitosan samples were characterized by proton nuclear magnetic resonance (1H NMR), infrared spectroscopy (IR), conductimetric titration and thermal analysis (TG and DSC) in order to compare commercial chitosans from different supplies. The average viscosimetric molecular weight Mv was estimated from the intrinsic viscosity. The results confirmed remarkable differences in relation to the mean degree of acetylation (
). Several applications of chitosan have been proposed in the literature, mainly in water treatment, cosmetic and drug manufacturing, food additives, semipermeable membranes and development of biomaterials. In this work, three commercial chitosan samples were characterized by proton nuclear magnetic resonance (1H NMR), infrared spectroscopy (IR), conductimetric titration and thermal analysis (TG and DSC) in order to compare commercial chitosans from different supplies. The average viscosimetric molecular weight Mv was estimated from the intrinsic viscosity. The results confirmed remarkable differences in relation to the mean degree of acetylation ( ) (or desacetylation,
) (or desacetylation,  ). The thermal analysis data permitted to follow the dehydration, decomposition, and glass transition temperature (Tg).
). The thermal analysis data permitted to follow the dehydration, decomposition, and glass transition temperature (Tg).
Keywords: Chitosan, medium degree of acetylation, thermogravimetry, DSC.
Introdução
A quitosana é um biopolímero obtido da desacetilação da quitina, que é o maior constituinte de exoesqueletos de crustáceos e outros animais marinhos[1]. Atualmente a quitosana vem sendo utilizada no tratamento de águas, produção de cosméticos, drogas e medicamentos, aditivos alimentícios, membranas semipermeáveis e no desenvolvimento de biomateriais[2]. Na presença de soluções diluídas de ácidos, a quitosana comporta-se como um polieletrólito catiônico, constituído de um copolímero de 2-amino-2-deoxi-D-glicopiranose e 2-acetamido-2-deoxi-D-glicopiranose de composição variável em função do grau médio de acetilação,  , que representa a fração de unidades 2acetamido-2-glicopiranose e 2-amino-2-deoxi-D-glicopiranose e é um dos principais parâmetros para sua caracterização. A proporção relativa dessas unidades nas cadeias macromoleculares de quitosana tem efeito marcante na sua solubilidade. A representação de uma unidade de repetição da quitosana é dada na Figura 1.
, que representa a fração de unidades 2acetamido-2-glicopiranose e 2-amino-2-deoxi-D-glicopiranose e é um dos principais parâmetros para sua caracterização. A proporção relativa dessas unidades nas cadeias macromoleculares de quitosana tem efeito marcante na sua solubilidade. A representação de uma unidade de repetição da quitosana é dada na Figura 1.
Várias técnicas foram propostas para a determinação do  de quitosana, baseadas em titulação condutimétrica[3], espectroscopia na região do infravermelho (IV)[4], espectroscopia de ressonância magnética de hidrogênio (RMN 1H)[5], análise elementar[6], cromatografia líquida de alta eficiência (HPLC)[7], termogravimetria (TG/DTG)[8], entre outras.
de quitosana, baseadas em titulação condutimétrica[3], espectroscopia na região do infravermelho (IV)[4], espectroscopia de ressonância magnética de hidrogênio (RMN 1H)[5], análise elementar[6], cromatografia líquida de alta eficiência (HPLC)[7], termogravimetria (TG/DTG)[8], entre outras.
A quitosana é insolúvel em água, mas dissolve-se em soluções aquosas de ácidos orgânicos, como acético, fórmico, cítrico, além de ácidos inorgânicos, como ácido clorídrico diluído resultando em soluções viscosas.
A solubilidade da quitosana está relacionada com a quantidade de grupos amino protonados (-NH3+) na cadeia polimérica. Quanto maior a quantidade destes grupos, maior a repulsão eletrostática entre as cadeias e também maior a solvatação em água. O grau de protonação pode ser determinado pela variação da concentração de quitosana. Para uma dada concentração de ácido, o grau de protonação depende do pK do ácido usado para solubilizar a quitosana[9].
A quitosana é susceptível a mudanças estruturais, devido à grande quantidade de grupos reativos como as hidroxilas e principalmente os grupos amino, especialmente em reações de N-acetilação, N-alquilação, N-carboxilação, N-sulfonação e formação de bases de Schiff com aldeídos e cetonas[10].
O objetivo deste trabalho é a caracterização de três amostras comerciais de diferentes marcas de quitosana e o estudo do comportamento térmico, usando termogravimetria (TG) e calorimetria exploratória diferencial (DSC). A caracterização é baseada no grau médio de acetilação  e/ou grau médio de desacetilação (
e/ou grau médio de desacetilação ( ), calculados por ressonância magnética nuclear de hidrogênio (RMN 1H) e titulação condutimétrica.
), calculados por ressonância magnética nuclear de hidrogênio (RMN 1H) e titulação condutimétrica.
Experimental
Reagentes
Os reagentes e solventes utilizados neste trabalho foram de grau analítico (PA), e usados sem purificação prévia, exceto as amostras de quitosana comercial. Estas amostras foram obtidas das empresas Fluka® (QF), Aldrich® (QA) e Polymar/Br (QP). Todas elas, foram obtidas preliminarmente de exoesqueletos de carangueijo. Segundo especificação dos fabricantes, as amostras QF e QP apresentam massa molar média e nenhuma especificação quanto ao  , enquanto a amostra QA apresenta massa molar baixa e
, enquanto a amostra QA apresenta massa molar baixa e  de 84,7%.
de 84,7%.
Purificação das amostras de quitosana
As amostras de quitosana foram purificadas de acordo com o procedimento descrito por Signini e Campana-Filho[11]. Amostra de quitosana foi dissolvida em ácido acético 0,5mol L-1 sob agitação constante por aproximadamente 18 horas. A solução resultante foi filtrada sob pressão positiva através de membranas de porosidades 5 e 0,8µm. À solução filtrada adicionou-se aos poucos hidróxido de amônio concentrado até a precipitação. O precipitado foi lavado com água várias vezes até pH neutro, em seguida lavado com metanol seco a temperatura ambiente e depois em estufa a vácuo, a 60 °C por 24 horas.
Caracterização das Amostras
Espectroscopia na região do Infravermelho (IV)
Aproximadamente 1,5mg das amostras de quitosana foram secas em estufa a vácuo por 15 horas a 60 °C. Após este período, 100mg de KBr foram adicionados e a mistura homogeneizada em almofariz de ágata. As pastilhas foram preparadas e deixadas em estufa a vácuo a 110 °C por 20 horas. Os espectros de IV foram registrados em um espectrofotômetro Bomem-Michelson FT-IR, MB 102.
Ressonância Magnética Nuclear de Hidrogênio (RMN 1H)
Os espectros de RMN 1H foram obtidos em um espectrômetro BRUKER DRX400. Todos os espectros foram obtidos a partir de um procedimento descrito por Signini e Campana-Filho[12]. Aproximadamente 10 mg de amostra de quitosana foi solubilizada em 1mL de solução de HCl/D2O 1% (v/v), durante 24 horas formando uma solução viscosa. Uma alíquota dessa solução foi colocada em tubos de 5 mm de diâmetro para a análise a 70 °C. Como referência externa foi usado ácido 3-(trimetilsilil)-1-propano sulfonico-d4 (TSPA da Aldrich).
Titulação condutimétrica
O procedimento foi adaptado do trabalho de Raymond et al.[3]. Neste caso, 200mg das amostras de quitosana foram agitadas em 40mL de solução de ácido clorídrico 0,05mol L1 por 18 horas. As amostras foram tituladas com solução por NaOH 0,17mol L-1 à temperatura de 25,0° ± 0,1 °C. As variações de condutância durante a titulação foram medidas por um condutivímetro Micronal B330, equipado com célula condutimétrica Digimed DMC-010.
Viscosidade
Para determinações de viscosidade intrínseca, [h], foi adotado o procedimento descrito por Signini e Campana Filho[12]. Cerca de 50 mg de amostra de quitosana purificada foi dissolvida em 25 mL de uma solução tampão (ácido acético / acetato de sódio, pH ~ 4,5) sob agitação constante por 15 horas. A solução foi então aquecida em banho-maria a 80 °C durante dois minutos e após atingir a temperatura ambiente, acrescentou-se 25 mL de solução tampão e aqueceu-se novamente a 80 °C por dois minutos. Após atingir a temperatura ambiente, a solução foi filtrada em membrana de porosidade 0,45 µm. Alíquota de 15 mL foi colocada em capilar de vidro (f = 0,45 mm) termostatizado em 25 ° ± 0,1 °C para diluição seriada. Os tempos de escoamento foram determinados em viscosímetro AVS-350 acoplado ao sistema diluidor automático AVS 20, ambos da Schott-Geräte. A solução, com viscosidade relativa menor que 1,8, foi seqüencialmente diluída no próprio capilar através da adição do tampão ácido acético/acetato (pH = 4,5), até atingir uma viscosidade relativa próxima de 1,2. Os valores de tempos de escoamento de [h] correspondem à média de quatro determinações independentes e que não apresentaram variação maior que 0,09%. Todos os tempos de escoamento foram automaticamente corrigidos para efeitos cinéticos pelo acionamento de dispositivo específico no sistema de gerenciador das medidas.
Análise Térmica
As curvas TG foram obtidas em um módulo termogravimétrico TGA 2050 e as DSC em um módulo calorimétrico DSC 2100, acoplados a um analisador térmico TA 2000, todos da TA Instruments.
As medidas termogravimétricas foram efetuadas usando suporte de amostra de platina, massas de amostra em torno de 7 mg, razão de aquecimento de 5, 10, 20 e 30 °C min-1 em atmosfera dinâmica de ar e N2, ambas com uma vazão de 90 mL min-1.
As curvas DSC foram obtidas em suporte de amostra de alumínio com tampa furada no centro e massas de amostra em torno de 4 mg. As amostras foram aquecidas a uma razão de aquecimento de 10 °C min-1 em atmosfera dinâmica de ar e N2, ambas com uma vazão de 90 mL min-1.
Resultados e Discussão
Espectroscopia na região do infravermelho
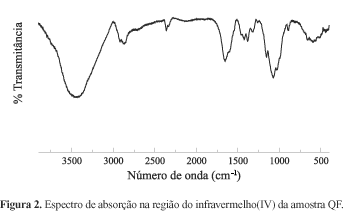
O espectro de absorção no infravermelho (IV) da amostra QF é apresentado na Figura 2, como exemplo representativo dos demais, já que todos foram semelhantes.
As principais bandas observadas nos espectros IV das amostras de quitosana foram: banda de estiramento axial de OH entre 3440 a 3480 cm-1, a qual aparece sobreposta à banda de estiramento N-H; deformação axial de C = O de amida I (entre 1661 a 1671 cm-1); deformação angular de N-H (entre 1583 a 1594 cm-1); deformação angular simétrica de CH3 (entre 1380 a 1383 cm-1); deformação axial de -CN de amida (por volta de 1425 cm-1) e deformação axial de -CN de grupos amino (entre 1308 a 1380 cm-1), além de bandas de estruturas polissacarídicas na região de 890 1156 cm-1. Todas as bandas características são muito semelhantes aquelas descritas por Brugnerotto et al[4] e estão presentes em todas as amostras comerciais investigadas, mostrando que todas apresentam basicamente os mesmos grupos funcionais.
Grau médio de acetilação ou desacetilação
O grau médio de desacetilação ( ) é definido como o número de grupos amino em relação aos grupos amida da cadeia polimérica, podendo ser determinado por meio de várias técnicas[3-8]. No presente caso, descreveu-se os resultados obtidos por condutimetria e RMN 1H, que fornece o grau médio de acetilação.
) é definido como o número de grupos amino em relação aos grupos amida da cadeia polimérica, podendo ser determinado por meio de várias técnicas[3-8]. No presente caso, descreveu-se os resultados obtidos por condutimetria e RMN 1H, que fornece o grau médio de acetilação.
As curvas condutimétricas das amostras de quitosana usadas neste trabalho com solução de NaOH e excesso de ácido clorídrico são mostradas na Figura 3. O primeiro ramo linear representa a neutralização do ácido presente, o segundo corresponde à neutralização de prótons dos grupos amino da quitosana e o terceiro conjunto de pontos refere-se ao excesso de base, após o ponto de equivalência. Estas três retas originam por extrapolação dois pontos de inflexão, que correspondem ao volume de base necessário para neutralizar os grupos amino protonados. O número de equivalentes de grupos ácidos foi calculado usando a Equação 1.
Nestas equações,  é o grau médio de desacetilação,
é o grau médio de desacetilação,  é o grau médio de acetilação, V1 é o volume de base usado para a neutralização de HCl em excesso (mL); V2 V1 é o volume de base usado para a neutralização dos grupos ácidos de quitosana (mL); [base] é a concentração da base usada e m é a massa da amostra de quitosana.
é o grau médio de acetilação, V1 é o volume de base usado para a neutralização de HCl em excesso (mL); V2 V1 é o volume de base usado para a neutralização dos grupos ácidos de quitosana (mL); [base] é a concentração da base usada e m é a massa da amostra de quitosana.
Na Tabela 1, estão apresentados os valores de grau médio de desacetilação  das amostras QF, QA e QP, determinados por titulação condutimétrica usando a Equação 1, e o grau médio de acetilação
das amostras QF, QA e QP, determinados por titulação condutimétrica usando a Equação 1, e o grau médio de acetilação  por RMN 1H calculado com auxílio da Equação 3.
por RMN 1H calculado com auxílio da Equação 3.
Como foi feito para o infravermelho, apresenta-se na Figura 4 o espectro de RMN 1H da amostra QA, como exemplo representativo, dado a sua semelhança com os demais. A espectroscopia de RMN 1H é quantitativa nas análises de amostras de quitosana em relação aos valores de  . Como a dissolução da quitosana em meio ácido resulta em uma solução viscosa, faz-se necessário que a medida seja realizada a 70 °C. No entanto, é necessário que a varredura do espectro e a aquisição de dados sejam realizadas rapidamente ao se efetuar a análise nesta temperatura, de modo a minimizar problemas causados pela hidrólise ácida[13]. A determinação de grau médio de acetilação
. Como a dissolução da quitosana em meio ácido resulta em uma solução viscosa, faz-se necessário que a medida seja realizada a 70 °C. No entanto, é necessário que a varredura do espectro e a aquisição de dados sejam realizadas rapidamente ao se efetuar a análise nesta temperatura, de modo a minimizar problemas causados pela hidrólise ácida[13]. A determinação de grau médio de acetilação  por RMN 1H das amostras investigadas foi feita utilizando a área do pico na região de 2 ppm atribuído aos núcleos de hidrogênio da metila do grupo acetamido (ACH3) e a área do pico em 3,2 ppm atribuído ao núcleo de hidrogênio na posição 2 do anel de glicosamino (AH2), segundo procedimento descrito por Signini e Campana-Filho[12].
por RMN 1H das amostras investigadas foi feita utilizando a área do pico na região de 2 ppm atribuído aos núcleos de hidrogênio da metila do grupo acetamido (ACH3) e a área do pico em 3,2 ppm atribuído ao núcleo de hidrogênio na posição 2 do anel de glicosamino (AH2), segundo procedimento descrito por Signini e Campana-Filho[12].
A escolha da relação de áreas representada pela Equação 3, se deve ao fato de que as áreas relativas a núcleos dos grupos metila presentes no grupo acetamido e ao núcleo na posição 2 do anel de glicosamino, estão relativamente livres das influências do pico de HOD (d = 3,8 ppm).
A determinação do grau médio de desacetilação  por titulação condutimétrica é um método simples, de baixo custo e não destrutivo, que apresentou concordância com os valores de
por titulação condutimétrica é um método simples, de baixo custo e não destrutivo, que apresentou concordância com os valores de  obtidos por RMN 1H. Os fabricantes não fornecem informações a respeito dos valores de
obtidos por RMN 1H. Os fabricantes não fornecem informações a respeito dos valores de  , logo, é importante comparar métodos que permitam determinar este parâmetro para prever propriedades físico-químicas da quitosana, oferecendo opções quanto a custo e grau de dificuldade experimental de diferentes técnicas.
, logo, é importante comparar métodos que permitam determinar este parâmetro para prever propriedades físico-químicas da quitosana, oferecendo opções quanto a custo e grau de dificuldade experimental de diferentes técnicas.
Análise elementar
Os dados de análise elementar apresentados na Tabela 2 são próximos da fórmula C6H11O4N para a unidade de repetição, quando se desconta o teor de água presente na amostra. O teor de água pode ser obtido por termogravimetria, como descrito abaixo.
A hidratação se deve ao fato de que a quitosana tem forte afinidade pela água e, no estado sólido, as macromoléculas podem apresentar estruturas distorcidas, que são facilmente hidratadas[14]. Em adição, deve-se considerar que a análise elementar é um método conveniente para análise de quitosana somente na ausência de proteína residual[4].
Viscosidade
Na Tabela 3 são apresentados os valores de grau médio de acetilação,  , de viscosidade intrínseca, ([h]), e os valores encontrados da massa molar média viscosimétrica (MV) para as amostras de quitosana (QA e QF). Não foi possível realizar os estudos viscosimétricos com a amostra QP, em virtude da baixa solubilidade da mesma.
, de viscosidade intrínseca, ([h]), e os valores encontrados da massa molar média viscosimétrica (MV) para as amostras de quitosana (QA e QF). Não foi possível realizar os estudos viscosimétricos com a amostra QP, em virtude da baixa solubilidade da mesma.
A viscosimetria, embora seja um método não absoluto, é um dos processos mais utilizados para a determinação da massa molar de polímeros. As medidas são feitas com base no tempo de escoamento do solvente e das soluções diluídas do polímero, utilizando-se um viscosímetro. A viscosidade de uma solução de polieletrólito pode ser descrita como função de sua viscosidade intrínseca e de sua concentração se não ocorrerem interações entre as macromoléculas (sistema diluído). Neste caso, a equação de Huggins[15] pode ser usada:
em que: h sp é a viscosidade específica; h sp/ C é a viscosidade reduzida (mLg-1 ); [h] é a viscosidade intrínseca (mLg1); KH é a constante de Huggins e C é a concentração da solução (gmL-1 )
A Figura 5 mostra as curvas de viscosidade reduzida (hred) versus concentração da solução de quitosana das amostras QA e QF. A viscosidade intrínseca, [h], foi determinada pela extrapolação dos dados de viscosidade à diluição infinita, de acordo com a equação 4. As retas obtidas apresentam excelentes coeficientes de correlação entre os pontos experimentais (r > 0,9) e os valores de constantes de Huggins, determinados no tampão ácido acético/acetato, são relativamente pequenos (Tabela 3), indicando que soluções de boa qualidade foram obtidas pela dissolução das amostras purificadas de quitosana. A viscosidade assim determinada satisfaz a relação de Mark-Houwink (Equação 5)
em que, [h] é a viscosidade intrínseca da solução, K é uma constante característica do polímero e depende da temperatura e do solvente, a é a constante característica da geometria da molécula do polímero e Mv é a massa molecular viscosimétrica.
O valor de viscosidade intrínseca determinado a partir da Eq.5 proposta por Rinaudo et al[16] permite determinar a massa viscosimétrica, Mv das amostras QA e QF (Tabela 3).
Termogravimetria (TG)
Inicialmente, foi feita uma otimização da razão de aquecimento a ser usada nos estudos de decomposição térmica, usando a amostra QF, como modelo. A amostra foi submetida às razões de aquecimento de 5, 10, 20 e 30 °C min-1. Tal avaliação foi necessária, pois a razão de aquecimento apresenta influência significativa no aspecto qualitativo da curva TG[17], pois razões de aquecimento maiores levam uma menor definição e poderiam induzir a uma sobreposição de eventos térmicos sucessivos. Já razões menores tornam o experimento demorado.
Apesar da semelhança nos perfis nas curvas TG, concluiu-se que a razão de 10 °C min-1 seria mais adequada para estudos envolvendo as quitosanas, devido ao perfil mais bem definido das curvas em relação aos 20 °C min-1 e ao menor tempo de análise em relação aos 5 °C min-1.
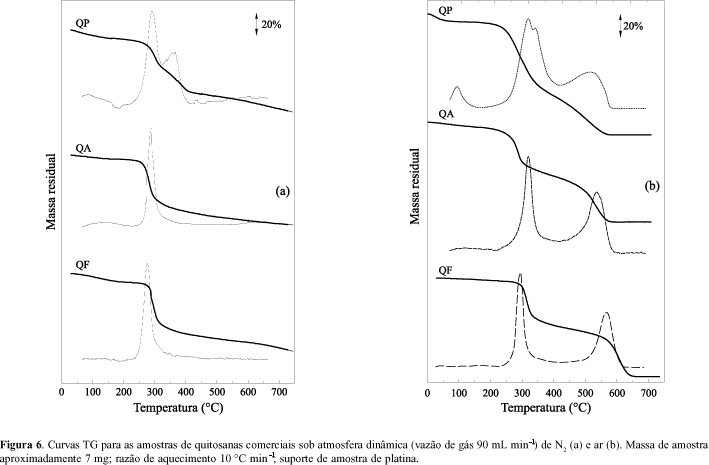
Também foi desenvolvido um estudo da influência do gás de purga na decomposição térmica, para todas as amostras de quitosanas comerciais, usando atmosferas dinâmicas de ar e nitrogênio. Os resultados são apresentados na Figura 6a e 6b.
Tais experimentos revelaram que sob atmosfera dinâmica N2 (Fig. 6a), as amostras de QF, QA e QP apresentaram um processo de desidratação, seguido da decomposição do biopolímero, com geração de material carbonizado. A decomposição deste material não se completa mesmo acima de 700 °C. Sob ar, além dos eventos acima, observa-se a queima do material carbonizado formado na segunda etapa, sem resíduos no suporte de amostra já em torno de 600 °C (Fig. 6b).
As perdas de massa, percentagem de resíduos e intervalo de temperatura, observados em cada etapa das curvas de TG das amostras de quitosanas comerciais, são resumidos na Tabela 4.
Observa-se também que sob as mesmas condições experimentais, a amostra QF, com massa molar média, é a que apresenta maior estabilidade térmica após desidratação. Já as amostras QP e QA apresentaram estabilidade térmica semelhantes, apesar das diferenças de massa molar das cadeias poliméricas especificada pelos fabricantes. Assim seria possível considerar uma relação inversamente proporcional entre estabilidade térmica e grau de desacetilação, pois a amostra QF apresenta  da ordem de 75%, enquanto as amostras QA e QP apresentam um
da ordem de 75%, enquanto as amostras QA e QP apresentam um  da ordem de 90%.
da ordem de 90%.
Calorimetria Exploratória Diferencial (DSC)
A Figura 7a, mostra as curvas DSC de amostras de quitosanas comerciais sob atmosfera de N2 na faixa de temperatura entre 20 e 500 °C. Observaram-se dois picos que são descritos na Tabela 4. O primeiro, endotérmico, correspondente ao processo de desidratação, cuja área depende do histórico de secagem da amostra e o segundo, exotérmico, corresponde ao processo de decomposição, que continua além do limite de temperatura do experimento. Os dois processos estão coerentes com os eventos observados nas curvas TG e concordam com o que foi observado por Sreenivasan[18] que descreveu dois eventos térmicos para amostras de quitosana, sob N2 em curvas DSC.
A Figura 7b mostra curvas DSC de quitosanas comercias (QF, QA e QP) sob atmosfera dinâmica de ar na faixa de temperatura entre 24 e 500 °C. Observaram-se três eventos térmicos, sendo o primeiro endotérmico correspondente ao processo de desidratação. O segundo pico, exotérmico, corresponde ao processo de decomposição. O terceiro evento corresponde ao início da queima do material carbonizado. Os três processos estão coerentes com os eventos observados no TG e são representados na Tabela 4.
Observa-se que o segundo processo de decomposição da amostra QP apresenta-se dividido em dois e com perfil térmico diferente das demais, em atmosfera de ar. Isso pode evidenciar a presença de materiais, tais como proteínas residuais, que não podem ser eliminados pelo processo de purificação utilizado.
A Figura 8 mostra curvas DSC de amostras de quitosana em temperatura sub-ambiente na faixa de -50 e 150 °C. A presença de temperatura de transição vítrea (Tg) pode ser observada em aproximadamente 30 °C para as amostras QA e QF e em torno de 10 °C para a amostra QP, ainda que com pouca definição. Segundo Hatakeyama e Quinn[19] este fenômeno se torna difícil de visualizar por DSC, uma vez que o evento depende do teor de água presente na amostra.
Conclusões
A titulação condutimétrica e a ressonância magnética nuclear (RMN 1H) constituem métodos eficientes e reprodutíveis para determinar o grau médio de desacetilação ( ), embora a titulação condutimétrica tenha ligeira vantagem, por ser uma técnica não destrutiva e de baixo custo. Porém, a análise por RMN 1H requer preparação menos exigente amostra, devido à especificidade do pico do grupo acetamida.
Observou-se também que o  varia dependendo do fabricante e não concordam exatamente com o valor rotulado, quando este é fornecido.
varia dependendo do fabricante e não concordam exatamente com o valor rotulado, quando este é fornecido.
A análise elementar, apesar de ser um método preciso, deve ser usado com muita cautela em virtude dos diferentes teores de hidratação, que variam de acordo com as condições de armazenamento e tratamento prévio da amostra.
As técnicas termoanalíticas fornecem informações sobre o mecanismo de decomposição e estabilidade térmica, sendo a DSC mais apropriada para investigação da transição vítrea. Entretanto ela é fortemente dependente do teor de H2O enquanto a TG fornece informações a temperaturas mais elevadas, tendo sido observadas diferenças de estabilidade térmica nas amostras comerciais com diferentes massas moleculares e  .
.
As técnicas utilizadas mostraram diferenças em relação às características das quitosanas comerciais avaliadas. Entretanto, é preciso determinar o  para caracterizar o material, não bastando confiar na especificação rotulada.
para caracterizar o material, não bastando confiar na especificação rotulada.
Agradecimentos
Os autores agradecem ao CNPq e a CAPES pelo apoio financeiro outorgado durante a realização deste trabalho.
- 1. Matteus, F.A.G (ed.). "Application of Chitin and Chitosan", Technomic Publishing AG, Switzerland (1997).
- 2. Mathur, N.K. & Narang, C. K. J. Chem. Educ., 67(11), p.938 (1990).
- 3. Raymond, L.; Morin, F.G. & Marchessault, R.H. Carbohydr. Res., 246, p.331 (1993).
- 4. Brugnerotto, J.; Lizardi, J.; Goycoolea, W.; Argüelles-Monal; Desbrières, J. & Rinaudo, M. - Polym., 42(8), p.3569 (2001).
- 5. Hirai, A.; Odani, H. & Nakajima, A. Polym. Bull., 26(1), p.87 (1991).
- 6. Niola, F.; Basora, N.; Chornet, E & Vidal, P.F. Carbohydr. Res., 238, p.1 (1993).
- 7. Roberts, G. A. F. "Chitin chemistry", The Mucmillan Press Ltd, London (1992).
- 8. Alonso, I.G.; Peniche-Covas, C & Nieto, J.M. J. Thermal Anal., 28, p.189 (1983).
- 9. Rinaudo, M.; Pavlov, G. & Desbriéres, J. - Polym., 40, p.7029 (1999).
- 10. Peter, M.G. J. Macromol. Sci-Pure & Appl. Chem., 32A, p.629 (1995).
- 11. Signini, R & Campana Filho, S.P. - Polímeros: Ciênc.Tecnol., 11(2), p.58 (2001).
- 12. Signini, R & Campana Filho, S.P. Polímeros: Ciênc. Tecnol., 4(4), p.63 (1998).
- 13. Varum, K.M.; Ottoy, M.H. & Smidsrod, O. Carbohyd. Polym., 46, p.89 (2001).
- 14. Rinaudo, M.; Desbrières, J.; Dung, P. Lê.; Binh Thuy, P.; & Dong, N.T. Carbohyd. Polym, 46, p.339 (2001).
- 15. Huggins, M.L. J. Am. Chem. Soc. 64, p.2716 (1942).
- 16. Rinaudo, M.; Milas, M. & Dung, P.L. Int. J. Biol. Macromol., 15, p.281 (1993).
- 17. Cavalheiro, E. T. G.; Ionashiro, M.; Breviglieri, S. T.; Marino, G. & Chierice, G. O. - Quím. Nova., 18, p.305 (1995).
- 18. Sreenivasan, K. Polym. Degrad. Stabil., 52, p.85 (1996).
- 19. Hatakeyama, T & Quinn, F.X. "Thermal analysis: fundamentals and applications to polymer science", John Wiley & Sons Ltd. Chichester (1999).
Datas de Publicação
-
Publicação nesta coleção
12 Maio 2004 -
Data do Fascículo
Dez 2003