Resumos
Este trabalho descreve a preparação e caracterização do híbrido celulose/fosfato de nióbio hidratado (Cel/NbOPO4.nH2O) utilizando como material de partida a celulose branqueada de bagaço de cana-de-açúcar e o nióbio metálico. O híbrido foi preparado por dois métodos: denominados métodos I e II. O método I consistiu na dissolução do nióbio metálico em solução de ácido fluorídrico/nítrico (100:10), com tempo de contato de 16 horas entre a celulose branqueada do bagaço de cana-de-açúcar e a solução ácida. Adicionou-se a essa solução ácido fosfórico para precipitação do material. O método II foi semelhante, com proporções diferentes da solução ácida fluorídrico/nítrico (160/100), sem tempo de contato da celulose com a solução ácida. Os métodos I e II utilizaram as seguintes proporções de cel/ Nb2O5.nH2O: (10:10);(10:6) e (10:2). Os materiais preparados pelos métodos I e II foram caracterizados por difração de raios X (DRX), termogravimetria (TG/DTG) e microscopia eletrônica de varredura (MEV). Observou-se aumento do índice do grau de cristalinidade e mudanças na morfologia dos materiais preparados.
Bagaço de cana-de-açúcar; híbrido orgânico-inorgânico; fosfato de nióbio hidratado
This work describes the preparation and characterization of cellulose/hydrous niobium phosphate hybrid with bleached cellulose from sugarcane bagasse. The hybrid was prepared in two different forms: named methods I and II. Method I consisted in dissolving metallic niobium in a fluoridric/nitric (100:10) mixture, with aging time of 16 hours in which the sugarcane bagasse was in contact with the acid solution. Phosphoric acid was then added to the solution for precipitation of the material. Method II was similar, but metallic niobium was diluted in a fluoridric /nitric (160/100) solution without aging time. In both methods different proportions of Cel/NbOPO4.nH2O were used: (10:10); (10:6) and (10:2). These materials were characterized by X-ray diffraction (XRD), thermogravimetry (TG/DTG) analysis and scanning electronic microscopy (SEM). The deposition of niobium phosphate and an increase in crystallinity were observed.
Sugarcane bagasse; organic-inorganic hybrid; hydrous phosphate niobium
Preparação e caracterização de materiais híbridos celulose/NbOPO4.nH2O a partir de celulose branqueada de bagaço de cana-de-açúcar
Preparation and characterization of a cellulose/NbOPO4.nH2O hybrid from bleached sugarcane bagasse
Paulo H. F. PereiraI; Herman C. J. VoorwaldI; Maria O. H. CioffiI; Maria L. C. P. da S. PereiraII
IDepartamento de Materiais e Tecnologia, UNESP
IIDepartamento de Engenharia Química, USP
Autor para correspondênciaAutor para correspondência: Paulo H. F. Pereira Departamento de Materiais e Tecnologia, Faculdade de Engenharia de Guaratinguetá, UNESP Av. Ariberto Pereira da Cunha, 333, Pedregulho CEP 12516-410, Guaratinguetá, SP, Brasil e-mail: fernandes_eng@yahoo.com.br
RESUMO
Este trabalho descreve a preparação e caracterização do híbrido celulose/fosfato de nióbio hidratado (Cel/NbOPO4.nH2O) utilizando como material de partida a celulose branqueada de bagaço de cana-de-açúcar e o nióbio metálico. O híbrido foi preparado por dois métodos: denominados métodos I e II. O método I consistiu na dissolução do nióbio metálico em solução de ácido fluorídrico/nítrico (100:10), com tempo de contato de 16 horas entre a celulose branqueada do bagaço de cana-de-açúcar e a solução ácida. Adicionou-se a essa solução ácido fosfórico para precipitação do material. O método II foi semelhante, com proporções diferentes da solução ácida fluorídrico/nítrico (160/100), sem tempo de contato da celulose com a solução ácida. Os métodos I e II utilizaram as seguintes proporções de cel/ Nb2O5.nH2O: (10:10);(10:6) e (10:2). Os materiais preparados pelos métodos I e II foram caracterizados por difração de raios X (DRX), termogravimetria (TG/DTG) e microscopia eletrônica de varredura (MEV). Observou-se aumento do índice do grau de cristalinidade e mudanças na morfologia dos materiais preparados.
Palavras-chave:Bagaço de cana-de-açúcar, híbrido orgânico-inorgânico, fosfato de nióbio hidratado.
ABSTRACT
This work describes the preparation and characterization of cellulose/hydrous niobium phosphate hybrid with bleached cellulose from sugarcane bagasse. The hybrid was prepared in two different forms: named methods I and II. Method I consisted in dissolving metallic niobium in a fluoridric/nitric (100:10) mixture, with aging time of 16 hours in which the sugarcane bagasse was in contact with the acid solution. Phosphoric acid was then added to the solution for precipitation of the material. Method II was similar, but metallic niobium was diluted in a fluoridric /nitric (160/100) solution without aging time. In both methods different proportions of Cel/NbOPO4.nH2O were used: (10:10); (10:6) and (10:2). These materials were characterized by X-ray diffraction (XRD), thermogravimetry (TG/DTG) analysis and scanning electronic microscopy (SEM). The deposition of niobium phosphate and an increase in crystallinity were observed.
Keywords:Sugarcane bagasse, organic-inorganic hybrid, hydrous phosphate niobium.
Introdução
Nos últimos tempos, tem sido dada uma atenção especial para minimização e reaproveitamento de resíduos agrícolas e a busca de novos materiais que atendam as tendências mundiais quanto a viabilidade econômica envolvida no processo, como a disponibilidade, usos, custos e preocupação com meio ambiente. Outro fator de grande relevância prática é a diversidade de fibras naturais existentes[1]. Existem na literatura diversos trabalhos utilizando resíduos lignocelulósicos como matéria-prima tais como: sisal[2-4]; banana[5-7]; curauá[8,9]; bambu[10] e o bagaço de cana-de-açúcar[11-15]. O bagaço de cana-de-açúcar, em particular, tem sido objeto de inúmeros trabalhos[16-22].
A cana-de-açúcar (Saccharum officinarum, L.)[23] é uma gramínea de grande porte e produz colmos suculentos devido ao armazenamento de sacarose. É utilizada pelo homem a milhares de anos, é originária da Ásia, numa região entre a Índia e a China. Historicamente a cana-de-açúcar é um dos principais produtos agrícolas do Brasil, trazidas pelos portugueses, sendo cultivada desde a época da colonização. Do seu processo de industrialização obtém-se como produtos o açúcar nas suas mais variadas formas e tipos, o álcool (anidro e hidratado), o vinhoto e o bagaço[24]. A cana-de-açúcar é composta, em média, de 65 a 75% de água, mas seu principal componente é a sacarose, correspondendo de 70 a 91% de seus sólidos solúveis. A planta também contém glicose (de 2 a 4%), frutose (de 2 a 4%), sais (3 a 5%), proteínas (0,5 a 0,6%), amido (0,001 a 0,05%), ceras e graxas (0,05 a 0,15%) e outros[25]. Do ponto de vista morfológico, o bagaço possui: 50% de fibras, 30% de parênquimas, 15% de vasos e 5% de epidermes. A composição química do bagaço de cana-de-açúcar varia de acordo com diversos fatores tais como: o tipo de cana e de solo[26]. Do ponto de vista químico, o bagaço de cana-de-açúcar é composto de componentes macromoleculares: celulose (40-48%), hemicelulose (25%), lignina (20%), extrativos e outros[27-32].
Marques et al.[33] estudaram nanocompósitos de fibras celulósicas recobertas com dióxido de titânio preparados por um método de hidrólise controlada e observaram que este material pode ser usado como reforço em matriz polimérica.
Mulinari et al.[34] estudaram a preparação e caracterização do óxido de zircônio na superfície da celulose oriunda do bagaço de cana-de-açúcar e observaram que a deposição do óxido na superfície da celulose foi distribuída de forma uniforme[49].
Toledo et al.[35] estudaram a deposição de óxido de antinômio na superfície da fibra de celulose utilizando cloreto de antinômio (SbCl3) como agente precursor e observaram que o método para preparar o compósito Cel/Sb2O3 é reprodutivo e que a deposição é uniforme.
Mulinari et al.[36] estudaram a adsorção de íons fosfato e dicromato nos compósitos celulose/óxido de zircônio hidratado obtidos pelos métodos da precipitação convencional e pela precipitação em solução homogênea sendo a celulose proveniente do bagaço de cana-de-açúcar. Os resultados foram satisfatórios mostrando que os compósitos obtidos por ambos os métodos apresentaram boa capacidade de adsorção para os íons estudados.
Vários trabalhos tem sido realizados na formulação de compósitos de celulose/óxidos metálicos (Cel/MxOy).[37-39] Porém não se encontra na literatura nenhum trabalho com fosfato de nióbio hidratado sobre superfície da celulose branqueada oriunda do bagaço de cana-de-açúcar. O mesmo pode ser dito quanto à metodologia para geração do híbrido Cel/fosfato de nióbio hidratado, bem como a utilização do nióbio metálico como matéria-prima. A busca de novos materiais faz parte do progresso tecnológico, uma vez que poucos materiais apresentam todas as propriedades desejadas para determinada aplicação, essa é uma vantagem na preparação dos materiais híbridos orgânicos -inorgânicos.
Dessa forma, a proposta deste trabalho é utilizar nióbio metálico e celulose branqueada obtida do bagaço de cana-de-açúcar para preparação de híbridos orgânico/inorgânico, utilizando materiais de recursos renováveis, baixo custo e de fácil manuseio, contribuindo assim com a preservação do meio ambiente. No presente trabalho estudou-se diferentes razões estequiométricas para a síntese no método do híbrido cel/NbOPO4.nH20 a fim de verificar a influência da concentração da solução ácida no método de preparação. Para isso utilizou-se duas rotas diferentes, a primeira utilizando uma relação molar (100HF/10HNO3), com tempo de contato com a celulose branqueada e a segunda utilizando relação molar (160HF/100HNO3) sem tempo de contato da celulose branqueada com a solução ácida, antes da adição do ácido fosfórico. Alguns parâmetros como tempo de intumescimento, tempo de contato com a solução ácida, tempo da dissolução ácida, já vem sendo estudado pelo grupo de Novos Materiais (EEL/USP) em outros trabalhos[40]. O objetivo foi o desenvolvimento de uma metodologia reprodutiva para a preparação de materiais híbridos Cel/NbOPO4. nH2O, cujo híbrido apresente a melhor deposição e uniformidade do material inorgânico na superfície da celulose. Para isto será utilizando a celulose oriunda do bagaço de cana-de-açúcar e o nióbio metálico com posterior aplicação da melhor proporção no estudo de adsorção, preparação de membranas inorgânicas e reforço em matrizes poliméricas.
Experimental
Materiais e métodos
Preparação da celulose branqueada
A celulose branqueada foi obtida tratando-se o bagaço de cana-de-açúcar com solução de H2SO4 10%, com a finalidade de separar as pentosanas. A celulignina obtida foi deslignificada com solução NaOH 1%, obtendo-se a polpa bruta e, em seguida, branqueada com hipoclorito de sódio. Uma vez obtida a celulose branqueada, esta foi seca em uma estufa à 50ºC por 12 horas[36].
Preparação do NbOPO4.nH2O
NbOPO4.nH2O foi preparado pela dissolução do nióbio metálico, usando-se um béquer de polietileno com uma mistura de ácido fluorídrico (40%) e ácido nítrico concentrado. Após dissolução adicionou-se ácido fosfórico concentrado e a solução foi colocada em banho-maria na temperatura de aproximadamente 60ºC. O precipitado formado foi lavado com ácido nítrico, água deionizada e etanol[41].
Preparação do Híbrido Cel/ NbOPO4.nH2O com tempo de contato com solução ácida e relação molar (100 HF/10 HNO3): Método I
Cel/NbOPO4.nH2O foi obtido pela dissolução de nióbio metálico, usando um béquer de polietileno, com ácido nítrico e fluorídrico, ambos concentrados, com relação molar (100HF/10HNO3)[42] até a dissolução total do metal. A celulose do bagaço de cana-de-açúcar permaneceu imersa em água destilada por 1 hora. Colocou-se a celulose branqueada do bagaço de cana de açúcar em contato com a solução ácida por 6 horas. Montou-se um sistema em banho maria a 60ºC e em seguida adicionou-se lentamente ácido fosfórico (85%), com auxílio de uma bureta. A solução permaneceu em banho-maria com agitação até a formação de um precipitado gelatinoso branco (48 horas). A solução foi filtrada e o precipitado lavado com ácido nítrico (5M), água deionizada e álcool etílico. O material foi seco a 50ºC até peso constante. Preparou-se materiais nas proporções 5 g Cel /5 g NbOPO4.nH2O, denominado síntese 1; 5 g Cel/2,5 g NbOPO4.nH2O denominado síntese 2; 5 g Cel /1 g NbOPO4.nH2O denominado síntese 3, respectivamente.
Preparação do Híbrido Cel/ NbOPO4.nH2O sem tempo de contato com a solução ácida e relação molar (160 HF/100 HNO3): Método II
Cel/ NbOPO4.nH2O foi obtido de modo similar ao método I, alterando-se somente a relação molar (160HF/100HNO3)[43] e eliminando-se o tempo de contato da celulose com a solução ácida. Preparou-se materiais nas proporções 5 g Cel /5 g NbOPO4.nH2O, (síntese 1); 5 g Cel /2,5 g NbOPO4.nH2O (síntese 2) e 5 g Cel /1 g NbOPO4.nH2O (síntese 3), respectivamente.
Caracterização dos materiais preparados
Os materiais preparados pelos métodos I e II foram caracterizados por difração de raios X (DRX), termogravimetria (TG) e microscopia eletrônica de varredura (MEV).
As análises de difração de raios X foram realizadas num difratômetro marca Shimadzu modelo XDR-6000, com fonte de radiação CuKα, voltagem de 40 kV, corrente de 40 mA, varredura 0,05(2θ/5 s) com fonte de radiação CuKα variando-se 2θ entre 10 e 70º. A termogravimetria foi efetuada em uma termobalança modelo TGA-50, da Shimadzu em cadinho de platina aberto, com razão de aquecimento de 20ºC/min e fluxo de N2 (g) de 50 mL/min, numa faixa de temperatura entre a temperatura ambiente e 900ºC. As fotomicrografias foram obtidas em um microscópio eletrônico de varredura (MEV) modelo JEOL JSM5310 usando elétrons secundários, sendo a amostra coberta com uma fina camada de ouro.
Resultados e Discussão
Na preparação dos materiais pelos métodos I e II, a celulose permaneceu imersa em água deionizada para intumescimento a fim de aumentar a reatividade da celulose com o material a ser depositado na superfície da fibra.
A determinação do grau de cristalinidade é importante para o entendimento do comportamento dos materiais celulósicos, visto que estes materiais possuem regiões cristalinas e amorfas. Essa determinação permite observar as mudanças que ocorrem na estrutura do material celulósico, tanto na região cristalina como na região amorfa. O índice de cristalinidade das fibras foram calculados de acordo com o método empírico de Segal et al.[44]
sendo:
Ic = índice de cristalinidade, em porcentagem;
I(002) = pico de intensidade da difração que representa o material cristalino perto de 2θ = 22º;
I(am) = pico de intensidade da difração que representa o material amorfo perto de 2θ = 18º.
Nos gráficos de difração de raios X da celulose vegetal para a intensidade do vale mínimo, isto é, a fração amorfa é de 18º < 2θ < 19º para celulose tipo I e 13º < 2θ < 15º para celulose tipo II. Para a intensidade do pico máximo o qual corresponde a fração cristalina, esta fração está entre 22º < 2θ < 23º para celulose I e 18º < 2θ < 22º para celulose II[43]. A análise de difração de raios X da celulose branqueada e dos híbridos preparados pelos métodos I e II estão nas Figuras 1 e 2, respectivamente. Os materiais preparados apresentam um difratograma típico de celulose I, com picos na região amorfa (18º < 2θ < 19º) e picos na região cristalina (22º < 2θ < 23º), correspondendo aos planos cristalográficos (101), (002) e (040) tanto na celulose branqueada quanto nos híbridos, concordantes com os dados da literatura[45]. Conforme descrito por Pereira, et al.[41] o fosfato de nióbio hidratado apresenta reflexões bem definida e estrutura cristalina.
Com os dados obtidos pelos difratogramas (Figuras 1 e 2) calculou-se o grau cristalinidade através da Equação 1 e os resultados encontram-se na Tabela 1.
Pode-se observar pela Tabela 1, um aumento no índice de cristalinidade dos materiais preparados pelo método I e II. Observa-se que este aumento não é proporcional à quantidade de fosfato incorporado. Nota-se um aumento significativo do índice de cristalinidade dos híbridos em relação à celulose branqueada indicando a efetividade no método de preparação para a geração do híbrido. Este aumento de cristalinidade após tratamento com ácidos tem sido relatado por outros autores[46-48]. Outro fator relevante com esse aumento esta relacionado com a natureza cristalina do fosfato de nióbio hidratado.
Comparando os dados de raios X e termogravimetria (Figuras 1 e 3) é possível verificar o aumento da cristalinidade nos dados de raios x e o decréscimo da estabilidade térmica pela análise térmica no segundo intervalo de perda de massa, na faixa de temperatura de 130-800ºC, dos materiais híbridos preparados nas diferentes proporções estudadas (5cel:5NbOPO4.nH20; 5cel:2,5NbOPO4.nH20; 5cel:1NbOPO4.nH20) isso se deve a presença no fosfato de nióbio na superfície do material.
A Figura 3 amostra (a) apresenta curva TG do fosfato de nióbio hidratado com duas perdas de massa ocorrendo na faixa de temperatura entre 40 e 800ºC, com uma perda de massa de 14% concordantes com os dados da literatura[41].
Segundo Mulinari et al.[15], na curva TG da celulose foram observado três estágios de principais. O primeiro estágio foi atribuído à eliminação de voláteis, como água. Na Figura 3, amostra (b), este estágio ocorreu na faixa de 40-200ºC com perda de 5%. O segundo e o terceiro estágio é atribuída à decomposição das cadeias poliméricas da celulose, segundo estágio ocorreu entre 200-500ºC com 84% de perda de massa e o terceiro entre 500-800ºC com perda massa de 9% de gerando um resíduo de 2%. A Figura 3, amostra (c) apresenta uma perda de massa ocorrendo em duas etapas, sendo a primeira ocorre na faixa de 40 a 160ºC com uma perda de massa de 4% que corresponde a desidratação do material e a segunda entre a temperatura de 160-800ºC com uma perda de massa de 85% correspondente a decomposição da celulose com resíduo de 11%. O mesmo comportamento é observado para as curvas TG, Figuras 3 amostra (d) e amostra (e), com duas perdas de massa na faixa de temperatura de 40 a 800ºC, com resíduo de 39 e 34%, respectivamente. A Tabela 2 apresenta os resultados das curvas TG/DTG para os materiais híbridos e para a celulose branqueada com as perdas de massa (mp) observados nos intervalos definidos (ΔT), com a temperatura de velocidade máxima de perda de massa (dm), bem como o resíduo gerado correspondente à quantidade de material inorgânico presente. A quantidade de material inorgânico depositado na superfície da celulose pode ser determinada pela quantidade de resíduo gerado[15]. A porcentagem de resíduo dos materiais preparados pelo método I, sínteses 1, 2, 3 foi 11; 39; 34, respectivamente (Tabela 2).
A Figura 4 apresenta as curvas TG para os materiais preparados pelo método II sínteses 1, 2 e 3. A perda de massa para os materiais preparados pelo método II apresentam o mesmo comportamento dos materiais preparados pela método I. Conforme Tabela 2 pode-se observar um resíduo de 10, 27, 34% para as sínteses 1, 2, 3 respectivamente, devido a presença do material inorgânico na amostra pirolisada. Observa-se nos mesmos materiais uma redução da temperatura de maior velocidade de perda de massa (dm), quando comparado com a celulose do bagaço de cana. Isso se deve a presença do fosfato de nióbio hidratado na superfície da celulose, o mesmo comportamento é apresentado pelos materiais preparados pelo método I. É observado que os valores dos resíduos gerados não apresentam uma ordem decrescente conforme as proporções (5cel:5NbOPO4.nH20; 5cel:2,5NbOPO4.nH20; 5cel:1NbOPO4.nH20) estudadas, o que seria esperado. O materiais preparados pelos método I e II apresentam resíduos (11, 39 e 34) e (10, 27, 34), respectivamente, o que mostra que a deposição do fosfato de nióbio hidratado não aconteceu de forma homogênea na superfície da celulose.
As curvas TG (Figuras 3 e 4) mostram um decréscimo na estabilidade térmica proporcionada pela deposição do material inorgânico quando comparada com a celulose branqueada conforme mostrado na literatura[49].
A Figura 5 apresenta a micrografia da celulose branqueada mostrando uma estrutura fibrosa de forma alongada tipo bastonete[50].
As Figuras 6-8 apresentam as fotomicrografias dos híbridos preparados método I, síntese 1, 2 e 3, respectivamente, não observa-se mais a estrutura fibrosa da celulose pura (Figura 5). Observa-se o aspecto fibroso do material porém quebradiço, isto está relacionado com a exposição da celulose à solução ácida por 16 horas. Na ampliação de 1700× (Figura 7) pode-se observar a presença de "pits" sobre a superfície da fibra. Os "pits" estão presentes nas células de parênquimas e traqueídeos e apresentam uma função fundamental para o crescimento da planta que é transportar nutrientes ao longo de várias células da raiz até a folhas[51].
Nas micrografias da Figura 9 do híbrido preparado método II síntese I, observa-se um aspecto fibroso, com fibras alongadas em formas de bastonete conforme pode ser visto na ampliação de 500 e 1000×. Com ampliação de 10000× observa-se que a superfície mantém-se na forma fibrosa com aspecto rugoso, permanecendo o mesmo da celulose pura. As fotomicrografias da síntese II (Figura 10) apresentam aspecto fibroso, em forma de placas.
Nas micrografias da síntese III (Figura 11) pode-se observar um aspecto pouco fibroso na superfície do material com uma ampliação de 500 e 1000×. Na ampliação de 10000× pode-se observar uma superfície com maior rugosidade. Em todas as Figuras 9-11 observa-se a presença de pontos esbranquiçados na superfície da fibra, proveniente da presença do fosfato de nióbio hidratado. Deve ser salientado que, nesse método de preparação os híbridos (sínteses I, II e III) mantém a estrutura das fibras de celulose mais preservadas, devido a não exposição da celulose com a solução ácida por 16 horas. Observa-se uma deposição distinta nas diferentes proporções estudadas (5cel:5NbOPO4.nH20; 5cel:2,5NbOPO4.nH20; 5cel:1NbOPO4.nH20) com mudança na morfologia dos híbridos.
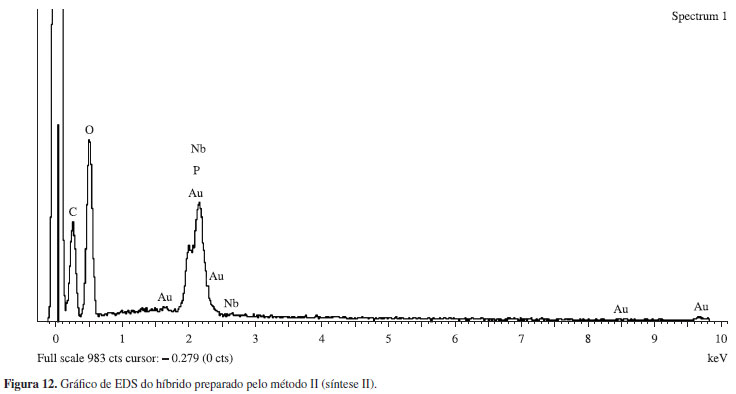
A composição química dos híbridos preparados pode ser verificada através da análise de EDS feita no microscópio eletrônico de varredura. O gráfico de EDS do híbrido (5cel:2,5NbOPO4.nH20) síntese II está apresentado na Figura 12. O pico de ouro presente no gráfico é proveniente do recobrimento realizado na superfície da amostra durante a etapa de preparação da mesma para análise em MEV. Para os materiais preparados pelos métodos I e II foram feitas análise de EDS e confirmado a presença dos elementos nióbio, fósforo e oxigênio.
Com base nesses resultados apresentados o melhor método a ser utilizado na preparação dos híbridos é o método II.
Conclusão
Os resultados obtidos indicam que a celulose de bagaço de cana-de-açúcar pode ser utilizado como substrato para obtenção de materiais híbridos.
Os materiais preparados pelo método I e II apresentam aumento no grau de cristalinidade com a incorporação do fosfato de nióbio hidratado e este aumento não é proporcional à quantidade de fosfato incorporado.
A incorporação do material inorgânico na superfície dos materiais preparados pelos métodos I e II diminui a estabilidade térmica quando comparado com a celulose branqueada.
A quantificação dos materiais se deu através dos resíduos gerados pela análise térmica e observou-se que a deposição não é uniforme nas proporções estudadas através das micrografias.
Os materiais preparados pelos dois métodos sofrem modificações em sua morfologia e evidencia a presença do inorgânico sobre a celulose. Os materiais que permaneceram em solução ácida tiveram sua estrutura mais quebradiça. Portanto o melhor método de preparação dos híbridos a ser utilizado é o método II na proporção de 160HF/100HNO3 sem tempo de contato com a solução ácida.
Agradecimentos
Os autores agradecem à FAPESP pelo auxílio financeiro, Processo nº: 2006/06740-2.
Enviado: 30/03/10
Reenviado: 14/04/11
Aceito: 09/06/11
- 1. D'Almeida, J. R. M. & Monteiro, S. N. - "Compósitos Reforçados por Fibras Naturais-oportunidades e Desafios", Rio de Janeiro, Brasil (2003).
- 2. Milanese, A. C. - "Caracterização de compositos de matrizes poliméricas reforçadas com fibra de sisal e de vidro," Tese de Mestrado, Faculdade de Engenharia de Guaratinguetá, Brasil (2008).
- 3. Corradini, E.; Agnelli, J. M. A.; Mattoso, L. C. & Castro, S. C. - Polímeros, 18, p.353 (2008).
- 4. Joseph, K.; Medeiros, E. S. & Carvalho, L. H. - Polímeros, 9, p.136 (1999).
- 5. Bilba, K.; Arseme, M. A. & Ouensanga, A. - Bioresour. Technol., 98, p.58 (2007).
- 6. Adinugraha, M. P.; Marseno, D. W. & Haryadi, P. - Carbohydr. Polym., 62, p.164 (2005).
- 7. Sapuan, S. M.; Leenie, A.; Harimi, M. & Berg, Y. K. - Mater. Des., 27, p.689 (2006). http://dx.doi.org/10.1016/j.matdes.2004.12.016c
- 8. Monteiro, S. N.; Aquino, R. C. M. P.; Lopes, P. D.; Carvalho, E. A. & D`Almeida, J. R. - Rev. Matéria, 11, p.197 (2006).
- 9. Mothé, C. & Araújo, C. R. - Polímeros, 14, p.274 (2004).
- 10. Mohan Rao, K. M. & Mohana Rao, K. - Compos. Struct., 77, p.288 (2007).
- 11. Albertini, S.; Do Carmo, L. F. & Prado Filho, L. G. - Ciênc. Tecnol. Aliment., 27, p.113 (2007).
- 12. Mattoso, L. H. C. - Polímeros, 9, p.16 (1999). http://dx.doi.org/10.1590/S0104-14281999000200008
- 13. Paiva, J. M. F.; Silva, S. P.; Tanaka, I. A.; Trindade, W. G.; Angelucci, C. A.; Frollini, E. - "Impact Strength of Phenolic Matrices Reinforced with Lignocellulosic Material", in: Nat. Polym. and Compos, p.460, Mattoso, L.H.C.; Leão , A. & Frollini, E. (2000).
- 14. Pandey, A.; Socccol, C. R.; Nigam, P. & Soccol, V. T. - Bioresour. Technol, 74, p.69 (2000).
- 15. Mulinari, D. R.; Voorwald , H. J. C.; Cioffi, M.O. H.; Da Silva , M. L. C. P.; Cruz, T.G. & Saron, C. - Carbohydr. Polym., 76, p.214 (2009).
- 16. Luz, S. M.; Gonçalves, A. R. & Del`Arco Junior, A. P. - Rev. Matéria, 11, p.101 (2006).
- 17. Karnitz Junior, O.; Gurgel, L. V. A.; Melo, J. C. P.; Botaro, V. R.; Melo, T. M. S.; Gil, R. P. F. & Gil, L. F. - Bioresour. Technol., 98, p.1291 (2007).
- 18. Ferreira, A. C.; Lebrão, G. W.; Nagashi, L., Su, M. T.; Hanna, R. K.; Lebrão, S. M. G. & Vicenti, T. - "Compósitos: Fibras de cana-de-açúcar e poliéster", in: Anais do 17ş Congresso Brasileiro de Engenharia e Ciência dos Materiais, Foz do Iguaçu , Brasil (2006).
- 19. Garcia-Hernardes, E.; Licea-Claveríe, A.; Zizumbo A.; Alvarez-Castilho A. & Herrera-Franco, P. - Polym. Compos., 25, p.134 (2004).
- 20. Pasquini, E. M.; Teixeira, A. A. S.; Curvelo, M. N.; Belgacem, A. & Dufresne, E. - Compos. Sci. Technol., 68, p.193 (2008). http://dx.doi.org/10.1016/j.compscitech.2007.05.009
- 21. Said Abd El-aziz, A.; Ludwick, A. G. & Aglan, H. A. - Bioresour. Technol., 100, p.2219 (2009).
- 22. Shaikh, H. M.; Pandare, K. V.; Nair, G. & Varma, A. J. - Carbohydr. Polym., 76, p.29 (2009).
- 23. Manzano, R. P.; Fukuskima, R. S.; Gomes, J. D. F. & Garippo, G. - Rev. Bras. Zootec., 29, p.1196 (2000).
- 24. Joaquim, A. P. - "Estudo das etapas de ativação no processo de benzilação da polpa de medula de bagaço de cana", Tese de Mestrado, Instituto de Química de São Carlos, Brasil (1997).
- 25. Geplacea. - "Atlas Del Bagazo de la Cana de Azúcar", Geplace, PNUD, México (1990).
- 26. Silva, V. L. M. M.; Gomes, W. C. & Alsina, O. L. S. - Rev. Elet. Mater. Proces., 2, p.27 (2007).
- 27. Klemm, D.; Phillipp, B.; Heinze, T.; Hein, U. & Wagenknecht, W. - "Comprehensive Cellulose Chemistry", Wiley-VCH, Weinheim (1998).
- 28. Fengel, D. & Wegener, G. - "Wood-Chemistry, Ultrastructure, Reactions", Walter de Gruyter, New York (1989).
- 29. Hill Callum, A. S. - "Wood Modification: Chemical, Thermal and other Processes", John Wiley (2006).
- 30. Neureiter, M.; Danner, H.; Thomasserc, C.; Saidi, B. & Braun, R. - Appl. Microbiol. Biotechnol., 98, p.49 (2002).
- 31. John, M. J. & Thomas, S. - Carbohydr. Polym., 71, p.343 (2008).
- 32. Saha, B. C. J. - Ind. microbiol. biotechnol., 30, p.271 (2003).
- 33. Marques, P. A. A.; Trindade, T. & Pascoal Neto, C. - Compos. Sci. Technol., 66, p.1038 (2006).
- 34. Mulinari, D. R.; Cruz, T.G.; Cioffi, M. O. H.; Voorwald , H. J. C.; Da Silva , M. L. C. P. & Rocha, G. J. M. - Carbohydr. Reserach., in press.
- 35. Toledo, E. A.; Gushikem, Y. & Castro, S. C. - J. Colloid Interface Scie., 225, p.455 (2000).
- 36. Mulinari, D. R.; Da Silva, G. L. J. P. & Da Silva, M. L. C. P. - Quim. Nova, 29, p.496 (2006).
- 37. Padilha, P. M.; Campos, J. T. S.; Moreira, J. C. & Federici, C. C. - Quim. Nova, 18, p.529 (1995).
- 38. Alfaya, R. V. S. & Gushikem, Y. - J. Colloid Interface Scie., 85, p.383 (1999).
- 39. Pavan, F. A.; Francisco, M. S. P.; Landers, R. & Gushikem, Y. - J. Brazilian Society, 16, p.815 (2005).
- 40. Silva, R. E.; Maschio, L. J. & Silva, M. L. C. P. - "Estudo de intumescimento de celulose em água na síntese de híbridos Cel/Nb2O5.nH2O", in: Anais do 8ş Congresso Brasileiro de Engenharia Química: Iniciação Científica 2009, Uberlândia, Minas Gerais, Brasil (2009).
- 41. Pereira, P. H. F. & Silva, M. L. C. P. - Quim. Nova, 32 , p.7 (2009). http://dx.doi.org/10.1021/ja01155a022
- 42. Hanh, R. B. - J. Am.Chem. Soc., 73, p.5091(1951).
- 43. Tagliaferro, G. V.; Silva, M. L. C. P. & Silva, G. L. P. - Quim. Nova, 28, p.250 (2005). http://dx.doi.org/10.1590/S0100-40422005000200016
- 44. Segal, L.; Creely, J.; Martin Junior, A. E. & Conrad, C. M. - Text. Res. J., 29, p.786 (1959).
- 45. Ass, B. A. P.; Begacem , M. N. & Frollini, E. - Carbohydr. Polym., 63, p.19 (2006).
- 46. Cherian, B. M.; Leão, A. L.;De Souza, S. F.; Thomas, S.; Pothan, L. A. & Kottaisamy, M. - Carbohydr. Polym., 81, p.720 (2010). http://dx.doi.org/10.1016/j.carbpol.2010.03.046
- 47. Tang, L. G.; Hon, D. N. S.; Pan, S. H.; Zhu, Y. Q.; Wang, Z. & Wang, Z. Z. - J. Appl. Polym. Sci., 59, p.483 (1996). http://dx.doi.org/10.1002/(SICI)1097-4628(19960118)59:3%3C483::AID-APP13%3E3.0.CO;2-V
- 48. Teixeira, E. M.; Oliveira, R. C.; Mattoso, L. H. C.; Corrêa, A. C. & Paladin, P. D. - Polímeros, 20, p.268 (2010).
- 49. Cunha, A. G.; Freire, C. S. R.; Silvestre, A. J. D.; Pascoal Neto, C. & Gandini, A. - Carbohydr. Polym, 80, p.1048 (2010).
- 50. Pereira, P. H. F.; Voorwald, H. J. C.; Cioffi, M. O. H. & Pinto Da Silva, M. L. C. - Bioresources, 5, p.1010 (2010).
- 51. Carvalho, K. C. C.; Mulinari, D. R.; Voorwald, H. J. C. & Cioffi, M. O. H. - Bioresources, 5, p.1143 (2010).
Autor para correspondência:
Datas de Publicação
-
Publicação nesta coleção
27 Jan 2012 -
Data do Fascículo
2012
Histórico
-
Recebido
30 Mar 2010 -
Aceito
09 Jun 2011 -
Revisado
14 Abr 2011