Resumos
Polímeros sintéticos biorreabsorvíveis podem ser utilizados sob a forma de membranas para sustentar e guiar o crescimento celular, através do processo de reparação tecidual. Este trabalho avaliou membranas de poli(ácido lático), PLLA, com adição de 10% de trietil-citrato usadas como curativos de feridas cutâneas agudas em ratos Wistar. Inicialmente uma ferida de 2cm² foi provocada na região dorsal de 24 animais. Estes foram divididos em 2 grupos: tratamento, nos quais as feridas foram recobertas pela membrana polimérica e controle, com feridas permanecendo cruentas. Os resultados obtidos em 1, 3, 7 e 15 dias mostraram uma resposta inflamatória mais satisfatória nas feridas protegidas pelas membranas, com reparação precoce e colágeno mais organizado quando comparadas com as áreas incialmente mantidas sem proteção. Além do que, as áreas protegidas pelas membranas não mostraram alterações inflamatórias irritativas que pudessem ser imputadas ao uso da membrana polimérica. Diante disso, conclui-se que a membrana de PLLA/Trietil-citrato protegeu efetivamente as feridas, permitindo o processo de reparação e mostrando-se promissora como curativo cutâneo.
PLLA/Trietil-citrato; reparação tecidual; curativo cutâneo
Bioresorbable polymers can be applied as membranes to sustain and guide cell growth through the regeneration process. This study evaluated poly(acid lactide), PLLA, membranes with addition of 10% triethyl citrate as skin wound healing in Wistar rats. Initially a 2cm² skin wound was exercised of the back of 24 animals. The animals were divided into two groups: treated, whose the polymer membrane was implanted, and control, in which the wound was kept exposed. The results obtained after 1, 3, 7 and 15 days showed an inflammatory response more satisfactory in the implanted wounds, with early repair and collagen more organized when compared to exposed wounds. In addition to, the protected areas showed no irritant inflammatory response which could be attributed to the membrane. Thus, we conclude that the PLLA/Triethyl citrate membrane has effectively protected the wounds, allowing the repair and presenting itself as a promising skin dressing.
PLLA/triethyl citrate; tissue repair; skin wound
ARTIGO TÉCNICO CIENTÍFICO
Implante de membranas de PLLA/Trietil-Citrato como alternativa no tratamento de feridas cutâneas
PLLA/Triethyl citrate membrane as an alternative for the treatment of skin wounds
Lenon CardosoI; Raphael UseroI; Silvia M. M. CataniI; Maria L. P. BarboI; Andrea R. EspositoII; Eliana A. R. DuekII
IFaculdade de Ciências Médicas e da Saúde, PUC-SP
IIFaculdade de Engenharia Mecânica, UNICAMP
Endereço para correspondência Endereço para correspondência: Andrea Rodrigues Esposito Laboratório de Biomateriais, Pontifícia Universidade Católica de São Paulo PUC-SP Rua Joubert Wey, 290 CEP 18030-070, Sorocaba, SP, Brasil e-mail: aesposito@fem.unicamp.br
RESUMO
Polímeros sintéticos biorreabsorvíveis podem ser utilizados sob a forma de membranas para sustentar e guiar o crescimento celular, através do processo de reparação tecidual. Este trabalho avaliou membranas de poli(ácido lático), PLLA, com adição de 10% de trietil-citrato usadas como curativos de feridas cutâneas agudas em ratos Wistar. Inicialmente uma ferida de 2cm2 foi provocada na região dorsal de 24 animais. Estes foram divididos em 2 grupos: tratamento, nos quais as feridas foram recobertas pela membrana polimérica e controle, com feridas permanecendo cruentas. Os resultados obtidos em 1, 3, 7 e 15 dias mostraram uma resposta inflamatória mais satisfatória nas feridas protegidas pelas membranas, com reparação precoce e colágeno mais organizado quando comparadas com as áreas incialmente mantidas sem proteção. Além do que, as áreas protegidas pelas membranas não mostraram alterações inflamatórias irritativas que pudessem ser imputadas ao uso da membrana polimérica. Diante disso, conclui-se que a membrana de PLLA/Trietil-citrato protegeu efetivamente as feridas, permitindo o processo de reparação e mostrando-se promissora como curativo cutâneo.
Palavras-chaves: PLLA/Trietil-citrato, reparação tecidual, curativo cutâneo.
ABSTRACT
Bioresorbable polymers can be applied as membranes to sustain and guide cell growth through the regeneration process. This study evaluated poly(acid lactide), PLLA, membranes with addition of 10% triethyl citrate as skin wound healing in Wistar rats. Initially a 2cm2 skin wound was exercised of the back of 24 animals. The animals were divided into two groups: treated, whose the polymer membrane was implanted, and control, in which the wound was kept exposed. The results obtained after 1, 3, 7 and 15 days showed an inflammatory response more satisfactory in the implanted wounds, with early repair and collagen more organized when compared to exposed wounds. In addition to, the protected areas showed no irritant inflammatory response which could be attributed to the membrane. Thus, we conclude that the PLLA/Triethyl citrate membrane has effectively protected the wounds, allowing the repair and presenting itself as a promising skin dressing.
Keywords: PLLA/triethyl citrate, tissue repair, skin wound.
Introdução
Uma ferida é representada pela interrupção da continuidade de um tecido corpóreo, em maior ou em menor extensão, causada por qualquer tipo de trauma físico, químico, mecânico ou desencadeada por uma afecção clínica, que aciona as frentes de defesa orgânica[1].
Uma vez estabelecida a lesão, a pele possui dois mecanismos para reparação tissular: a regeneração e a cicatrização. A regeneração envolve a substituição do tecido lesado por tecido novo, equivalente ao lesado, através de um processo inflamatório agudo. Isso ocorre quando a camada basal da epiderme mantém-se intacta, e assim as bordas epiteliais vão se aproximando em direção ao centro da ferida, ocluindo rapidamente sua superfície. A cicatrização, por sua vez, ocorre quando há um dano mais profundo às camadas da pele, e há impossibilidade de regeneração das estruturas epiteliais, sendo que a cicatrização ocorre com deposição de colágeno[2].
A cicatrização das feridas pode ocorrer por primeira intenção, quando a perda tecidual não impede que as bordas da lesão sejam aproximadas ou por segunda intenção, quando a perda tecidual é intensa a ponto de impossibilitar as bordas lesadas de se aproximarem, formando tecido de granulação; ou por terceira intenção, quando a ferida é mantida aberta para uma cicatrização por segunda intenção até substituição do tecido perdido através de enxertos[3].
Atualmente, um dos grandes dilemas da medicina é tratar feridas nas quais a cicatrização só é possível por segunda intenção. Assim, o paciente está exposto a uma série de complicações como infecções, dificuldades de cicatrização, perda de fluídos, entre outros. O tratamento para esta perda excessiva de tecido cutâneo seria o transplante ou implante[4].
O transplante envolve uma série de medidas a serem adotadas para evitar que o tecido transplantado não sofra rejeição, como a imunossupressão, estando o paciente exposto a outros tipos de infecção[5]. Diante disso, implantes biorreabsorvíveis representam uma alternativa viável, pois além de não enfrentarem o risco de rejeição, atuam na interface com os tecidos receptores, interagindo com os mesmos[6].
Os polímeros biorreabsorvíveis mais pesquisados para a pele são PGA, PLLA e o PLGA[7]. Esses polímeros apresentam algumas vantagens em relação aos substratos biológicos uma vez que, por serem sintéticos, apresentam produção padronizada; podem ser modificados para atender as necessidades clínicas sem que haja perda de suas propriedades mecânicas; e praticamente eliminam a possibilidade de carrearem microrganismos, sendo assim mais seguros aos pacientes[8], além de seus metabólitos serem totalmente eliminados sem efeitos colaterais residuais, suprindo portanto, a necessidade de um outro procedimento cirúrgico[9].
O homopolímero PLLA, poli(L-ácido lático), é um polímero semicristalino com ponto de fusão em torno de 180 °C e cristalinidade por volta de 70%, e, dentre os poli(lactides), é o que possui a menor taxa de degradação[10]. As propriedades mecânicas apresentadas por este polímero são compatíveis para engenharia tecidual da pele[11].
Vários pesquisadores das áreas médica, biológica, química e engenharias têm estudado os processos de biocompatibilidade, perda de propriedades mecânicas e alterações das propriedades físico-químicas do PLLA quando implantado[11,12]. Algumas das aplicações nas quais este polímero já vem sendo utilizado são como dispositivos para recuperação de fraturas, fios para sutura intradérmica, liberação controlada de fármacos, regeneração guiada de tecidos, preenchimento facial e arcabouço para cultura de células.
Apesar dos extensos avanços realizados no campo de biomateriais, o número de polímeros disponíveis para aplicações biomédicas ainda é limitado[13]. Assim, a utilização de blendas, uso de aditivos como plastificantes ou síntese de copolímeros, são preferidos devido à possibilidade de combinarem diversas propriedades favoráveis em um único dispositivo[14,15].
A adição de trietil-citrato, um agente plastificante, em membranas de PLLA foi previamente caracterizada e descrita por Luciano[12,16], Moura[17] e Cherutti[18] com concentrações de plastificante entre 0 e 11%. Os resultados demonstraram que a presença de trietil-citrato promoveu a redução do tempo para completa degradação do dispositivo com o acréscimo da flexibilidade, hidrofilicidade e porosidade em relação às membranas de PLLA puro sem comprometer a biocompatibilidade[19], o que aumenta sua interação com as células fibroblásticas[18] e melhora da reação histológica do implante com o tecido subcutâneo[20-22].
Neste caso, membranas porosas de polímeros biorreabsorvíveis são obtidas com o intuito de atuar como um substrato para que células possam se fixar e crescer até formar o neotecido. Em se tratando da regeneração tecidual, seja através do recrutamento de células sadias de tecido vizinho ou através de transplante de células, é necessária a existência de um substrato que sirva como arcabouço para o crescimento celular. O arcabouço deve ser então absorvido, desaparecendo à medida que o tecido se regenera com características semelhantes às da matriz extracelular[12].
Diante destas perspectivas, o objetivo deste estudo foi utilizar membranas de PLLA com adição de 10% de trietil-citrato para implante como curativo cutâneo em ratos Wistar, com o intuito de avaliar a biocompatibilidade do dispositivo, possibilitando assim, a aplicação dos mesmos no tratamento de lesões cutâneas.
Experimental
Obtenção das membranas de PLLA
Soluções de poli(L-ácido lático), PLLA, foram preparadas por diluição do polímero em clorofórmio (Merck) (10% m/v) a temperatura ambiente. Após completa dissolução do polímero foi acrescentado 10% de trietil-citrato, e a solução foi vertida em um molde de teflon (350 × 120 mm) para evaporação do solvente. Após completa evaporação do solvente, as amostras foram secas a vácuo. Os filmes foram cortados nas dimensões 2,0 cm × 2,0 cm e mantidos em etanol 70% overnight, lavados em PBS e secos antes de serem implantados.
Microscopia eletrônica de varredura (MEV)
As amostras foram fixadas em suporte metálico e recobertas com uma fina camada de ouro, utilizando-se um metalizador de amostras BAL-TEC SCD 050 e observadas ao MEV Zeiss modelo EVO MA-15.
Animais
Foram utilizados 24 ratos Wistar de ambos os sexos e com idade de 3 meses, pesando 300 g em média, provenientes do Biotério da FCMS/PUC-SP. Os animais foram divididos em 2 grupos de acordo com o tratamento aplicado: implante da membrana de PLLA/Trietil-citrato e controle, onde o defeito permaneceu vazio. Foram sacrificados 3 animais de cada grupo para cada tempo de 1, 3, 7 e 15 dias após a intervenção cirúrgica inicial.
Cirurgia
O procedimento cirúrgico consistiu da anestesia intramuscular dos animais com solução de cloridrato de xilazina (2%) 5 mg/kg e cloridrato de cetamina (10%) 95 mg/kg. Anestesiados, prosseguiu-se com a tricotomia do dorso próximo à região cervical. Em cada animal foi dissecada a pele e o subcutâneo de uma área regular de 2,0 cm × 2,0 cm. Como tratamento, as feridas foram recobertas por membranas de PLLA/Trietil-citrato, as quais foram fixadas por 8 pontos cirúrgicos efetuados nas bordas e porções laterais dos defeitos. No grupo controle foi realizado o mesmo defeito mantendo-se sem tratamento algum. Finalizados os períodos de 1, 3, 7 e 15 dias pós-cirúrgicos, os animais foram sacrificados com overdose de halotano, anestésico inalante. O material foi retirado através da orientação da cicatriz do implante. Os segmentos de tecido abrangendo toda região do implante foram fixados em formol 10% para realização dos procedimentos histológicos.
Processamento do material
As amostras foram preparadas para análise histológica de acordo com as técnicas utilizadas para Microscopia de Luz, utilizando-se parafina como meio de inclusão. Os cortes foram realizados em micrótomo com espessura de 3 µm e coloração com Hematoxilina e Eosina. Os cortes foram fixados entre lâmina e lamínula com o uso de Entelan (Merk®).
Avaliação histopatológica
Nos exames histológicos das secções do neotecido os seguintes elementos foram avaliados: 1- Características da resposta inflamatória aguda; 2- Tempo de reparação; 3- Formação de cicatriz.
Resultados e Discussão
Nos últimos anos o interesse na utilização de polímeros biorreabsorvíveis como dispositivos para uso na engenharia tecidual tem aumentado. A avaliação de um biomaterial envolve a caracterização do dispositivo, bem como estudos in vitro e in vivo[23].
As membranas de PLLA/Trietil-citrato apresentaram morfologia da superfície irregular e porosa, composta por pequenos glóbulos pontiagudos com cerca de 50 µm de diâmetro (Figura 1a). Observa-se uma discreta rugosidade superficial (Figura 1c), característica do material previamente caracterizado por Luciano[12,16].
Em aplicações para engenharia de tecidos moles, como é o caso da pele, é aconselhável o uso de materiais com caracteristicas flexíveis, porém relativamente rígidos capazes de proteger a lesão, e tempo de degradação compatível com a regeneração tecidual[24].
Em sua dissertação Luciano[12] classificou as membranas de PLLA/Trietil-citrato em duas categorias relacionadas à presença do plastificante para distintas aplicações: membranas densas (puras), biorreabsorvíveis, que não favorecem a invasão celular porém são biocompatíveis, indicadas para regeneração guiada de tecidos; e membranas porosas (com adição de 10 e 15% de plastificante), também biorreabsorvíveis, facilmente invadidas por células, indicadas para recuperação e recomposição de tecidos moles.
A presença de trietil-citrato exerce influência nas propriedades térmicas e mecânicas do PLLA, atuando através de interações físicas entre as cadeias poliméricas, afastando-as. O ensaio mecânico de tração mostrou que a quantidade de plastificante utilizada em 10% (m/v) reduziu significativamente o módulo de elasticidade das membranas, que não ultrapassou o valor de 60MPa, tornando a análise inviável após 10 dias de degradação in vitro, devido a fragilidade[12].
Por outro lado, as membranas sem plastificante (PLLA puro) apresentaram módulo de elasticidade da ordem de 900MPa e mantiveram as propriedades mecânicas por muito mais tempo, demonstrando que as membranas com plastificante degradam mais rapidamente, conduzindo sua aplicação para técnicas de recuperação de lesões ou cultura celular onde ocorra uma rápida migração e invasão celular, para que a matriz extracelular passe a repor a estrutura degradada da membrana e o neotecido se forme[12], como é o caso da pele.
Além disso, foi constatado que com o aumento na concentração de plastificante, há modificação morfológica da membrana, tornando-a porosa, aumentando assim a invasão celular, diminuindo seu tempo de degradação, proporcionando à membrana maior elasticidade e menor rigidez. Sabe-se que a porosidade contribui para a fixação e crescimento celular[16].
Diante disso selecionou-se o material PLLA com 10% de trietil-citrato uma vez que o dispositivo possui as caracteristicas desejáveis para a aplicação em questão ou recuperação de lesões como as causadas por queimaduras[16].
Os resultados morfológicos obtidos por MEV estão de acordo com os apresentados por Luciano[12,16], Moura[17] e Cherruti[18], onde a adição do trietil-citrato em diferentes concentrações proporcionou a obtenção de membranas porosas com morfologia globular[12,16-18].
Nos tempos de 1, 3, 7 e 15 dias pós-cirurgia, os animais foram observados, macroscopicamente, em relação à formação de crosta e estado de cicatrização das feridas. Naqueles submetidos ao implante da membrana não houve nenhum sinal de rejeição da mesma, a qual permaneceu no dorso de todos os ratos até a data do sacrifício, e tampouco sinais que sugerissem infecção.
Nos ratos com 1 dia pós-cirurgia o aspecto das feridas mostrava boa vitalidade sem indícios de infecção, observando-se apenas a presença da membrana no local (Figura 2a). Após 3 dias, observou-se a adesão da membrana à ferida, as quais permaneceram recobrindo-as, embora alguns pontos já houvessem sido perdidos. Não se evidenciou formação de crosta espessa (Figura 2b). Nos ratos com 7 dias de cicatrização verificou-se processo reparativo avançado com contração da ferida e presença de crosta (Figura 2c). Com 15 dias, as feridas estavam praticamente fechadas com reepitelização, sem sinais de presença das membranas (Figura 2d).
Os ratos do grupo controle também apresentaram contração da ferida correspondente ao tempo pós-cirúrgico. Não houve sinal de processo infeccioso exacerbado em nenhum animal. Nos ratos com 1 dia de reparação, o tecido estava completamente exposto (Figura 3a). Principalmente, os ratos com 3 e 7 dias de cicatrização exibiram superfície das feridas recobertas com extensas e espessas crostas (Figuras 3b, c). Nos ratos com 15 dias de cicatrização já não havia a presença de crosta e a cicatriz mostrava contração significativa, havendo uma pequena área ainda não reepitelizada (Figura 3d).
Quando comparamos microscopicamente as lesões recobertas pelas membranas e as mantidas expostas (controle) algumas diferenças tornam-se aparentes: em relação ao primeiro tempo avaliado (1 dia pós-cirurgia), as feridas recobertas pelas membranas evidenciam mais edema intersticial e, consequentemente, de maior espessura. Por outro lado, as feridas expostas mostram-se menos espessas, com menos edema intersticial e com resposta inflamatória aguda acentuada caracterizada por abundantes polimorfonucleares neutrófilos (Figura 4).
No terceiro dia, nas feridas recobertas, apesar da menor resposta inflamatória aguda, há inicio de reparação caracterizado por vasos ectásicos e presença de células fusiformes (Figura 5a). Já nos controles a resposta inflamatória aguda é mais evidente, com predomínio de neutrófilos e ainda não há evidência de resposta reparativa (Figura 5b).
Interpretamos tais diferenças baseados nos eventos que caracterizam a resposta inflamatória frente às feridas cutâneas com perda substancial de pele: logo após o trauma ocorrem uma série de eventos que tem por finalidade iniciar a resposta do organismo[2]. Tais eventos estão na dependência dos vasos íntegros contidos na e ao redor da lesão. Caracterizam-se por dilatação e aumento de permeabilidade vascular e estes fenômenos preparam o local para a migração de células, no caso os polimorfonuclerares neutrófilos[25].
No primeiro tempo a espessura das feridas resultou maior nas naquelas recobertas pelas membranas, pois estas evitaram a desidratação. De modo análogo a crosta resultou mais espessa nos controles, pois ela é consequência do ressecamento da área cruenta e, em feridas não protegidas, até certo ponto ela tem a finalidade de proteção. Após o terceiro dia pós-cirúrgico, frente a feridas sem infecção e com o agente externo neutralizado, inicia-se o processo de reparação caracterizado por angiogênese (novos vasos a partir dos pré-existentes) e proliferação de fibroblastos com o intuito de restaurar os tecidos. Comparando os dois grupos, torna-se aparente que o processo reparativo iniciou-se precocemente nas feridas recobertas pelas membranas, enquanto nos controles, com feridas não protegidas, estas ainda estavam sujeitas às condições do meio ambiente.
Após 7 dias as diferenças resultam evidentes em relação às feridas recobertas com membrana de PLLA/Trietil-citrato, com presença de tecido de granulação ainda jovem, bem vascularizado, resposta inflamatória escassa e deposição de colágeno organizado nos animais tratados com a membrana polimérica (Figura 6b). Já nos controles o tecido de granulação presente apresenta-se em fase imatura com sinais de pouca vitalidade/angiogênese nas feridas (Figura 6a).
O assim chamado tecido de granulação se caracteriza por vasos capilares neoformados, fibroblastos, colágeno jovem e células inflamatórias mononucleares, tais como monócitos, macrófagos e linfócitos[25]. É evidente que nas feridas protegidas o processo reparativo teve inicio precoce em relação às feridas totalmente expostas, pois as membranas agiram como curativos protegendo os tecidos lesados da desidratação e evitando a contaminação externa.
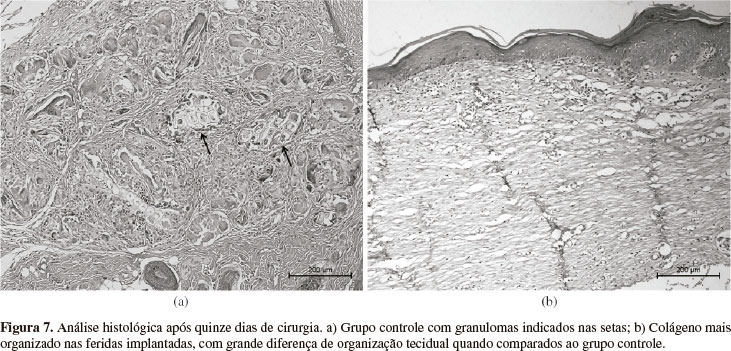
Com 15 dias, as feridas mostraram-se em processo de fechamento por segunda intenção e o colágeno resulta mais organizado nas feridas recobertas por membranas (Figura 7b). A presença de grandes granulomas nos controles provavelmente interferiu na reparação das feridas (Figura 7a). Os granulomas de corpo estranho são resultantes do acúmulo de células macrofágicas que têm por finalidade englobar ou encapsular partículas não digeríveis[25]. Eles praticamente não foram visualizados nas áreas recobertas pelas membranas e resultaram frequentes nas feridas expostas, com presença de material estranho, como restos de pelos.
O reparo de feridas é caracterizado como o esforço dos tecidos em restaurar a função e estrutura natural. A regeneração é a restauração completa da arquitetura do tecido pré-existente, sem formação de cicatriz, ocorre somente no período embrionário, organismos inferiores ou em determinados tecidos como o ósseo[2].
O processo de cicatrização envolve três fases principais: inflamatória, seguida da fase proliferativa (ou reparativa) e após a formação da cicatriz ocorre uma terceira fase longa caracterizada pela remodelação. Nesta última fase, os vasos são remodelados e se diferenciam e o colágeno maduro depositado organiza-se em feixes paralelos á superfície[26]. O neotecido formado é chamado tecido de granulação. Em relação ao epitélio as células basais proliferam e tendem a recobrir a superfície. Caso permaneçam nos tecidos fragmentos de corpos estranho como, por exemplo, fios de sutura ou fragmentos de pelos, estes na impossibilidade de serem eliminados, são englobados por células macrofágicas (as chamadas células gigantes de corpo estranho) e aí permanecerão até serem eliminados[26].
Existem vários fatores que interferem na cicatrização das feridas cutâneas tais como localização, vascularização do local, profundidade das feridas, estado nutricional e estados patológicos associados[11]. A infecção é a causa mais frequente de não fechamento de feridas cutâneas. Quando do uso de membranas poliméricas como curativos é necessário levar em conta outros fatores, tais como sua taxa de degradação, biocompatibidade, além da porosidade, estrutura química e propriedades mecânicas do dispositivo, dentre outros fatores.
Em seu processo de degradação, estes polímeros são quebrados em unidades menores por hidrólise simples e os produtos de sua decomposição eliminados do corpo por vias metabólicas, como a via do ácido cítrico, ou diretamente por excreção renal[7].
Com o aumento da expectativa de vida humana, a busca por metodologias para substituição de tecidos lesados tornou-se uma necessidade[6]. A literatura médica descreve numerosos estudos in vitro e in vivo em modelos de cicatrização de feridas. Devido as facilidades de manuseio e baixo custo, animais pequenos tais como o coelho, cobaia, rato e camundongo, são frequentemente utilizados em estudos de cicatrização de feridas. Estes mamíferos têm uma densa camada de pêlos no corpo, epiderme e derme fina e, mais importante, eles cicatrizam principalmente através de contração da ferida[27].
Em nosso estudo, analisamos o comportamento de membranas de PLLA com adição do plastificante trietil-citrato como substrato para curativos cutâneos em ratos Wistar.
Sabe-se que em substratos de PLLA, foi observado que as células foram capazes de aderir, proliferar sobre ele e produzirem moléculas de matriz extracelular, como colágeno IV e fibronectina[28]. Esse comportamento faz com que o PLLA seja um substrato considerado para lesões de pele.
A citocompatibilidade e bicompatibilidade da composição PLLA/Trietil-citrato em diferentes proporções já foi previamente demonstrada através de cultura de células Vero[18] e implante subcutâneo em ratos[19-22]. A reação tecidual após implante foi evidenciada pela presença de fibroblastos, macrógafos, células gigantes e polimorfonucleares[21]. Não obstante, a invasão da membrana por tecido conjuntivo vascular indica que, além de estimular a reação inflamatória à membrana favorece a regeneração tecidual do tecido lesionado[19].
Estes estudos concluíram que o tipo de resposta inflamatória em relação ao PLLA depende da concentração de plastificante, uma vez que a alta concentração do trietil-citrato promove um dispositivo com maior porosidade e por conseguinte, maior resposta celular e maior velocidade de degradação sem comprometer, no entanto, a biocompatibilidade do polímero[19-22].
Isso foi demonstrado na análise histológica dos animais operados em nosso estudo; inicialmente o polímero causou uma resposta inflamatória menos intensa nos primeiros dias de cicatrização em relação ao controle, o processo de reparação tornou-se mais organizado e acelerado nos animais implantados. Logo concluímos que as membranas protegeram as áreas lesadas e propiciaram uma reparação efetiva e mais rápida, em comparação com o grupo controle.
Além disso, a membrana de PLLA/Trietil-citrato evitou a desidratação excessiva, porém sem eliminá-la, com adesão efetiva à superfície da ferida e posterior biorreabsorção ao longo do período de cicatrização, como pode ser visualizado na análise macroscópica. Tampouco foram evidenciadas alterações que sugerissem respostas irritativas do organismo à membrana propriamente dita.
Resultados semelhantes foram obtidos em outros trabalhos in vivo. O estudo com membranas de PLGA de Rezende et al.[29] mostrou que o polímero degradou rapidamente em contato com a pele sem causar processos inflamatórios exacerbados e protegeu a área ulcerada da ação de agentes externos, com cicatrização das feridas mais rápida na presença das membranas. Assaf et al.[30] com a utilização de membranas PLGA imobilizadas com colágeno, demonstrou na análise histológica que as feridas tratadas com PLGA-col apresentaram contração, com colágeno compactado bem organizado e pouca reação inflamatória com presença de miofibroblastos evidentes. Ambos os estudos apresentam resultados semelhantes aos obtidos nesse estudo, e sugerem que as membranas poliméricas estimulam e tornam mais organizado o processo de regeneração tecidual em feridas cutâneas[29,30].
As pesquisas sobre substitutos parciais ou totais da pele representam uma área substancial da bioengenharia[31-34]. Através da engenharia tecidual e o recrutamento de células, substitutos que mimetizam a pele estão em desenvolvimento para aumentar a restauração cutânea e melhorar a qualidade da cicatrização de feridas a partir de modelos in vitro[35].
Diante do exposto, este trabalho contribui como modelo para obtenção de dispositivos que permitam a regeneração dos elementos da pele, principalmente aqueles dérmicos, ou seja, vasos, células e colágeno.
Conclusão
A membrana de PLLA/Trietil-citrato facilitou o processo de reparação e cicatrização da ferida de forma organizada, protegendo a lesão, apresentando-se promissora como alternativa para curativos cutâneos, principalmente nos pacientes em que há lesões cutâneas agudas extensas, dificultando a obtenção de enxertos autólogos, além de ser um procedimento cirúrgico de menor complexidade.
Agradecimentos
Os autores agradecem a Kelly Fernanda Martins pela obtenção das membranas e ao CNPq/PIBIC e CNPq/RHAE pelas bolsas concedidas.
Enviado: 22/06/12
Reenviado: 26/09/12
Aceito: 28/03/13
- 1. Cesaretti, I. U. R. - Pelle Sana, 2, p.10 (1998).
- 2. Gurtner, G. C.; Werner, S.; Barrandon Y. & Longaker M. T. - Nature, 453, p.314 (2008). PMid:18480812. http://dx.doi.org/10.1038/nature07039
- 3. Tazima, M. F. G. S.; Vicente, Y. A. M. V. A & Moriya, T. - Medicina (Ribeirão Preto), 41, p.259 (2008).
- 4. Arruda, G. G. A.; Barbo, M. L. P. & Duek, E. A. R. - "Membranas de PLGA como curativos cutâneos", in: Anais do 6º Congresso Latino Americano de Órgãos Artificiais e Biomateriais, Gramado - RS, ago (2010).
- 5. Hench, L. L. - Biomaterials, 19, p.1419 (1998). http://dx.doi.org/10.1016/S0142-9612(98)00133-1
- 6. Barbanti, S. H.; Zavaglia, C. A. C. & Duek, E. A. R. - Polímeros, 15, p.13 (2005). http://dx.doi.org/10.1590/S0104-14282005000100006
- 7. Santos Junior, A. R. & Wada, M. L. F. - Polímeros, 17, p.308 (2007).
- 8. El Ghalbzouri, A.; Lamme, E. N.; Van Blitterswijk, C.; Koopman, J. & Ponec, M. - Biomaterials, 25, p.2987 (2004). PMid:14967531. http://dx.doi.org/10.1016/j.biomaterials.2003.09.098
- 9. Duek, E. A. R.; Zavaglia, C. A. C. & Belangero, W. D. - Polymer, 40, p.6465 (1999). http://dx.doi.org/10.1016/S0032-3861(98)00846-5
- 10. Motta, A. C. - "Síntese e caracterização do poli(L-ácido lático) - PLLA e poli(L-acido lático - co-ácido glicólico) - PLGA, estudo da degradação in vitro", Tese de Mestrado, Universidade Estadual de Campinas, Brasil (2002).
- 11. Redaelli, A. - J. Plastic Dermatol., 4, p.41 (2008).
- 12. Luciano, R. M. - "Síntese, caracterização e degradação de membranas de poli(ácido lático), um polímero biorreabsorvível", Tese de Mestrado, Universidade Estadual de Campinas, Brasil (1997).
- 13. Pego, A. P.; Poot, A. A.; Grijpma, D. W. & Feijen, J. J. - J. Mater. Sci. Mater. Med., 14, p.767 (2003). http://dx.doi.org/10.1023/A:1025084304766
- 14. Eppley, B. L.; Morales, L.; Wood, R.; Pensler, J.; Goldstein, J.; Havlik, R. J.; Habal, M.; Losken, A.; Williams, J. K.; Burstein, F.; Rozzelle, A. A. & Sadove, A. M. - Plast. Reconstr. Surg., 114, p.850 (2004). PMid:15468389. http://dx.doi.org/10.1097/01.PRS.0000132856.69391.43
- 15. Nieminen, T.; Rantala, I.; Hiidenheimo, I; Keranen, J; Kainulainen, H.; Wuolijoki, E. & Kallela, I. - J. Mater. Sci. Mater. Med., 19, p.1155 (2008). PMid:17701310. http://dx.doi.org/10.1007/s10856-007-3082-x
- 16. Luciano, R. M. - "Efeitos da concentração de plastificante em membranas de poli(ácido lático) para implantes", Tese de Doutorado, Universidade Estadual de Campinas, Brasil (2001).
- 17. Moura, L. A. - "Utilização de Membranas de Poli (L-ácido láctico) em Regeneração Tecidual Guiada para Periodontia", Dissertação de Mestrado, Universidade Estadual de Campinas, Brasil (2007).
- 18. Cherruti, G. - "Desenvolvimento e caracterização de dispositivo de PLLA/Trietil-citrato associado a derme suína acelular para reparo de lesões cutâneas", Dissertação de Mestrado, Universidade Estadual de Campinas, Brasil (2012).
- 19. Scapin, S. M.; Silva, D. R.; Joazeiro, P. P.; Alberto-Rincon, M. C.; Luciano, R. M. & Duek, E. A. - J. Mater. Sci. Mater. Med., 14, p.635 (2003). http://dx.doi.org/10.1023/A:1024031225911
- 20. Silva, D.; Scapin, S. M. N.; Luciano, R. M.; Joazeiro, P. P.; Duek, E. A. R. & Alberto-Rincon, M. C. - J. Mater. Sci. Mater. Med., 13, p.327 (2002). http://dx.doi.org/10.1023/A:1014027405057
- 21. Maluf-Meiken, L. C. V.; Silva, D. R. M.; Duek E. A. R. & Alberto-Rincon M. C. - J. Mater. Sci. Mater. Med., 17, p.481 (2006). PMid:16688589. http://dx.doi.org/10.1007/s10856-006-8476-7
- 22. Silva, D. R.; Joazeiro, P. P.; Duek, E. A. & Alberto-Rincon, M. C. - J. Biomater. Sci. Polym. Ed., 17, p.177 (2006). http://dx.doi.org/10.1163/156856206774879018
- 23. Wang, W.; Zhang, M.; Lu, W.; Zhang, X.; Ma, D.; Rong, X.; Yu, X. & Jin, Y. - Tissue Eng. Part C, 15, p.1 (2009).
- 24. Stock, U. A. & Vacanti, J. P. - Annu. Rev. Med., 52, p.443 (2001). PMid:11160788. http://dx.doi.org/10.1146/annurev.med.52.1.443
- 25. Kumar, V.; Abbas, A. K.; Fausto, N. & Aster, J. C. - "Patologia. Bases patológicas das doenças", Elsevier, Rio de Janeiro (2010).
- 26. Rodero, M. P. & Khosrotehrani, K. - Int. J. Clin. Exp.Pathol., 3, p.643 (2010). PMid:20830235 PMCid:PMC2933384.
- 27. Sullivan, T. P.; Eaglstein, W. H.; Davis, S. C. & Mertz, P. - Wound Rep. Reg., 9, p.66 (2001). http://dx.doi.org/10.1046/j.1524-475x.2001.00066.x
- 28. Santos Junior, A. R.; Barbanti, S. H.; Duek, E. A. R.; Dolder,H.; Wada, R. S. & Wada, M. L. F. - Artif. Organs, 25, p.7 (2001).
- 29. Rezende, C. A.; Luchesi, C.; Barbo, M. L. P. & Duek, E. A. R. - Polímeros, 15, p.232 (2005). http://dx.doi.org/10.1590/S0104-14282005000300015
- 30. Assaf, K.; Mas, B. A.; Esposito, A. R.; Cardoso, L.; Usero, R.; Martins, K.; Duek, E. A. R. & Barbo, M. L. P. - "Membranas de PLGA imobilizadas com colágeno como curativo cutâneo", in: Anais do 11º Congresso Brasileiro de Polímeros, Campos do Jordão - SP, out (2011).
- 31. Metcalfe, A. D. & Ferguson, M. W. - J. R. Soc. Interface, 4, p.413 (2007). PMid:17251138 PMCid:PMC2373411. http://dx.doi.org/10.1098/rsif.2006.0179
- 32. Wong, D. J. & Chang, H. Y. - "Skin Tissue Engineering", in: Stembook, cap. 7, Bhatia, S. & Polak, J. (ed), The Stem Cell Research Community, Cambrigde (2008).
- 33. Shevchenko, R. V.; James, S. L. & James, E. - J. R. Soc. Interface, 7, p.229 (2010). PMid:19864266 PMCid:PMC2842616. http://dx.doi.org/10.1098/rsif.2009.0403
- 34. Murphy, P. S. & Evans, G. R. D. - Plat Surg. Int. (2012). In press.
- 35. Groeber, F.; Holeiter, M.; Hampel, M.; Hinderer, S. & Schenke-Layland, K. - Adv. Drug Deliv. Rev., 128, p.352 (2011). PMid:21241756. http://dx.doi.org/10.1016/j.addr.2011.01.005
Datas de Publicação
-
Publicação nesta coleção
21 Fev 2014 -
Data do Fascículo
2013
Histórico
-
Recebido
22 Jun 2012 -
Aceito
28 Mar 2013 -
Revisado
26 Set 2012