GPIIb/IIIa receptors; Platelets; Antagonists
Receptores IIb/IIIa; Plaquetas; Antagonistas
Artigo de Revisão
Antagonistas do receptor plaquetário GPIIb/IIIa
M.E.W. Gomes, C. Fabris, J.L.B. Filho, R. Dreher, G.A. Rosito
Departamento de Farmacologia e Toxicologia da Fundação Faculdade Federal de Ciências Médicas de Porto Alegre, Porto Alegre, RS
UNITERMOS: Receptores IIb/IIIa. Plaquetas. Antagonistas.
KEY WORDS: GPIIb/IIIa receptors. Platelets. Antagonists.
INTRODUÇÃO
As plaquetas têm sido relacionadas aos processos ateroscleróticos, trombose e síndromes coronarianas. Os agentes antiplaquetários atuais, tanto endovenosos como orais, apesar de comprovada eficácia clínica, apresentam algumas limitações1. Através de seus mecanismos de ação, provocam inibição plaquetária relativamente fraca e podem causar efeitos colaterais sistêmicos. A aspirina inibe irreversivelmente a ciclooxigenase, bloqueando a síntese tecidual de prostaglandinas e tromboxane A2, podendo causar úlcera péptica. A ticlopidina inibe apenas a ativação plaquetária desencadeada pelo agonista ADP, estando associada à agranulocitose2. A descoberta do receptor GP IIb/IIIa como via final comum da agregação plaquetária gerou interesse na investigação de antagonistas para este sítio, visando efeitos mais específicos e minimizando as reações adversas3-9.
Nesta revisão, será sumarizado o conhecimento atual sobre os receptores GP IIb/IIIa, e, principalmente, serão comentados os mais importantes estudos clínicos realizados com antagonistas destes receptores em seres humanos.
BIOLOGIA E FUNÇÃO DAS PLAQUETAS
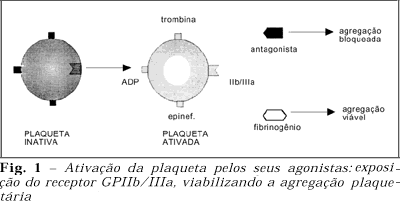
As plaquetas são pequenas células anucleadas e discóides, derivadas dos megacariócitos e possuem uma vida média de dez dias. Acredita-se que seja sua principal função manter a integridade do sistema circulatório, evitando a perda de sangue10. Após a lesão na parede de um vaso ocorre a exposição de componentes da mesma (colágeno, fibrinogênio, fibronectina, etc.) que causam adesão das plaquetas no local da injúria, seguida de ativação destas na presença de trombina. A ativação plaquetária causa uma mudança conformacional no receptor IIb/IIIa, que torna-se apto a ligar-se a diferentes glicoproteínas (ligantes), como fibrinogênio, fator von Willebrand, fibronectina e vitronectina, possibilitando a agregação entre as plaquetas (figura 1)11-14. As próprias plaquetas ativadas agem liberando mediadores químicos (ADP, tromboxane A2, epinefrina, cálcio, etc.) que ativam plaquetas próximas, aumentando a adesão e formando um tampão. Finalmente, esta ativação catalisa a conversão de protrombina em trombina, enzima proteolítica que transforma fibrinogênio em fibrina, formando uma rede aderente que estabiliza o coágulo sangüíneo15.
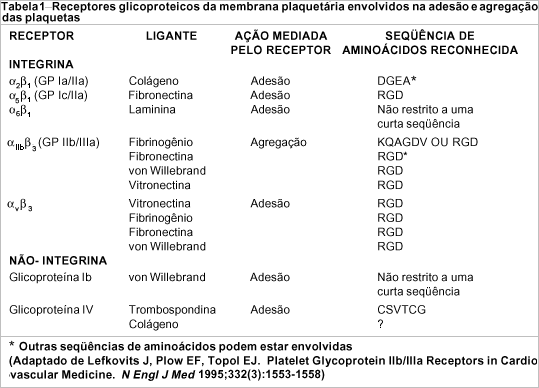
A interação entre plaquetas e superfícies lesadas é mediada por moléculas de adesão localizadas na superfície da membrana plasmática (tabela 1). Estas moléculas (geralmente glicoproteínas) são responsáveis pela ligação entre células e entre uma célula e a matriz extracelular. Dentre as famílias destas moléculas (integrinas, mucinas, proteoglicanas)16, sabe-se que as integrinas participam na fisiologia plaquetária e na patogenia de diversas lesões isquêmicas. Mais especificamente, as integrinas citoadesinas (compartilham a subunidade beta3) são as que incluem o complexo glicoproteico IIb/IIIa e o receptor da vitronectina3.
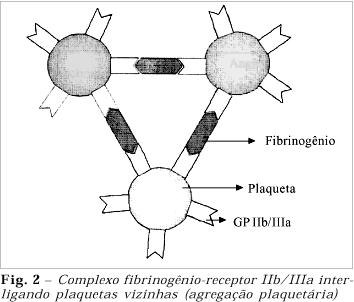
O complexo GP IIb/IIIa é um heterodímero cálcio-dependente, presente nas plaquetas e nos megacariócitos4,5. Todas as glicoproteínas ligantes do receptor IIb/IIIa possuem uma seqüência de aminoácidos em comum: a seqüência RGD (arginina, glicina e aspartato). Inúmeros trabalhos comprovam a importância desta seqüência e de suas relações com outras porções da mesma molécula na interação ligante-receptor7,17-23. Apesar de o fibrinogênio, principal ligante do complexo IIb/IIIa, apresentar até três seqüências específicas para este receptor, a região RGD possui um papel central, conforme foi verificado por estes estudos. A glicoproteína IIb/IIIa está presente em grande número na membrana plaquetária, constituindo-se na mais densamente distribuída nesta célula4,24. Podemos entender esta informação como um retrato da importância da ligação fibrinogênio-receptor IIb/IIIa, mediadora da via final de agregação plaquetária (figura 2).
A inibição da formação neoíntima, componente da aterosclerose e restenose pós-angioplastia, também foi verificada através de anticorpos direcionados contra fatores de crescimento liberados pelas plaquetas25, e bloqueadores de receptores plaquetários IIb/IIIa6.
DESENVOLVIMENTO DOS INIBIDORES DO RECEPTOR GP IIb/IIIa
Anticorpos
A partir de 1983, nos Estados Unidos, foram realizados alguns estudos em plaquetas, utilizando-se anticorpos (10E5 e c7E3), que resultaram na descoberta de um complexo glicoproteico (GPIIb/IIIa) na superfície das mesmas8,9. A eficácia antitrombótica destes anticorpos (enfatizando-se o anticorpo c7E3) foi aprofundada posteriormente em estudos em animais de laboratório, verificando-se resultados positivos, embora quase sempre houvesse aumento no tempo de sangramento26-30.
Novos tipos de anticorpos monoclonais (AP-2, LJ-CP8 e YM207) também foram testados em animais com a intenção de verificar sua efetividade antitrombótica e as conseqüências hemostáticas. Foram constatados resultados semelhantes; existindo, entretanto, pequenas diferenças em relação às doses e tempos de sangramento31,32.
Inibidores Naturais
Inúmeras substâncias encontradas na natureza exercem atividade sobre os receptores GPIIb/IIIa. Peptídios contendo a seqüência RGD foram isolados de várias espécies de cobras, tendo sido denominados "disintegrinas" por sua capacidade de interferir na interação de ligantes com receptores da família das integrinas. Cada disintegrina recebe um nome derivado da espécie de cobra de onde foi retirada21-23,33,34. Em 1990, Musial et al. compararam as propriedades antiplaquetárias de quatro disintegrinas e um peptídio numa simulação de circulação extra-corpórea35. O estudo terminou por confirmar a hipótese da importância da interação fibrinogênio-GPIIb/IIIa para a adesão plaquetária, tema extensamente revisado na literatura36,37.
Outros estudos isolaram antagonistas GPIIb/IIIa de carrapatos (Variabilina) e sanguessugas (Decorsina). Estes antiagregantes, possuidores da seqüência RGD, inibiram a agregação plaquetária induzida por ADP e colágeno, interferindo na seqüência trombogênica38,39. Também foram encontrados inibidores plaquetários naturais sem a seqüência RGD, como a Barbourina, com menor potência inibitória sobre as integrinas34, e o peptídio Disagreguina40.
Peptídios
O Integrelin (Eptifibatide) é um heptapeptídio cíclico com alta afinidade por receptores GPIIb/IIIa que tem sido pesquisado como antagonista plaquetário. Em modelo canino, Nicolini et al. mostraram que a combinação de baixas doses de Integrelin e hirudina associadas ao r-tPA levou à recuperação completa do fluxo sangüíneo por 92±19 minutos (P<0,01 vs. todos os tratamentos) e reduziu a reoclusão em 25% (P<0,05)41.
Não-peptídios
O Tirofiban (MK-383) é um antagonista não-peptídico dos receptores GP IIb/IIIa derivado da Tirosina. Ele mimetiza a geometria, estereoatividade e características elétricas do RGD, interferindo na agregação plaquetária42. O tirofiban mostrou eficácia em modelos animais43 e mais recentemente em humanos, onde demonstrou uma inibição da agregação plaquetária e prolongamento dose-dependente do tempo de sangramento em homens normais44.
O Xemilofiban (SC-54684A) vem sendo estudado como antiagregante oral em animais e humanos. Seu fragmento ativo (SCa) mostrou ser um potente inibidor fibrinogênio específico, que bloqueia grande variedade de estímulos e tem boa biodisponibilidade oral em cães45. A utilização de doses repetidas por duas semanas garantiu efeitos antiagregantes previsíveis e reversíveis, sem sangramentos graves46.
O L-734,217 é um antagonista não-peptídico que imita a seqüência RGD encontrada no fibrinogênio. Foi observada atividade antiagregante dose-dependente após administração oral e endovenosa em animais, observando-se prevenção do infarto agudo do miocárdio e ectopia ventricular nos mesmos47.
O DMP 728, um ácido sintético, teve sua eficácia e especificidade avaliadas por Mousa e colegas48. Em modelo animal de trombose arterial na artéria coronária (modelo Folts) e carótida (induzido por corrente elétrica), a administração de DMP 728 mostrou potencial terapêutico como agente antitrombótico oral em distúrbios tromboembólicos, com efeito reversível sobre o tempo de sangramento49,50.
ENSAIOS CLÍNICOS
Abciximab (c7E3)
Em 1994, Tcheng et al. realizaram um estudo multicêntrico em pacientes submetidos à angioplastia coronariana de alto risco (n=56), visando elucidar alguns aspectos da farmacodinâmica do anticorpo c7E3. A dose estabelecida como suficiente para suprimir a atividade plaquetária foi de 0,25 mg/kg, a qual obteve bloqueio de mais de 80% dos receptores IIb/IIIa, assim como redução da agregação plaquetária para menos de 20%, apesar de ter-se obtido maior freqüência de sangramentos leves51. Um ano antes, Kleiman et al. já haviam demonstrado menor incidência de eventos isquêmicos em pacientes tratados com 0,20 mg/kg e 0,25mg/kg do anticorpo m7E352. Simoons et al., utilizando as doses de c7E3 determinadas por Tcheng, realizaram um pequeno ensaio clínico com 60 pacientes com angina instável, no qual verificou-se uma redução de 44% na isquemia recorrente após angioplastia no grupo tratado, sem aumento excessivo do sangramento53.
O grupo EPIC54 realizou um estudo randomizado, multicêntrico e duplo-cego com 2099 pacientes. Foram arrolados pacientes com angina instável ou infarto do miocárdio recente que seriam submetidos à angioplastia. Um grupo recebeu bolo e infusão de placebo, outro recebeu c7E3 em bolo mais infusão de placebo e o último grupo foi tratado com bolo e infusão de c7E3. Os desfechos foram morte, infarto do miocárdio não-fatal e a necessidade de uma revascularização de emergência durante os trinta primeiros dias. Observou-se uma redução significativa de 35% na ocorrência dos desfechos no grupo que recebeu bolo e infusão de c7E3 comparado ao placebo. Entretanto, este grupo apresentou também um aumento na taxa de sangramento e necessidade de transfusões de sangue. Em seis meses de follow-up, o benefício manteve-se com uma redução de 23% em qualquer tipo de evento isquêmico; no entanto, os sangramentos permaneceram maiores no grupo que recebeu bolo e infusão de c7E355.
O ensaio EPILOG56 foi delineado originalmente incluindo 4800 pacientes submetidos à angioplastia de alto e baixo risco, randomizados para receber dose padrão de heparina (bolo de 100 U/Kg) mais placebo, ou um dos dois tratamentos pesquisados: dose padrão de heparina mais c7E3 ou dose baixa de heparina (70 U/Kg) mais c7E3. Este último foi administrado em bolo 0,25mg/kg mais infusão 0,125mg/kg/min. Os desfechos primários foram morte, infarto do miocárdio ou necessidade urgente de revascularização. A análise parcial dos resultados, devido à eficácia prematura do tratamento, levou à interrupção do estudo com um total de 2792 pacientes57. O grupo que recebeu abciximab mais heparina em baixa dose obteve, em 30 dias, uma redução de 56% no desfecho composto, sem que houvesse um aumento substancial nas complicações hemorrágicas. Em seis meses de follow-up, manteve-se a redução das complicações isquêmicas após o tratamento com abciximab.
O ensaio CAPTURE58 foi originalmente delineado como um estudo multicêntrico utilizando c7E3 controlado por placebo em 1400 pacientes com angina instável refratária submetidos à angioplastia. Além de receberem aspirina e heparina, os pacientes foram tratados com bolo (0.25mg/Kg) mais infusão (10mg/min) de c7E3, iniciando 18 a 24hs antes do procedimento e continuando por até uma hora após o mesmo. A análise parcial dos resultados, mostrando resultados positivos, fez com que o estudo fosse interrompido com um total de 1265 pacientes57. Os pacientes tratados com abciximab tiveram, em 30 dias, uma taxa 29% mais baixa dos desfechos primários (morte, infarto do miocárdio ou reintervenção urgente) quando comparados aos pacientes do grupo placebo. A taxa de sangramento foi de 3,8% contra 1,9% no grupo placebo. Em seis meses, o efeito benéfico do c7E3 foi menos evidente. Verificou-se em um subgrupo de 332 pacientes deste ensaio clínico (através de ECG) que o tratamento com c7E3 estava associado à redução de isquemia recorrente e redução total de isquemia de sobrecarga (fatores preditores de infarto e morte)59.
Outro ensaio clínico, chamado RAPPORT60, randomizou 483 pacientes com infarto agudo do miocárdio (<12h) submetidos à angioplastia para receber placebo ou abciximab (bolo de 0,25mg/kg + infusão de 0,125mg/kg/min 12h). Houve uma redução significativa em 30 dias nos desfechos morte, reinfarto e revascularização de urgência. Por outro lado, observou-se que as taxas de sangramento foram excessivas, e que o desfecho primário de seis meses não foi devidamente afetado.
Segundo um estudo de 1995, os fatores de risco evidenciados para complicações hemorrágicas após angioplastia mais c7E3 foram idade avançada, infarto agudo do miocárdio (<12 horas), sexo feminino, baixo peso, maior duração do procedimento e pressão diastólica aumentada61.
Eptifibatide (Integrelin)
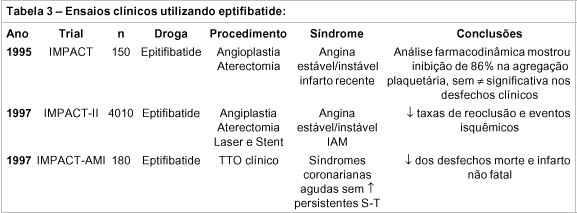
Em 1995, Tcheng et al. realizaram um estudo multicêntrico, randomizado, duplo-cego, controlado com placebo em 150 pacientes submetidos à angioplastia. O estudo levou o nome de IMPACT62 e foi o estudo-piloto sobre a droga Integrelin. Os resultados mostraram eficácia do integrelin em dose de 90 mg/kg (bolo) seguida de infusão de 1.0mg/kg/min (4-12 horas). Os desfechos finais (morte, infarto agudo do miocárdio, repetição de urgência da intervenção) representaram 4,1% contra 12% no grupo placebo, o que não foi significativamente diferente, assim como o índice de sangramento (47% contra 14% no placebo). Na mesma época, um pequeno estudo verificou que o integrelin na dose de 135mg/kg em bolo proporcionou inibição plaquetária de 80 a 90% em 75% dos pacientes63.
Devido a restrita amostragem do estudo anterior, investigou-se um grupo de 4010 pacientes submetidos à intervenção coronariana de alto e baixo risco (IMPACT-II)64. O grupo foi randomizado para receber placebo ou integrelin (0,50 ou 0,75mg/kg-min por 20 a 24 horas após 135mg/kg em bolo). O grupo que recebeu o antagonista demonstrou, nas primeiras 24 horas, redução de 30-35% nas complicações como morte, infarto agudo do miocárdio e repetição urgente do procedimento. O risco de hemorragia não se mostrou aumentado. Em follow-up de 30 dias, verificou-se redução da freqüência de infarto agudo do miocárdio em 22%, apesar de a eficácia mostrar-se reduzida em 13-19%. Nas primeiras 24hs, verificou-se maior efeito nos pacientes eletivos em relação aos de alto risco, o que não ocorreu no follow-up de 30 dias. Este estudo verificou que os pacientes que receberam uma maior dose do fármaco não apresentaram um melhor benefício se comparados com os de menor dose. Da mesma forma, estes últimos (menor dose) não apresentaram menor índice de sangramento se comparados com os de maior dose.
Os investigadores do IMPACT-AMI65 arrolaram 142 pacientes com menos de 6hs no início de infarto agudo do miocárdio para receber dose em bolo mais infusão contínua de 1 de 6 doses de integrelin ou placebo. Outros 48 pacientes foram randomizados para receberem a dose mais alta de integrelin da etapa anterior ou placebo. Todos os pacientes receberam alteplase. Os grupos de maior dose da droga obtiveram uma reperfusão mais completa (TIMI nível 3, 66% vs 39% no placebo) e menor tempo de recuperação do segmento S-T (65 vs 116 minutos no placebo). A incidência de desfechos clínicos e sangramento severo foi similar nos grupos tratados e placebo.
No ensaio clínico chamado PURSUIT66, investigou-se o benefício do integrelin adicionado à terapia padrão nas síndromes coronarianas agudas sem elevação persistente do segmento S-T. Um total de 10.948 pacientes foi randomizado para receber dose em bolo (180mg/kg) mais infusão (1,3 ou 2,0 mg/kg/min) de integrelin ou placebo. Em relação ao placebo, o grupo que recebeu o fármaco teve uma redução absoluta de 1,5% na incidência do desfecho composto (morte e IAM). Apesar de mais comuns no grupo do integrelin, as complicações hemorrágicas não contribuíram para o risco de AVC hemorrágico.
O integrelin também teve seu efeito avaliado em relação a angina instável num estudo multicêntrico randomizado controlado por placebo com uma amostra de 227 pacientes. Os pacientes foram separados em três grupos (placebo, integrelin dose alta, integrelin dose baixa), sendo que todos receberam heparina endovenosa. O grupo de alta dose de integrelin (90mg/kg-bolo + 1.0mg/kg/min-infusão) experimentou menor número de episódios isquêmicos comparado com placebo, e com menor duração (monitorizado por Holter). Não houve diferença significativa entre os eventos hemorrágicos nos três grupos67.
Tirofiban
O RESTORE68 foi um estudo que randomizou 2141 pacientes submetidos à angioplastia com balão ou aterectomia para receber Tirofiban em dose bolo (10 mg/kg) mais infusão de 36h (0.15 mg/kg/min por 12hs mais 0,10 mg/kg/min por 24hs). A novidade deste ensaio foi a infusão de antagonista por 36hs. A eficácia no segundo dia foi altamente significativa, com 38% de redução relativa nos desfechos clínicos no grupo tratado. Entretanto, após 30 dias, metade da redução relativa havia sido perdida, ficando em 16%. Apesar disso, houve um benefício relativo em todos os subgrupos de pacientes tratados com o antiagregante. O regime de dose deste agente foi estabelecido previamente a este estudo, verificando-se rápida e profunda inibição da agregação plaquetária (90%) e baixo risco de hemorragia69.
O estudo PRISM70 consistiu na randomização de 3232 pacientes com sintomas de angina instável, que já estavam recebendo aspirina, para receberem tirofiban ou heparina por 48hs. A incidência do desfecho primário (morte, IAM ou isquemia refratária) em 48hs foi 32% mais baixa no grupo que recebeu tirofiban (3,8% vs. 5,6% com heparina). Em 30 dias, o benefício do tirofiban em relação aos desfechos estava menos evidente (15,9% vs 17,1% com heparina); entretanto, a mortalidade estava significativamente menor no grupo antagonista IIb/IIIa (2,3% vs 3,6% com heparina). Não houve diferença no risco de complicações hemorrágicas. O PRISM-PLUS71 acrescentou ao estudo anterior um braço com tirofiban mais heparina (além de heparina ou tirofiban) em 1915 pacientes com angina instável ou IAM sem onda Q. O grupo que recebeu tirofiban sozinho foi interrompido devido à alta mortalidade. Em sete dias, a incidência de morte, IAM ou isquemia refratária foi menor no grupo tirofiban+heparina (12,9 vs 17,9% no grupo da heparina). Esta diferença persistiu em 30 dias e em seis meses. Embora os sangramentos graves fossem mais freqüentes no grupo tirofiban+heparina, não houve significância estatística.
Lamifiban
Um estudo canadense serviu de piloto na avaliação do antagonista IIb/IIIa lamifiban em pacientes com angina instável. Uma amostra de 365 pacientes foi randomizada para receber uma das 4 diferentes doses de infusão do não-peptídio (1, 2, 4, 5 mg/min) ou placebo. O risco de desfechos clínicos (morte, IAM, revascularização urgente) durante o período de infusão foi reduzido de 8,1 para 3,3% (P=0,04) no grupo do fármaco. Em um mês, os desfechos ocorreram em 8,1% dos pacientes no grupo placebo e 2,5% no grupo do antagonista (altas doses). A ocorrência de pequenos sangramentos foi maior no grupo tratado (P=0,02)72. O PARADIGM73 estudou 353 pacientes com IAM com elevação do segmento S-T. Na fase A, 30 pacientes receberam lamifiban em um esquema de escala de doses para definir a dose mais eficaz (85-95% inibição). Na fase B, houve randomização dos pacientes para placebo ou lamifiban (bolo+infusão 24h), e, na fase C, a infusão prolongou-se até 48 horas. A agregação plaquetária foi inibida de forma dose-dependente, sendo que as altas doses excederam 85%. Houve mais sangramento associado à droga (transfusões 16,1% vs 10,3% no placebo). O antagonista provocou reperfusão mais rápida em relação ao placebo, de acordo com os parâmetros eletrocardiográficos.
Os investigadores do ensaio PARAGON74 randomizaram 2282 pacientes com angina instável ou IAM sem onda Q para receberem lamifiban (1mg/min com e sem heparina vs 5 mg/min com e sem heparina) ou placebo. Em 30 dias, a incidência de morte ou IAM foi semelhante entre os grupos do antagonista IIb/IIIa e o grupo placebo. Em seis meses, no entanto, a incidência foi notavelmente menor no grupo que recebeu lamifiban em baixas doses (13,7% vs 17,9% no placebo), sendo que a taxa de sangramento foi similar à do grupo controle, e ainda com menos efeitos isquêmicos.
Xemilofiban
A ação antiagregante do xemilofiban, um antagonista oral não-peptídio do receptor IIb/IIIa, foi analisada em um pequeno ensaio com uma amostra de 74 pacientes submetidos à colocação de "stent". Deste grupo, 17 pacientes receberam abciximab durante a angioplastia (bolo+infusão). O pacientes foram randomizados para receber xemilofiban oral (5, 10, 15 ou 20 mg) ou placebo (receberam ticlopidina 250 mg) após o procedimento. Foi observado que o efeito antiagregante da droga estudada foi maior e mais duradouro nos pacientes previamente tratados com abciximab, não ocorrendo nenhum episódio significativo de hemorragia75. Os investigadores do estudo ORBIT76 randomizaram 549 pacientes submetidos à angioplastia para receber xemilofiban (15 ou 20 mg) ou placebo (receberam ticlopidina 250 mg). O antagonista gerou níveis de inibição da agregação plaquetária similares em 14 e 28 dias. Houve uma tendência, em três meses, para uma redução nos eventos cardiovasculares nos pacientes que receberam a maior dose de xemilofiban (naqueles que não receberam abciximab durante o procedimento). Em outro estudo, 30 pacientes submetidos a intervenções coronarianas foram randomizados para placebo ou xemilofiban oral (35 mg antes e 20-25 mg durante 30 dias após o procedimento). A agregação plaquetária após 2 horas da dose inicial e 2 e 4 semanas mais tarde foi 15%, 8% e 11% no grupo do antagonista, e 80%, 68% e 69% no grupo placebo77.
Sibrafiban
Um antagonista oral do receptor IIb/IIIa, o sibrafiban, foi estudado pelos investigadores do TIMI 1278. Um grupo de 106 pacientes (coorte farmacocinética e dinâmica) com síndromes coronarianas agudas foi randomizado e recebeu um de sete regimes da droga em questão durante 28 dias. Numa segunda fase, 223 pacientes (coorte de segurança) receberam randomicamente um de quatro regimes do antagonista ou aspirina. Nos sete grupos da primeira fase, houve inibição da agregação plaquetária de 47 a 97%. A dose dupla diária promoveu maior inibição, entretanto, apenas a dose única diária resultou em retorno aos níveis basais em 24 horas. A taxa de hemorragia grave foi de 1,5% no grupo da droga estudada e 1,9% no grupo da aspirina.
O estudo SYMPHONY79 foi um ensaio clínico que arrolou 9.233 pacientes com síndrome coronariana aguda, que foram randomizados para receber um dos seguintes tratamentos: Aspirina 80mg, Sibrafiban em baixa dose ou Sibrafiban em alta dose. O desfecho primário constituiu-se de morte, IAM e isquemia recorrente em 90 dias. Não houve diferença significativa na freqüência do desfecho composto entre os três grupos estudados. Além disso, houve um excesso de complicações hemorrágicas dose-dependente no grupo que recebeu Sibrafiban em comparação ao que recebeu aspirina. O presente estudo não mostrou evidência que justifique o uso desse agente inibidor da glicoproteína IIb/IIIa em episódios coronarianos agudos. Entretanto, novos estudos devem ser realizados para orientar a utilização destes agentes.
Orbofiban
Recentemente, os resultados de um grande ensaio clínico utilizando um inibidor oral do receptor IIb/IIIa (Orbofiban) foram apresentados em congresso. O OPUS-TIMI 1680 foi um estudo que randomizou 10.302 pacientes, apresentando síndrome coronariana aguda, para receber placebo, Orbofiban 50mg b.i.d. ou Orbofiban 50mg durante 30 dias seguidos de 30mg b.i.d.. O estudo foi interrompido precocemente devido ao aumento da mortalidade em um dos braços de tratamento (possivelmente provocado pelo aumento dos eventos trombóticos). Houve uma redução não significativa de 11% na ocorrência do desfecho primário (morte, IAM e revascularização de urgência, em 30 dias), sendo que, no seguimento de 300 dias, houve um aumento no risco de sangramento, incluindo sangramentos maiores e severos. Esses resultados falam contra o uso a longo prazo (30 dias) desse agente oral em síndromes coronarianas agudas.
Lefradafiban
A inibição da agregação plaquetária gerada pelo fradafiban, um antagonista não peptídio do receptor IIb/IIIa, e de sua prodroga oral, o lefradafiban, foram estudadas em 130 homens saudáveis. Verificou-se que a administração oral de lefradafiban manteve o potente antagonismo de fradafiban durante uma semana sem perda da atividade antiplaquetária81.
CONCLUSÃO
Após a verificação da importância do papel das plaquetas no desenvolvimento de doenças cardiovasculares, iniciou-se a investigação de drogas capazes de atuar na função plaquetária. A intervenção farmacológica em nível dos receptores GP IIb/IIIa, via final comum da agregação plaquetária, parece ser uma alternativa promissora. Os resultados de grandes estudos demonstraram que a utilização de Abciximab em pacientes submetidos à angioplastia foi eficaz na redução de eventos mórbidos. Em relação ao uso dos bloqueadores GP IIb/IIIa para o tratamento das síndromes coronarianas agudas, os resultados de vários estudos inclinam-se para um efeito favorável, embora uma melhor investigação seja necessária quanto à dosagem e duração do tratamento para os antagonistas averiguados. A associação dos bloqueadores GP IIb/IIIa à terapia trombolítica no IAM pode ser benéfica, porém merece melhor definição científica. Finalmente, estão sendo desenvolvidos bloqueadores GP IIb/IIIa para o uso oral, e o seu estudo nas síndromes cardíacas pode resultar em um importante avanço nesta área. Estas pendências devem ser esclarecidas após a publicação de alguns estudos clínicos de grande magnitude, que estão, atualmente, em andamento.
- 1. Antiplatelet Trialists' Collaboration. Collaborative overview of randomised trials of antiplatelet therapy - I: Prevention of death, myocardial infarction, and stroke by prolonged antiplatelet therapy in various categories of patients. BMJ 1994;308:81-106.
- 2. Wannmacher L. Farmacologia clínica da inflamação. In: Fuchs F, Wannmacher L, eds. Farmacologia clínica - Fundamentos da terapêutica racional. Rio de Janeiro: Guanabara Koogan, 1992: 149-171.
- 3. Hynes R. Integrins: a family of cell surface receptors. Cell 1987;48:549-54.
- 4. Phillips D, Charo I, Parise L, Fitzgerald L. The platelet membrane glycoprotein IIb-IIIa complex. Blood 1988;71(4): 831-43.
- 5. Jennings L, Phillips D. Purification of glycoproteins IIb and III from human platelet plasma membranes and characterization of a calcium-dependent glycoprotein IIb-III complex. J Biol Chem 1982;257(17):10458-66.
- 6. Matsuno H, Stassen J, Vermylen J, Deckmyn H. Inhibition of integrin function by a cyclic RGD-containing peptide prevents neointima formation. Circulation 1994;90:2203-06.
- 7. Padoin E, Alexandre A, Cavallini L, Laureto P, Rao G, Doni M. Human platelet activation is inhibited by the occupancy of glycoprotein IIb/IIIa receptor. Arch Biochem Biophys 1996; 333(2):407-13.
- 8. Coller B, Peerschke E, Scudder L, Sullivan C. A murine monoclonal antibody that completely blocks the binding of the fibrinogen to platelets produces a thrombasthenic-like state in normal platelets and binds to glycoproteins IIb and/or IIIa. J Clin Invest 1983;72:325-38.
- 9. Coller B. A new murine monoclonal antibody reports an activation-dependent change in the conformation and/or microenvironment of the platelet glycoprotein IIb/IIIa complex. J Clin Invest 1985;76:101-8.
- 10. Junqueira I, Carneiro J. Células do Sangue. In: Junqueira I, Carneiro J, eds. Histologia Básica. 8 ed. Rio de Janeiro: Guanabara Koogan, 1995.
- 11. Hantgan R, Hindriks G, Taylor R, Sixma J, de Groot P. Glycoprotein Ib, von Willebrand factor, and glycoprotein IIb:IIIa are all involved in platelet adhesion to fibrin in flowing whole blood. Blood 1990;76(2):345-53.
- 12. Wencel-Drake J, Boudignon-Proudhon C, Dieter M, Criss A, Parise L. Internalization of bound fibrinogen modulates platelet aggregation. Blood 1996;87(2):602-12.
- 13. Plow E, McEver R, Coller B, Woods V, Marguerie G, Ginsberg M. Related binding machanisms for fibrinogen, fibronectin, von Willebrand factor, and thrombospondin on thrombin-stimulated human platelets. Blood 1985;66(3):724-27.
- 14. Coller B. Platelets and thrombolytic therapy. N Engl J Med 1990;322(1):33-42.
- 15. Lefkovits J, Plow E, Topol E. Platelet glycoprotein IIb/IIIa receptors in cardiovascular medicine. N Engl J Med 1995;332 (23) :1553-59.
- 16. Jang Y, Lincoff M, Plow E, Topol E. Cell adhesion molecules in coronary artery disease. J Am Coll Cardiol 1994;24 (1591-601).
- 17. Ruoslahti E, Pierschbacher M. Arg-Gly-Asp: a versatile cell recognition signal. Cell 1986;44: 517-18.
- 18. Plow E, Pierschbacher M, Ruoslahti E, Marguerie G, Ginsberg M. Arginyl-Glycil-Aspartic acid sequences and fibrinogen binding to platelets. Blood 1987;70(1): 110-15.
- 19. Ruoslahti E, Pierschbacher M. New perspectives in cell adhesion: RGD and integrins. Science 1987;238: 491-97.
- 20. Plow E, Pierschbacher M, Ruoslahti E, Marguerie G, Ginsberg M. The effect of arg-gly-asp-containing peptides on fibrinogen and von Willebrand factor binding to platelets. Proc Natl Acad Sci 1985;82: 8057-61.
- 21. McLane M, Vijai-Kumar S, Marcinkiewicz C, Calvete J, Niewiarowski S. Importance of the structure of the RGD-containing loop in the disintegrins echistatin and eristostatin for recognition of alfa IIb beta3 and alfa v beta3 integrins. FEBS 1996;391: 139-143.
- 22. Scaloni A, Di martino E, Miraglia N, et al. Amino acid sequence and molecular modelling of glycoprotein IIb-IIIa and fibronectin receptor iso-antagonists from Trimeresurus Elegans venom. Biochem J 1996;319: 775-82.
- 23. Scarborough R, Rose J, Naughton M, et al. Charcterization of the integrin specificities of disintegrins isoled from american pit viper venoms. J Biol Chem 1993;268: 1058-65.
- 24. Leytin V, Shapiro H, Novikov I, Radnay J. Flow cytometric analysis of the platelet surface area and surface density of glycoprotein IIb-IIIa of unactivated human platelets of various sizes. Biochem Biophys Res Commun 1996;226(1): 94-100.
- 25. Ferns G, Raines E, Sprugel K, Motani A, Reidy M, Ross R. Inhibition of neointimal smooth muscle accumulation after angioplasty by an antibody to PDGF. Science 1991;253: 1129-32.
- 26. Coller B, Folts J, Scudder L, Smith S. Antithrombotic effect of monoclonal antibody to the platelet glycoprotein IIb/IIIa receptor in an experimental animal model. Blood 1986;68: 783-86.
- 27. Coller B, Folts J, Smith S, Scudder L, Jordan R. Abolition of in vivo platelet thrombus formation in primates with monoclonal antibodies to the platelet GP IIb/IIIa receptor. Circulation 1989;80: 1766-74.
- 28. Gold H, Coller B, Yasuda T, et al. Rapid and sustained coronary artery recanalization with combined bolus injection of recombinant tissue-type plasminogen activator and monoclonal antiplatelet GP IIb/IIIa antibody in a canine preparation. Circulation 1988;77: 670-77.
- 29. Yasuda T, Gold H, Leinbach R, et al Lysis of plasminogen activator-resistant platelet-rich coronary artery thrombus with combined bolus injection of recombinant tissue-type plasminogen activator and antiplatelet GP IIb/IIIa antibody. J Am Coll Cardiol 1990;16: 1728-35.
- 30. Shetler T, Crowe V, Bailey B, Jackson C. Anithrombotic assesment of the effects of combination therapy with the anticoagulants efegatran and heparin and the glycoprotein IIb-IIIa platelet receptor antagonist 7E3 in a canine model of coronary artery thrombosis. Circulation 1996;94: 1719-25.
- 31. Hanson S, Pareti F, Ruggeri Z, et al. Effects of monoclonal antibodies against the platelet glycoprotein IIb/IIIa complex on thrombosis and hemostasis in the baboon. J Clin Invest 1988;81: 149-58.
- 32. Kaku S, Kawasaki T, Sakai Y, et al Antithrombotic effect of a humanized anti-GP IIb/IIIa monoclonal antibody, YM 207, in a photochemically induced thrombosis model in monkeys. Eur J Pharmacol 1995;279: 115-21.
- 33. Dennis M, Hensel W, Pitti R. Platelet glycoprotein IIb/IIIa protein antagonists from snake venoms: evidence for a family of platelet-aggregation inhibitors. Proc Natl Acad Sci 1990;87: 2471-75.
- 34. Scarborough R, Rose J, Hsu M, et al. Barbourin - A GPIIb-IIIa-specific integrin antagonist from the venom of Sistrurus m. barbouri. J Biol Chem 1991;266: 9359-62.
- 35. Musial J, Niewiarowski S, Rucinski B, et al. Inhibition of platelet adhesion to surface of extracorporeal circuits by disintegrins. RGD-containing peptides from viper venoms. Circulation 1990;82: 261-73.
- 36. Hennessy V, Hicks R, Niewiarowski S, Edmunds L, Colman R. Function of human platelets during extracorporeal circulation. Am J Physiol 1977;232: H622-H628.
- 37. Gluszko P, Rucinski B, Musial J, et al Fibrinogen receptors in platelet adhesion to surfaces of extracorporeal circuit. Am J Physiol 1987;252: H615-H621.
- 38. Wang X, Coons L, Taylor D, Stevens Jr. S, Gartner T. Variabilin, a novel RGD-containing antagonist of glycoprotein IIb-IIIa and platelet aggregation inhibitior from the hard tick Dermacentor variabilis. J Biol Chem 1996;271: 17785-90.
- 39. Seymour J, Henzel W, Nevins B, Stults J, Lazarus R. Decorsin. A potent glycoprotein IIb-IIIa antagonist and platelet aggregation inhibitor from the leech Macrobdella decora. J Biol Chem 1990;265(17): 10143-47.
- 40. Karczewski J, Endris R, Connolly T. Disagregin is a fibrinogen receptor antagonist lacking the arg-gly-asp sequence from the tick, Ornithodoros moubata. J Biol Chem 1994;269: 6702-08.
- 41. Nicolini F, Lee P, Rios G, Kottke-Marchant K, Topol E. Combination of platelet fibrinogen receptor antagonist and direct thrombin inhibitor at low doses markedly improves thrombolysis. Circulation 1994;89: 1802-09.
- 42. Tcheng J. Glycoprotein IIb/IIIa receptor inhibitors: putting the EPIC, IMPACT-II, RESTORE, and EPILOG trials into perspective. Am J Cardiol 1996;78 (suppl 3A):35-40.
- 43. Lynch Jr. J, Cook J, Sitko G, et al Nonpeptide glycoprotein IIb/IIIa inhibitors. 5. Antithrombotic effects of MK-0383. JPET 1995;272(1): 20-32.
- 44. Peerlinck K, De Lepeleire I, Goldberg M, et al. MK-383 (L-700,462), a selective nonpeptide platelet glycoprotein IIb/IIIa antagonist, is active in man. Circulation 1993;88 (part 1): 1512-17.
- 45. Szalony J, Haas N, Salyers A, et al. Extended inhibition of platelet aggregation with the orally active platelet inhibitor SC-54684A. Circulation 1995;91:411-16.
- 46. Nicholson N, Panzer-Knodle S, Sallyers A, et al SC-54684A: an orally active inhibitor of platelet aggregation. Circulation 1995;91:403-10.
- 47. Cook J, Holahan M, Lyle E, et al. Nonpeptide glycoprotein IIb/IIIa inhibitors. 8. Antiplatelet activity and oral antithrombotic efficacy of L-734, 217. JPET 1996;278: 62-73.
- 48. Mousa S, Bozarth J, Forsythe M, et al Antiplatelet efficacy and specificity of DMP 728, a novel platelet GP IIb/IIIa receptor antagonist. Cardiology 1993;83: 374-82.
- 49. Mousa S, DeGrado W, Jackson S, Thoolen M. Antiplatelet efficacy and safety of the platelet GP IIb/IIIa antagonist, DMP 728, in anesthetized dogs. Circulation 1993;88 (Suppl II):I-319.
- 50. Mousa S, DeGrado W, Mu D, Kapil R, Lucchesi B, Reilly T. Oral antiplatelet, antithrombotic efficacy of DMP 728, a novel platelet GP IIb/IIIa antagonist. Circulation 1996;93: 537-43.
- 51. Tcheng J, Ellis S, George B, et al. Pharmacodynamics of chimeric glycoprotein IIb/IIIa integrin aniplatelet antibody fab 7E3 in high-risk coronary angioplasty. Circulation 1994; 90: 1757-64.
- 52. Kleiman N, Ohman M, Califf R, et al. Profound inhibition of platelet aggregation with monoclonal antibody 7E3 Fab after thrombolytic therapy. Results of the thrombolysis and angioplasty in myocardial infarction (TAMI) 8 pilot study. J Am Coll Cardiol 1993;22: 381-9.
- 53. Simoons M, de Boer M, van den Brand M, et al Randomized trial of a GPIIb/IIIa platelet receptor blocker in refractory unstable angina. Circulation 1994;89:596-603.
- 54. The EPIC investigators. Use of a monoclonal antibody directed against the platelet glycoprotein IIb/IIIa receptor in high-risk coronary angioplasty. N Engl J Med 1994;330: 956-61.
- 55. Topol E, Califf R, Weisman H, et al Randomised trial of coronary intervention with antibody against platelet IIb/IIIa integrin for reduction of clinical restenosis: results at six months. Lancet 1994;343: 881-86.
- 56. The EPILOG investigators. Platelet glycoprotein IIb/IIIa receptor blockade and low-dose heparin during percutaneous coronary revascularization. N Engl J Med 1997;336: 1689-96.
- 57. Ferguson J. EPILOG and CAPTURE trials halted because of positive interim results. Circulation 1996;93: 637.
- 58. The CAPTURE investigators. Randomised placebo-controlled trial of abciximab before and during coronary intervention in refractory unstable angina: the CAPTURE study. Lancet 1997;349:1429-35.
- 59. Klootwijk P, Meij S, Melkert R, Lenderink T, Simoons M. Reduction of current isquemia with abciximab during continuous ECG-ischemia monitoring in patients with unstable angina refractory to standard treatment (CAPTURE). Circulation 1998;14:1358-64.
- 60. Brener S, Barr L, Burchenal J, et al. Randomized, placebo-controlled trial of platelet glycoprotein IIb/IIIa blockade with primary angioplasty for acute myocardial infarction. Circulation 1998;98:734-41.
- 61. Aguirre F, Topol E, Ferguson J, et al. Bleeding complications with the chimeric antibody to platelet glycoprotein IIb/IIIa integrin in patients undergoing percutaneous coronary intervention. Circulation 1995;91:2882-90.
- 62. Tcheng J, Harrington R, Kottke-Marchant K, et al. Multicenter, randomized, double-blind, placebo-controlled trial of the platelet integrin glycoprotein IIb/IIIa blocker integrelin in elective coronary intervention. Circulation 1995;91:2151-57.
- 63. Harrington R, Kleiman N, Kottke-Marchant K, et al Immediate and reversible platelet ingibition after intravenous administration of a peptide glycoprotein IIb/IIIa inhibitor during percutaneous coronary intervention. Am J Cardiol 1995;76: 1222-27.
- 64. The IMPACT-II investigators. Randomised placebo-controlled trial of effect of eptifibatide on complications of percutaneous coronary intervention: IMPACT-II. Lancet 1997;349: 1422-28.
- 65. Ohman E, Kleiman N, Gacioch G, et al. Combined accelerated tissue-plasminogen activator and platelet glycoprotein IIb/IIIa integrin receptor blockade with integrilin in acute myocardial infarction. Results of a randomized, placebo-controlled, dose-ranging trial. Circulation 1997;95: 846-54.
- 66. The PURSUIT trial investigators. Ingibition of platelet glycoprotein IIb/IIIa with eptifibatide in patients with acute coronary syndromes. N Engl J Med 1998;339: 436-43.
- 67. Schulman S, Goldschmidt-Clermont P, Topol E, Califf R. Effects of integrelin, a platelet glycoprotein IIb/IIIa receptor antagonist, in ustable angina. Circulation 1996;94: 2083-89.
- 68. The RESTORE investigators. Effects of platelet glycoprotein IIb/IIIa blockade with tirofiban on adverse cardiac events in patients with unstable angina or acute myocardial infarction undergoing coronary angioplasty. Circulation 1997;96: 1445-53.
- 69. Kereiakes D, Kleiman N, Ambrose J, et al. Randomized, double-blind, placebo-controlled dose-ranging study of tirofiban (MK-383) platelet IIb/IIIa blockade in high risk patients undergoing coronary angioplasty. J Am Coll Cardiol 1996;27: 536-42.
- 70. The PRISM investigators. A comparison of aspirin plus tirofiban with aspirin plus heparin for unstable angina. N Engl J Med 1998;338: 1498-505.
- 71. The PRISM-PLUS Study Investigators. Inhibition of the platelet glycoprotein IIb/IIIa receptor with tirofiban in unstable angina and non-Q wave myocardial infarction. N Engl J Med 1998;338: 1488-97.
- 72. Théroux P, Kouz S, Roy L, et al Platelet membrane receptor glycoprotein IIb/IIIa antagonism in unstable angina. The canadian lamifiban study. Circulation 1996;94: 899-905.
- 73. The PARADIGM investigators. Inhibitor lamifiban: results of the platelet aggregation receptor antagonist dose investigation and reperfusion gain in myocardial infarction (PARADIGM) trial. J Am Coll Cardiol 1998;32: 2003-10.
- 74. The PARAGON investigators. International, randomized, controlled trial of lamifiban (a platelet glycoprotein IIb/IIIa inhibitor), heparin, or both in unstable angina. Circulation 1998;97: 2386-95.
- 75. Kereiakes D, Runyon J, Kleiman N, et al Differential dose-response to oral xemilofiban after antecedent intravenous abciximab. Administration for complex coronary intervention. Circulation 1996;94: 906-10.
- 76. Kereiakes D, Kleiman N, Ferguson J, et al. Pharmacodynamic efficacy, clinical safety, and outcomes after prolonged platelet glycoprotein IIb/IIIa receptor blockade with oral xemilofiban. Results of a multicenter, placebo-controlled, randomized trial. Circulation 1998;98: 1268-78.
- 77. Simpfendorfer C, Kottke-Marchant K, Lowrie M, et al. First chronic platelet glycoprotein IIb/IIIa integrin blockade. A randomized, placebo-controlled pilot study of xemilofiban in unstable angina with percutaneous coronary interventions. Circulation 1997;96: 76-81.
- 78. Cannon C, McCabe C, Borzak S, et al. Randomized trial of an oral platelet glycoprotein IIb/IIIa antagonist, sibrafiban, in patients after an acute coronary syndrome. Results of the TIMI 12 trial. Circulation 1998;97: 340-49.
- 79. The SYMPHONY Investigators. Comparison of sibrafiban with aspirin for prevention of cardiovascular events after acute coronary syndromes: a randomised trial. Lancet 2000; 355(9201):337-45.
- 80. Morris D. Results from late-breaking clinical trials sessions at ACCIS`99 and ACC`99. JACC 1999;34(1):1-8.
- 81. Müller T, Weisenberger H, Brickl R, Narjes H, Himmelsbach F, Krause J. Profound and sustained inhibition of platelet aggregation by fradafiban, a nonpeptide platelet glycoprotein IIb/IIIa antagonist, and its orally active prodrug, lefradafiban, in men. Circulation 1997;96:1130-38.
Datas de Publicação
-
Publicação nesta coleção
16 Nov 2000 -
Data do Fascículo
Set 2000