Resumos
OBJETIVO: Investigar no pulmão, por imunohistoquímica, a localização das proteínas TGFbeta1 latente e TGFbeta1 ativa, se ocorre ativação radioinduzida da proteína TGFbeta1 latente e a distribuição das fibras colágenas em diversos períodos de tempo após irradiação. MÉTODOS: 32 camundongos isogênicos (C57BL) foram divididos em dois grupos: GI (não irradiado) com 12 animais e GII (irradiado) com 20 animais. Os animais do GII receberam radiação gama (telecobaltoterapia, 60Co, com rendimento de 0,97Gy/min, dose única de 7Gy em corpo inteiro). Os camundongos dos grupos I e II foram sacrificados por estiramento cervical nos períodos de 1, 14, 30 e 90 dias após irradiação. RESULTADOS: Os pulmões irradiados apresentaram: 1) congestão vascular e espessamento dos septos alveolares aos 30 dias e mais intensamente aos 90 dias depois da irradiação; 2) aumento significante da deposição de colágeno em todos os períodos de tempo após irradiação; 3) fraca ativação da proteína TGFbeta1 latente em um dia e intensa aos 14 dias depois da irradiação em brônquios e alvéolos. Nossos resultados sugerem que células dos brônquios e alvéolos podem participar do complexo mecanismo de fibrose pulmonar radioinduzida atuando como fontes da proteína TGFbeta1 ativa.
Radiação ionizante; Fibrose pulmonar; Fator beta de transformação do crescimento (TGFbeta)
PURPOSE: assess the latent and active TGFb1 localization in the lung, whether or not radiation induces latent TGFbeta1 activation, and the distribution of collagen fibers in the irradiated lung. METHODS: Thirty two C57BL mice were randomly assigned in two groups: GI (non irradiated animals) and GII (irradiated animals). The mice from GII received a single whole <FONT FACE=Symbol>¾</FONT> body radiation dose of 7Gy, using a 60Co source at a dose rate of 0.97 Gy/min. They were sacrificed by cervical dislocation at 1, 14, 30 and 90 days after radiation. RESULTS: The irradiated lungs showed: 1) vascular congestion and thickness of the alveolar septa 30 days and more intense 90 days after irradiation; 2) significant increase of collagen deposition in all time periods after irradiation; 3) weak latent TGFbeta1 activation 1 day and strong activation 14 days after irradiation in the bronchi and alveoli. Our results suggest that some bronchial and alveolar cells may have a role in the complex process of radiation-induced lung fibrosis acting as cellular sources of active TGFbeta.
Ionizing radiation; Lung fibrosis; Transforming growth factor b (TGFbeta)
Artigo Original
ATIVAÇÃO DA PROTEÍNA TGFbI LATENTE EM PULMÃO IRRADIADO IN VIVO
MARCOS DUARTE MATTOS, EDNA TERUKO KIMURA, MARIA REGINA RÉGIS SILVA, MIZUE IMOTO EGAMI, ROBERTO ARAÚJO SEGRETO, HELENA REGINA COMODO SEGRETO* * Correspondência: Rua Botucatu, 740 CEP: 04023-900 ¾ São Paulo ¾ SP
Trabalho realizado no Laboratório de Radioterapia Experimental Prof. Dr. Camillo Segreto ¾ Setor de Radioterapia do Departamento de Medicina da Universidade Federal de São Paulo, São Paulo, SP
RESUMO ¾ OBJETIVO: Investigar no pulmão, por imunohistoquímica, a localização das proteínas TGFb1 latente e TGFb1 ativa, se ocorre ativação radioinduzida da proteína TGFb1 latente e a distribuição das fibras colágenas em diversos períodos de tempo após irradiação.
MÉTODOS: 32 camundongos isogênicos (C57BL) foram divididos em dois grupos: GI (não irradiado) com 12 animais e GII (irradiado) com 20 animais. Os animais do GII receberam radiação gama (telecobaltoterapia, 60Co, com rendimento de 0,97Gy/min, dose única de 7Gy em corpo inteiro). Os camundongos dos grupos I e II foram sacrificados por estiramento cervical nos períodos de 1, 14, 30 e 90 dias após irradiação.
RESULTADOS: Os pulmões irradiados apresentaram: 1) congestão vascular e espessamento dos septos alveolares aos 30 dias e mais intensamente aos 90 dias depois da irradiação; 2) aumento significante da deposição de colágeno em todos os períodos de tempo após irradiação; 3) fraca ativação da proteína TGFb1 latente em um dia e intensa aos 14 dias depois da irradiação em brônquios e alvéolos. Nossos resultados sugerem que células dos brônquios e alvéolos podem participar do complexo mecanismo de fibrose pulmonar radioinduzida atuando como fontes da proteína TGFb1 ativa.
UNITERMOS: Radiação ionizante. Fibrose pulmonar. Fator b de transformação do crescimento (TGFb).
INTRODUÇÃO
A radiossensibilidade pulmonar e a formação de fibrose radioinduzida são importantes fatores a serem considerados nas irradiações torácicas localizadas em campos restritos bem como na irradiação de corpo inteiro1,2.
A resposta do pulmão à radiação depende do volume do órgão irradiado1, dose total3,4, fracionamento da dose1,5 e da taxa de dose utilizada(6,7). Dessa forma, as alterações histopatológicas observadas no pulmão irradiado podem variar desde edema e congestão da parede alveolar até a deposição de fibras colágenas e fibrose pulmonar3,8.
Quanto ao mecanismo da fibrose pulmonar radioinduzida, o fator b de transformação do crescimento, TGFb, parece exercer um papel importante no processo. A TGFb é uma citoquina multifuncional envolvida no controle da proliferação e diferenciação celular9. Promove inibição da proliferação de células do tecido conjuntivo10,11 e diminuição da degradação do colágeno12. Parte da resposta fibrótica induzida pelo TGFb parece estar relacionada com a modulação do sistema fibroblasto/fibrócito, levando ao acúmulo de colágeno tipo I e tipo III13-15. Em células de mamíferos, a TGFb está presente sob três isoformas, TGFb1, TGFb2 e TGFb3, sendo as proteínas produzidas na forma inativa e ligadas ao peptídeo associado à latência (LAP)10,16-18. Dessa forma, a atividade biológica desta proteína depende da dissociação da TGFb madura do complexo latente19. In vivo, são ativadas por proteases que clivam o complexo latente, e a plasmina é uma das proteases envolvidas no processo de ativação20.
Observou-se ativação da proteína TGFb1 em células da glândula mamária, horas depois da irradiação19. Por outro lado, é relatado na literatura a presença da proteína TGFb1 em pneumócitos tipo II de ratos, após irradiação com diferentes doses iniciais até àquela de 7 Gy13. Não é referido, porém, se a ativação da TGFb1 ocorre nessas células, ou se a proteína é proveniente de células do estroma e age de modo parácrino nas células do parênquima pulmonar.
Acreditamos que devido à importância clínica da fibrose pulmonar radioinduzida, o esclarecimento dos mecanismos envolvidos no processo são relevantes e irão otimizar sua prevenção e tratamento. Dessa forma, o objetivo do presente trabalho é investigar no pulmão, por imunohistoquímica, a localização das proteínas TGFb1 latente e TGFb1 ativa, se ocorre ativação radioinduzida da proteína TGFb1 latente e a distribuição das fibras colágenas em diversos períodos de tempo após irradiação.
MÉTODOS
Animais: foram utilizados 32 camundongos da linhagem C57BL, machos, com idade média de 75 dias, pesando aproximadamente 22g. O estudo foi aprovado pelo Comitê de Ética da UNIFESP/EPM/HSP. Durante o experimento, os animais foram mantidos em número de quatro por gaiola de plástico, contendo serragem, recebendo alimento e água ad libitum.
Os camundongos foram numerados, sorteados e distribuídos em dois grupos: Grupo I ¾ GI (não irradiado), com 12 animais e Grupo II ¾ GII (irradiado), com 20 animais. Os animais do grupo II foram subdivididos em quatro subgrupos com cinco camundongos cada, de acordo com o período de tempo escolhido para o sacrifício, isto é, 1(n=5), 14((n=5), 30(n=5) e 90(n=5) dias após irradiação. Os animais do grupo I (controle) foram manipulados, subdivididos e sacrificados de maneira semelhante àqueles do grupo II, sendo 3 (n=3) para cada subgrupo. Os dias de sacrifício foram escolhidos após a realização de estudo piloto para determinar quais os melhores períodos de tempo para evidenciar os parâmetros escolhidos para análise. Para isso, os animais foram sacrificados em diversos dias após irradiação (1,3,6,14,20,30 e 90 dias). Foram também utilizados alguns dados da literatura21.
Irradiação: Os camundongos do grupo GII foram submetidos à radiação gama em aparelho de telecobaltoterapia* * Ração: Nuvilab CR1 (Nuvital Nutrientes Ltda.) da marca CGR, modelo Alcyon II, contendo fonte de 60Co com rendimento de 0,97Gy/min, em campo 20 x 20cm, à distância de 80 cm da fonte. Na ocasião da exposição à radiação, os camundongos foram colocados em caixas de madeira de 20 x 20 cm com tampa de acrílico e divisões internas que possibilitaram a imobilização dos mesmos e, portanto, não foram anestesiados. Foram irradiados com a dose de 7Gy em corpo inteiro, calculado em todo volume corporal, com a técnica de paralelo oposto, num campo de 20 x 20 cm, com distância foco-superfície de 80 cm.
Nos períodos de tempo pré-estabelecidos (1,14,30 e 90 dias), os animais foram sacrificados por estiramento cervical e os pulmões retirados.
Morfologia: Após sacrifício dos animais por estriamento cervical, os pulmões foram retirados e submetidos a técnicas histopatológicas rotineiras. Em cada amostra de pulmão dos animais do GI (não irradiado) e GII (irradiado) realizou-se cuidadosa análise morfológica do parênquima pulmonar em secções coradas pelo HE e das regiões onde ocorreram deposição de fibras colágenas após coloração por picro sirius e prata de Gomori, em todos os períodos de tempo escolhidos.
Realizou-se também quantificação utilizando-se uma ocular histométrica, em microscópio de luz, das fibras colágenas com aspecto morfológico característico, coradas pelo picro sirius, que não discrimina sub-tipos de colágeno e pela prata de Gomori que evidencia o colágeno III, contando-se ao acaso as regiões no tabique alveolar22, nos pulmões dos animais dos grupos I (1d, n=3; 14d, n=3; 30d, n=3; 90d, n=3) e II (1d, n=5; 14d, n=5; 30d, n=5; 90d, n=5).
Utilizou-se ocular integradora de 100 pontos da marca Carl Zeiss. Foram contados 10 campos com 100 pontos em cada lâmina, sendo 1000 pontos por lâmina (picro sirius e reticulina) totalizando 2000 pontos por animal.
As contagens foram realizadas em região de tabique alveolar, "às cegas", ou seja, as lâminas tinham suas identificações encobertas. Os resultados numéricos obtidos foram submetidos à análise estatística.
Análise estatística: A análise de variância por postos de Kruskal-Wallis23 foi utilizada para comparar os resultados obtidos nos diferentes períodos de tempo de sacrifício (1,14,30 e 90 dias), dentro de cada grupo, isto é, GI (não irradiado) e GII (irradiado), para os dois métodos utilizados (picros sírius e prata de Gomori).
Foi aplicado o teste não-paramétrico de Mann-Whitney23 para duas amostras independentes, para comparar o grupo não irradiado (GI) com o grupo irradiado (GII), em cada um dos quatro períodos de sacrifício, para os dois métodos empregados (picro sírius e prata de Gomori).
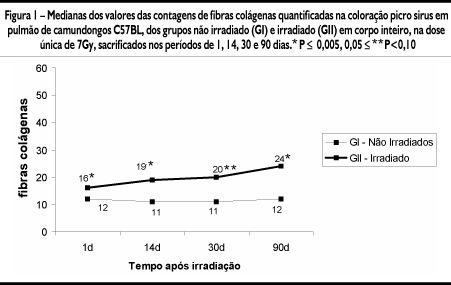
Em todos os testes fixou-se em 0,05 ou 5% (p<0,05) o nível de rejeição da hipótese de nulidade, assinalando-se com um asterisco os valores significantes e (0,05 £ p £ 0,10) para nível de significância limítrofe, assinalando-se com dois asteriscos.
Anticorpos: Foram utilizados os seguintes anticorpos: anticorpo policlonal anti LAP (TGFb1) recombinante humano, obtido em cabra (R & D Systems Inc. Minneapolis MN), específico para evidenciar a expressão da proteína TGFb1 latente, e o anticorpo policlonal anti TGFb1 de rato, camundongo e humano, obtido em coelho (Santa Cruz Biotechnology, Santa Cruz, CA), para observação da imunoexpressão da proteína TGFb1 ativa. Desta forma, o uso de diferentes anticorpos permite detectar a proteína na forma latente e inativa (ligada ao complexo latente) e na forma ativa (após clivagem do complexo latente), e evidenciar se ocorre ou não a ativação in situ da proteína19 .
Imunohistoquímica: O ensaio imunohistoquímico baseou-se no método imunoenzimático indireto em três etapas, utilizando-se o complexo estreptoavidina-biotina-fosfatase alcalina. Os cortes foram colocados em lâminas silanizadas (Sigma, St. Louis, MD) e após desparafinização foram incubados com os anticorpos primários, em temperatura ambiente, a noite toda. Após lavagem em solução de PBS, as seções foram incubadas com os anticorpos secundários biotinilados por três horas. Posteriormente, foram incubadas com a solução do complexo estreptoavidina ¾ fosfatase alcalina (Sigma) por duas horas para detectar as proteínas TGFb1 latente e TGFb1 ativa. Para revelação da fosfatase alcalina, os cortes foram incubados com solução substrato-cromógeno recém-preparada, contendo naftol- AS- MX-fosfato (Sigma), levamizol (Sigma) e o sal cromogênico "fast red TR" (Sigma), diluídos em solução tempão acetato de veronal, pH8,3. Os complexos de imunoglobulina foram demonstrados pela positividade expressa em vermelho para as proteínas TGFb1 latente e TGFb1 ativa. Os cortes foram então lavados durante toda a noite, contra-corados com Hematoxilina de Gill e montados com immu-mount (Shandon, Pittsburgh, PA). Controles com omissão do anticorpo primário foram incluídos em todos os experimentos.
A análise imunohistoquímica foi realizada em pulmões dos animais de ambos os grupos, GI e GII, sendo um animal para cada período de sacrifício (GI) e dois animais para cada período de sacrifício (GII).
RESULTADOS
Alterações morfológicas e histométricas: comparação entre os pulmões irradiados (GII) e não-irradiados (GI): observou-se congestão vascular em áreas focais, especialmente peribrônquicas e espessamento dos septos alveolares, aos 30 dias após irradiação. Estas alterações foram mais intensas aos 90 dias após irradiação. Nos períodos de 1 e 14 dias depois da irradiação não foram observadas alterações significantes no parênquima pulmonar.
Após análise dos resultados morfológicos que sugeriram aumento da deposição de colágeno, especialmente na região do tabique alveolar, realizamos quantificação do mesmo. Esta contagem mostrou aumento significante das fibras colágenas em geral, evidenciadas pelo picro sírius, em região de tabique alveolar, em todos os períodos de tempo estudados (Fig. 1).
Quanto ao colágeno III, evidenciado pela prata de Gomori, também verificou-se aumento deste, em região de tabique alveolar, em todos os períodos de tempo estudados (Fig. 2).
Análise imunohistoquímica
TGFb latente: A imunoexpressão da proteína TGFb1 latente, demonstrada pela cor vermelha, foi observada com forte positividade nas células de revestimento dos brônquios, bronquíolos, alvéolos e vasos, distribuídos difusamente pelo parênquima pulmonar em todos os animais não irradiados (GI) (Fig. 3A). Quanto aos animais irradiados (GII), a imunoexpressão da proteína TGFb1 latente manteve a mesma localização e forte positividade semelhante aos animais controle, isto, é em brônquios, bronquíolos, alvéolos e vasos no período de um dia.
Aos 14 dias após irradiação a intensidade de expressão da proteína TGFb1 latente ocorreu de maneira variável entre as diversas células de revestimento dos brônquios e bronquíolos, ou seja, foram observadas células positivas, fracamente positivas e negativas, resultando em aspecto descontínuo de expressão. Os alvéolos também apresentaram menor imunorreatividade, e foram freqüentes regiões fracamente positivas e/ou negativas (Fig. 3B).
No período de 30 dias após irradiação, os brônquios, alvéolos e vasos apresentaram áreas negativas alternadas com regiões de fraca imunopositividade, difusamente distribuídas pelo parênquima pulmonar.
Noventa dias após irradiação, algumas células em brônquios, alvéolos e vasos voltaram a apresentar imunorreatividade forte para TGFb1 latente, havendo ainda algumas regiões fracamente positivas.
TGFb1 ativa: O parênquima pulmonar dos animais controles (GI) nos diversos períodos de sacrifício, revelou ausência de imunopositividade para proteína TGFb1 ativa em regiões de brônquios e alvéolos (Fig. 3C).
No período de um dia após irradiação, a maioria das células não apresentou imunopositividade para TGFb1 ativa em região de brônquios e bronquíolos. Observou-se porém escassas regiões com células imunorreativas em raros brônquios.
Aos 14 dias após irradiação foram observadas células imunopositivas, distribuídas de forma heterogênea em brônquios e vasos. A imunopositividade para proteína TGFb1 ocorreu de forma difusa nos alvéolos (Figs. 3D e 3E).
A avaliação de imunoexpressão da proteína TGFb1 ativa aos 30 e 90 dias após irradiação, evidenciou ausência de imunopositividade em regiões de brônquios, alvéolos e vasos.
DISCUSSÃO
Nossos resultados histopatológicos nos pulmões irradiados evidenciaram congestão vascular mais acentuada nos vasos do parênquima pulmonar em relação aos animais controle. A alteração mais relevante observada foi a formação de áreas focais de espessamento do septo alveolar aos 30 dias e mais intensas e difusas 90 dias após irradiação. Achados semelhantes foram relatados por diversos autores após exposição do tórax de camundongos a diferentes doses únicas de radiação3,24,25. Importante ressaltar os achados de Jennings e Arden26, que observaram, com a dose de 3000 rad em tórax de ratas, a formação de edema e congestão da parede alveolar, que se iniciou precocemente aos dois dias e se intensificou até 60 dias após irradiação. À semelhança dos nossos resultados, Finkelstein, Johnston, Baggs e Rubin27 observaram também espessamento do septo alveolar em camundongos C57BL irradiados com a dose única de 12,5 Gy e sacrificados após 14 dias.
No presente trabalho, o espessamento do septo foi evidente no período de 30 dias após irradiação estendendo-se até aos 90 dias, e não mais precocemente como nos trabalhos supra citados. Acreditamos que este fato ocorreu devido à dose de 7Gy por nós utilizada, inferior àquelas empregadas pelos autores referidos.
Para análise quantitativa da deposição inicial do colágeno, realizamos coloração com picro sirius e com a prata de Gomori. Em relação especificamente ao método do picro sirius, a quantificação do colágeno não foi realizada em microscópio de luz polarizada28, porque o fundo escuro deste, associado ao retículo em preto da ocular histométrica, dificultava consideravelmente a contagem. Desta forma, optamos por utilizar o microscópio de luz comum, tomando-se o cuidado de considerar para as contagens as estruturas com características morfológicas de fibras colágenas coradas em vermelho. Isto nos possibilitou estimar o colágeno em geral. Esta análise foi complementada pela coloração com a prata de Gomori, eletiva para colágeno III, que permitiu assim quantificar a fibrose reticulínica inicial29.
O aumento significante da deposição do colágeno em geral e do colágeno III observado constitui importante efeito radioinduzido no pulmão, e de implicações clínicas para o paciente irradiado. Nossos resultados corroboram aqueles de Johnston e colaboradores30, que observaram elevação do RNA mensageiro para fibras colágenas tipo I e tipo III em pulmões de camundongos após irradiação torácica, com a dose única de 12,5 Gy. Outros observaram aumento da expressão do RNA mensageiro para fibras colágenas tipo I, III, IV e fibronectina em pulmões de camundongos irradiados em torax com doses únicas de 5 e 12 Gy, em um dia após irradiação, persistindo até oito semanas21. É relatada também evidente fibrose intersticial, associada ao depósito de colágeno no parênquima pulmonar de camundongos irradiados com doses úinicas de 6 e 12 Gy, 24 semanas depois da irradiação torácica4.
Pelo exposto, observa-se que o efeito relevante induzido pela radiação na dose empregada é o processo inflamatório inicial e conseqüente edema, espessamento do tabique alveolar e aumento da deposição de colágeno que podem levar ao processo de fibrose pulmonar.
Em relação ao mecanismo ou fatores envolvidos no aumento do colágeno após irradiação, a proteína TGFb1 parece exercer relevante papel.
Nossos resultados revelaram que a imunoexpressão da proteína TGFb1 latente ocorreu nas células de revestimento dos bronquíolos, alvéolos e vasos nos pulmões dos animais não irradiados. Porém, a expressão da proteína TGFb1 ativa não foi detectada nos pulmões destes animais. Estes achados nas células e estruturas pulmonares diferem daqueles encontrados em células de outros tecidos, como a medula óssea. Neste caso, os granulócitos apresentam a imunoexpressão da proteína TGFb1 latente e ativa em condições fisiológicas(31). Talvez este fato se deva à diferença na cinética dos tipos celulares em ambos os tecidos. Os granulócitos são células que desenvolvem mitose até a fase de mielócito e após esse estágio, amadurecem(31). Precisam portanto, de controle fisiológico para a proliferação e diferenciação. No caso das células pulmonares, estas não estão em processo de divisão constante em condições fisiológicas. Esta pode ter sido uma das razões para encontrarmos a imunopositividade apenas para TGFb1 latente nos pulmões dos animais controle. Diferentes padrões de expressão para as diferentes isoformas da proteína TGFb também foram observados em outros tipos de células32.
Após irradiação, a imunoexpressão da proteína TGFb1 latente tornou-se tênue, descontínua e até ausente nos brônquios, bronquíolos e alvéolos aos 14 e 30 dias depois da irradiação. Ao mesmo tempo, a expressão da proteína TGFb1 ativa, que era negativa nas células do parênquima pulmonar dos animais não irradiados, apresentou fraca imunopositividade em um dia e forte imunopositividade especialmente nos alvéolos aos 14 dias depois da irradiação. Talvez, esta discreta ativação da proteína TGFb1, um dia depois da irradiação se deva à baixa concentração da mesma neste período de tempo, e, portanto, de difícil detecção imunohistoquímica. Tais resultados indicam ativação "in situ" da proteína TGFb1 em células do parênquima pulmonar. Em outros tecidos, como a glândula mamária, observou-se ativação da TGFb em horas e em dias após irradiação19,33. Sugeriu-se que a ativação precoce seria conseqüente ao "stress" oxidativo induzido pelos radicais livres produzidos pela radiação e a elevação continuada e tardia da proteína devido aos mecanismos celulares via plasmina. Sugere-se que a plasmina é uma protease que ativa a proteína TGFb1 latente in vivo. A indução do ativador do plasminogênio tecidual (tPA) e do inibidor do ativador do plasminogênio (PAI) foi demonstrada em vários tecidos após irradiação34. Demonstrou-se também aumento da ativação da proteína TGFb1 latente pelo tPA, pelo ativador do plasminogênio tipo uroquinase e pelo plasminogênio após irradiação35.
Em relação aos nossos resultados, a discreta ativação da proteína TGFb1 observada em um dia e a evidente ativação em 14 dias após irradiação sugerem a importância da via celular de ativação da TGFb1 latente no pulmão. Porém, o papel da ativação desta proteína induzida pelos radicais livres, que apresentam meia vida curta, não foi verificada em nosso experimento, uma vez que o período mais precoce estudado foi o de um dia após irradiação. Talvez ambos os mecanismos possam ser importantes para a ativação da proteína TGFb1 latente no pulmão irradiado.
Nossos achados que mostram elevação da proteína TGFb1 ativa radioinduzida em pulmão corroboram os de diversos autores. Aumento do RNA mensageiro para as proteínas TGFb1, TGFb2 e TGb3 foi observado em pulmão de camundongos após irradiação torácica com as doses de 5, 12 e 12,5 Gy21,27,30. Em culturas de fibroblastos e pneumócitos, a irradiação induziu a síntese de TGFb1 nestas células36. Estudos in vivo, em pulmões de camundongos irradiados, mostraram a imunoexpressão da proteína TGFb1 ativa em fibroblastos próximos à regiões que apresentavam lesões fibróticas37 e em pneumócitos tipo II4. No entanto, estes trabalhos não estudaram especificamente a ativação in situ da proteína TGFb1 em pulmão. O esclarecimento destes aspectos histopatológicos é crítico, especialmente quando se planeja desenvolver estratégias para evitar ou mesmo tratar a fibrose pulmonar radioinduzida. Uma possível estratégia é o uso de drogas antioxidantes, uma vez que a literatura mostra que a proteína TGFb1 ativa induz a liberação do peróxido de hidrogênio (H2O2) de fibroblastos do pulmão humano(38). Mostra também que o aumento da oxidação intracelular induzido pela TGFb1 é abolido após o uso de drogas antioxidantes39.
Em conclusão, analisados em conjunto, nossos resultados mostram aumento da deposição de colágeno nos pulmões dos animais irradiados e ativação da proteína TGFb1 em células do parênquima pulmonar em 1 e 14 dias depois da irradiação. Apesar da ativação da TGFb1 ser discreta em um dia após irradiação, já ocorre elevação do colágeno neste período de tempo. Sugerem também a importância da participação da proteína TGFb1 no complexo processo da fibrose pulmonar radioinduzida, e que células do próprio parênquima pulmonar (brônquios e alvéolos), podem participar deste mecanismo atuando como fontes da proteína TGFb1 ativa.
Tese apresentada à UNIFESP-EPM para obtenção do título de Mestre em Radiologia Clínica ¾ área de Radioterapia. Realizado com Auxílio à Pesquisa FAPESP e bolsa de Pós-Graduação CNPq.
SUMMARY
Latent Tgfb1 activation in the lung irradiated in vivo
PURPOSE: assess the latent and active TGFb1 localization in the lung, whether or not radiation induces latent TGFb1 activation, and the distribution of collagen fibers in the irradiated lung.
METHODS: Thirty two C57BL mice were randomly assigned in two groups: GI (non irradiated animals) and GII (irradiated animals). The mice from GII received a single whole ¾ body radiation dose of 7Gy, using a 60Co source at a dose rate of 0.97 Gy/min. They were sacrificed by cervical dislocation at 1, 14, 30 and 90 days after radiation.
RESULTS: The irradiated lungs showed: 1) vascular congestion and thickness of the alveolar septa 30 days and more intense 90 days after irradiation; 2) significant increase of collagen deposition in all time periods after irradiation; 3) weak latent TGFb1 activation 1 day and strong activation 14 days after irradiation in the bronchi and alveoli. Our results suggest that some bronchial and alveolar cells may have a role in the complex process of radiation-induced lung fibrosis acting as cellular sources of active TGFb. [Rev Assoc Med Bras 2002; 48(4): 329-34]
KEY WORDS: Ionizing radiation. Lung fibrosis. Transforming growth factor b (TGFb).
Artigo recebido: 20/09/2001
Aceito para publicação: 20/03/2002
- 1. Emami B, Lyman J, Brown A, Coia L, Goitein M, Muzenrider JE, et al. Tolerance of normal tissue to therapeutic irradiation. Int J Radiatr Oncol Biol Phys 1991; 21:109-22.
- 2. Van Dyk J, Keane TJ, Kan S, Rider WD, Fryer CJH. Radiation pneumonitis following large single dose irradiation: a re-evaluation based on absolute dose to lung. Int J Radiat Oncol Biol Phys 1981; 7:1365-70.
- 3. Travis EL. The sequence of histological changes in mouse lungs after single doses of X-rays. Int J Radiat Oncol Biol Phys 1980; 6:345-47.
- 4. Rube CE, Uthe D, Schimid KW, Richter KD, Wessel J, Schuck A, et al. Dose-dependent inductions of transforming growth factor b (TGFb) in the lung tissue of fibrosis-prone mice after thoracic irradiation. Int J Radiat Oncol Biol Phys 2000; 47:1033-42.
- 5. Wara WM, Phillips TL, Margolis LW, Smith V. Radiation pneumonitis: A new approach to the derivation of time dose factors. Cancer 1973; 32: 547-52.
- 6. Down JD, Easton DF, Steel GG. Repair in the mouse lung during low dose-rate irradiation. Radiother Oncol 1986; 6:29-42.
- 7. Lockhart SP, Dewn JD, Steel GG. The effect of low dose-rate cyclophosphamide on the radiation tolerance of mouse lung. Int J Radiat Oncol Biol Phys 1986; 12:1437-40.
- 8. Miller GG, Sharplin J, Franko AJ. Immunohistochemical quantitation of three collagen isotypes in perfused areas and nonperfused foci of lungs of irradiated mice. Radiat Res 1989; 119:3238.
- 9. Roberts AB, Anzano MA, Lamb LC, Smith JM, Sporn MB. New class of tansforming growth factor protentiated by epidermal growth factor: isolation form non neoplastic tissues. Proc Natl Acad Sci USA 1981; 78: 5339-43.
- 10. Roberts AB, Sporn MB. The transforming growth factor bs. In: Sporn R, editor. Peptide growth factors and their receptors. New York: Springer-Verlag; 1991. p.419-72.
- 11. Sporn MB, Roberts AB, Wakefield LM, Assoian RH. Transforming growth factor-beta: biological function and chemical struture. Science 1986; 233: 532-4.
- 12. Border WA, Rouslahti E. Transforming growth factor-b in disease: the dark side of tissue repair. J Clin Invest 1992; 90:1-7.
- 13. Ruifrok ACC, Mc Bride WH. Growth factors: biological and clinical aspects. Int J Radiat Oncol Biol Phys 1999; 43:877-81.
- 14. Bernstein EF, Harisiadis L, Salomon G. Transforming growth factor b improves healing of radiation-impaired wounds. J Invest Dermatol 1991; 97:430-4.
- 15. Bernstein EF, Sullivan FJ, Mitchell JB. Biological of chronic radiation effect on tissues and wound healing. Clin Plast Surg 1993; 20:435-53.
- 16. O'Malley Y, Zhao W, Barcellos-Hoff MH, Robbins MEC. Radiation induced alterations in rat mesangial cell Tgfb1 and tgfb3 gene expression are not associated with altered secretion of active Tgfb isoforms. Radiat Res 1999; 152:622-8.
- 17. Miyazono K, Hellman U, Wernsted C, Heldin CH. Latent high molecular weight complex of transforming growth factor b1: purification from human platelets and structural characterization. J Biol Chem 1988; 263: 6407-15.
- 18. Barnard JA, Lyons RM, Moses HL. The cell biology of transforming growth factor b. Biochem Biophys Acta 1990; 1032:79-87.
- 19. Barcellos-Hoff MH, Derynck R, Tsang ML-S, Weatherbee JA. Transforming growth factor b activation in irradiated murine mammary gland. J Clin Invest 1994; 93:892-9.
- 20. Lyons RM, Moses HL. Transformin growth factors and the regulation of cell proliferation. Eur J Biochem 1990; 187:467-73.
- 21. Rubin P, Johnston CJ, Willians JP, Mc Donalds S, Finkelstein JN. A perpetual cascate of cytokines postirradiation leads to pulmonary fibrosis. Int J Radiat Oncol Biol Phys 1995; 33:99-109.
- 22. Weibel ER. Principles and methods for the morphometric study of the lung and other organs. Lab Invest 1963, 12:131-55.
- 23. Siegel S. Estadistica no paramétrica. México: Trilla; 1975.
- 24. Sharplin J, Franko AJ. A quantitative histological study of strain dependent diferences in the effects of irradiation on mouse lung during the early phase. Radiat Res 1989; 119:1-14.
- 25. Dileto CL, Travis EL. Fibroblast radiosensitivity in vitro and lung fibrosis in vivo: Comparison between a fibrosis-prone and fibrosis-resistant mouse strain. Radiat Res 1996, 146:61-7.
- 26. Jennings FL, Arden A. Development of experimental radiation pneumonitis. Arch Pathol 1961; 71:437-46.
- 27. Finkelstein JN, Johnston CJ, Baggs R, Rubin P. Early alterations in extracellular matrix and transforming growth factor b gene expression in mouse lung indicative of late radiation fibrosis. Int J Radiat Oncol Biol Phys 1994; 28:621-31.
- 28. Junqueira LCU, Bignolas G, Brentani RR. Picrosirius staining plus polarization microscopy: a specific method for collagen detection in tissue sections. Histochem J 1979; 11:447-55.
- 29. Piguet PF, Rosen H, Versin, C, Grau, GE. Effective treatment of the pulmonary fibrosis elicited in mice by bleomicyn or silica with anti-CD-11 antibodies. Am Rev Respir Dis 1993; 147:435-41.
- 30. Johnston CJ, Piedboeuf B, Baggs R, Rubin P, Finkelstein JN. Differences in correlation of mRNA gene expression in mice sensitive and resistant to radiation-induced pulmonary fibrosis. Radiat Res 1995; 142:197-203.
- 31. Segreto HRC, Egami MI, Kimura ET, Silva MRR, Segreto RA. Transforming growth factor b (TGFb) activation in megakaryocytes irradiated in vivo, with and without the thiol compound WR2721. In: 47th Annual Meeting of Radiation Research Society, Albuquerque, New Mexico, USA; 2000. Abstract. p.120.
- 32. Pelton RW, Saxena B, Jones M, Mosel HL, Gold LI. Immunohistochemical localization of TGFb1, TGFb2, TGFb3 in the mouse embryo: Expression patterns suggest multiple roles during embryonic development. J Cell Biol 1991; 115:1091-105.
- 33. Ehchart EJ, Segarini P, Tsang MLS, Carrol AG, Barcellos-Hoff MH. Latent transforming growth fator b1 activation in situ: Quantitative and functional evidence after low-dose gama-irradiation. FASEB J 1997; 11:991-1003.
- 34. Fukunaga N, Burrows HL, Meyers M, Schea RA, Boothman DA. Enhanced induction of tissue-type plasminogen activator in normal human cells compared to cancer-prone cells following ionizing radiation. Int J Radiat Oncol Biol Phys 1992; 24:949-57.
- 35. Flaumenhaft R, Abe M, Mignatti P, Mignatti P, Rifkin DB. Basic fibroblast growth factor-induced activation of latent transforming growth factor b in endothelial cells: regulation of plasminogen activator activity. J Cell Biol 1992; 118: 901-9.
- 36. Smith EB, White DC, Hartsock RJ, Dixon AC. Acute ultrastructural effects of 500 roentgens on the mouse. Am J Pathol 1967; 50:159-75.
- 37. Franko AJ, Sharplin J, Ghahary A, Barcellos-Hoff MH, Imunohistochemical localization of transforming growth factor b and tumor necrosis factor a in the lung of fibrotic-prone and "non-fibrosing" mice during the latent period and early phase after irradiation. Radiat Res 1997; 147:245-56.
- 38. Thannickal VJ, Fanburg BL. Activation of an H2O2-generating NADH oxidase in human lung fibroblasts by transforming growth factor b1. J Biol Chem 1995; 270:30334-8.
- 39. Ohba M, Shibanuma M, Kuroki T. Production of hydrogen peroxide by transforming growth factor b1 and its involvement in induction of egr-1 in mouse osteoblastic cells. J Cell Biol 1994; 126:1079-88.
Datas de Publicação
-
Publicação nesta coleção
28 Jan 2003 -
Data do Fascículo
Dez 2002
Histórico
-
Aceito
20 Mar 2002 -
Recebido
20 Set 2001