Resumos
O diabetes tipo 1A (DM1) é causado por mecanismo auto-imune contra células beta em indivíduos com predisposição genética. Auto-anticorpos anti-GAD e anti-IA2 são considerados importantes marcadores destas alterações, cuja prevalência variam, segundo a população estudada e história familiar. Dados sobre freqüência desses marcadores na população brasileira são escassos. OBJETIVOS: Avaliar a freqüência de anti-GAD e anti-IA2 em parentes de primeiro grau de portadores de DM1 (PDM1) em amostra da população da Grande São Paulo. MÉTODOS: Quarenta e oito jovens PDM1 foram recrutados junto a 36 propósitos assistidos em ambulatórios especializados em diabetes da Grande São Paulo, apresentando mediana de idade de 14,5 anos (6,7 a 17,9 anos). Os valores de referência do anti-GAD foram obtidos utilizado-se soros de 194 voluntários normais, sem antecedentes familiares de DM1, com idade de 9,7 a 64,0 anos (mediana de 13,4). Soros de 71 indivíduos normais com idade variando de 11,1 a 15,2 anos (Mi= 12,6) foram submetidos à dosagem de anti-IA2. As dosagens dos marcadores foram através do radioensaio (KRONUS®, Idaho, USA). Valores acima do 99º percentil obtido no grupo controle foram considerados positivos. RESULTADOS: O 99º percentil correspondeu ao valor 1,72 U/ml para o anti-GAD e 0,97 U/ml para o anti-IA2. Cinco indivíduos dos PDM1 (10,4%) foram positivos para o anti-GAD, contra 0,5% dos controles (P<0,01). Um jovem do grupo PDM1 mostrou-se positivo para o anti-IA2 (2,1%), com freqüência semelhante aos controles. CONCLUSÃO: O anti-GAD mostrou maior prevalência entre os PDM1, não havendo diferença entre o PDM1 e controles quanto à freqüência de anti-IA2.
Diabetes Mellitus Tipo 1; Autoanticorpos; População brasileira
BACKGROUND: Increasingly accurate prediction of Type1 Diabetes Mellitus (DM1), based on analysis of autoantibody markers, has become possible in first-degree relatives of patients with diabetes (PDM1). These markers indicate autoimmune process against pancreatic islet beta-cells. Anti-GAD and anti-IA2 are considered predictive of DM1, whose prevalences are considerably variable in different populations studied. There are few data about the frequency of these markers on the Brazilian population. The aim of this study is determine the prevalence of positivity for anti-GAD and for anti-IA2 among DM1 patients first-degree relatives (PDM1) in a sample of the Brazilian population of Great São Paulo City. METHODS: Forty-eight children and adolescents PDM1 with median of age of 14.5 years (range 6.7 to 17.9 years). Anti-GAD and anti-IA2 was mesured by radioassay (Kronus®, USA). The cut-off limit for both antibodies was set at the 99th percentile from normal subjects serum samples (anti-GAD: n=194; Median of age=13.4 yrs; range 9.7 to 64 yrs; anti-IA2: n=71; Median of age= 12.6; range 11.1 - 15.2 yrs). A subject was considered to be positive for anti-IA2 if specific binding exceeded the 99th among the analysis of 71 subjects. The limit to positivity was 1.72 U/ml to anti-GAD and 0.97 U/ml to anti-IA2. RESULTS: Five PDM1(10.4%) have showed positivity to anti-GAD, with significantly higher prevalence than controls (P<0.01). The anti-IA2 prevalence rate seems to be equivalent between PDM1 and controls. CONCLUSION: The prevalence of anti-GAD has been more prevalent among the PDM1. No differences were observed between prevalences for anti-IA2 showed by PDM1 and controls.
Type 1 Diabetes Mellitus; Autoantibodies; Brazil
ARTIGO ORIGINAL
Prevalência dos marcadores imunológicos Anti-GAD e Anti-IA2 em parentes de primeiro grau de diabéticos do tipo 1 em amostra da população da Grande São Paulo
Prevalence of immunological markers (Anti-GAD and Anti-IA2) in first-degree relatives of patients with type 1 diabetes in Great São Paulo City
Paulo Roberto Cesarini; Eurico Mendonça; Vânia Fernandes; Regina do Carmo Silva; Lílian K. Morimitsu; Fabíola E. Garcia; Stella Vechiatti; Walkiria L. Miranda; Sergio Atala Dib
Endereço para correspondência Endereço para correspondência Paulo Roberto Cesarini Rua Dr. Diogo de Faria, 929 apto. 141 Vila Clementino São Paulo SP CEP: 04037-003 lucivalmel@uol.com.br
RESUMO
O diabetes tipo 1A (DM1) é causado por mecanismo auto-imune contra células beta em indivíduos com predisposição genética. Auto-anticorpos anti-GAD e anti-IA2 são considerados importantes marcadores destas alterações, cuja prevalência variam, segundo a população estudada e história familiar. Dados sobre freqüência desses marcadores na população brasileira são escassos.
OBJETIVOS: Avaliar a freqüência de anti-GAD e anti-IA2 em parentes de primeiro grau de portadores de DM1 (PDM1) em amostra da população da Grande São Paulo.
MÉTODOS: Quarenta e oito jovens PDM1 foram recrutados junto a 36 propósitos assistidos em ambulatórios especializados em diabetes da Grande São Paulo, apresentando mediana de idade de 14,5 anos (6,7 a 17,9 anos). Os valores de referência do anti-GAD foram obtidos utilizado-se soros de 194 voluntários normais, sem antecedentes familiares de DM1, com idade de 9,7 a 64,0 anos (mediana de 13,4). Soros de 71 indivíduos normais com idade variando de 11,1 a 15,2 anos (Mi= 12,6) foram submetidos à dosagem de anti-IA2. As dosagens dos marcadores foram através do radioensaio (KRONUSÒ, Idaho, USA). Valores acima do 99o percentil obtido no grupo controle foram considerados positivos.
RESULTADOS: O 99o percentil correspondeu ao valor 1,72 U/ml para o anti-GAD e 0,97 U/ml para o anti-IA2. Cinco indivíduos dos PDM1 (10,4%) foram positivos para o anti-GAD, contra 0,5% dos controles (P<0,01). Um jovem do grupo PDM1 mostrou-se positivo para o anti-IA2 (2,1%), com freqüência semelhante aos controles.
CONCLUSÃO: O anti-GAD mostrou maior prevalência entre os PDM1, não havendo diferença entre o PDM1 e controles quanto à freqüência de anti-IA2.
Unitermos: Diabetes Mellitus Tipo 1. Autoanticorpos. População brasileira.
SUMMARY
BACKGROUND: Increasingly accurate prediction of Type1 Diabetes Mellitus (DM1), based on analysis of autoantibody markers, has become possible in first-degree relatives of patients with diabetes (PDM1). These markers indicate autoimmune process against pancreatic islet beta-cells. Anti-GAD and anti-IA2 are considered predictive of DM1, whose prevalences are considerably variable in different populations studied. There are few data about the frequency of these markers on the Brazilian population. The aim of this study is determine the prevalence of positivity for anti-GAD and for anti-IA2 among DM1 patients first-degree relatives (PDM1) in a sample of the Brazilian population of Great São Paulo City.
METHODS: Forty-eight children and adolescents PDM1 with median of age of 14.5 years (range 6.7 to 17.9 years). Anti-GAD and anti-IA2 was mesured by radioassay (Kronus®, USA). The cut-off limit for both antibodies was set at the 99th percentile from normal subjects serum samples (anti-GAD: n=194; Median of age=13.4 yrs; range 9.7 to 64 yrs; anti-IA2: n=71; Median of age= 12.6; range 11.1 15.2 yrs). A subject was considered to be positive for anti-IA2 if specific binding exceeded the 99th among the analysis of 71 subjects. The limit to positivity was 1.72 U/ml to anti-GAD and 0.97 U/ml to anti-IA2.
RESULTS: Five PDM1(10.4%) have showed positivity to anti-GAD, with significantly higher prevalence than controls (P<0.01). The anti-IA2 prevalence rate seems to be equivalent between PDM1 and controls.
CONCLUSION: The prevalence of anti-GAD has been more prevalent among the PDM1. No differences were observed between prevalences for anti-IA2 showed by PDM1 and controls. [Rev Assoc Med Bras 2003; 49(4): 395-400]
Key words: Type 1 Diabetes Mellitus. Autoantibodies. Brazil.
Introdução
O diabetes mellitus do tipo 1(DM1), também conhecido como diabetes juvenil, devido à maioria dos casos surgir na juventude, ou como insulino-dependente, porque necessitam de insulina exógena para a sobrevivência é atualmente considerado como uma doença auto-imune órgão-específica.
O diabetes mellitus do tipo 1 (DM1) é considerado problema de saúde pública de importância crescente. O aumento de sua incidência é observado em diversas comunidades1,2.
O diabetes do tipo 1 clássico ou tipo 1A3 (DM1) é considerado a forma mais prevalente de diabetes da infância e adolescência. Trata-se de doença de etiologia auto-imune, caracterizada pela presença de auto-anticorpos contra constituintes da célula ß pancreática levando à sua autodestruição4-7. Há diminuição progressiva da função secretora dessas células, que se traduz inicialmente pela perda da primeira fase da secreção de insulina e elevação gradual dos níveis glicêmicos8,9. Há, assim, um período mais ou menos longo de "latência", de pouca expressão clínica, que pode preceder a eclosão da doença em vários anos.
O DM1 tem distribuição universal, apresentando incidência variável segundo a população estudada10. No Brasil, Ferreira et al.11 encontraram incidência de 7,6/100.000 por ano em população de jovens com idade inferior a quinze anos. No sexo feminino, a maior incidência foi observada no grupo etário de 5 a 9 anos e, no sexo masculino, entre 10 e 14 anos.
Estudos em diferentes grupos étnicos sugerem que a suscetibilidade genética para o DM 1 está associada à presença de certos antígenos de histocompatibilidade (histocompatibility leucocyte antigen - HLA). Observou-se que haplótipos HLA-DR3 e DR4 estão presentes em 90 a 95% dos diabéticos do tipo 1 europeus caucasianos12. Em amostra da população brasileira com DM1, caracterizada por um alto grau de miscigenação13-15, evidenciou-se igualmente associação desses haplótipos com a presença da doença16-18.
Há aproximadamente três décadas, com a descoberta dos auto-anticorpos anti-ilhotas pancreáticas19, o papel da auto-imunidade na etiopatogenia do DM1 foi reforçado. Os primeiros auto-anticorpos descritos foram os anti-ilhotas (islet cell antibody - ICA)20 e os anti-insulina (AAI)21,22. Embora o significado patogênico desses auto-anticorpos não esteja bem caracterizado, a sua dosagem tem possibilitado a detecção de indivíduos com maior risco para o desenvolvimento da doença. Por exemplo, os portadores de ICA possuem um risco para desenvolver o DM1 de até 42% e quando associado à presença de AAI, de 77%23 em prazo menor que dez anos.
Posteriormente, foram descritos mais dois auto-anticorpos nos pacientes com DM1. Estes reagem contra duas enzimas, a descarboxilase do ácido glutâmico (anti-GAD)24 e a tirosina fosfatase (anti-IA2)25. Esses auto-anticorpos e os ICA e AAI aumentaram significativamente a capacidade de determinar o risco de desenvolvimento do DM1 em parentes com a doença. A sensibilidade do anti-GAD e IA2, tomados em conjunto para o diagnóstico do DM 1, pode chegar a 91% entre os pacientes que tiveram início da doença antes dos 16 anos, contra 74% obtida com a dosagem apenas do ICA26.
Apesar do reconhecido valor dos marcadores em estudos envolvendo parentes de primeiro grau de diabéticos do tipo 1, a sua real utilidade, em estudos na população geral, é ainda alvo de discussões. Embora haja evidências da capacidade dos auto-anticorpos em avaliar o risco de DM 1 na população geral27, amplo estudo prospectivo ressaltou menor valor preditivo de anti-GAD e IA2 em jovens sem história familiar de DM 128.
Os dados disponíveis sobre a freqüência desses marcadores imunológicos na população brasileira são ainda limitados, sendo necessários estudos adicionais para se avaliar a sua prevalência e o seu valor preditivo na nossa população.
Objetivo do estudo
Analisar a prevalência dos auto-anticorpos anti-células ß pancreáticas (anti-GAD e anti-IA2) em crianças de idade escolar e adolescentes da Grande São Paulo.
Indivíduos e Métodos
Indivíduos
Um total de 48 crianças e adolescentes parentes de primeiro grau (irmãos) de portadores de diabetes do tipo 1 (PDM1) foram recrutados junto às famílias de 36 portadores assistidos em instituições localizadas na área metropolitana da Grande São Paulo: Centro de Diabetes da Escola Paulista de Medicina da UNIFESP, Hospital do Servidor Público Municipal, Hospital Cândido Fontoura, Hospital Infantil Darcy Vargas e Associação do Diabetes Juvenil (ADJ). O grupo PDM1 apresentava mediana de idade de 14,5 anos, com variação de 6,7 a 17,9 anos. Para a determinação dos valores de referência do anti-GAD e do anti-IA2, foram utilizados soros de 194 voluntários que compunham grupo cuja mediana de idade era de 13,4 anos (variando de 9,7 a 64,0 anos), com glicemia de jejum normal (inferior a 110 mg/dl) e sem antecedentes familiares de DM1, abordados junto aos ambulatórios das referidas instituições e de escola municipal de Diadema (SP). Soro de setenta e um indivíduos desse grupo foram submetidos à dosagem de anti-IA2 séricos.
O presente estudo foi avaliado e aprovado pelo Comitê de Ética em Pesquisa da Universidade Federal de São Paulo (processo de número 568/99). Termo de consentimento esclarecido foi assinado pelos pais e responsáveis legais que concordaram em colaborar no estudo.
Métodos
Glicemia, anticorpos anti-descarboxilase do ácido glutâmico e anti-tirosina fosfatase
Os participantes tiveram o sangue coletado no período matutino por punção de veia periférica, após 12 horas de jejum. As amostras foram centrifugadas e o soro obtido era separado em frascos revestidos de silicone para dosagem da glicemia de jejum. O soro era congelado à temperatura de -10oC e, posteriormente, estocado a -70oC, para posterior dosagem dos auto-anticorpos anti-GAD e anti-IA2.
A dosagem da glicose sérica por método enzimático baseado em reação envolvendo o enzima glicose-oxidase (Merckotest, Bayer Diagnóstica, Rio de Janeiro RJ, Brasil). Os valores normais obtidos em dosagem em soro situam-se entre 75 a 110 mg/dl.
Os ensaios para avaliação dos auto-anticorpos anti-GAD e anti-IA2 foram avaliados no laboratório da Disciplina de Endocrinologia da UNIFESP através de radioensaio, utilizando-se GAD e IA2 humanos recombinantes liofilizados marcados com isótopo 125 do iodo (Kronus, Inc., Boise, ID, EUA). O ensaio para anti-GAD apresenta coeficiente de variação intra-ensaio de 3,1% para valor médio de 4,2 U/ml, 2,9% para valor médio de 27,2 U/ ml e coeficiente de variação interensaio de 3,6% (4,2U/ml) e 5,1% (25,0U/ml) (níveis de controle baixo e alto, respectivamente).
O método para a detecção do IA2 apresenta coeficiente de variação intra-ensaio de 2,9% para valor médio de 7,4 U/ml e 3,5% para valor médio de 31,7 U/ml. Seu coeficiente de variação interinsaio é de 7,2% (8,10U/ml) e 2,1% (39,3U/ml) (níveis de controle baixo e alto, respectivamente). Estabeleceu-se o critério de positividade a partir de dados obtidos na dosagem de anti-GAD e anti-IA2 no soro dos indivíduos do grupo controle normal. Os valores superiores ao nonagésimo nono percentil (99o) foram considerados positivos.
A análise comparativa dos títulos de anti-GAD e IA2 dos dois grupos foi efetuada empregando-se o teste t de Student para amostras independentes. Fixou-se em 0,05 ou 5% o nível de rejeição da hipótese de nulidade. Os cálculos foram efetuados com o auxílio do programa de informática SigmaStat Software (Jandel Inc, EUA).
Resultados
A mediana de idade dos adolescentes dos grupos controle e PDM1 foram semelhantes, apresentando os primeiros maior variação (Controles: Mi=13,4 com variação de 9,7 a 64,0; PDM1: Mi=14,5 anos, variando de 6,7 a 17,9 anos). O grupo controle apresentou maior média de glicemia de jejum em relação ao PDM1 (91,1±9,7 vs 87,7±8,9 mg/dl; p<0,002).
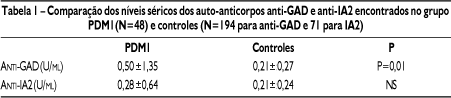
A análise dos 194 indivíduos do grupo controle do anti-GAD revelou valor médio de títulos de 0,21±0,27 U/ml, variando de 0,01 a 1,98 U/ml. Em relação ao anti-IA2, a análise de 71 soros mostrou a média de valor médio de 0,21±0,24 U/ml, com variação de 0,01 a 0,97 U/ml.
Os PDM1 apresentaram títulos médios de 0,50±1,35 U/ml (variação de 0,01 a 7,52 U/ml) para anti-GAD e 0,28±0,64 U/ml (0,01 a 4,40 U/ml) para o anti-IA2.
A análise comparativa entre os grupos mostrou títulos mais elevados de anti-GAD no grupo PDM1 em relação aos controles (0,50±0,27 vs 0,21±0,27 U/ml, p=0,01). Os dois grupos não diferiram quanto aos títulos de anti-IA2 (0,28±0,64 vs 0,21±0,24 U/ml, PDM1 e controles, respectivamente, p=0,43) (Tabela 1).
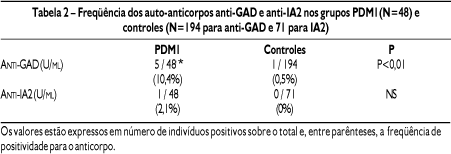
O 99o percentil dos valores de anti-GAD obtidos nos controles correspondeu a 1,72 U/ml. Cinco indivíduos no grupo PDM1 (10,4%) apresentaram valores acima desse limite, sendo considerados positivos para esse auto-anticorpo. Assim, obtivemos freqüência maior de positividade em relação ao grupo controle (10,4 vs 0,5%, P<0,01). Em relação ao anti-IA2, valor acima de 0,97 U/ml (99o percentil) foi observado em um jovem (2,1%) do grupo PDM1. Este indivíduo também mostrou positividade para o anti-GAD. Os grupos PDM1 e Controles não mostraram diferença significativa em relação à presença de indivíduos positivos para anti-IA-2 (Tabela 2 e Figuras 1 e 2).
Discussão
No presente estudo, a freqüência de positividade de 10,4% para o auto-anticorpo anti-GAD e 2,4% para o anti-IA2 observada entre os PDM1 foi elevada, se comparada aos dados obtidos em estudos de amostras populacionais do hemisfério norte, com taxas que oscilam em torno de 2,7 e 0,2% para anti-GAD e anti-IA2, respectivamente. Entretanto, a concomitância dos dois auto-anticorpos foi de 2,1% (um em 48 indivíduos), valor muito próximo à freqüência de 1,8% descrita29 nesses estudos.
A detecção de "frações" do ICA, como os anticorpos anti-descarboxilase do ácido glutâmico (anti-GAD65) e o anti-tirosina-fosfatase (IA2), acrescentou maior acurácia na detecção do indivíduo de risco para o DM127,30. Verge et al. avaliaram o valor preditivo dos marcadores anti-GAD, IA2 e AAI31 em parentes de primeiro grau. Os autores observaram que 65% dos indivíduos portadores de dois dos auto-anticorpos apresentaram diabetes no prazo de cinco anos, e todos aqueles que apresentavam positividade para os três marcadores contraíram a doença naquele período. Estudo envolvendo 2855 crianças de idade escolar mostrou risco estimado para o desenvolvimento do diabetes em 71% quando da detecção de pelo menos dois marcadores, entre ICA, anti-GAD e IA227. Por ocasião do diagnóstico de DM1, crianças e adolescentes apresentaram maior freqüência de cada um dos diversos marcadores avaliados (ICA, AAI, anti-GAD ou IA2), quando comparadas a grupos adultos32. Tais observações são concordantes com evidências da maior prevalência de marcadores em idades menores22,33, podendo refletir agressão imunológica mais intensa contra a célula beta e a maior importância desses marcadores nessa faixa etária. Estudo prospectivo no qual grupo de 3000 adolescentes com mediana de idade de 14 anos, avaliados quanto à presença de anti-GAD, IA2 e ICA, evidenciou que apenas os indivíduos com positividade para mais de um anticorpo (0,2% da amostra) desenvolveram DM1 após oito anos de acompanhamento, representando 100% de sensibilidade e 50% de valor preditivo positivo34. Portanto, o anti-GAD e o anti-IA2 apresentam, em conjunto, sensibilidade e especificidade suficientemente elevadas para serem utilizados em estudos populacionais26,29,35.
A experiência prévia obtida em nosso laboratório, com o radioensaio para dosagem de anti-GAD utilizado no presente estudo, revelou satisfatórios índices de especificidade (95,6%), de sensibilidade (86,7%), mostrando valor preditivo positivo de 74,3% e valor preditivo negativo de 98,0% para o DM136.
Pequeno número de estudos bem conduzidos abordou a freqüência de auto-anticorpos entre portadores de DM1 ou parentes de primeiro grau no Brasil. Gomes et al. avaliando grupo de pacientes com DM1, com tempo médio de doença de 18,8 meses, constataram que 33% apresentaram positividade para o ICA37. Deve ser salientado, todavia, que o referido estudo incluiu portadores de diabetes de até 10 anos de diagnóstico, o que pode ter influído nas taxas de positividade, uma vez que os títulos de ICA decaem progressivamente após o diagnóstico. Em estudos efetuados em nosso laboratório, na Disciplina de Endocrinologia da UNIFESP, avaliando-se grupo de diabéticos do tipo 1 de início recente, exclusivamente formado por pacientes com tempo de manifestação clínica de até seis meses, observou-se 68% a 73,4% de positividade para ICA38,39. Estudos de prevalência de AAI, também efetuados em nosso laboratório, avaliando-se indivíduos diabéticos do tipo 1 de início recente, 37,5% a 56% mostraram positividade para o marcador38,40,41. Em estudo recente, também efetuado em nosso serviço, França et al. observaram prevalência de 87,6% de positividade para o anti-GAD em grupo de pacientes de DM1 de início recente36. A concomitância dos dois auto-anticorpos foi registrada em 36% dos casos38. Pardini et al., avaliando pacientes com até 12 meses de evolução, encontraram freqüência de 80% para anti-GAD, reatividade de 62,9% para IA2, com positividade de 82,9% para um ou mais marcadores51. Em pacientes com mais de um ano de doença, a positividade para os dois auto-anticorpos foi demonstrada em 54,1% e em 67,5% deles para pelo menos um marcador42.
Estudos em amostras da população brasileira avaliando a freqüência de auto-anticorpos em familiares de diabéticos do tipo 1 mostraram positividade para o ICA variando entre 5,6% e 13,5%38,43, e positividade de 3,5% a 18,7% para o AAI38,40,41,43. Alves et al. estudaram grupo de 538 indivíduos brasileiros, composto em sua maioria por parentes de primeiro, mas também de segundo grau de diabéticos do tipo 1, o anti-GAD mostrou-se positivo em 3,5% e o IA2 em 3,6% dos indivíduos43. No referido estudo, abrangendo faixa etária bastante larga (de um a 60 anos), a exemplo dos dados obtidos em outros países22,32,33, observou-se os maiores títulos de auto-anticorpos em idade abaixo dos 20 anos e em irmãos de indivíduos portadores de DM1.
A positividade de 10% encontrada para anti-GAD em nosso estudo foi significativamente mais alta se comparada aos 3,5% obtidos por Alves et al.43 em brasileiros parentes de diabéticos do tipo 1. O anti-IA2 mostrou-se positivo em 3,6%, valor próximo aos 2,7% obtidos no presente estudo. Os mesmos autores mostraram que tanto a positividade exclusiva para o anti-GAD como a presença de mais de dois dos auto-anticorpos (ICA, AAI, Anti-GAD e anti-IA2) relacionam-se a risco aumentado de DM1, sobretudo em irmãos dos propósitos43. A maior prevalência do anti-GAD encontrada no presente estudo pode ser explicada, ao menos em parte devido à faixa etária mais jovem avaliada. É possível também que outros aspectos do grupo estudado, formado exclusivamente por irmãos, junto às características genéticas de nossa população e ainda ao tamanho da amostra explicassem, pelo menos em parte, a prevalência para o anti-GAD maior que a esperada.
A positividade de 0,5% encontrada entre 194 indivíduos do grupo controle para o anti-GAD e a ausência de indivíduos simultaneamente positivos para anti-GAD e anti-IA2 nesse grupo é concordante aos dados obtidos por Bingley et al.27 e pelo grupo de LaGasse34. Estes autores obtiveram, a partir da avaliação de 4505 adolescentes da população geral em idade escolar, a freqüência de positividade de 2,3% para um único marcador (anti-GAD, IA2 ou AAI) e 0,3% para dois ou mais marcadores35. Por outro lado, a freqüência de 10,4% foi maior que os 4,5% observados em estudo envolvendo população do hemisfério norte29.
A validade de programas de prospecção de marcadores na população geral ainda é alvo de discussão. Foram observadas freqüências próximas de positividade dos marcadores entre os parentes de primeiro grau de diabéticos do tipo 1 e a população geral27,29. Os dados de Knip et al. sugerem que a presença de autoanticorpos teria maior capacidade de predição de DM1 em parentes de primeiro grau de diabéticos do que em indivíduos sem história familiar37. Os recentes resultados obtidos pelo grupo de LaGasse34 mostraram que a presença de dois ou mais marcadores detectados em adolescentes de 14 anos puderam identificar, prospectivamente, todos aqueles que desenvolveram DM1 no prazo de oito anos. Por outro lado, durante o seguimento, seis de doze pacientes com positividade para dois ou mais marcadores dos indivíduos desenvolveram diabetes. Estudos são necessários para se determinar se as implicações futuras da ocorrência de auto-anticorpos seriam condicionadas por fatores genéticos de predisposição para a doença.
A Immunology Diabetes Society (IDS), em seu último consenso44, ratificou a utilização do anti-GAD combinado com a dosagem de anti IA2 (ou AAI), como estratégia de detecção de indivíduos de risco para o DM1, como o efetuado no presente estudo. Todavia, é importante observar que, na avaliação de crianças menores de dez anos, os três marcadores (anti-GAD, anti-IA2 e AAI) devem ser incluídos já no primeiro teste. Conforme a IDS, indivíduos com positividade confirmada para múltiplos marcadores ou portador de títulos elevados devem ser submetidos a testes metabólicos e endócrinos, como a avaliação de tolerância à glicose e o estudo da primeira fase de secreção de insulina. Como exemplo, em nosso estudo, um dos participantes do grupo PDM1 com 14,6 anos de idade, que apresentava glicemia de 78 mg/ml, e títulos de anti-GAD de 7,52 U/ml e de anti-IA2 de 4,41 U/ml, preenchia critérios indicativos dessas avaliações.
Ao contrário do que se possa supor, o óbito no ínicio do DM1 ainda é freqüente. Infelizmente, em muitas circunstâncias, na assistência primária, a criança DM1 não tem a doença diagnosticada adequadamente, o que concorre para o aumento do risco de complicações agudas e óbito. A mortalidade observada no início do DM1 está relacionada à atenção pública ao diabetes. No estado norte-americano do Colorado, cerca de uma criança morre no início do diabetes a cada dois anos, casos que estão associados a diagnóstico retardado45. A detecção de auto-anticorpos, marcadores da fase pré-clínica da doença, é importante para o seguimento e orientação de crianças com elevado risco de evoluírem para o DM1 manifesto.
O presente estudo visou fornecer subsídios para programas de prevenção e rastreamento do diabetes mellitus. Os resultados obtidos devem ser acrescidos de amplos estudos genéticos, imunológicos e metabólicos que envolvam várias comunidades. Tais estudos permitirão caracterizar o grupo de risco para o diabetes do tipo 1 em nossa população, proporcionando a utilização de recursos humanos e técnicos de forma racional, priorizando aqueles indivíduos com maior probabilidade de desenvolvimento da doença e das complicações crônicas relacionadas, com grande impacto na esperança de vida. Até que o DM1 possa ser curado ou prevenido, a identificação de indivíduos de risco proporciona a oportunidade de acompanhamento clínico e educação precoces.
Conclusão
No grupo dos parentes de primeiro grau de diabetes do tipo 1 encontrou-se maior prevalência do marcador sorológico anti-GAD, sugerindo que este seria o mais importante auto-anticorpo entre os avaliados no presente estudo, a ser considerado em futuros estudos de detecção de risco de DM1 na população brasileira.
Artigo recebido: 07/10/2002
Aceito para publicação: 04/08/2003
Trabalho realizado na Universidade Federal de São Paulo Escola Paulista de Medicina - Disciplina de Endocrinologia Centro de Diabetes, São Paulo, SP
- 1. Onkamo P, Vaananen S, Karvonen M, Tuomilehto J. Worldwilde increase in incidence of type 1 diabetes: analysis of the data on published incidence trends. Diabetologia 1999; 42:1395-403.
- 2. Rosembloom AL, Joe JR, Young RS, Winter WE. Emerging epidemic of type 2 diabetes in youth. Diabetes Care 1999; 22:345-54.
- 3. American Diabetes Association. Report of the expert on the diagnosis and classification of diabetes mellitus. Diabetes Care 1999; 22(suppl 1):S5-S19.
- 4. Eisenbarth GS. Type I diabetes mellitus: a chronic autoimmune disease. N Engl J Med 1986; 314:1360-8.
- 5. Schloot NC, Roep BO. Islet antigen-specific T cell clones in autoimmune diabetes: from mice to men. Diabetes Metab Rev 1997; 13:127-38.
- 6. Tisch R, McDevitt H. Insulin-dependent diabetes mellitus: review. Cell 1996; 85:291-7.
- 7. Bach JF. Insulin-dependent diabetes mellitus as an autoimmune disease. Endocr Rev 1994; 15:516-42.
- 8. Vardi P, Crisa L, Jackson RA. Predictive value of intravenous glucose tolerance test insulin secretion less than or greater than first percentile in islet cell antibody positive relatives of Type I (insulin-dependent) diabetic patients. Diabetologia 1991; 34:93-102.
- 9. Bleich D, Jackson RA, Soeldner JS, Eisenbarth GS. Analysis of metabolic progression to Type I diabetes in ICA+ relatives of patients with type I diabetes. Diabetes Care 1990; 13:111-8.
- 10. Karvonen M, Viik-Karjander M, Moltchanova E, Libman I, LaPorte R,Tuomilehto J. Incidence of childhood type 1 diabetes worldwide. Diabetes Mondiale (DiaMond) Project Group. Diabetes Care 2000; 23:1516-26.
- 11. Ferreira SRG, Franco LJ, Vivolo MA, Negrato CA, Simões ACP, Ventureli CR. Population-based incidence of IDDM in the state of São Paulo, Brazil. Diabetes Care 1993; 16:701-4.
- 12. Wolf E, Spencer, KM, Cudworth AG. The genetic susceptibility of type-I (insulin dependent) diabetes: analysis of HLA-DR association. Diabetologia 1983; 24:224-9.
- 13. Fundação Instituto Brasileiro de Geografia e Estatística. IBGE. Pesquisa Nacional por amostra de Domicílios de 1987: cor da população região metropolitana de São Paulo. Periódico Anual 1987; 2:218.
- 14. Prado Jr C. Formação do Brasil Contemporâneo. São Paulo: Editora Brasiliense/Publifolha; 2000. p.81-113.
- 15. Ribeiro D. O povo brasileiro. Estudos de Antropologia da Civilização. São Paulo: Companhia das Letras; 1995. p.228-44.
- 16. Eizirik DL, Monteiro CMC, Voltarelli, JC, Foss, MC. Frequency of HLA antigens in a Brazilian type 1 diabetic population. Braz J Med Biol Res 1987; 20:533-7.
- 17. Marques SBD, Volpini W, Caillat-Zucman S, Lieber S, Pavin EJ, Persoli LB. Distribuition of HLA-DRB1 alleles in a mixed population with insulin-dependent diabetes mellitus from the Southeast of Brazil. Braz J Med Biol Res 1998; 31:365-8.
- 18. Volpini WMG; Testa GV, Marques SBD, Alves LI, Silva MER, Dib SA, et al. Family-based association of HLA Class II alleles and haplotypes with type I diabetes in Brazilians reveals some characteristics of a highly diversified population. Hum Immunol 2001; 62:1226-33.
- 19. Bottazzo G, Lorin-Christiansen A, Doniach D. Islet cell antibodies in diabetes mellitus with autoimmune polyendocrine deficiences. Lancet 1974; 2:1279.
- 20. Bottazzo, GF, Geichmann H. Immunology and diabetes workshops: report of the first International Workshop on the standartization of cytoplasmic islet cell antibodies. Diabetologia 1986; 29:125-6.
- 21. Palmer JP, Asplin CM, Clemons P, Lyen K.; Tatpati O, Raghu PK, et al.Insulin autoantibodies in insulin-dependent diabetes before insulin treatment. Science 1983; 222:1337-9.
- 22. Vardi P. Dib SA, Tuttelman M, Connelly JE, Grinsbergs-Radizabeh A, Riley WJ, et al. Competitive insulin autoantibody assay. Prospective evaluation of subjects at risk for development of Type I diabetes mellitus. Diabetes 1987; 36:1286-91.
- 23. Ziegler, AG, Herskowitz RD, Jackson RA, Soeldner JS, Eisenbarth GS. Predicting Type 1 diabetes. Diabetes Care 1990; 13:762-75.
- 24. Baekkeskov S, Aanstoot, HJ, Christgau S, Reetz A, Solimena M, Cascalho M, et al. Identification of the 64K autoantigen, in insulin-dependent diabetes mellitus as GABA-sythetizing enzyme glutamic acid decaboxylase. Nature 1990; 347:151-156.
- 25. Rabin DU, Pleasic SM, Shapiro JA, Yoo-Warren H, Oles J, Hicks JM. et al. Islet cell antigen 512 is a diabetes-specific islet autoantigen related to protein tyrosine phosphatase. J Immunol 1994; 152:3183-8.
- 26. Wiest-Landenburger U, Hartmann R, Hartmann U, Berling K, Böhm BO, Richter W. Combined analysis and single-step Detection of GAD65 and IA2 autoantibodies in IDDM can replace the histochemical islet cell antibody test. Diabetes1997; 46:565-571.
- 27. Bingley PJ, Bonifacio E, Williams AJK, Genovese S, Bottazzo GF, Gale EAM. Prediction of IDDM in general population. Strategies based on combinations of autoantibody markers. Diabetes 1997; 46:1701-10.
- 28. Knip M, Karjalainen J, Akerblom HK. Islet cell antibodies are less predictive of IDDM among unaffected children in general population than in sibs of children with diabetes. The Childhood Diabetes in Finland Study Group. Diabetes Care 1998, 21:1670-3.
- 29. Bingley PJ, Colman P, Eisenbarth GS, Jackson RA, McCulloch DK, Riley, et al. Standartization of intravenous glucose tolerance test for use in prediction of insulin dependent diabetes. Diabetes 1992; 15:1313-6.
- 30. Verge CF Gianani R, Kawasaki E, Yu L, Pietropaolo M, Jackson RA, et al. Prediction of Type I diabetes in first-degree relatives using a combination of insulin, GAD, and ICA512bdc/IA2 autoantibodies. Diabetes 1996; 45:926-33.
- 31. Sabbah E, Savola K, Ebeling T, Kulmala P, Vähäsalo P, Ilonen J, et al. Genetic, autoimmune, and clinical characteristics of childhood- and adult-onset type 1 diabetes. Diabetes Care 2000; 23:1326-32.
- 32. Vanderwalle CL, Falorni A, Svanholm S, Lenmark A, Pipeleers DG Gorus FK. High diagnostic sensitivity of glutamate decarboxilase autoantibodies in insulin-dependent diabetes mellitus with clinical onset between age 20 and 40 years. J Clin Endocrinol Metab 1995; 80:846-51.
- 33. LaGasse JM, Brantley MS, Leech NJ, Rowe RE; Monks S, Palmer JP. Successful prospective prediction of type 1 diabetes in schoolchildren through multiple defined autoantibodies. Diabetes Care 2002; 25:505-11.
- 34. Dittler J, Seidel, Schenker M, Ziegler AG. GADIA2-Combi determination as first-line screening for improved prediction of type 1 diabetes in relatives. Diabetes 1998, 47:592-7.
- 35. Seissler J, Morgenthaler NG, Achenbach P, Lampeter EF, Glawe D, Payton M, et al. The DENIS Study Group: Combined screening for autoantibodies to IA2 and antibodies to glutamic acid decarboxylase in first degree relatives of patients with IDDM. Diabetologia 1996; 39:1351-6.
- 36. França AP, Bezerra DL, Franco LJ, Dib SA. GAD autoantibodies, beta-cell function, and function, and insulin resistance in Japanese-Brazilian adults. Centro de Estudos da Comunidade nipo-brasileira de Bauru. Diabetes Care 2000; 23:1437-9
- 37. Gomes MB, Vieira LMM, Marques EP, Sarno EN, Chacra AR. Prevalence of autoantibodies in simplex and multiplex families of Brazilian insulin-dependent diabetic patients. Braz J Med Biol Res 1991; 24:375-81.
- 38. Kasse CA, Miranda WL, Calliari LEP, Sá JR, Dib SA. Autoanticorpos anti-ilhota e anti-insulina em diabéticos do Tipo 1 de diagnóstico recente e parentes de primeiro grau brasileiros. Arq Bras Endocrinol Metab 1998; 42:45-52.
- 39. Dib SA, Mechica JB, Russo EMK, Chacra AR, Cudworth AG. Anticorpos circulantes contra ilhotas pancreáticas, mucosa gástrica, tireóide, córtex adrenal em pacientes diabéticos brasileiros (resumo). Arq Bras Endocrinol Metab 1983; 27:20.
- 40. Pinheiro MFMC, Dib SA, Sá JR, Castro MAS, Vieira JGH, Russo EMK. Insulin autoantibodies in first degree relatives of type I diabetic patients. Braz J Med Biol Res 1992; 25:231-8.
- 41. Oliveira KS, Pinheiro MFMC, Miranda WL, Dib SA Russo EMK. Associação entre auto-anticorpos anti-pró-insulina e anti-insulina com diabetes mellitus do tipo I. Arq Bras Endocrinol Metab 1993; 37:120-4.
- 42. Pardini VC, Mourão DM, Nascimento PD, Vivolo MA, Ferreira SRG, Pardini H. Frequency of islet cell autoantibodies (IA2 and GAD) in young Brazilian type 1 diabetes patients. Braz J Med Biol Res 1999; 32:1195-8.
- 43. Alves LI, Silva MRE, Correia MRS, Fukui RT, Wajchenberg BL, Santos RF, et al. Prevalência de autoanticorpos ICA, IAA, anti-GAD65 e IA2 em familiares de diabéticos do tipo 1. In: Anais do XXIV Congresso Brasileiro de Endocrinologia e Metabologia. Rio de Janeiro; 2000. p.S243.
- 44. Bingley PJ, Bonifácio, E.; Ziegler AG, Atkinson MA, Eisenbarth GS, on behalf of The Immunology Diabetes Society. Proposed guidelines on screening for risk of Type 1 diabetes. Diabetes Care 2001, 24:398.
- 45. Atkinson MA, McLaren NK, Riley WJ, Winter WE, Fisk DD, Spillar RP. Are insulin autoantibodies markers for insulin-dependent diabetes mellitus? Diabetes 1986; 35:894-8.
Datas de Publicação
-
Publicação nesta coleção
13 Fev 2004 -
Data do Fascículo
2003
Histórico
-
Recebido
07 Out 2002 -
Aceito
04 Ago 2003