Resumos
OBJETIVO: Avaliar a influência dos genótipos nulos dos genes GSTT1 e GSTM1 na carcinogênese em cabeça e pescoço. MÉTODOS: Foram avaliadas as freqüências dos genótipos nulos GSTT1 e GSTM1 pela técnica de reação em cadeia de polimerase (PCR) multiplex em 45 pacientes com carcinoma espinocelular de cabeça e pescoço e 45 indivíduos sem história de doença neoplásica. Ambos os grupos foram compostos por indivíduos fumantes pareados por sexo, idade e etnia. RESULTADOS: O genótipo GSTT1 nulo foi encontrado em 24,4% dos pacientes e em 17,8% dos indivíduos controle (P = 0,606), enquanto 44,4% dos pacientes e 48,9% dos indivíduos controle revelou genótipo GSTM1 nulo (P = 0,832). Não foi observada correlação entre os genótipos nulos GSTT1 e GSTM1 e os sítios primários de tumor. CONCLUSÃO: Em nosso estudo não foi possível estabelecer a influência da nulidade dos genótipos GSTT1 e GSTM1 na carcinogênese em cabeça e pescoço.
Neoplasmas de cabeça e pescoço; Carcinoma de células escamosas; Polimorfismo; Tabaco. Glutationa transferase
BACKGROUND: To evaluate the influence of GSTM1 and GSTT1 null genotypes in head and neck carcinogenesis. METHODS: The frequencies of GSTM1 and GSTT1 null genotypes were evaluated by multiplex polymerase chain reaction (PCR) in 45 patients with head and neck squamous cell carcinoma and in 45 control group individuals. Both groups were composed of smokers paired by gender, age and race. RESULTS: The GSTT1 null genotype was found in 24.4% of the patients and 17.7% of the control group (P= 0.606), while 44.4% of the patients and 48.8% of the control group were bearers of the GSTM1 null genotype (P=0.832). No associations between GSTT1 and GSTMI null genotypes and primary tumor sites were found. CONCLUSION: In our study, it was impossible to establish the influence of the GSTT1 and GSTM1 null genotypes in head and neck carcinogenesis.
Head and neck neoplasms; Squamous cell carcinoma; Polymorphism; Tobacco; Glutathione transferase
ARTIGO ORIGINAL
Avaliação da influência da nulidade dos genótipos GSTT1 e GSTM1 na carcinogênese em cabeça e pescoço
Evaluation of the influence of GSTT1 AND GSTM1 null genotypes in head and neck carcinogenesis
Eny Maria Goloni-Bertollo* * Correspondência: Av. Brigadeiro Faria Lima, 516 Cep: 15090-000, São José do Rio Preto, SP ; Joice Matos Biselli; Léa Carolina de Lima Corrêa; José Victor Maníglia; Andréa Regina Baptista Rossit; Mariângela Torreglosa Ruiz; Érika Cristina Pavarino-Bertelli
RESUMO
OBJETIVO: Avaliar a influência dos genótipos nulos dos genes GSTT1 e GSTM1 na carcinogênese em cabeça e pescoço.
MÉTODOS: Foram avaliadas as freqüências dos genótipos nulos GSTT1 e GSTM1 pela técnica de reação em cadeia de polimerase (PCR) multiplex em 45 pacientes com carcinoma espinocelular de cabeça e pescoço e 45 indivíduos sem história de doença neoplásica. Ambos os grupos foram compostos por indivíduos fumantes pareados por sexo, idade e etnia.
RESULTADOS: O genótipo GSTT1 nulo foi encontrado em 24,4% dos pacientes e em 17,8% dos indivíduos controle
(P = 0,606), enquanto 44,4% dos pacientes e 48,9% dos indivíduos controle revelou genótipo GSTM1 nulo (P = 0,832). Não foi observada correlação entre os genótipos nulos GSTT1 e GSTM1 e os sítios primários de tumor.
CONCLUSÃO: Em nosso estudo não foi possível estabelecer a influência da nulidade dos genótipos GSTT1 e GSTM1 na carcinogênese em cabeça e pescoço.
Unitermos: Neoplasmas de cabeça e pescoço. Carcinoma de células escamosas. Polimorfismo. Tabaco. Glutationa transferase.
SUMMARY
BACKGROUND: To evaluate the influence of GSTM1 and GSTT1 null genotypes in head and neck carcinogenesis.
METHODS: The frequencies of GSTM1 and GSTT1 null genotypes were evaluated by multiplex polymerase chain reaction (PCR) in 45 patients with head and neck squamous cell carcinoma and in 45 control group individuals. Both groups were composed of smokers paired by gender, age and race.
RESULTS: The GSTT1 null genotype was found in 24.4% of the patients and 17.7% of the control group (P= 0.606), while 44.4% of the patients and 48.8% of the control group were bearers of the GSTM1 null genotype (P=0.832). No associations between GSTT1 and GSTMI null genotypes and primary tumor sites were found.
CONCLUSION: In our study, it was impossible to establish the influence of the GSTT1 and GSTM1 null genotypes in head and neck carcinogenesis.
Key words: Head and neck neoplasms. Squamous cell carcinoma. Polymorphism. Tobacco. Glutathione transferase.
INTRODUÇÃO
As neoplasias epiteliais de cabeça e pescoço são responsáveis por uma grande mortalidade em todo o mundo, constituindo a sexta causa de morte por câncer1. O tipo histológico mais freqüente, o carcinoma de células escamosas (espinocelular), presente em mais de 90% dos casos 2-4, é associado com o consumo de álcool e tabaco5-8. Sabe-se que a fumaça do cigarro é uma mistura complexa de mais de 4000 substâncias, entre as quais pelo menos 40 são carcinogênicas, iniciadoras ou promotoras de tumores em animais9. Os níveis de seus produtos eletrofílicos lançados na circulação sangüínea dependem da atuação de enzimas envolvidas no biometabolismo, que compreende a ativação (Fase I) e detoxificação (Fase II) de compostos químicos,9-10. Polimorfismos em genes que codificam essas enzimas podem alterar sua expressão ou função, alterando o biometabolismo de compostos carcinógenos11.
Vários genes polimórficos que codificam enzimas envolvidas na biotransformação de carcinógenos têm sido associados ao desenvolvimento de câncer12-19. Dois genes em particular, GSTT1 e GSTM1, que codificam enzimas de fase II pertencentes à família das glutationa S-transferases (GSTs), parecem relevantes para a suscetibilidade ao carcinoma espinocelular de cabeça e pescoço, pois atuam na detoxificação de metabólitos reativos de substâncias carcinógenas da fumaça do tabaco12,14,11,17,20,10,19.
O gene GSTM1 é polimórfico na população humana com um alelo apresentando atividade nula (GSTM1) devido a uma grande deleção gênica, e dois outros funcionais (GSTM1A e GSTM1B). O gene GSTT1 é também polimórfico na população humana, podendo apresentar genótipo nulo por deleção21,22. Indivíduos que apresentam genótipo nulo desses genes em homozigose agrupam-se no fenótipo conjugador negativo, uma vez que ocorre perda completa da atividade enzimática23,24, enquanto os que apresentam pelo menos um alelo funcional agrupam-se no fenótipo conjugador positivo25.
Desse modo, a variabilidade individual em genes relacionados aos processos de ativação e detoxificação metabólica parece crucial na suscetibilidade ao câncer de cabeça e pescoço. O objetivo deste trabalho foi avaliar a influência dos genótipos nulos dos genes GSTT1 e GSTM1 na carcinogênese em cabeça e pescoço.
MÉTODOS
Trata-se de um estudo caso-controle, realizado na Faculdade de Medicina de São José do Rio Preto, SP. Foram incluídos 45 indivíduos com carcinoma espinocelular de cabeça e pescoço (93,3% do sexo masculino; média de idade 57,6 ± 8,8 anos; 84,4% caucasóides) procedentes do Serviço de Otorrinolaringologia e Cirurgia de Cabeça e Pescoço do Hospital de Base / Faculdade de Medicina de São José do Rio Preto e do Instituto Arnaldo Vieira de Carvalho, SP. Todos os casos foram diagnosticados e confirmados patologicamente, e o sítio primário de tumor mais representativo foi a cavidade oral (40% dos casos). O grupo controle foi constituído por 45 indivíduos sem história de doença neoplásica (84,4% do sexo masculino; média de idade 53,9 ± 11,0 anos; 97,8% caucasóides), pareado por sexo, idade e etnia. Em relação à etnia, negros, pardos e orientais foram considerados não-caucasóides. Todos os indivíduos (pacientes e controles) eram tabagistas. Os indivíduos foram incluídos no estudo após a obtenção do Termo de Consentimento Livre e Esclarecido e todas as informações necessárias foram obtidas por meio de questionário padronizado para coleta de dados e mantidas em sigilo. O estudo foi aprovado pelo Comitê de Ética em Pesquisa da Faculdade de Medicina de São José do Rio Preto (CEP-FAMERP) e pelo Conselho Nacional de Ética em Pesquisa (CONEP).
O DNA genômico foi extraído a partir de 5mL de sangue periférico, segundo a técnica de Abdel-Rahman e col26. A amostra de sangue periférico foi colhida em tubo contendo anticoagulante (EDTA) e os linfócitos foram isolados com auxílio de Ficoll-Paque Plus. O DNA genômico foi obtido adicionando aos linfócitos isolados SDS (Sodium Dodecyl Sulfate), proteinase K e RNAse A. Após purificação com NaCl, o DNA foi precipitado com etanol e armazenado a 20ºC em tampão Tris-EDTA para posterior análise.
A análise para os genes GSTT1 e GSTM1 foi realizada simultaneamente pela reação em cadeia da polimerase (PCR) multiplex, segundo Abdel-Rahman e col27. A amplificação da seqüência do DNA de interesse foi obtida por 35 ciclos que compreenderam etapas de desnaturação do DNA a 94ºC por 2 minutos, anelamento das seqüências iniciadoras da reação (primers) a 59ºC por 1 minuto e extensão das cadeias de DNA pela adição dos nucleotídeos a 72ºC por 1 minuto. Uma seqüência do exon 7 do gene CYP1A1 foi coamplificada como um controle interno de amplificação. Os produtos de PCR foram analisados em gel de agarose 1,5% corado com brometo de etídio, sendo que o genótipo nulo (ambos alelos com deleção) para os genes GSTT1 e GSTM1 foi identificado pela ausência dos fragmentos de amplificação de 480 pares de base (pb) e 219 pb, respectivamente. A presença do fragmento de 312 pb corresponde à seqüência amplificada do gene CYP1A1 e revela o sucesso da reação de amplificação.
Para a análise estatística das freqüências dos genótipos obtidos, utilizou-se o teste Exato de Fisher, com nível de significância de 5%.
RESULTADOS
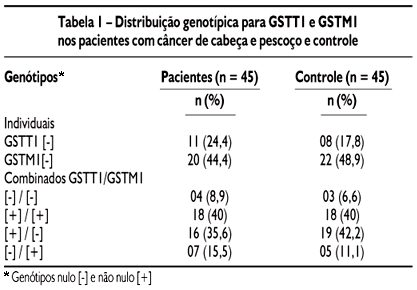
Freqüência dos polimorfismos: o genótipo GSTT1 nulo [-] foi encontrado em 24,4% (11 de 45) dos pacientes e em 17,8% (8 de 45) dos indivíduos controle (P = 0,606), e 20 (44,4%) dos 45 pacientes e 22 (48,9%) dos indivíduos controle revelaram genótipo GSTM1 nulo [-] (P = 0,832). O genótipo nulo combinado para os genes GSTT1 e GSTM1 foi observado em 8,9% (4 de 45) dos pacientes e em 6,7% (3 de 45) dos controle (P = 1,0). A combinação genotípica mais freqüente considerando a presença de um genótipo desfavorável (GST nulo) foi GSTT1 [+] / GSTM1 [-] em 35,6% (16 de 45) dos pacientes e 42,2% (19 de 45) dos controle (P = 0,757) (Tabela 1).
Os genótipos foram agrupados por sítio do tumor (Tabela 2) e não foi observada correlação com os genótipos nulos GSTT1 e GSTM1.
DISCUSSÃO
A disponibilidade de informações sobre os polimorfismos GSTT1 e GSTM1 na população brasileira é escassa. Rossit et al.28, em um estudo realizado na população brasileira proveniente dos estados do Pará e São Paulo, mostraram freqüências de 18% e 47,3% para os genótipos nulos dos genes GSTT1 e GSTM1, respectivamente. Em nosso estudo, freqüências similares foram observadas para estes genótipos (24,4% e 17,8% para GSTT1 [-] para pacientes e controle, respectivamente, e 44,4% e 48,9% para GSTM1 para pacientes e controle, respectivamente).
Os estudos dos polimorfismos GSTT1 e GSTM1 realizados em carcinomas de cabeça e pescoço são contraditórios. Vários autores demonstram uma associação com o genótipo nulo [-] GSTM114,13,19,29, 30,31, enquanto outros não5,15,32. Para o genótipo nulo [-] GSTT1 também foi demonstrada uma relação em alguns estudos14,19,33,34 e ausência desta em outros5,15,28,29,31. A combinação destes genótipos nulos e risco aumentado para este tipo de carcinoma também já foi observada13,31. Além disso, o tempo e a quantidade de exposição a carcinógenos (álcool e tabaco) podem influenciar na interação destes genótipos ao desenvolvimento deste tipo de neoplasia11,35, e esses dados não foram considerados em nosso estudo.
O estudo de Konig-Greger et al.36 mostrou que a atividade da enzima GSTM1 encontrava-se significantemente reduzida em pacientes com carcinoma de cabeça e pescoço em relação aos controle, mas não foi dependente do genótipo desfavorável GSTM1, o que pode sugerir a participação de outras enzimas em sua regulação.
Curiosamente, Evans et al.12 encontraram que o genótipo positivo [+] GSTT1 está associado ao risco de carcinoma espinocelular de cabeça e pescoço entre os tabagistas (OR = 1,6; CI 95% = 1,1-2,5) e sugerem que o genótipo nulo [-] GSTT1 pode proteger o indivíduo do desenvolvimento deste tipo de câncer. Embora usualmente as GSTs sejam consideradas enzimas de detoxificação, para alguns substratos químicos em particular, como por exemplo o diclorometano (DCM), a conjugação da glutationa com a enzima GSTT1 pode resultar em ativação de um componente eletrofílico com conseqüente potencial mutagênico37,38.. Embora o DCM não esteja associado com tabaco, podem existir outros bioprodutos do tabaco que ganhem função carcinogênica pela ativação mediada da enzima GSTT1. Dois outros estudos também mostraram risco aumentado de doença coronária e vascular periférica em tabagistas com genótipo GSTT1 [+]39,40.
CONCLUSÃO
Em nosso estudo não foi possível estabelecer a influência da nulidade dos genótipos GSTT1 e GSTM1 na carcinogênese em cabeça e pescoço.
Conflito de interesse: não há
Artigo recebido: 18/05/2005
Aceito para publicação: 19/05/2006
Trabalho realizado na Faculdade de Medicina de São José do Rio Preto FAMERP e no departamento de Biologia da Unidade de Pesquisa em Genética e Biologia Molecular, UPGEM São José do Rio Preto, SP
- 1. Walker DM, Boey G, McDonald, LA. The pathology of oral cancer. Pathology 2003;35:376-83.
- 2. Casiglia J, Woo SB. A comprehensive review of oral cancer. Gen Dent 2001;49:72-82.
- 3. Reichart PA. Identification of risk groups for oral precancer and cancer preventive measures. Clin Oral Investig 2001;5:207-13.
- 4. Ahmed KA, Robbins KT, Wong F, Salazar JE. Efficacy of concomitant chemoradiation and surgical salvage for N3 nodal disease associated with upper aerodigestive tract carcinoma. Laryngoscope 2000;110:1789-93.
- 5. Chang HW, Ling GS, Wei WI, Yuen AP. Smoking and drinking can induce p15 methylation in the upper aerodigestive tract of healthy individuals and patients with head and neck squamous cell carcinoma. Cancer 2004;101:125-32.
- 6. Hasnis E, Reznick AZ, Pollack S, Klein Y, Negler RM. Synergistic effect os cigarette smoke and saliva on lymphocytes: the mediatory role of volatile aldehydes and redox active iron and possible implications for oral cancer. Int J Biochem Cell Biol 2004;36:326-39.
- 7. Kjaerhim K, Gaard M, Andersen A. The role of alcohol, tobacco, and dietary factors in upper aerogastric tract cancers: a prospective study of 10.900 Norwegian men. Cancer Causes Control 1998;9:99-108.
- 8. Blot WJ, McLaughlin JK, Winn DM, Austin DF, Greenberg RS, Preston-Martin S, et al. Smoking and drinking in relation to oral and pharyngeal cancer. Cancer Res 1988;48:3282-7.
- 9. Maser E. Stress, hormonal changes, alcohol, food constituents and drugs: factors that advance the incidence of tobacco smoke-related cancer? Trends Pharmacol Sci 1997;18:270-5.
- 10. Anwar WA, Abdel-Rahman SZ, El-Zein RA. Genetic polymorphism of GSTM1, CYP2E1and CYP2D6 in egyptian bladder patients. Carcinogenesis 1996;17:1929-32.
- 11. Olshan, AF, Weissler MC, Watson MA, Bell DA. GSTM1, GSTT1, GSTP1, and NAT1 polymorphisms, tobacco use, and the risk of head and neck cancer. Cancer Epidemiol Biomakers Prev 2000; 9:185-191.
- 12. Evans AJ, Henner WD, Eilers KM, Montalto MA, Wersinger EM, Andersen PE, et al. Polymorphisms of GSTT1 and related genes in head and neck cancer risk. Head Neck 2004;26:63-70.
- 13. Gronau S, Koenig-Greger D, Jerg M, Riechelmann H. Gene polymorphism in detoxification enzymes as susceptibility factor for head and neck cancer? Otolaryngol Head Neck Surg 2003;128:674-80.
- 14. Amador AG, Righi PD, Radpour S, Everett ET, Weisberger E, Langer M, et al. Polymorphisms of xenobiotic metabolizing genes in oropharyngeal carcinoma. Oral Maxillofac Pathol 2002;93:440-5.
- 15. To-Figueras J, Gené M, Gómez-Catalán J, Piqué E, Borrego N, Caballero M, et al. Microssomal epoxide hydrolase and glutathione S-transferase polymorphism in relation to laryngeal carcinoma risk. Cancer Lett 2002;187:95-101.
- 16. Jourenkova-Mironova N, Voho A, Bouchardy C, Wikman H, Dayer P, Benhamou S, et al. Glutathione S-transferase GSTM3 and GSTP1 genotypes and larynx cancer risk. Cancer Epidemiol Biomakers Prev 1999;8:185-8.
- 17. Matthias C, Jahnke V, Jones PW, Hoban PR, Alldersea JE, Worrall SF, et al. Cyclin D1, Glutathione S-Transferase, and Cytocrome P450 genotypes and outcome in patients with upper aerodigestive tract cancers: assessment of the importance of individual genes using multivariate analysis. Cancer Epidemiol Biomakers Prev 1999;8:815-23.
- 18. Denissenko MF, Pao A, Tang M, Pfeifer GP. Preferential formation of benzo[a]pyrene adducts at lung cancer mutational hotspots in P53. Science 1996; 274:430-2.
- 19. Sreelekla TT, Ramadas K, Pandey M, Thomas G, Nalinakumari KR, Pillai MR. Genetic polymorphism of CYP1A1, GSTM1 and GSTT1 genes in Indian oral cancer. Oral Oncol 2001;37:593-8.
- 20. Nair UJ, Nair J, Mathew B, Bartsch H. Glutathione S-transferase M1 and T1 null genotypes as risk factors for oral leukoplakia in ethnic betel quid/tobacco chewers. Carcinogenesis 1999;20:743-8.
- 21. Pemble S, Schroeder K, Spencer S, Meyer DJ, Hallier E, Bolt HM, et al. Human glutathione S-transferase theta (GSTT1): DNA cloning and the characterization of a genetic polymorphism. Biochem J 1994;300:271-6.
- 22. Rossit ARB, Conforti-Froes NDT. Suscetibilidade genética, biometabolismo e câncer. Rev Soc Bras Cancerol 2000;10:22-30.
- 23. Bruhn C, Brockmoller J, Kerb R, Roots I, Borchert HH. Concordance between enzyme activity and genotype of glutathione S-transferases theta ( GSTT1). Biochem Pharmacol 1998;56:1189-93.
- 24. Seidgard J, Ekstrom G. The role of human gluthatione transferases and epoxide hydrolases in the metabolism of xenobiotics. Environ Health Perspect 1997;105:791-7.
- 25. Rebbeck T. Molecular epidemiology of the human glutathione S-transferase genotypes GSTM1 and GSTT1 in cancer susceptibility. Cancer Epidemiol Biomarkers Prev 1997;6:733-43.
- 26. Abdel-Rahman SZ, Nouraldeen AM, Ahmed AE. Molecular interaction of 2,3-[14c]-acrylonitrile with DNA in gastric tissues of rat. J Biochem Toxicol 1994;9:121-8.
-
27Abdel-Rahman SZ, El-Zein RA, Anwar NA. WW: Multiples PCR procedure for polymorphic analisys of GSTM1 and GSTT1 genes in population studies. Cancer Lett 1996;107:229-33.
-
28Rossit ARB, Cabral IR, Conforti-Froes NDT. Avaliação das freqüências alélicas de genes do biometabolismo em uma população brasileira. Genet Mol Biol 1999;22:23.
- 29. Buch SC, Notani PN, Bhisey RA. Polymorphism at GSTM1, GSTM3 and GSTT1 gene loci and susceptibility to oral cancer in an indian population. Carcinogenesis 2002;23:803-7.
- 30. Kietthubthew S, Sriplung H, Au WW. Genetic and environmental interactions on oral cancer in Southern Thailand. Environ Mol Mutagen 2001; 37:111-116.
- 31. Hong YJ, Lee JK, Lee GH, Hong SI. Influence of glutathione S-transferase M1 and T1 genotypes on larinx cancer risk among Korean smokers. Clin Chem Lab Med 2000;38:917-19.
- 32. McWilliams JE, Evans AJ, Beer TM, Andersen PE, Cohen JI, Everts EC, et al. Genetic polymorphisms in head and neck cancer risk. Head Neck 2000;22:609-17.
- 33. Hamel N, Karimi S, Hebert-Blouin MN, Brunet JS, Gilfix B, Ghadirian P, et al. Increased risk of head and neck cancer in association with GSTT1 nullizygosity for individuals with low exposure to tobacco. Int J Cancer 2000;87:452-4.
- 34. Drummond SN, Gomez RS, Noronha JCM, Pordeus IA, Barbosa AA, De Marco L. Association between GSTT-1 gene deletion and the susceptibility to oral squamous cell carcinoma in cigarette-smoking subjects Oral Oncol 2005;41:5159.
- 35. Lazarus P, Park JY. Metabolizing enzyme genotype and risk for upper aerodigestive tract cancer. Oral Oncol 2000;36:421-31.
- 36. Konig-Greger D, Riechelmann H, Wittich U, Gronau S. Genotype and phenotype of glutathione-S-transferase in patients with head and neck carcinoma. Otolaryngol Head Neck Surg 2004;130:718-25.
- 37. Sherratt PJ, Manson MM, Thomson AM, Hissink EA, Neal GE, Van Bladeren PJ, et al. Increased bioactivation of dihaloalkanes in rat liver due to induction of class theta glutathione S-transferase T1-1. Biochem J 1998;335:619-30.
- 38. Landi S. Mammalian class theta GST and differential susceptibity to carcinogens: a review. Mutat Res 2000;463:247-83.
- 39. Li R, Boerwinkle E, Olshan AF, Chambless LE, Pankow JS, Tyroler HA, et al. Increased bioactivation of dihaloalkanes in rat liver due to induction of class theta glutathione S-transferase T1-1. Biochem J 1998;335:619-30.
- 40. Li R, Folsom AR, Sharrett AR, Couper D, Bray M, Tyroler HA. Interaction of the glutathione S-transferase genes and cigarrete smoking on risk of lower extremity arterial disease: the Atherosclerosis Risk in Communities (ARIC) study. Atherosclerosis 2001;154:729-38.
Datas de Publicação
-
Publicação nesta coleção
08 Dez 2006 -
Data do Fascículo
Out 2006
Histórico
-
Aceito
19 Maio 2006 -
Recebido
18 Maio 2005