Resumos
OBJETIVOS: Quantificar glicosaminoglicanos sulfatados (GAGs) no útero de camundongas durante o ciclo estral. MÉTODOS: Utilizaram-se quatro grupos de camundongas virgens com 100 dias de idade (n= 10 cada) conforme a fase ciclo estral: proestro, estro, metaestro e diestro. Amostras da porção média dos cornos uterinos foram preparadas para observação em microscopia de luz (H/E e Alcian blue + PAS). Os GAGs foram extraídos e caracterizados por eletroforese em gel de agarose. Os dados foram analisados pelo teste t de Student não pareado. RESULTADOS: À microscopia de luz, os GAGs sulfatados apresentam-se em todas as camadas do útero, em especial no endométrio, entre as fibras colágenas, na membrana basal e ao redor dos fibroblastos. A análise bioquímica mostrou haver dermatam sulfato (DS), condroitim sulfato (CS) e heparam sulfato (HS) durante todas as fases do ciclo estral. Não houve separação eletroforética clara entre DS e CS, de modo que estes dois GAGs foram considerados em conjunto (DS+CS) (proestro = 0,854 ± 0,192; estro = 1,073 ± 0,254; metaestro = 1,003 ± 0,255; e diestro = 0,632 ± 0,443 µg/mg). Os resultados de HS foram: proestro = 0,092 ± 0,097; estro = 0,180 ± 0,141; metaestro = 0,091 ± 0,046; e diestro = 0,233 ± 0,147 µg/mg. A concentração DS+CS apresentou-se maior no estro (ação estrogênica) e a do HS no diestro (ação progestagênica). CONCLUSÃO: Os GAGs no útero de camundongas sofrem alterações durante as fases do ciclo estral, refletindo o constante processo de renovação, sendo modulados pelos hormônios sexuais.
Glicosaminoglicanos sulfatados; Útero; Ciclo estral; Camundongas
OBJECTIVE: Identification and quantitation of sulphated glycosaminoglycans (GAGs) in the uterus of female mice during the estrous cycle. METHODS: Four groups (n = 10 each) of virgin, 100-day old female mice were assembled according to the estrous cycle phase: proestrus, estrus, metaestrus and diestrus. Samples of the median portion of uterine horns were processed for light microscopy examination (H/E and Alcian blue + PAS). The GAGs were extracted and characterized by agarose gel electrophoresis. Data were analyzed by the unpaired Student's t-test. RESULTS: At light microscopy GAGs appear in all layers of the uterus, especially in the endometrium, between collagen fibers, in the basal membrane and around fibroblasts. Biochemical analyses disclosed presence of dermatan sulphate (DS), chondroitin sulphate (CS and heparan sulphate (HS) during all estral cycle phases. There was no clear electrophoretic separation between DS and CS, thus these two GAGs were considered together (DS+CS) (proestrus = 0.854 ± 0.192; estrus = 1.073 ± 0.254; metaestrus = 1.003 ± 0.255; diestrus = 0.632 ± 0.443 µg/mg). HS was as follows: proestrus = 0.092 ± 0.097; estrus = 0.180 ± 0.141; metaestrus = 0.091 ± 0.046; diestrus = 0.233 ± 0.147 µg/mg. The uterine content of DS+CS peaked at estrus (estrogenic action) and that of HS at diestrus (progestagen action). CONCLUSION: Due to a constant turnover process, there are definite alterations in the uterine profile of GAGs content during the estrous cycle in mice, which may be modulated by female sex hormones.
Sulphated glycosaminoglycans; Uterus; Estrous cycle; Mice
ARTIGO ORIGINAL
Perfil de glicosaminoglicanos sulfatados no útero de camundongas durante o ciclo estral
Profile of sulphated glycosaminoglycans content in the murine uterus during the different phases of the estrous cycle
Regina Célia Teixeira Gomes; Ricardo Santos Simões; José Maria Soares Júnior; Helena Bonciani Nader; Manuel de Jesus Simões; Edmund C. Baracat* * Correspondência Departamento de Ginecologia da UNIFESP-EPM Rua Borges Lagoa, 783, cj 31, 3º andar Vila Clementino, São Paulo, SP CEP: 04038-031
RESUMO
OBJETIVOS: Quantificar glicosaminoglicanos sulfatados (GAGs) no útero de camundongas durante o ciclo estral.
MÉTODOS: Utilizaram-se quatro grupos de camundongas virgens com 100 dias de idade (n= 10 cada) conforme a fase ciclo estral: proestro, estro, metaestro e diestro. Amostras da porção média dos cornos uterinos foram preparadas para observação em microscopia de luz (H/E e Alcian blue + PAS). Os GAGs foram extraídos e caracterizados por eletroforese em gel de agarose. Os dados foram analisados pelo teste t de Student não pareado.
RESULTADOS: À microscopia de luz, os GAGs sulfatados apresentam-se em todas as camadas do útero, em especial no endométrio, entre as fibras colágenas, na membrana basal e ao redor dos fibroblastos. A análise bioquímica mostrou haver dermatam sulfato (DS), condroitim sulfato (CS) e heparam sulfato (HS) durante todas as fases do ciclo estral. Não houve separação eletroforética clara entre DS e CS, de modo que estes dois GAGs foram considerados em conjunto (DS+CS) (proestro = 0,854 ± 0,192; estro = 1,073 ± 0,254; metaestro = 1,003 ± 0,255; e diestro = 0,632 ± 0,443 µg/mg). Os resultados de HS foram: proestro = 0,092 ± 0,097; estro = 0,180 ± 0,141; metaestro = 0,091 ± 0,046; e diestro = 0,233 ± 0,147 µg/mg. A concentração DS+CS apresentou-se maior no estro (ação estrogênica) e a do HS no diestro (ação progestagênica).
CONCLUSÃO: Os GAGs no útero de camundongas sofrem alterações durante as fases do ciclo estral, refletindo o constante processo de renovação, sendo modulados pelos hormônios sexuais.
Unitermos: Glicosaminoglicanos sulfatados. Útero. Ciclo estral. Camundongas.
SUMMARY
OBJECTIVE: Identification and quantitation of sulphated glycosaminoglycans (GAGs) in the uterus of female mice during the estrous cycle.
METHODS: Four groups (n = 10 each) of virgin, 100-day old female mice were assembled according to the estrous cycle phase: proestrus, estrus, metaestrus and diestrus. Samples of the median portion of uterine horns were processed for light microscopy examination (H/E and Alcian blue + PAS). The GAGs were extracted and characterized by agarose gel electrophoresis. Data were analyzed by the unpaired Student's t-test.
RESULTS: At light microscopy GAGs appear in all layers of the uterus, especially in the endometrium, between collagen fibers, in the basal membrane and around fibroblasts. Biochemical analyses disclosed presence of dermatan sulphate (DS), chondroitin sulphate (CS and heparan sulphate (HS) during all estral cycle phases. There was no clear electrophoretic separation between DS and CS, thus these two GAGs were considered together (DS+CS) (proestrus = 0.854 ± 0.192; estrus = 1.073 ± 0.254; metaestrus = 1.003 ± 0.255; diestrus = 0.632 ± 0.443 µg/mg). HS was as follows: proestrus = 0.092 ± 0.097; estrus = 0.180 ± 0.141; metaestrus = 0.091 ± 0.046; diestrus = 0.233 ± 0.147 µg/mg. The uterine content of DS+CS peaked at estrus (estrogenic action) and that of HS at diestrus (progestagen action).
CONCLUSION: Due to a constant turnover process, there are definite alterations in the uterine profile of GAGs content during the estrous cycle in mice, which may be modulated by female sex hormones.
Key words: Sulphated glycosaminoglycans. Uterus.Estrous cycle. Mice.
INTRODUÇÃO
Há muito os glicosaminoglicanos (GAGs) vêm despertando interesse clínico em todas as áreas da medicina, pois consoante seu importante papel no reconhecimento celular, na migração, na proliferação e diferenciação celular estariam direta ou indiretamente envolvidos com tumores, metástases, angiogênese, reações imunológicas, desenvolvimento folicular e infertilidade, entre outros1-6.
A matriz extracelular é um conjunto de agregados supramoleculares constituídos por uma rede molecular contendo colágeno, glicoproteínas, proteoglicanos e GAGs que mantêm as células associadas possibilitando a organização dos tecidos e a sobrevivência celular7.
Os proteoglicanos (PGs) são formados por um esqueleto protéico, ao qual estão covalentemente ligadas as cadeias de GAGs presentes na matriz extracelular, na superfície celular e na membrana com domínio intracelular8-9.
Os GAGs possibilitam várias funções, tais como a hidratação dos espaços ao redor das células, formando géis que variam quanto ao tamanho dos poros e a densidade da carga que atua como filtro regulador da passagem de moléculas pelo meio extracelular, ligando fatores de crescimento e outras proteínas que servem como sinais para as células, com a função de bloquear, ativar ou guiar a migração celular através da matriz10
O primeiro estudo sobre a distribuição dos GAGs sulfatados no útero humano ocorreu em 196211. Mais recentemente, outros pesquisadores estudaram o miométrio de mulheres no período reprodutivo, na gravidez e na pós-menopausa, e observando que os GAGs constituintes da matriz compreendiam heparam sulfato, dermatam sulfato e condroitim sulfato, porém não notaram variações em suas concentrações nas diferentes fases do ciclo reprodutivo, exceto por significativa diminuição dos GAGs durante a gestação e pelo aumento do condroitim sulfato no leiomioma e no leiomiossarcoma6,12.
Na área experimental, acreditamos que pesquisas realizadas em animais nas diferentes fases do ciclo estral permitiriam elucidar a ação dos hormônios esteróides (estrogênio e progesterona) sobre os componentes da matriz extracelular para podermos compreender melhor as patologias do trato reprodutivo13-17.
A análise dos GAGs sulfatados no útero de ratas sob a ação do 17bestradiol ou da progesterona identificou como constituintes normais o condroitim 4 ou 6 sulfato, o dermatam sulfato e o heparam sulfato18. Quando os animais foram tratados com 17bestradiol foi encontrado, de maneira geral, maior concentração de GAGs, havendo aumento mais acentuado do condroitim 4 ou 6 sulfato em relação ao dermatam sulfato13-14.
Pesquisas com cultura de células do epitélio uterino de ratas mostraram produção e secreção do queratam sulfato e heparam sulfato e em cultura de células de estroma uterino de camundongas, observou ser o condroitim sulfato o glicosaminoglicano mais secretados por estas células19-20.
Contudo, são poucos os trabalhos que quantificaram e relacionaram os GAGs sulfatados com as fases do ciclo estral, em úteros de camundongas.
Este trabalho teve por objetivo avaliar alterações morfológicas, bem como a caracterização e quantificação dos GAGs sulfatados no útero de camundongas durante o ciclo estral.
MÉTODOS
Este estudo foi realizado na Disciplina de Histologia da Universidade Federal de São Paulo Escola Paulista de Medicina (UNIFESP EPM) e aprovado pelo Comitê de Ética e Pesquisa (Projeto nº 0809/04). Para tanto, foram utilizadas camundongas (Mus musculus), adultas, com 100 dias de idade, virgens, procedentes do Centro de Desenvolvimento de Modelos Experimentais para Medicina e Biologia (CEDEME) da (UNIFESP EPM).
Todos os animais foram mantidos, em número de 20 por gaiola, alimentação e água ad libitum, em temperatura ambiente de 22ºC, iluminação artificial produzida por lâmpadas fluorescente marca Phillips (modelo luz do dia de 40 W), sendo o fotoperíodo de 12 horas claro e 12 horas escuro, considerando o período de luz das 7h00 às 19h00.
Após uma semana de adaptação ao novo ambiente, foram colhidos esfregaços vaginais, diários, durante oito dias consecutivos para monitorizar a periodicidade do ciclo estral. Os esfregaços eram distribuídos em lâminas de vidro, fixados em solução de álcool-éter (1:1), sendo então submetidos à coloração pelo Harris-Shorr.
Em seguida, 40 animais foram divididos, aleatoriamente, em quatro grupos, com dez animais cada, a saber: proestro, estro, metaestro e diestro.
As camundongas foram inicialmente anestesiadas com xilasina (1 mg/Kg) e ketamina (1 mg/Kg), sacrificadas e imediatamente retirados os cornos uterinos, após abertura da cavidade abdomino-pélvica. Fragmentos do terço médio dos cornos uterinos foram mergulhados em formaldeído a 10%, tamponado, para análise morfológica e histoquímica, e o restante dos cornos uterinos destinados à análise bioquímica, conservados em acetona.
Análise morfológica
Após fixação, os fragmentos dos cornos uterinos foram convenientemente desidratados em concentrações crescentes de álcool etílico, diafanizados pelo xilol e impregnados em parafina. Cortes de 3 mm foram submetidos ao método de coloração pela Hematoxilina e Eosina (H.E) para descrição morfológica e outros dois cortes de cada corno uterino foram submetidos aos métodos do Alcian Blue (pH 1,0) e do ácido periódico de Schiff (PAS), para identificação e localização prévia dos GAGs.
Análise bioquímica
A análise bioquímica para caracterização e quantificação dos GAGs foi realizada no Departamento de Bioquímica, Disciplina de Biologia Molecular da Universidade Federal de São Paulo Escola Paulista de Medicina (UNIFESP EPM).
Após a remoção, fragmentos dos cornos uterinos foram mergulhados em acetona e mantidos overnight a 4ºC. A seguir, de fragmentados secos foram extraídos os GAGs sulfatados, segundo metodologia desenvolvida por Aguiar et al.21.
A identificação de cada glicosaminoglicano sulfatado foi realizada tendo como parâmetros padrões conhecidos e purificados de condroitim 4-sulfato extraído de cartilagem de baleia, condroitim 6-sulfato extraído de cartilagem de tubarão e dermatam sulfato extraído da mucosa intestinal bovina (Seikagaku Kogyo Co - Tóquio, Japão); heparam sulfato de pulmão bovino (purificado na Disciplina de Biologia Molecular da UNIFESP-EPM).
Como controle, foi realizada degradação enzimática dos GAGs sulfatados com condroitinases, isoladas da F. heparinum, com a finalidade de degradar GAGs sulfatados e não sulfatados e, assim, se tornaram importantes instrumentos para identificação e análise da estrutura de GAGs de diferentes origens22.
Para a caracterização do dermatam sulfato e do condroitim sulfato foram utilizadas as enzimas condroitinase AC e a condroitinase ABC22.
Os produtos da incubação foram submetidos à migração eletroforética em gel de agarose. A confirmação do tipo de glicosaminoglicano foi feita pela ação da enzima específica na eletroforese no gel de agarose.
Estes mesmos padrões também foram usados para a determinação quantitativa das amostras, através de densitometria a 525 nm. Os resultados foram expressos em mg de GAGs por mg de pó cetônico (Figura 3).
Os resultados obtidos foram submetidos à análise de variância seguida pelo teste t de Student, não pareado. Utilizou-se o nível de significância menor ou igual a 5% para rejeição da hipótese de nulidade (a < ,05).
RESULTADOS
Morfológicos
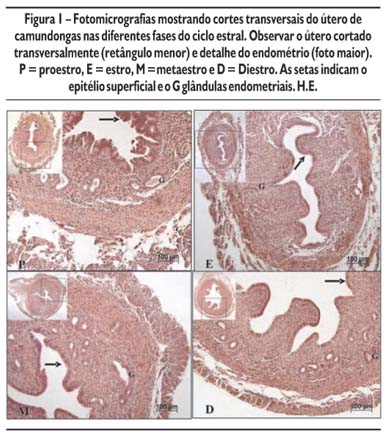
No proestro, o endométrio apresenta-se bem desenvolvido, revestido internamente por epitélio cilíndrico simples, e no estroma, inúmeras glândulas endometriais, bem dilatadas, algumas contendo material no seu interior. O estroma endometrial mostra-se rico em células com núcleos volumosos e eucromáticos. No estro, o útero mostra-se ainda desenvolvido, sendo o endométrio revestido internamente por epitélio cilíndrico simples, contendo células com núcleos volumosos. Na lâmina própria identificam-se glândulas endometriais e o estroma rico em células com núcleos volumosos e entre elas inúmeros eosinófilos. No metaestro, o útero encontra-se pouco desenvolvido, o endométrio está revestido internamente por epitélio cilíndrico simples contendo núcleos heterocromáticos, entre as células epiteliais observa-se infiltração leucocitária. O estroma endometrial mostra-se rico em células com núcleos heterocromáticos. No diestro, o útero acha-se pouco desenvolvido revestido internamente por epitélio cilíndrico simples com inúmeras figuras de mitose. O endométrio apresenta projeções para o seu lúmen. O estroma mostra-se rico em células com núcleos volumosos e eucromáticos (Figura 1).
O método do PAS associado ao AB pH 1,0 mostrou a presença de GAGs no útero de camundongas em todas as fases do ciclo estral, sendo a reatividade maior no endométrio do que nas outras camadas. No endométrio identificamos forte reatividade ao AB no pólo apical das células epiteliais, membrana basal, entre os feixes de colágeno e ao redor dos fibroblastos (Figura 2).
Bioquímicos
Encontramos no útero de camundongadas os seguintes GAGs sulfatados: condroitim sulfato (CS), dermatam sulfato (DS) e heparam sulfato (HS) caracterizados pela migração eletroforética em gel de agarose e degradação por enzimas específicas.
Na comparação entre as diversas fases estudadas foi observado aumento do CS e DS na fase de estro (1,073 ± 0,254* µg/mg com p d" 0,05) em relação às outras fases do ciclo estral (proestro 0,845 ± 0,192, metaestro 1,003 ± 0,255 e diestro 0,632 ± 0,443 µg/mg). Em relação ao heparam sulfato obtivemos aumento na fase de diestro (0,233 ± 0,147* µg/mg com p d" 0,02), em relação às outras fases (proestro = 0,233 ± 0,147; estro = 0,180 ± 0,141; metaestro = 0,091 ± 0,046 µg/mg) (Tabela 1 e Figuras 3 e 4).
DISCUSSÃO
O útero, em especial a camada endométrial, de camundongas sofre modificações morfológicas e bioquímicas sob efeito dos esteróides ovarianos (estrogênios e progestagênios), bem como dos hormônios da adeno-hipófise (FSH, LH e da prolactina) durante o ciclo estral23. Nestes animais, a citologia vaginal é considerada um bom parâmetro de referência para se observar a ação que as alterações hormonais induzem nos diversos órgãos do sistema genital feminino, de tal maneira, que o ciclo é dividido em quatro fases, o proestro, estro, metaestro e diestro23.
Em nossos resultados morfológicos notamos endométrio bem desenvolvido nas fases de proestro e de estro, sendo que nesta última notamos no estroma endometrial intensa infiltração leucocitária representada pelos eosinófilos. Devemos mencionar que a infiltração por eosinófilos no útero está na dependência dos níveis de estrogênios circulantes, servindo como um marcador hormonal24. Já nas fases de proestro e de diestro notamos atrofia endometrial.
Dos vários GAGs existentes na natureza, os principais GAGs sulfatados encontrados em mamíferos são o condroitim 4 e 6 sulfato (CS), dermatam sulfato (DS), heparam sulfato (HS), heparina (HEP) e queratam sulfato (QS)2,7.
Cidadão et al.18 estudaram pela imunohistoquimica o padrão de distribuição dos GAGs, no útero de camundongas sob ação do estradiol e da progesterona e notaram que a administração simultânea destes hormônios induz mudanças prevalecentes na sulfatação dos CS adjacentes à proteína principal do estroma.
Potter e Morris16 estudaram pela imunohistoquímica a presença de heparam sulfato no útero de camundongas durante o ciclo estral; notaram haver distribuição regular do HS acompanhando as mudanças hormonais, no entanto não realizaram quantificação.
Nas análises bioquímicas do tecido uterino em nosso experimento encontramos condroitim sulfato, dermatam sulfato e heparam sulfato. Deve ser ressaltado que o condroitim sulfato e dermatam sulfato aparecem em maior quantidade em relação ao heparam sulfato nas diferentes fases do ciclo estral. Pela análise histoquímica notamos maior positividade dos GAGs sulfatados no endométrio.
Na fase de estro, a concentração do condroim sulfato e do dermatam sulfato no útero foi maior em relação às outras fases do ciclo. Devemos ressaltar que o pico de estradiol ocorre na fase de proestro, no entanto, acreditamos que devido a atividade celular ser um pouco mais lenta, sua ação secretora só aparece na fase de estro, visto o esfregaço vaginal aparecer cornificado nesta fase. A grande concentração destes GAGs no estro pode explicar o aumento macroscópico observado no útero desses animais por essa ocasião, visto que os GAGs estão relacionados com a hidratação tecidual. No entanto, acreditamos que estas macromoléculas devem desempenhar sua principal função no processo de implantação.
A ação dos hormônios sexuais sobre os GAGs no útero, em especial o condroitim sulfato e o dermatam sulfato, já foi descrito em útero de ratas ooforectomizas por Kofoed et al.14 e Simões et al.25. Estes autores relataram que os estrogênios isoladamente aumentam a concentração do dermatam sulfato, por outro lado, verificaram que a associação do estrogênio + progesterona promove diminuição do dermatam sulfato e do heparam sulfato, enquanto a progesterona isoladamente promove a diminuição apenas do heparam sulfato.
Uma das funções do condroitim-sulfato parece estar relacionada com o deslocamento celular, orientando-as durante sua migração e impedindo o contato intercelular1,4. Já o dermatam sulfato talvez seja o principal GAG associado ao colágeno, estando envolvido inclusive com a organização e fibrilogênese desta proteína3, daí notarmos na lâmina própria fibroblastos contendo núcleos volumosos e eucromáticos indicando intensa atividade de síntese.
Em nosso experimento a concentração do heparam sulfato mostrou-se maior no diestro em relação às demais fases. Este achado muito provavelmente relaciona-se ao fato de que é nesta fase que se encontram aumentados os níveis de progesterona, sendo que ao seu final inicia-se o aumento do estradiol. De fato, sabe-se que é o diestro a fase em que ocorre maior proliferação dos epitélios luminal e glandular17.
Comparando as curvas hormonais existentes com as dosagens do condroitim sulfato e do dermatam sulfato, é plausível inferir que estes GAGs estão sob ação dos estrogênios; ao passo que o heparam sulfato estaria sob a ação da progesterona26.
O heparam sulfato aparece na face externa da membrana celular e, desta maneira além de manter a célula hidratada, liga-se a proteínas da matriz extracelular e a fatores de crescimento estabelecendo contato com ligantes da matriz. Pode estar ainda associado a uma proteína integral de membrana formando um proteoglicano denominado de sindecam, que está envolvido com a sinalização celular por intermédio de integrinas e receptores ligados à tirosina quinase que estão envolvidas na atividade de replicação5,27.
Alguns trabalhos sugerem que o heparam sulfato desempenha papel importante na diferenciação, reconhecimento, adesão e sinalização celular atuando como co-receptor juntamente com as integrinas e moléculas de adesão, entre as quais estão incluídas a fibronectina, vitronectina, lamininas e fibrilas colágenas1,5,9. Vários trabalhos relacionam a associação de moléculas de heparam com fatores de crescimento, principalmente na interação célula-célula que tem papel fundamental na implantação do embrião, visto que ele e suas correspondentes proteínas ligantes apóiam a fase inicial da fixação do embrião ao epitélio uterino3,28.
No endométrio humano, estudos imunohistoquímicos realizados nas fases proliferativa e secretora revelaram a presença de condroitim sulfato distribuído por todo o estroma, aparecendo também ao redor dos vasos sangüíneos e das glândulas endometriais. Deve ser mencionado que estes autores relatam ainda a ocorrência de pequenas quantidades de heparam sulfato e de dermatam sulfato associados ao condrotim sulfato. No entanto não encontraram diferenças qualitativas de tais GAGs entre as duas fases. A sugestão dos autores é que os GAGs, durante o ciclo menstrual, estariam relacionadas com o crescimento e remodelação do endométrio humano6.
Em suma, nossos dados mostram haver alterações nas concentrações dos GAGs sulfatados da matriz extracelular uterina de camundongas nas diferentes fases do ciclo estral, que podem ajudar a entender a fisiologia endometrial.
Nossos dados mostram a existência de flutuações no perfil relativo das concentrações de GAGs sulfatados da matriz extracelular uterina de camundongas nas diferentes fases do ciclo estral. Visto que esta ciclagem é hormônio-dependente, sugere-se a forte possibilidade de tais flutuações serem devidas às diferentes relações de concentração entre estrogênios e progestagênios ao longo do ciclo estral desse animal
CONCLUSÃO
Os GAGs presentes no útero de camundongas sofrem alterações durante as fases do ciclo estral, refletindo o constante processo de renovação, com degradação e re-síntese de seus componentes, estando sob ação dos hormônios sexuais.
Conflito de interesse: não há
Artigo recebido: 29/11/06
Aceito para publicação: 30/01/07
Trabalho realizado nos Departamentos de Bioquímica, Morfologia e Ginecologia da Universidade Federal de São Paulo (UNIFESP)
- 1. Dietrich CP. A model for cell- cell recognition and control of cell growth mediated by sulfated glycosaminoglicans. Braz J Med Biol Res. 1984;17:5-15.
- 2. Esko JD. Genetic analysis of proteoglycan structure, function and metabolism. Curr Opin Cell Biol. 1991;3:805-6.
- 3. Greca CD, Nader HB, Dietrich CP, Abrahamsohn PA, Zorn TM. Ultrastructural cytochemical characterization of collagen-associated proteoglycans in the endometrium of mice. Anat Rec. 2000;259:413-23.
- 4. Dutt S, Matasci M, Sommer L, Zimmermann DR. Guidance of neural crest cell migration: the inhibitory function of the chondroitin sulfate proteoglycan, versican. Sci World J. 2006;6:1114-7.
- 5. Lopes CC, Dietrich CP, Nader HB. Specific structural features of syndecans and heparan sulfate chains are needed for cell signaling. Braz J Med Biol Res. 2006;39:157-67.
- 6. Nasciutti LE, Ferrari R, Berardo PT, Souza ML, Takiya CM, Borojevic R, et al. Distribution of chondroitin sulfate in human endometrium. Micron. 2006; 37:544-50.
- 7. Bulow HE, Hobert O. The molecular diversity of glycosaminoglycans shapes animal development. Annu Rev Cell Dev Biol. 2006;22:375-407.
- 8. Aono S, Tokita Y, Yasuda Y, Hirano K, Yamauchi S, Shuo T, et al. Expression and identification of a new splice variant of neuroglycan C, a transmembrane chondroitin sulfate proteoglycan, in the human brain. J Neurosci Res. 2006;83:110-8.
- 9. Cattaruzza S, Perris R. Approaching the proteoglycome: molecular interactions of proteoglycans and their functional output. Macromol Biosci. 2006;6:667-80.
- 10. Kresse H, Schönher E. Proteoglycans of the extracellular matrix and growth control. J Cell Physiol. 2001;189:266-74.
- 11. Loewi G, Consden R. Acid mucopolysaccharides of the uterus. Nature. 1962;195:148-50.
- 12. Chen MJ, Peng Y, Yang YS, Huang SC, Chow SN, Torng PL. Increased hyaluronan and CD44 expressions in intravenous leiomyomatosis. Acta Obstet Gynecol Scand. 2005; 84:322-8.
- 13. Kofoed JA, Houssay AB, Tocci A A, Curbelo HM. Effects of oestrogens upon glycosaminoglycans in uterus of rats. Acta Endocrinol. 1972; 69:87-94.
- 14. Kofoed JA, Houssay, AB, Tocci AA, Curbelo HM, Barcelo C. Effects of acetoxyprogesterone upon glycosaminoglycans in uterus and salivary glands of rats. Horm Metab Res. 1977;9:58-9.
- 15. Takata K, Terayama H. Hormonal effect on glycosaminoglycans and glycoproteins in uteri of ovariectomized rats. Biochim Biophys Acta. 1977;500:333-43.
- 16. Potter SW, Morris JE. Changes in histochemical distribution of cell surface heparan sulfate proteoglycan in mouse uterus during estrous cycle and early pregnancy. Anat Rec. 1992;234:383-90.
- 17. Mendoza-Rodriguez CA, Merchant-Larios H, Segura-Valdez ML, Moreno-Mendoza N, Cruz ME, Arteaga-Lopez P, et al. C-fos and estrogen receptor gene expression pattern in the rat uterine epithelium during the estrous cycle. Mol Reprod Dev. 2003;64:379-88.
- 18. Cidadão AJ, Thorsteinsdottir S, Ferreira DJF. Immunocytochemical study of tissue distribution and hormonal control of chondroitim, dermatan and keratan sulfate from rodent uterus. Eur J Cell Biol. 1990;52:105-16.
- 19. Jacobs AL, Carson DD. Proteoglycan synthesis and metabolism by mouse uterine stroma cultured in vitro. J Biol Chem. 1991;266:15464-73.
- 20. Carson DD, Tang JP, Julian J, Glasser SR. Vectorial secretion of proteoglycans by polarized rat uterine epithelial cells. J Cell Biol. 1988;107:2425-35.
- 21. Dietrich CP, Dietrich SMC. Eletrophoretic behaviour of acidic mucopolysaccharides in diamine buffers. Anal Biochem. 1976;70:645-7.
- 22. Aguiar JAK, Lima CR, Berto AGA, Michelacci YM. An improved methodology to produce Flavobacterium heparinum condroitinases, important instruments for diagnosis of diseases. Biotechnol Appl Biochem. 2003;37:115-27.
- 23. Rossi AG, Soares JM Jr, Motta EL, Simões MJ, Oliveira-Filho RM, Rodrigues GL, et al. Metoclopramide-induced hyperprolactinemia affects mouse endometrial morphology. Gynecol Obstet Invest. 2002;54:185-90.
- 24. Gouon-Evans V, Pollard JW. Eotaxin is required for eosinophil homing into the stroma of the pubertal and cycling uterus. Endocrinology. 2001;142:4515-21
- 25. Simoes MJ, Simões RS, Nader HB, Soares Jr JM, Baracat, EC. Histomorphological analysis and characterization of glycosaminoglycans of adult castrated rat uteri treated with estrogen, progestogen and raloxifene. Climateric. 2002; 5:144.
- 26. Kelley RL, Kind KL, Lane M, Robker RL, Thompson JG, Edwards LJ. Recombinant human follicle-stimulating hormone alters maternal ovarian hormone concentrations and the uterus and perturbs fetal development in mice. Am J Physiol Endocrinol Metab. 2006;291:E761-70.
- 27. Moreira CR, Lopes CC, Cuccovia IM, Porcionatto MA, Dietrich CP, Nader HB. Heparan sulfate and control of endothelial cell proliferation: increased synthesis during the S phase of the cell cycle and inhibition of thymidine incorporation induced by ortho-nitrophenyl-beta-D-xylose. Biochim Biophys Acta. 2004;1673:178-85.
- 28. Hjelm Cluff A, Malmstrom A, Tingaker B, David G, Ekman-Ordeberg G. Normal labor associated with changes in uterine heparan sulfate proteoglycan expression and localization. Acta Obstet Gynecol Scand. 2005;84:217-24.
Datas de Publicação
-
Publicação nesta coleção
31 Jul 2007 -
Data do Fascículo
Jun 2007
Histórico
-
Recebido
29 Nov 2006 -
Aceito
30 Jan 2007