Resumos
As polimixinas são antibióticos polipeptídeos com potente ação sobre várias bactérias gram-negativas. O seu uso foi praticamente abandonado entre 1970 e 1980, em virtude do aparecimento de drogas com menor toxicidade. Com o aparecimento de bactéria gram-negativas multirresistentes, principalmente em pacientes internados em unidades de terapia intensiva, e a ausência de novos antimicrobianos para combater esses patógenos, renovou-se o interesse pelas polimixinas nos últimos anos. O principal efeito adverso desta classe de antibióticos é a nefrotoxicidade. Atualmente, somente as polimixinas B e E são utilizadas na prática clínica. A polimixina E é conhecida como colistina e utilizada na forma de colestimetato de sódio com o intuito de reduzir sua nefrotoxicidade, sendo o composto mais utilizado e mais estudado. Não existem dados consistentes sobre a prevalência de leão renal associada ao uso das polimixinas ou sobre os fatores de risco para desenvolvimento de nefrotoxicidade desses antibióticos. A proposta deste artigo é rever os principais aspectos de farmacodinâmica das polimixinas, prover um melhor entendimento dos seus mecanismos de nefrotoxicidade e comparar as diferentes prevalências de lesão renal descritas com o uso desta classe de antibióticos.
Polimixina B.; Colistina; Insuficiência renal aguda; Nefrotoxicidade
Polymyxins are polypeptide antibiotics with strong action against Gram-negative bacteria. Their use was almost halted between 1970 and 1980 due to the launching of less toxic compounds. The emergence of multiresistant Gram-negative bacterial strains, mainly in patients hospitalized in intensive care units, and the absence of new antimicrobials effective against these pathogens, renewed interest in polymyxins in recent years. The major adverse effect of this class of antibiotics is nephrotoxicity. Currently, only polymyxins B and E are used in clinical practice. Polymyxin E, the compound more employed and studied, is known as colistin and is used in the form of sodium colistimethate, for the purpose of reducing its nephrotoxicity. There is no consistent data about prevalence of renal injury associated with use of the polymyxins or about the risk factors to develop nephrotoxicity with these antibiotics. The aim of this manuscript is to review the main aspects of polymyxin pharmacodynamics, to provide a better understanding about the mechanism of renal injury associated with them and to compare the different prevalences of renal injury described with the use of these antibiotics.
Polymyxin B.; Colistin; Acute renal failure; Nephrotoxicity
ARTIGO DE REVISÃO
Polimixinas - revisão com ênfase na sua nefrotoxicidade
Carlos Alberto Caldeira MendesI, * * Correspondência: Hospital de Base da Faculdade de Medicina de São José do Rio Preto - CEATOX. Av. Brigadeiro Faria Lima, nº 5544 - São Pedro. São José do Rio Preto - SP. CEP: 15090-000. Tel: (17) 3201-5000 - Fax: (17) 3201-5000 - ramal 1560. cacaldeira@uol.com.br ; Emmanuel A BurdmannII
IGraduação em Medicina - Médico Assistente da Unidade de Terapia Intensiva do Serviço de Emergência Clínica, Disciplina de Clínica Médica do Hospital de Base da Faculdade de Medicina de São José do Rio Preto, São José do Rio Preto, SP
IIProfessor Livre-Docente pela Disciplina de Nefrologia da Faculdade de Medicina da Universidade de São Paulo e Professor Adjunto da Disciplina de Nefrologia da Faculdade de Medicina de São José do Rio Preto, São Paulo, SP
RESUMO
As polimixinas são antibióticos polipeptídeos com potente ação sobre várias bactérias gram-negativas. O seu uso foi praticamente abandonado entre 1970 e 1980, em virtude do aparecimento de drogas com menor toxicidade. Com o aparecimento de bactéria gram-negativas multirresistentes, principalmente em pacientes internados em unidades de terapia intensiva, e a ausência de novos antimicrobianos para combater esses patógenos, renovou-se o interesse pelas polimixinas nos últimos anos. O principal efeito adverso desta classe de antibióticos é a nefrotoxicidade. Atualmente, somente as polimixinas B e E são utilizadas na prática clínica. A polimixina E é conhecida como colistina e utilizada na forma de colestimetato de sódio com o intuito de reduzir sua nefrotoxicidade, sendo o composto mais utilizado e mais estudado. Não existem dados consistentes sobre a prevalência de leão renal associada ao uso das polimixinas ou sobre os fatores de risco para desenvolvimento de nefrotoxicidade desses antibióticos. A proposta deste artigo é rever os principais aspectos de farmacodinâmica das polimixinas, prover um melhor entendimento dos seus mecanismos de nefrotoxicidade e comparar as diferentes prevalências de lesão renal descritas com o uso desta classe de antibióticos.
Unitermos: Polimixina B. Colistina. Insuficiência renal aguda. Nefrotoxicidade.
As polimixinas formam um grupo de antibióticos ativos contra várias bactérias gram-negativas. Sintetizadas por cepas de Bacillus polimyxa, foram descritas de forma independente em 1947 por pesquisadores norte-americanos e ingleses e o nome genérico de polimixinas foi adotado para os antibióticos originados por este microorganismo1. Constituem um grupo de cinco substâncias intimamente relacionadas, que receberam o nome de polimixinas A, B, C, D e E, sendo esta última chamada de colistina, produzida pelo Bacillus colistinus. Somente as polimixinas B e E são utilizadas clinicamente, em virtude da grande toxicidade das demais2.
ATIVIDADE ANTIMICROBIANA
O espectro antimicrobiano abrange somente germes gram-negativos. Num programa de vigilância epidemiológica (SENTRY - 2001 a 2004) encontrou-se excelente atividade da polimixina B contra Pseudomonas aeruginosa (1,3% de resistência) e Acinetobacter spp (2,1% de resistência), com MIC50< 1 mg/L e MIC90< 2mg/L para ambos os patógenos, e para Citrobacter spp., Escherichia coli e Klebsiella spp (MIC90, < 1 mg/L; < de 2% de resistência). A sensibilidade foi mais variável para Enterobacter spp (83,3% de susceptibilidade; MIC50, < 1 mg/L) e Stenotrophomonas maltophilia (72,4% de susceptibilidade; MIC50< 1 mg/L). A sensibilidade é mais limitada (MIC50 > 8 mg/L) para Burkholderia cepacia (11,8% de susceptibilidade), Serratia spp. (5,4% de susceptibilidade), Proteus spp indol-positivo. (1,3% de susceptibilidade) e Proteus mirabilis (0,7% de susceptibilidade)3.
As polimixinas não são ativas contra bactérias gram-positivas e fungos. A atividade bactericida desta classe de antibióticos manteve-se praticamente inalterada desde a sua introdução4, 5, apesar de já ter sido observada alguma resistência, e existirem relatos de associação de antibióticos para potencializar o seu efeito bactericida6, 7.
ESTRUTURA QUÍMICA DAS POLIMIXINAS
São decapeptídeos policatiônicos cíclicos caracterizados por um anel heptapeptídeo, alta porcentagem de ácido 2,4-diaminobutírico (Dab) e um ácido graxo ligado ao peptídeo através de uma ligação amida. O anel se completa através dos grupos α-amino e carboxil do resíduo do Dab na posição 4. A colistina (polimixina E) diferencia-se da polimixina B pela presença do aminoácido D-leucina no lugar de D-fenilalanina na posição 6. O colestimetato de sódio (CMS) é um derivado da colistina obtido através da reação com formaldeído e bissulfito de sódio. Este derivado é menos potente em comparação com o composto original e parece causar menos efeitos adversos 2, 8. Após a administração, o CMS é convertido em colistina "in vivo", e ambas as formas circulam pelo organismo. Estudo recente sugeriu que o CMS é inativo, e seu efeito bactericida depende da metabolização "in vivo" para formar colistina, que seria o único composto ativo9.
MECANISMO DE AÇÃO
São antibióticos anfipáticos e atuam primariamente nas membranas externa e citoplasmática, com ação semelhante a detergentes catiônicos simples. Ligam-se a componentes do envelope celular como fosfolipídeos e lipopolisacárides (LPS), deslocando competitivamente os íons Ca e Mg que agem como estabilizadores da membrana, provocando ruptura da mesma, levando à perda do conteúdo celular e ocasionando morte da bactéria. Essa ação parece ser inibida na presença desses cátions divalentes4. A capacidade de ligação e inativação do lipopolisacarídeo (LPS), molécula relacionada com o desencadeamento da sepse e choque séptico têm suscitado estudos com o objetivo de avaliar a sua capacidade para o tratamento destas síndromes, inibindo ou reduzindo o estímulo inflamatório induzido pelo LPS10. Neste sentido, aparatos para remoção de LPS e mediadores inflamatórios, como filtros de diálise impregnados de polimixina B, têm sido utilizados com algum sucesso11, 12.
PREPARAÇÕES COMERCIAIS
A polimixina E (colistina) é encontrada comercialmente como sulfato, usada topicamente para descontaminação intestinal, e como colestimetato de sódio (CMS) para uso parenteral (intravenoso, intramuscular, intratecal e inalatório). A polimixina B na forma de sulfato é utilizada topicamente (pele, ouvidos e olhos) e por via parenteral (intravenosa e intratecal) 13.
FARMACOCINÉTICA/FARMACODINÂMICA
Informações mais antigas sobre a farmacocinética desses antibióticos são pouco confiáveis em relação ao CMS, uma vez que os métodos utilizados não diferenciavam o CMS da colistina, sua forma ativa. Portanto esses estudos devem ser interpretados com cautela. Estudo recente, utilizando cromatografia líquida de alta performance, avaliou 14 pacientes com função renal normal portadores de infecções graves por bacilos gram-negativos multirresistentes que receberam 225 mg de CMS IV a cada oito horas (um paciente recebeu 150 mg a cada oito horas) por no mínimo dois dias, encontrou concentrações máxima e mínima de 2,93 mg/L (desvio padrão - DP = 1,24) e 1,03 mg/L (DP = 0,44), respectivamente. O clearance, volume de distribuição e meia vida com seus respectivos DP foram 13,6 (5,8) L/h, 139,9 (60,3) L e 7,4 (1,7) horas, respectivamente. É importante notar que essas doses foram associadas com uma relação sub ótima de CMÁX/MIC para muitas cepas de bacilos gram-negativos (< 2 mg/mL)14.Os estudos com sulfato de polimixina B são mais fidedignos. Um estudo recente determinou a concentração sérica de polimixina B1 (o maior constituinte do sulfato de polimixina B) em nove pacientes após uso endovenoso. A meia vida encontrada foi de 13 h. Também observou-se uma alta ligação protéica (> 95%) e um volume de distribuição de aproximadamente 1,39 L/kg15.
Esses antibióticos demonstraram efeito bactericida rápido e dependente da concentração. Em estudo com polimixina B, foi observado que a dose diária (mas não a frequência de doses) foi um fator importante para determinar a atividade do antibiótico, e a relação AUC/MIC (área sob a curva tempo/concentração inibitória mínima) parece ser o parâmetro farmacodinâmico mais relacionado ao efeito bactericida16.
DOSAGEM
A polimixina B é utilizada na dose de 1,5 a 2,5 mg/kg/dia (1,0 mg de sulfato de polimixina B = 10.000 UI) nos pacientes com função renal normal (depuração de creatinina > 80 mL/min)17. Nos pacientes com alteração da função renal, recomenda-se administrar dose de 2,5 mg/kg no primeiro dia, corrigindo as doses seguintes de acordo com a depuração de creatinina (ClCr). Entre 30 e 80 mL/min administra-se 1,0 a 1,5 mg/kg/d, com ClCr < 30 mL/min, administra-se 1,0 a 1,5 mg/kg a cada dois a três dias e nos pacientes anúricos administra-se 1,0 mg/kg a cada cinco a sete dias 18. O colestimetato de sódio comercializado nos EUA (coly-mycin M@) é utilizado na dose de 5,0 mg/kg/dia nos pacientes com creatinina normal (Cr < 1,2 mg/dL), dividido em três tomadas. Quando a Cr está entre 1,3 e 1,5 mg/dL, utiliza-se de 2,5 a 3,8 mg/kg/d. Com Cr entre 2,6 e 2,5 mg/dL a dose preconizada é de 2,5 mg/kg/d e com Cr entre 2,6 e 4,0 mg/dL, recomenda-se o uso de 1,5 mg/kg/d19.
Dados sobre a capacidade de remoção dessas substâncias por procedimentos dialíticos são conflitantes. Li et AL.20 recuperaram tanto colistina quanto seu derivado CMS através de cromatografia líquida de alta performance no plasma e no líquido de diálise, durante hemodiafiltração venovenosa contínua, sugerindo que o ajuste da dose seja menor nos pacientes submetidos a esse procedimento. Sarria et AL.21 não conseguiram detectar polimixina B no dialisato durante hemodiálise venovenosa contínua, a despeito de sua presença no plasma ter sido constatada através de repetidos testes, sugerindo que a droga não é dialisável e, portanto, não haveria necessidade de suplementação de doses em pacientes submetidos a procedimentos dialíticos.
TOXICIDADE
As polimixinas deixaram de ser usadas rotineiramente em virtude do desenvolvimento de outros agentes antimicrobianos com toxicidade inferior. Na década de 90 com o aparecimento de bactérias multirresistentes, inclusive à β-lactâmicos, aminoglicosídeos e quinolonas, causando infecções hospitalares, principalmente em unidades de terapia intensiva 2, 22, 23, 24, ressurgiu o interesse pelas polimixinas, que têm sido motivo de várias revisões25, 26.
Os efeitos adversos mais importantes destas drogas são nefrotoxicidade (principalmente insuficiência renal aguda) e neurotoxicidade. Outros efeitos descritos são alergias levando à lesão cutânea (tipo urticária), dor no local de injeção (intramuscular), tromboflebite (injeção EV), febre e eosinofilia17, 19. As informações referentes ao uso em humanos durante a gravidez são limitadas. Kazy et AL.27, não encontraram evidências de teratogenicidade humana com uso de polimixina B.
NEUROTOXICIDADE
A neurotoxicidade induzida pelas polimixinas caracteriza-se por fraqueza, parestesias periféricas e faciais, oftalmoplegia, dificuldade de deglutição, ataxia, ptose palpebral e até mesmo bloqueio muscular com insuficiência respiratória e necessidade de suporte ventilatório. O quadro reverte com a suspensão da droga. A maioria dos pacientes que apresentaram neurotoxicidade tinha insuficiência renal concomitante28,29. Alterações neurológicas foram descritas em 7,3% de 317 cursos de tratamento com CMS intramuscular 30.
NEFROTOXICIDADE
O aparecimento de lesão renal, principalmente insuficiência renal aguda (IRA), é o maior limitante do uso dessa classe de antibióticos. O quadro é caracterizado por elevação dos níveis de ureia e creatinina séricas e redução do ClCr, alem de hematúria, proteinúria, cilindrúria e oligúria. O mecanismo de lesão renal parece estar relacionado com o conteúdo de ácido d-aminobutírico e ácido graxo da molécula, e é semelhante ao efeito do antibiótico na membrana externa bacteriana. Ocorre aumento de permeabilidade da membrana, facilitando o fluxo de cátions, ânions e água, provocando edema e lise celular. Essa ação parece ser dependente da concentração e da duração da exposição ao antibiótico26. Em um grande estudo com CMS IM, seis pacientes foram clinicamente diagnosticados com necrose tubular aguda atribuída ao medicamento, havendo confirmação histológica em três deles30. Nefrite interstiscial aguda por hipersensibilidade ao antibiótico também já foi observada31, 32.
ESTUDOS EXPERIMENTAIS
Moyer et AL., estudando a administração de polimixina B IV em cães, na dose de 2,5 mg/kg, encontraram redução da filtração glomerular e do fluxo plasmático renal. A mesma dose administrada por via IM não causou alterações renais significativas. No exame histológico dos animais que apresentaram alteração renal, observou-se um edema difuso dos túbulos renais1. Em estudos comparativos com colistina, CMS e metanosulfato de polimixina B, o sulfato de polimixina B mostrou-se mais ativo, porém mais tóxico, principalmente em doses mais elevadas, quando ocasionou acentuada redução da função renal8,33.
ESTUDOS EM HUMANOS
Yow EM et AL. avaliaram a administração de polimixina B (2,5 mg/kg) em 10 indivíduos saudáveis, encontrando disfunção renal em três de quatro indivíduos que apresentavam ClCr <85 mL/min. Avaliaram também 26 pacientes em tratamento de infecção por P. aeruginosa e não encontraram alterações renais significativas34. Outro estudo antigo relacionou altas doses de CMS com elevação da ureia e creatinina e queda do ClCr, com recuperação da função renal após interrupção da droga35.
Em 288 pacientes (317 tratamentos com CMS IM), Koch-Weser et al. encontraram nefrotoxicidade em 20,2%, com maior incidência nos pacientes com função renal previamente comprometida e nos mais idosos. Não houve diferença de mortalidade entre os pacientes que apresentaram IRA ou não30.
Estudos em pacientes portadores de fibrose cística que utilizaram CMS, encontraram discreto comprometimento renal. No maior deles, com 52 pacientes (135 tratamentos), nenhum desenvolveu nefrotoxicidade36, em outro envolvendo 12 pacientes, encontrou-se aumento reversível da ureia ou creatinina em três pacientes37, enquanto Reed et AL.38observaram elevação da creatinina sérica somente em um de 31 pacientes (proteinúria em 14 pacientes). O número pequeno de pacientes que desenvolveram lesões renais pode ser explicado pelo tipo de pacientes estudados, geralmente mais jovem e menos graves, diferente dos indivíduos não portadores de fibrose cística que utilizam essa classe de antibióticos. Geralmente são portadores de doença aguda e grave, com necessidade de internação em UTI, com comorbidades e geralmente apresentam vários outros fatores de risco para nefrotoxicidade.
Levin et AL.39 , estudando 59 pacientes que utilizaram CMS, encontraram 37% de IRA. Essa complicação foi mais frequente nos pacientes com alteração renal prévia (58%) que nos pacientes que apresentavam função renal considerada normal (27%).
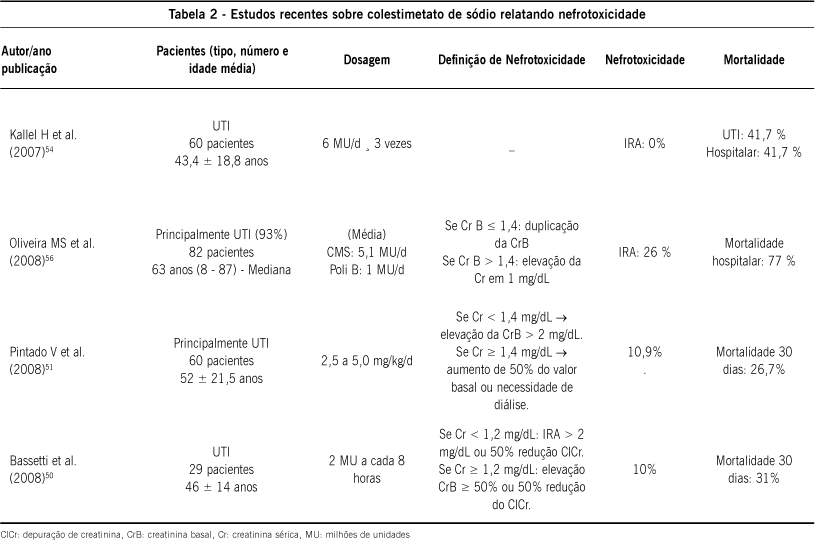
Falagas et AL.40 avaliaram pacientes que fizeram uso prolongado de mais de quatro semanas de CMS (média de 43,4 ± 14,6 dias). Somente um paciente evoluiu com aumento reversível dos níveis de creatinina durante a terapia, e esse paciente tinha função renal previamente alterada. Em outro estudo, o mesmo autor analisou 21 pacientes que utilizaram pelo menos sete dias de CMS. IRA ocorreu em três pacientes (dois morreram). Observou-se relação entre a dose acumulada de CMS e o aumento progressivo da creatinina sérica41. Kasiakou et al.42 estudaram 50 pacientes (54 tratamentos) de UTI que utilizaram CMS por pelo menos três dias. IRA foi observada em quatro pacientes (8%), dois deles com função renal previamente alterada. Michelopoulos et al.43 avaliaram 43 pacientes de UTI (77% > 50 anos) que utilizaram CMS. Oito pacientes(18,6%) desenvolveram IRA. Todos esses pacientes morreram. Kallel et al.44, avaliaram 75 pacientes (78 tratamentos) em UTI, que utilizaram CMS. Em 76,9% dos casos a evolução foi considerada satisfatória. Sete pacientes (9%) evoluíram para IRA.
Koomanachai et al.45 estudaram 78 pacientes com idade média de 63,5 anos, tratados com CMS. Nefrotoxicidade foi observada em 24 pacientes (30,8%), sendo que dezessete apresentavam outros fatores predisponentes para lesão renal (outras drogas nefrotóxicas, doença renal crônica e hipovolemia). A alteração renal foi considerada leve e reversível, sem necessidade de terapia dialítica. A mortalidade em 30 dias foi de 46%.
Fica et al.46 avaliaram 22 pacientes submetidos a 24 tratamentos com CMS. Não encontraram disfunção renal nessa série e a mortalidade hospitalar foi de 54,5%.
Bassetti et al.47 analisaram 29 pacientes infectados por A. baumannii utilizando CMS associado à rifampicina IV. Três pacientes evoluíram para IRA, sendo que todos tinham comprometimento renal prévio. A mortalidade em 30 dias foi de 31%. Pintado et al.48avaliaram 60 pacientes que utilizaram mais de 48 horas de CMS. Foi possível avaliar nefrotoxicidade em 55 pacientes. Seis pacientes (10,9%) evoluíram com IRA, sendo que quatro já apresentavam disfunção renal prévia. Apesar do alto número de pacientes que utilizaram CMS associado a aminoglicosídeos (48,3%), a taxa de IRA foi similar a dos pacientes que não usaram essa associação. A mortalidade em 30 dias foi de 26,7%.
Estudos publicados avaliando o uso de polimixina B são menos frequentes, provavelmente em virtude da discutível toxicidade inferior do CMS. Ouderkirket al.49 avaliando 60 pacientes que fizeram uso de polimixina B, encontraram 14% de IRA. Esses pacientes eram mais velhos (média de 76 vs 59 anos, p = 0,02) e apresentaram maior mortalidade (57% vs 15%, p<0,02). Nove pacientes apresentavam CrB alterada, fator considerado relevante para evolução para IRA, porém, curiosamente nenhum evoluiu com IRA. O mesmo foi observado por Holloway et al.50, que não detectaram pacientes com função renal alterada entre os 27% de pacientes que evoluíram com IRA, a despeito de sete pacientes entre os 33 estudados apresentarem essa alteração. Os sete pacientes que evoluíram para IRA não necessitaram de diálise e em cinco deles os valores de creatinina voltaram ao normal após a suspensão da droga. A mortalidade foi de 27%. Em outro estudo com polimixina B avaliou-se 23 pacientes com infecção pulmonar. Somente um paciente evoluiu com IRA. A mortalidade no final do tratamento foi de 21% e a mortalidade hospitalar de 48%7. Furtado et al.51 avaliaram 74 pacientes com pneumonia nosocomial causada por P. aeruginosa e que fizeram uso de no mínimo dois dias de polimixina B. A taxa de nefrotoxicidade foi de 9,4%. Não houve diferença com relação à IRA entre os pacientes que evoluíram favoravelmente ou não. A mortalidade hospitalar foi de 74,3%. Em outro estudo recente utilizando polimixina B, em pacientes de UTI com bacteremia e ITU, observou-se 55% de IRA, porém a definição de IRA foi mais rigorosa, a mortalidade alcançou 63%52.
Em vários estudos publicados recentemente comparando polimixinas com outros antibióticos antipseudomonas, incluindo carbapemênicos e ampicilina-sulbactam entre outros, não houve diferença entre os diferentes antibióticos e polimixinas em relação à nefrotoxicidade53-57.
As Tabelas 1, 2 e 3 resumem recentes avaliações de tratamentos com sulfato de polimixina B e CMS, apresentando número e tipo de pacientes, definição e incidência de nefrotoxicidade (IRA) e mortalidade .
Em conclusão, relatos de nefrotoxicidade com polimixinas variam de 15% a 55%. A grande variedade da definição de IRA impede conclusões mais significativas. Alguns trabalhos mostraram maior prevalência em pacientes com lesão renal prévia, nos mais velhos e nos que recebem doses elevadas do antibiótico, não corrigidas de acordo com o grau de alteração na função renal. Existe uma grande dificuldade em determinar qual o valor da participação dessas drogas na lesão renal, pois a grande maioria dos pacientes que fazem uso desse antibiótico é portadora de doenças graves, internada em UTI e quase sempre apresenta outros fatores que contribuem para disfunção renal. Portanto, é provável que a nefrotoxicidade dessas drogas seja menor que as prevalências encontradas. É importante lançar mão de todos os mecanismos disponíveis de proteção renal nos pacientes que utilizam esses antibióticos, como manutenção da volemia e cuidados na administração de outras drogas potencialmente nefrotóxicas, além de monitorizar rigorosamente a função renal.
SUPORTE FINANCEIRO:
EAB tem apoio financeiro do CNPQ.
Artigo recebido: 06/08/08
Aceito para publicação: 17/07/09
Conflito de interesse: Não há
Trabalho realizado no Hospital de Base da Faculdade de Medicina de São José do Rio Preto, S.Paulo, SP
- 1. Moyer JH, Mills LC, Yow EM. Toxicity of polymyxin B. I. Animal studies with particular reference to evaluation of renal function. Arch Intern Med. 1953;92:238-47.
- 2. Falagas EM, Kasiakou SK. Colistin: The revival of polymyxins for the management of multidrug-resistant gram-negative bacterial infections. Clin Infect Dis. 2005;40:1333-41.
- 3. Gales AC, Jones RN, Sader HS. Global assessment of the antimicrobial activity of polymyxin B against 54 731 clinical isolates of gram-negative bacilli: report from the SENTRY antimicrobial surveillance program (2001-2004). Clin Microbiol Infect. 2006;12:315-21.
- 4. Storm DR, Rosenthal KS, Swanson PE. Polymyxin and related peptide antibiotics. Ann. Rev Biochem. 1977;46:723-63.
- 5. Landman D, Bratu S, Kochar S, Panwar M, Trehan M, Doymaz M, et al. Evolution of antimicrobial resistance among Pseudomonas aeruginosa, Acinetobacter baumannii and Klebsiella pneumoniae in Brooklyn, NY.J Antimicrob Chemother. 2007;60:78-82 .
- 6. Falagas ME, Bliziotis IA, Kasiakou SK, Samonis G, Athanassopoulou P, Michaloupoulos A. Outcome of infections due to pandrug-resistant (PDR) Gram-negative bacteria. BMC Infect Dis. 2005;8:24
- 7. Sobieszczyk ME, Furuya EY, Hay CM, Pancholi P, Della-Latta P, Hammer SM, et al. Combination therapy with polymyxin B for the treatment of multidrug-resistant Gram-negative respiratory tract infections. J Antimicrob Chemother. 2004;54:566-9.
- 8. Vinnicombe J, Stamey TA. The relative nephrotoxicities of polymyxin B sulfate, sodium sulfomethyl-polymyxin B, sodium sulfomethyl-colistin (colimycin), and neomycin sulfate. Invest Urol. 1969;6:505-19.
- 9. Bergen PJ, Li J, Rayner CR, Nation RL. Colistin methanesulfonate is an inactive prodrug of colistin against Pseudomonas aeruginosa. Antimicrob Agents Chemother. 2006;50:1953-8.
- 10. Cooperstock M. Inativaction of endotoxin by Polymyxin B. Antimicrob Agents Chemother. 1974;6:422-5.
- 11. Shoji H. Extracorporeal endotoxin removal for the treatment of sepsis: endotoxin adsorption cartridge (Toraymyxin). Ther Apher Dial. 2003;7:108-14.
- 12. Vincent JL, Laterre PF, Cohen J, Burchardi H, Bruining H, Lerma FA, et al. A pilot-controlled study of a polymyxin B-immobilized hemoperfusion cartridge in patients with severe sepsis secondary to intra-abdominal infection. Shock. 2005;23:400-5.
- 13. Falagas ME, Kasiakou SK, Tsiodras S, Michalopoulos A. The use of intravenous and aerosolized polymyxins for the treatment of infections in critically ill patients: a review of recent literature. Clin Med Res. 2006;4:138-46.
- 14. Markou N, Markantonis SL, Dimitrakis E, Panidis D, Boutzouka E, Karatzas S, et al. Colistin serum concentrations after intravenous administration in critically ill patients with serious multidrug-resistant, gram-negative bacilli infections: A prospective, open-label, uncontrolledy study. Clin Ther. 2008;30:143-51.
- 15. Kwa AL, Lim TP, Low JG, Hou J, Kurup A, Prince RA, et al. Pharmacokinetics of polymyxin B1 in patients with multidrug-resistant Gram-negative bacterial infections. Diagn Microbiol Infect Dis. 2008;60:163-7.
- 16. Tam VH, Schilling AN, Vo G, Kabbara S, Kwa AL, Wiederhold NP, et al. Pharmacodynamics of polymyxin B against Pseudomonas aeruginosa. Antimicrob Agents Chemother. 2005;49:3624-30.
-
17Product information. Polymyxin B sulfate sterile, 500,000 units, Bedfordpoly B. Bedford. Ohio: Bem Venue Bedford Laboratories; February 2004.
- 18. Hoeprich PD. The polymyxins. Med Clin North Am. 1970; 54:1257-65.
-
19Colestimetato de Sódio (Coly-Mycin M)/ FDA: Information for Healthcare Professionals Colistimethate (Coly-Mycin M and generic products). Rockville: Food and Drug Administration; 2007. [cited 2007 jun 28]. Available from: URL:http://www.fda.gov/cder/drug/InfoSheets/HCP/colistimethateHCP.htm
- 20. Li J, Rayner CR, Nation RL. Colistin-associated acute renal failure: revisited. South Med J. 2005;98:1229-30.
- 21. Sarria JC, Angulo-Pernett F, Kimbrough RC, McVay CS, Vidal AM. Use of intravenous polymyxin B during continuous venovenous hemodialysis. Eur J Clin Microbiol Infect Dis. 2004;23:340-341.
- 22. Fass RJ, Barnishan J, Ayers LW. Emergence of bacterial resistance to imipenem and ciprofloxacin in a university hospital. J Antimicrob Chemother. 1995;36:343-53.
- 23. Levin AS, Mendes CM, Sinto SI, Sader, HS, Scarpitta CR, Rodrigues E, et al. An outbreak of multiresistant Acinetobacter baumanii in a university hospital in São Paulo, Brazil. Infect. Control Hosp. Epidemiol. 1996;17:366-8.
- 24. Dalla-Costa LM, Coelho JM, Souza HÁ, Castro ME, Stier CJ, Bragagnolo KL, et al. Outbreak of Carbapenem-resistant Acinetobacter baumannii producing the OXA-23 enzyme in Curitiba, Brazil. Clin Microbiol. 2003;41:3403-6.
- 25. Evans ME, Feola DJ, Rapp RP. Polymyxin B sulfate and colistin: old antibiotics for emerging multiresistant Gram-negative bacteria. Ann Pharmacother. 1999;33:960-7.
- 26. Falagas ME, Kasiakou SK. Toxicity of polymyxins: a systematic review of the evidence from old and recent studies. Crit Care. 2006;10:R27.
- 27. Kazy Z, Puhó E, Czeizel AE. Parenteral polymyxin B treatment during pregnancy. Reprod Toxicol. 2005;20:181-2.
- 28. Wolinsky E, Hines JD. Neurotoxic and nephrotoxic effects of colistin in patients with renal disease. N Engl J Med. 1962;266:759-62.
- 29. Lindesmith LA, Baines RD Jr, Bigelow DB, Petty TL. Reversible respiratory paralysis associated with polymyxin therapy. Ann Intern Med. 1968; 68:318-27.
- 30. Koch-Weser J, Sidel VW, Federman EB, Kanarek P, Finer DC, Eaton AE. Adverse effects of sodium colistimethate. Manifestations and specific reaction rates during 317 curses of therapy. Ann Intern Med. 1970;72:857-68.
- 31. Beirne GJ, Hansing CE, Octaviano GN, Burns RO. Acute renal failure caused by hypersensitivity to polymyxin B sulfate. JAMA. 1967;202:156-8.
- 32. Kallel H, Hamida CB, Ksibi H, Bahloul M, Hergafi L, Chaari A, et al. Suspected acute interstitial nephritis induced by colistin. J Nephrol. 2005;18:323-6.
- 33. Nord NM, Hoeprich PD. Polymyxin B and colistin: a critical comparison. N Engl J Med. 1964;270:1030-5.
- 34. Yow EM, Moyer JH. Toxicity of Polymyxin B. II. Human studies with particular reference to evaluation of renal function. Arch Intern Med. 1953;92:248-57.
- 35. Price DJ, Graham DI. Effects of large doses of colistin sulphomethate sodium on renal function. Br Med J. 1970;4:525-7.
- 36. Ledson MJ, Gallagher MJ, Cowperthwaite C, Convery RP, Walshaw MJ. Four years' experience of intravenous colomycin in an adult cystic fibrosis unit. Eur Respir J. 1998;12:592-4.
- 37. Conway SP, Etherington C, Munday J, Goldman MH, Strong JJ, Wootton M. Safety and tolerability of bolus intravenous colistin in acute respiratory exacerbations in adults with cystic fibrosis. Ann Pharmacother. 2000;34:1238-42.
- 38. Reed MD, Stern C, O'Riordan MA, Blumer JL. The pharmacokinetic of colistin in patients with cystic fibrosis. J Clin Pharmacol. 2001;41:645-54.
- 39. Levin AS, Barone AA, Penco J, Santos V, Narinho IS, Arruda EA, et al. Intravenous colistin as therapy for nosocomial infections caused by multidrug-resistant Pseudomonas aeruginosa and Acinetobacter baumannii. Clin Infect Dis. 1999;28:1008-11.
- 40. Falagas ME, Rizos M, Bliziotis IA, Rellos K, Kasiakou SK, Michalopoulos A. Toxicity after prolonged (more than four weeks) administration of intravenous colistin. BMC Infect Dis. 2005 ;5:1.
- 41. Falagas ME, Fragoulis KN, Kasiakou SK, Sermaidis GJ, Michalopoulos A. Nephrotoxicity of intravenous colistin: a prospective evaluation. Int J Antimicrob Agents. 2005; 26:504-7.
- 42. Kasiakou SK, Michalopoulos A, Soteriades ES, Samonis G, Sermaides GJ, Falagas ME. Combinations therapy with intravenous colistin for management of infections due multidrug-resistant gram-negative bacteria in patients without cystic fibrosis. Antimicrob Agents Chemother. 2005;49:3136-46.
- 43. Michelopoulos AS, Tsiodras S, Rellos K, Mentzelopoulos, Falagas ME. Colistin treatment in patients with ICU-acquired infections caused by multiresistant Gram-negative bacteria: the renaissance of an old antibiotic. Clin Microbiol Infect. 2005;11:115-21.
- 44. Kallel H, Bahloul M, Hergafi L, Akrout M, Ketata W, Chelly H, et al. Colistin as a salvage therapy for nosocomial infections caused by multidrug-resistant bacteria in the ICU. Int J Antimicrob Agents. 2006;28:366-9.
- 45. Koomanachai P, Tiengrim S, Kiratisin P, Thamlikitkul V. Efficacy and safety of colistin (colistimethate sodium) for therapy of infections caused by multidrug-resistant Pseudomonas aeruginosa and Acinetobacter baumannii in Siriraj Hospital, Bangkok, Thailand. Int J Infect Dis. 2007;11:402-6.
- 46. Fica CA, Céspedes JI, Gompertz GM, Jalón VM, Sakurada ZA, Sáez LE. Intravenous colistin in the treatment of infections due to pan-resistant Gram negative bacilli (Colistin en infecciones nosocomiales por bacilos gram negativos pan-resistentes). Rev Chilena Infectol. 2007;24:360-7.
- 47. Bassetti M, Repetto E, Righi E, Boni S, Diverio M, Molinari MP, et al. Colistin and rifampicin in the treatment of multidrug-resistant Acinetobacter baumannii infections. J Antimicrob Chemother. 2008;61:417-20.
- 48. Pintado V, San Miguel LG, Grill F, Mejía B, Cobo J, Fortún J, et al. Intravenous colistin sulphomethate sodium for therapy of infections due to multidrug-resistant gram-negative bacteria. J Infect. 2008;56:185-90.
- 49. Ouderkirk JP, Nord JA, Turett GS, Kislak JW. Polymyxin B nephrotoxicity and efficacy against nosocomial infections caused by multiresistant Gram-negative bacteria. Antimicrob Agents Chemother. 2003;47:2659-62.
- 50. Holloway KP, Rouphael NG, Wells JB, King MD, Blumberg HM. Polymyxin B and doxycycline use in patients with multidrug-resistant Acinetobacter baumannii infections in the intensive care unit. Ann Pharmacother. 2006;40:1939-45.
- 51. Furtado GH, dAzevedo PA, Santos AF, Gales AC, Pignatari AC, Medeiros EA. Intravenous polymyxin B for the treatment of nosocomial pneumonia caused by multidrug-resistant Pseudomonas aeruginosa. Int J Antimicrob Agents. 2007;30:315-9.
- 52. Pastewski AA, Caruso P, Parris AR, Dizon R, Kopec R, Sharma S, et al.Parenteral polymyxin B use in patients with multidrug-resistant gram-negative bacteremia and urinary tract infections: a retrospective case series. Ann Pharmacother. 2008;42:1177-87.
- 53. Garnacho-Montero J, Ortiz-Leyba C, Jimenez-Jimenez FJ, Barrero-Almodovar AE, Garcia-Garmendia JL, Bernabeu-Wittell M, et al. Treatment of multidrug-resistant Acinetobacter baumannii ventilator-associated pneumonia (VAP) with intravenous colistin: a comparison with imipenem-susceptible VAP. Clin Infect Dis. 2003;36:1111-8.
- 54. Reina R, Estenssoro E., Saenz G, Canales H S, Gonzalvo R, Vidal G, et al. Safety and efficacy of colistin in Acinetobacter and Pseudomonas infections: a prospective cohort study. Intensive Care Med. 2005;31:1058-65.
- 55. Kallel H, Hergafi L, Bahloul M, Hakim A, Dammak H, Chelly H, et al. Safety and efficacy of colistin compared with imipenem in the treatment of ventilator-associated pneumonia: a matched case-control study. Intensive Care Med. 2007;33:1162-7.
- 56. Hachem RY, Chemaly RF, Ahmar CA, Jiang Y, Boktour MR, Rjaili GA, et al. Colistin is effective in treatment of infections caused by multidrug-resistant Pseudomonas aeruginosa in cancer patients. Antimicrob Agents Chemother. 2007;51:1905-11.
- 57. Oliveira MS, Prado GVB, Costa SF, Grimbaum RS, Levin AS. Ampicillin/sulbactam compared with polymyxins for the treatment of infections caused by carbapenem-resistant Acinetobacter spp. J Antimicrob Chemother. 2008;61:1369-75.
Datas de Publicação
-
Publicação nesta coleção
25 Fev 2010 -
Data do Fascículo
2009
Histórico
-
Aceito
17 Jul 2009 -
Recebido
06 Ago 2008