PONTO DE VISTA
ENDOCRINOLOGIA
Pesquisa clínica como estratégia de desenvolvimento em saúde
Sonia Mansoldo DainesiI; Moisés GoldbaumII
IDoutora em Medicina Preventiva; Diretora Médica, Boehringer Ingelheim do Brasil, São Paulo, SP, Brasil
IIDoutor em Medicina Preventiva; Professor de Medicina Preventiva, Faculdade de Medicina da Universidade de São Paulo (FMUSP), São Paulo, SP, Brasil
Correspondência para Correspondência para: Sonia Mansoldo Dainesi Av. Dr. Arnaldo, 455, Cerqueira César CEP: 01246-903 - São Paulo, SP, Brasil sdainesi@gmail.com
A crescente participação do Brasil no cenário da pesquisa clínica internacional vem sendo descrita em diferentes publicações1-4. Esse crescimento traz a profissionalização do setor e o reconhecimento do país como parceiros em pesquisas multicêntricas internacionais. A indústria farmacêutica multinacional, que anteriormente concentrava seus esforços de inclusão de pacientes em protocolos nos Estados Unidos e Europa, vem expandindo seus horizontes em busca de centros de pesquisa capacitados no Leste Europeu, na América Latina e na Ásia, ampliando sua capacidade de recrutamento de pacientes5.
Artigo publicado por Thiers et al. descreve uma tendência de globalização dos estudos clínicos, tomando como parâmetro a densidade de estudos por país: (i) embora os estudos clínicos ainda sejam basicamente realizados nos países desenvolvidos tradicionais, praticamente todos esses países experimentaram um crescimento negativo em sua participação relativa, entre 2002 e 2006; (ii) individualmente, as economias emergentes ainda são relativamente pequenas em participação; (iii) em termos de quantidade de centros de pesquisa, as economias emergentes crescem mais rapidamente que os países tradicionais; (iv) substancial e crescente proporção de estudos vêm sendo conduzidos nessas regiões emergentes1.
Ao mesmo tempo, a chamada globalização da pesquisa clínica oferece oportunidades de treinamento e capacitação aos centros de pesquisa daquelas regiões, por meio do intercâmbio de informações, desenvolvimento e aprimoramento dos métodos de ensino e pesquisa, bem como fornecimento de novas opções terapêuticas aos pacientes5. Os estudos multicêntricos, usualmente desenhados em conjunto com centros de excelência e agências reguladoras, são elaborados contemplando-se o que há de mais atual sobre a doença pesquisada, selecionando tratamentos denominados "estado da arte", ou seja, aqueles considerados padrão atual de tratamento daquela condição clínica.
Até recentemente, os medicamentos eram avaliados por ensaios clínicos apenas em países do hemisfério norte, sendo aprovados para uso com base em dossiês resultantes apenas de estudos feitos naqueles países. Dessa forma, a população brasileira fazia (e faz) uso de medicamentos cuja segurança e eficácia não foram, obrigatoriamente, avaliadas em nosso país. Não é por acaso que estudo publicado no New England Journal of Medicine, em 2009, ressalta a preocupação dos autores com a crescente inclusão de pacientes de outros países nos estudos clínicos e, portanto, com a menor representatividade da população americana nas pesquisas. Seriam os resultados desses estudos generalizáveis para os pacientes norte-americanos? Estaria a validade externa dos estudos ainda assegurada5?
Acompanhando essa tendência de crescimento da pesquisa clínica no mundo e, em particular, no Brasil, tanto a Agência Nacional de Vigilância Sanitária (ANVISA) como a Comissão Nacional de Ética em Pesquisa (CONEP) vêm trabalhando no sentido de ampliar o debate ético da investigação científica em saúde, com participação ativa em várias reuniões e fóruns, ouvindo parceiros do setor acadêmico e do setor privado. O objetivo é aprimorar e agilizar o processo de aprovação de estudos clínicos no país, mantendo, simultaneamente, os rigores ético e processual que a questão exige.
Vale destacar, ainda, como avanço relativamente recente nessa área, a criação, em 2005, da Rede Nacional de Unidades de Pesquisa Clínica ligadas a Hospitais de Ensino, pela Secretaria de Ciência e Tecnologia e Insumos Estratégicos do Ministério da Saúde (SCTIE-MS), composta, na época, de 14 centros em diferentes localidades do território brasileiro, selecionados por meio de Chamada Pública e, posteriormente, ampliada para 19 centros. Mais recentemente, esse número cresceu para 30 centros6. O interesse estratégico dessa ação é criar centros de pesquisa clínica com mão de obra especializada e adequado treinamento técnico-científico em Boas Práticas de Pesquisa Clínica; garantir a infraestrutura apropriada para o acompanhamento de protocolos de pesquisa nacionais e internacionais, unicêntricos ou multicêntricos; e atender à demanda crescente de participação de centros brasileiros em grandes estudos clínicos, bem como em estudos nacionais de prioridade em saúde pública7,8.
Todo esse cenário acontece em um clima de estabilidade econômica, após décadas de instabilidade política e de inflação, no Brasil e na América Latina. Vários países passaram por reformas econômicas importantes nos últimos anos; a democracia foi estabelecida na maioria dos países da região. Como consequência, os governos vêm adotando políticas focadas no desenvolvimento científico e tecnológico e na construção de bases sólidas para dar suporte a todas essas iniciativas3.
Desnecessário dizer que o trabalho realizado em pesquisa clínica tem também como finalidade o paciente, muitas vezes sem acesso a melhores opções de tratamento. Por meio de protocolos de pesquisa adequadamente desenhados, são disponibilizados a eles tratamentos ou procedimentos dos mais modernos, além de cuidados de saúde considerados de ponta. A conduta ética é guia-mestra de todos esses projetos e é assegurada pela aprovação prévia dos protocolos de pesquisa pelos Comitês de Ética em Pesquisas (CEPs) das instituições em que se realizam. No Brasil, os protocolos de estudos multicêntricos internacionais são também submetidos à aprovação da Comissão Nacional de Ética em Pesquisa (CONEP) e, em seguida, da ANVISA, que avalia aspectos sanitários do projeto e fornece autorizações para importação dos materiais e medicamentos necessários ao estudo. No caso de estudos nacionais, geralmente não é necessário o aval ético dado pela CONEP. Entretanto, todos os estudos clínicos com produtos sujeitos a registro sanitário, mesmo que não exijam licença de importação (LI), devem submeter o processo à aprovação da ANVISA9.
Novos medicamentos e/ou procedimentos só deverão ser aprovados após a realização de estudos clínicos randomizados de qualidade e poder adequado estatístico. São essas as atuais definições de Medicina Baseada em Evidências, que preconizam como grau A de recomendação (nível I de evidência) os estudos clínicos randomizados ou as revisões sistemáticas10.
O Brasil, país que vem ganhando destaque entre as nações emergentes, não pode mais ser comparado, felizmente, a países onde não existe acesso universal à saúde. Aqui, esse direito é garantido pela Constituição Federal de 1988, Artigo 19611. Outro ponto em que o Brasil se destaca dos demais países em desenvolvimento é a histórica tradição da defesa ética dos participantes de pesquisas, por meio de resoluções éticas fortes e plenamente em vigor.
A PESQUISA EM PAÍSES EM DESENVOLVIMENTO
Muito se tem falado da pesquisa em países em desenvolvimento recentemente, quando a globalização, de uma forma geral, tem proporcionado a chegada de mais pesquisas e mais investimentos para o país . Torna-se importante, nesse caso, descrever o que exatamente se entende por países em desenvolvimento.
Não existe um consenso entre as várias escolas de pensamento econômico sobre a definição de desenvolvimento de um país. O mais comum é a classificação baseada no PIB (Produto Interno Bruto) per capita, como faz o Fundo Monetário Internacional (FMI) ou o Banco Mundial. O Brasil se encontra em 63º lugar na classificação do FMI e na 54º posição no ranking do Banco Mundial, sendo classificado como uma economia emergente e em desenvolvimento (ano base 2008)12. Esse critério, entretanto, recebe críticas, uma vez que há países como o Catar, por exemplo, que tem uma das maiores rendas per capita do mundo (US$ 93.204,00 anuais), mas não figura em quaisquer das listas usuais de países desenvolvidos.
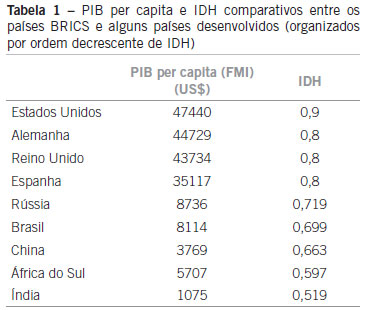
A Organização das Nações Unidas (ONU) desenvolveu um índice que avança em relação aos critérios puramente econômicos, e padroniza a avaliação do bem-estar de uma determinada população, o Índice de Desenvolvimento Humano (IDH), que contempla três dimensões: riqueza, educação e esperança média de vida. Os países desenvolvidos geralmente têm um IDH alto ou muito alto. Por esse critério, o Brasil tem um IDH de 0,699 (alto). A Tabela 1 traz os valores de PIB per capita (2008) e IDH (2010) dos principais países emergentes (Brasil, Rússia, Índia, China ou BRICS, e, mais recentemente, África do Sul) e alguns países desenvolvidos para comparação13,14.
Tais considerações são importantes, pois o Brasil, felizmente, não deve mais ser comparado a outros países em desenvolvimento, já que ocupa atualmente, no cenário mundial, uma posição muito diferente da que ocupava há alguns anos. No campo da ética em pesquisa clínica, podese dizer o mesmo: não é possível comparar o Brasil a países como a Índia, onde sequer existe um código de ética médica15.
Características de exploração dos sujeitos de pesquisa são por vezes citadas, como: 1) participação desses países somente para evitar a supervisão ética mais rigorosa existente nos países de origem dos projetos de pesquisa; 2) utilização de sujeitos de pesquisa em desvantagem econômica, para acelerar o recrutamento e, eventualmente, submetê-los a procedimentos não recomendados e que não seriam aprovados nos países desenvolvidos; 3) não disponibilidade dos benefícios gerados, ao término do estudo, aos participantes da pesquisa, ou mesmo às comunidades que acolheram a pesquisa16. Por exploração define-se o ato de tirar vantagem de outros para servir a seus próprios interesses17. Nesse sentido, testar intervenções novas em populações que não terão acesso aos resultados e benefícios após a pesquisa é considerado um ato exploratório, uma vez que se tira vantagem de uma população (a de países em desenvolvimento que participam das pesquisas clínicas) para servir a outra (aquela dos países desenvolvidos, onde o novo medicamento será comercializado).
Nos países desenvolvidos, onde, no passado, a pesquisa era predominantemente realizada, os sujeitos que dela participavam eram recompensados posteriormente com benefícios diretos: eram disponibilizados novos produtos e serviços. Indiretamente, são eles (e toda a população daqueles países) também beneficiados, por meio da geração de empregos e da riqueza obtida pela indústria17.
A vulnerabilidade de pacientes nos países em desenvolvimento acarreta grande preocupação e exige especial atenção das pessoas envolvidas com análise ética e regulatória, na medida em que representam os mecanismos adequados e necessários para proteger estes pacientes3. Populações de pacientes que, por algum motivo, não são consideradas detentoras de autonomia plena são designadas como "populações vulneráveis". A falta de autonomia pode conduzir a uma relação de subordinação, como ocorre com prisioneiros, por exemplo18. A Resolução nº 196/96 define vulnerabilidade como o estado de pessoas ou grupos que, por quaisquer motivos, tenham sua capacidade de autodeterminação reduzida, sobretudo no que se refere ao consentimento livre e esclarecido16.
Em saúde pública, observa-se que pesquisas e políticas desenhadas para proteger os mais vulneráveis acabam protegendo todos os membros da sociedade19. Portanto, é perfeitamente compreensível e saudável a preocupação com as populações vulneráveis que podem ser incluídas em pesquisas clínicas. O ideal é que os países em desenvolvimento criem seus próprios sistemas de revisão ética de pesquisas, com documentos coerentes em relação aos contextos locais, mas embasados, evidentemente, em códigos internacionalmente aceitos.
Denúncias de desvios éticos, como tentativas de "relaxamento de normas de proteção" da Declaração de Helsinque2 0 e a questão do "duplo standard"21-2 3 são, por vezes, citadas. O "duplo standard" se refere à existência de padrões éticos diferenciados para protocolos de pesquisa, teoricamente justificados em função da diversidade socioeconômica dos diversos países. No caso de populações para as quais tratamentos mais modernos não estejam disponíveis, alguns acreditam que seja aceitável utilizarem-se opções terapêuticas diferentes das consideradas padrão ouro (ou até mesmo placebo), uma vez que seria oferecida aos pacientes ao menos uma chance de tratamento, caso fossem sorteados para o braço de tratamento experimental. As justificativas para o "duplo standard" são, entretanto, questionáveis, uma vez que a falta de acesso a medicamentos não caracteriza uma desigualdade natural, e sim, uma situação de exclusão social. As dificuldades existentes, nesses casos são, muitas vezes, mais frequentemente relacionadas à precária capacidade de distribuição de medicamentos. O acesso aos cuidados de saúde não é determinado inteiramente por escolhas individuais; ele leva em conta também as políticas de saúde do país, seu compromisso com a saúde da população e a distribuição de recursos24.
Artigo publicado em 2009, por Garrafa e Lorenzo, comenta a última revisão da Declaração de Helsinque. Segundo os autores, a modificação introduzida na Declaração, por exemplo, no tópico referente aos cuidados após o estudo, "legitima benefícios secundários e indiretos e sedimenta a opção para os patrocinadores fazerem acordos que signifiquem menores custos para suas empresas. Tais acordos [...] envolvendo sujeitos e grupos sociais com baixo nível de instrução e em condições de exclusão social, tudo isso avaliado por comitês que possivelmente apresentem os p roblemas já anteriormente descritos"23. Certamente isso não reflete mais a realidade, pois o Brasil evoluiu com as oportunidades de participação em pesquisa e treinamentos, assim como o fez sua legislação ética e sanitária. Dessa forma, o país tem seus próprios sistemas de revisão ética de pesquisas, autônomos, suficientemente desenvolvidos e adequados aos contextos locais (Resoluções CNS nº 196/1996, nº 251/1997, nº 292/199, nº 301/2000, nº 404/2008 e RDC nº 39/2008, para citar apenas as mais relevantes). Adicionalmente, são eles inseridos em mecanismos de controle social, os quais muitas vezes fazem com que protocolos originalmente aprovados em países desenvolvidos não o sejam no Brasil.
O número de projetos em andamento em países desenvolvidos mas reprovados pela CONEP e impedidos em território nacional não é pequeno. Seguramente, essa independência é bem-vinda, desde que ponderada de forma apropriada e não impedindo o acesso de pacientes brasileiros a protocolos de pesquisa cujas opções terapêuticas adicionais possam, inclusive, salvar suas vidas. Sem dúvida, é antiético aprovar projetos de pesquisa que possam prejudicar os pacientes, mas é igualmente antiético não aprovar projetos que possam beneficiá-los. De fato, não há evidências de que os comitês de ética aprovem pesquisas com risco excessivo, mas evidências sugerem que os comitês sejam extremamente cautelosos, algumas vezes proibindo pesquisas com favorável relação risco-benefício25.
A diversidade é considerada, adicionalmente, importante para a generalização dos resultados da pesquisa (validade externa). Assim, "raça" refere-se a como a genética das pessoas é evidenciada em características físicas como cor da pele, aspectos faciais, caminhos metabólicos, entre outros. "Etnicidade" refere-se à raça mais o local de nascimento, religião, dieta, aspectos culturais, entre outros fatores. Tanto a raça como a etnicidade podem afetar a resposta do paciente aos medicamentos. Adicionalmente, a etnicidade afeta a atitude e a probabilidade de os pacientes serem incluídos em estudos clínicos. Fica evidente a importância da inclusão de pacientes de vários países, representando a diversidade das populações existentes26.
Em artigo que discute a ética ao incluir pacientes de países em desenvolvimento em pesquisas clínicas na área de oncologia, Mano et al. enfatizam que, embora o benefício individual para os pacientes deva ser levado em conta, o real benefício para a sociedade pode ser, muitas vezes, mínimo. Segundo os autores, é possível também que somente pacientes de economias mais saudáveis se beneficiem dos dados gerados pelos estudos. Em uma era de novas terapias biológicas, a questão do acesso a tratamentos de alto custo deve se tornar um dos maiores desafios para a sociedade e pode, na verdade, extrapolar o campo da ciência, envolvendo a sociedade como um todo. Seria inaceitável acompanhar todo um esforço de desenvolvimento de novos medicamentos e tecnologias disponíveis apenas para um grupo pequeno de pacientes. Acordos prospectivos devem ser firmados, de modo a assegurar os benefícios das pesquisas à população dos países onde elas são conduzidas. Os autores ressaltam, enfim, que não se trata de desencorajar a pesquisa em países em desenvolvimento, mas de definir acordos entre as várias partes, de modo que a pesquisa possa continuar sendo realizada nesses países, sem que eles se tornem mera linha de produção27.
Alguns autores consideram que, em estudos clínicos patrocinados por indústrias, a maioria das pesquisas não reflete as características e a epidemiologia dos países em desenvolvimento, limitando, "de forma perversa", a possibilidade de os pesquisadores nacionais fazerem alterações significativas no projeto28. Dessa forma, sugerem que o investigador (pesquisador) nem deveria ser assim chamado, uma vez que apenas aplica o protocolo, sem ter participado de seu desenho, feito qualquer crítica ou adição intelectual ao projeto. Nesse caso, o condutor da pesquisa seria mais bem designado como "executor da pesquisa" ou "prestador de serviço", e não um pesquisador de fato. Tal quadro tem mudado nos últimos anos, com participação mais ativa de pesquisadores nativos, graças à sua boa formação universitária e especialização, além da crescente participação do Brasil em estudos multicêntricos internacionais e consequente treinamento e capacitação dos pesquisadores nas metodologias de pesquisa.
O PAPEL DA PESQUISA CLÍNICA NO DESENVOLVIMENTO DO PAÍS
Cerca de dois bilhões de pessoas no mundo carecem de fornecimento de medicamentos essenciais. A responsabilidade de prover esse fornecimento é principalmente do Estado. Entretanto, outros atores, como a indústria farmacêutica, também dividem essa responsabilidade, por meio do desenvolvimento e posterior comercialização de medicamentos. Elas contribuem, à sua maneira, com inúmeros avanços para melhorar a qualidade de vida das pessoas, e ajudam a salvar vidas. Com essa contribuição, entretanto, vêm também as responsabilidades29.
Conduzida anteriormente apenas nos Estados Unidos e na Europa, a pesquisa clínica foi levada pela globalização para a América Latina, assim como para os países do Leste Europeu. Como sua estrutura e organização exigem boas práticas e utilização de procedimentos internacionais padronizados, essas atividades acabam induzindo a formação de competências gerenciais e capacitações tecnológicas que podem ser compartilhadas com outras áreas de empresas e instituições de pesquisa4. Como resumido por Marandola et al , "o Brasil precisa considerar a pesquisa clínica área estratégica, caso queira receber os crescentes investimentos internacionais, aproveitar os avanços biomédicos para a população e fomentar o desenvolvimento tecnológico do setor"4.
Quental, por sua vez, comenta, em publicação de 2006: "Para o fortalecimento do setor, em benefício dos interesses nacionais, é necessário ter todos os elementos do sistema fortes e suas interações, virtuosas, minimizando os obstáculos para tal. Nesse sentido, algumas capacitações precisam ser desenvolvidas". Parte da atual dificuldade nesse campo parece acontecer em função da escassez de recursos humanos capacitados, sendo necessárias medidas no sentido de apoiar a formação e o fortalecimento de grupos de pesquisa, e empresas de serviços relacionadas. A retenção dos recursos humanos é outro ponto a ser estudado e melhorado30.
A Medicina Translacional, emergindo como nova disciplina, traz o conceito da tradução do conhecimento da pesquisa básica para a pesquisa clínica e, avançando um pouco mais, das evidências geradas pela pesquisa clínica para propostas concretas de solução sustentável dos problemas em saúde pública31,32.
Existem dados na literatura que apontam para o fato de que a pesquisa clínica pode, inclusive, melhorar o atendimento médico da instituição como um todo. A presença de infraestrutura adequada, de profissionais qualificados e especializados, e o seguimento das boas práticas clínicas consistem em fatores exigidos e fundamentais para a participação de hospitais em estudos clínicos. A observação desses fatores poderá beneficiar a instituição envolvida e seus pacientes. Artigos publicados recentemente mostram que a participação em estudos clínicos está intimamente associada à melhor avaliação, tratamento e acompanhamento dos pacientes no ambiente hospitalar33,34. Os dados, entretanto, ainda são reduzidos e controversos. Revisão sistemática realizada pela Cochrane Foundation, em 2008, não conseguiu demonstrar efeito positivo da realização de pesquisa clínica na assistência à saúde35.
Schaefer, em 2009, em polêmico artigo, aborda a obrigação de participar de pesquisas biomédicas, e defende que o conhecimento biomédico é um bem público. Portanto, participar de pesquisas clínicas é uma forma de dar suporte a um bem público, de maneira que todos os indivíduos devem fazê-lo. Segundo o autor, um bem público tem duas características: (i) o uso individual daquele bem não diminui o uso por outros, e (ii) não é factível impedir os indivíduos de usarem esse bem. Em contrapartida, um bem é privado quando seu uso por um indivíduo diminui o uso pelos demais e/ou quando, ao dá-lo para um, isso impeça o uso por outros. Atualmente, seguindo seu raciocínio, os indivíduos participam de pesquisa clínica somente quando têm uma boa razão para fazê-lo, quando deveria ser o oposto, ou seja, deveriam participar sempre, a menos que tivessem uma boa razão pra não fazê-lo! Acrescente-se a isso que a obrigação de participar de pesquisas não elimina o direito de o indivíduo retirar sua autorização, se e quando achar conveniente36. Leitura crítica desse artigo permite identificar uma falha em sua premissa, pois não distingue pesquisas feitas sobre importantes questões clínicas ou científicas, e que, de fato, agregam valor substancial à sociedade, em oposição a pesquisas feitas para responder a questões regulatórias, não clínicas. O primeiro tipo de pesquisa poderia ser considerado uma obrigação, de acordo com o conceito de bem público de Schaefer, mas não o segundo tipo37.
CONCLUSÃO
Ouve-se que o Brasil deixou de ser o país do futuro para ser o país do presente. Talvez um termo ainda otimista, mas um pouco mais conservador, seja "um país de futuro". Para tal, é necessário pensar nos objetivos que devem ser atingidos nos próximos anos, de forma a construir um ambiente de pesquisa sólido, forte e adequado ao momento e às oportunidades que nosso país vem vivendo. É necessário cuidar dos recursos humanos, nossos verdadeiros talentos, de forma responsável e planejada, dando a eles incentivos para continuar investindo em nosso país e em nosso futuro. Com a inclusão do Brasil nos assim chamados "países emergentes", temos uma oportunidade imperdível de reforçar o ciclo virtuoso já iniciado e transformar o país e seus profissionais de coadjuvantes em protagonistas. Isso serve para a economia, para a educação, para a saúde e, dentro dela, para a pesquisa clínica. Vale lembrar que, junto com a oportunidade, vem a responsabilidade. Perder a oportunidade é pior do que não tê-la.
Trabalho realizado na Faculdade de Medicina da Universidade de São Paulo (FMUSP), São Paulo, SP, Brasil
- 1. Thiers F, Sinskey AJ, Berndt ER. Trends in the globalization of clinical trials. Nat Rev Drug Discov. 2008;7:13-4.
- 2. Rodrigues D, Kesselring G. Clinical trials in Brazil. Facing the challenges. Monitor April 2008;75-7.
- 3. Rodrigues D. Clinical research and drug development in Latin America: weighing the pros and cons, talking about the future. J Invest Med. 2007;55:223-9.
- 4. Marandola W, Pereira MFT, Castaldeli FF, Falci M. A pesquisa clínica como caminho para o desenvolvimento do medicamento inovador: experiência de uma empresa nacional. Anais do XXIII Simpósio de Gestão da Inovação Tecnológica; 2004.
- 5. Glickman SW, McHutchison JG, Peterson ED, Cairns CB, Harrington RA, Calif RM et al. Ethical and scientific implications of the globalization of clinical research. N Engl J Med. 2009;360:816-23.
- 6. DECIT/SCTIE/MS. Rede Nacional de Pesquisa Clínica do Brasil: respostas e redução da dependência estrangeira. Rev Saúde Pública. 2010;44:575-8.
- 7. Dainesi SM. Sharing the Brazilian experience on the implementation of clinical research national network. In: XVIII World Congress of Epidemiology / VII Congresso Brasileiro de Epidemiologia; 2008, XVIII World Congress of Epidemiology / VII Congresso Brasileiro de Epidemiologia. Porto Alegre; 2008.
- 8. Dainesi SM. Collaborative networks as a lever for the quality in clinical research. In: DIA (Drug Information Association). Annual Euro Meeting. Vienna; 2007.
- 9. Oliveira GG. Ensaios clínicos. Princípios e práticas. Agência Nacional de Vigilância Sanitária (ANVISA), Ministério da Saúde. Brasília (DF): ANVISA; 2006.
- 10. Projeto Diretrizes. Associação Médica Brasileira e Conselho Federal de Medicina. [citado 18 set 2010]. Disponível em: http://www.projetodiretrizes.org.br/projeto_diretrizes/texto_introdutorio.pdf
- 11. Presidência da República. Casa Civil. Constituição da República Federativa do Brasil de 1988 [citado 20 out 2010]. Disponível em: http://www.planalto. gov.br/ccivil_03/constituicao/constitui%C3%A7ao.htm
- 12. Barelli W. BRICS - semelhanças e diferenças. Julho; 2011. [citado 23 jul 2011]. Disponível em: http://www.afimesp.com.br/?acao=artigos&id=163&pag=1
- 13. Lista de países por PIB nominal per capita. [citado 27 jul 2011]. Disponível em: http://pt.wikipedia.org/wiki/Anexo:Lista_de_pa%C3%ADses_por_PIB_nominal_per_capita
- 14. Lista de países por índice de desenvolvimento humano. [citado 27 jul 2011]. Disponível em: http://pt.wikipedia.org/wiki/Anexo:Lista_de_pa%C3%ADses_por_%C3%8Dndice_de_Desenvolvimento_Humano
- 15. Shah S. Retratos de um apartheid médico. [citado 22 jul 2011]. Disponível em: http://www.brasilmedicina.com.br/noticias/pgnoticias_det.asp?Codigo=1401&AreaSelect=1
- 16. Conselho Nacional de Saúde. CNS. Resolução do Conselho Nacional de Saúde 196 de 1996. [citado 18 set 2010]. Disponível em: http://conselho.saude.gov.br/docs/Resolucoes/Reso196.doc
- 17. Schroeder D. Obrigações pós-pesquisa. RECIIS. Rev Eletr Comu m Inform Inov Saúde. 2008;2(Supl 1):S66-77.
- 18. Parvizi J, Tarity D, Conner K, Smith JB. Institutional review board approval: Why it matters. J Bone Joint Surg Am. 2007;89:418-26.
- 19. Ness RB, Andrews EB, Gaudino JA, Newman AB, Soskolne CL, Sturmer T et al. The future of epidemiology. Acad Med. 2009;84:1631-7.
- 20. Garrafa V, Prado MM. Tentativas de mudanças na Declaração de Helsinque: fundamentalismo econômico, imperialismo ético e controle social. Cad Saúde Pública. 2001;17:1489-96.
- 21. Carvalho M. Laboratórios farmacêuticos e pesquisa clínica. Radis. Comunicação em Saúde. Março; 2009. ENSP, Fundação Oswaldo Cruz. [citado 23 jul 2011]. Disponível em: http://www4.ensp.fiocruz.br/radis/79/05.html
- 22. Angell M. The ethics of clinical research in the third world. N Engl J Med. 1997;337:847-9.
- 23. Garrafa V, Lorenzo C. Helsinque 2008: Redução de proteção e maximização de interesses privados. Rev Assoc Med Bras. 2009;55:497-520.
- 24. Landes M. Can context justify an ethical double standard for clinical research in developing countries? Global Health. 2005;1(11). [citado 23 jul 2011]. Disponível em: http://www.biomedcentral.com/content/pdf/1744-8603-1-11.pdf
- 25. Emanuel EJ, Currie XE, Herman A, on behalf of Project Phidisa. Undue inducement in clinical research in developing countries: is it worry? Lancet. 2005;366:336-40.
- health+studies&ots=uFis70N4RC&sig=ajVwsWoP_MyFEGBT1ESbEp22bCU#v=onepage&q&f=false.
- 27. Mano MS, Rosa DD, Lago LD. Multinational clinical trials in oncology and post-trial benefits for host countries: where do we stand? Eur J Cancer. 2006; 42:2675-7.
- 27. Schlemper-Junior, BR. Acesso às drogas na pesquisa clínica. Rev Bioética. 2007;15:248-66.
- 29. Editorial Right-to-health responsibilities of pharmaceutical companies. Lancet, 2009;373:1998.
- 30. Quental C, Salles-Filho S. Ensaios clínicos: capacitação nacional para avaliação de medicamentos e vacinas. Rev Bras Epidemiol. 2006;9. [citado 22 jul 2011]. Disponível em: http://www.scielo.br/scielo.php?script=sci_arttext&pid=S1415-790X2006000400002&lng=en&nrm=iso
- 31. Woolf SH. The meaning of translational research and why it matters. JAMA. 2008;299:211-3.
- 32. Lean MEJ, Mann JI, Hoek JA, Elliot RM, Schofield G. Translational research. BMJ. 2008;337:a863.
- 33. Miyaoka TM, Cesar MB, Laranjeira LN, Guimarães HP, Avezum A. Hospitais envolvidos em pesquisa clínica oferecem melhores resultados aos seus pacientes? Rev Bras Hipertens. 2008;15:225-7.
- 34. Majumdar SR, Roe MT, Peterson ED, Chen AY, Gibler WB, Armstring PW Better outcomes for patients treated at hospitals that participate in clinical trials. Arch Intern Med. 2008;168:657-662.
- 35. Vist GE, Bryant D, Somerville L, Birminghem T, Oxman AD. Outcomes of patients who participate in randomized controlled trials compared to similar patients receiving similar interventions who do not participate. Cochrane Database Syst Rev. 2008;(3):MR000009.
- 36. Schaefer GO, Emanuel EJ, Wertheimer A. The obligation to participate in biomedical research. JAMA. 2009;302:67-72.
- 37. Katz KA. Participating in biomedical research. JAMA. 2009;302:2200-1.
Correspondência para:
Datas de Publicação
-
Publicação nesta coleção
28 Fev 2012 -
Data do Fascículo
Fev 2012