Resumos
As citoqueratinas (CQ) são constituintes do citoesqueleto das células epiteliais, pertencendo aos filamentos intermediários; sua distribuição é específica para cada subtipo de epitélio, permitindo que sejam utilizadas como importantes marcadores de sua diferenciação. Anticorpos monoclonais permitem sua localização nos tecidos e são utilizados no diagnóstico de tumores. Na última década inúmeras mutações foram descritas em seus genes, levando a alteração em sua estrutura molecular, esclarecendo várias enfermidades cutâneas, como epidermólise bolhosa simples (CQ 5 ou 14), hiperqueratose epidermolítica (CQ 1 ou 10), hiperqueratose palmoplantar epidermolítica (CQ 9) e paquioníquia congênita (CQ 6, 16 ou 17).
citoqueratinas; imuno-histoquímica; genética molecular; mutação
Cytokeratins (CK) belong to the intermediate filament group and are expressed in epithelial cells. Their expression is tissue specific and for this reason they are the most important markers of epithelial differentiation. Monoclonal antibodies, which specifically mark one CK, are used in the diagnosis of many tumors. In the last decade, several mutations were described in CK genes, which lead to structural changes in its molecule. As a result, the pathogenesis of many skin diseases has been clarified, such as Epidermolysis bullosa simplex (CK 5 or 14), Epidermolytic hyperkeratosis (CK 1 or 10), Epidermolytic palmoplantar keratoderma (CK 9) and Pachyonychia congenita (CK 6, 16 or 17).
cytokeratin; immunohistochemistry; molecular genetics; mutation
EDUCAÇÃO MÉDICA CONTINUADA
Citoqueratinas* * Trabalho realizado na Universidade Federal e Católica de Pelotas.
Hiram Larangeira de Almeida Jr.
Professor Adjunto de Dermatologia, Universidade Federal de Pelotas e do Mestrado de Saúde e Comportamento da Universidade Católica de Pelotas
Endereço para correspondência Endereço para correspondência Prof. Dr. Hiram Larangeira de Almeida Jr. Universidade Católica de Pelotas Mestrado em Saúde e Comportamento Rua Almirante Barroso,1202 - 107 - Bloco G 96010-280 Pelotas RS E-mail: hiramalmeidajr@hotmail.com
RESUMO
As citoqueratinas (CQ) são constituintes do citoesqueleto das células epiteliais, pertencendo aos filamentos intermediários; sua distribuição é específica para cada subtipo de epitélio, permitindo que sejam utilizadas como importantes marcadores de sua diferenciação. Anticorpos monoclonais permitem sua localização nos tecidos e são utilizados no diagnóstico de tumores. Na última década inúmeras mutações foram descritas em seus genes, levando a alteração em sua estrutura molecular, esclarecendo várias enfermidades cutâneas, como epidermólise bolhosa simples (CQ 5 ou 14), hiperqueratose epidermolítica (CQ 1 ou 10), hiperqueratose palmoplantar epidermolítica (CQ 9) e paquioníquia congênita (CQ 6, 16 ou 17).
Palavras-chave: citoqueratinas; imuno-histoquímica; genética molecular; mutação.
As citoqueratinas (CQ) são constituintes do citoesqueleto das células epiteliais, por isso também denominadas queratinas epiteliais ou queratinas moles, e devem ser diferenciadas das tricoqueratinas, as chamadas queratinas duras, as quais formam a haste do cabelo e a unha.1
O citoesqueleto, uma rede protéica intracelular, é constituído pelos chamados filamentos intermediários, os quais medem de sete a 10nm; pelos filamentos de actina, de cerca de de 7nm; e pelos microtúbulos, que medem 25nm.2 Os microtúbulos estão relacionados com o transporte intracelular de organelas, os filamentos de actina participam da motilidade celular, e os filamentos intermediários dão a estrutura tridimensional da célula.2
Três subclasses de filamentos intermediários são reconhecidas: vimentina e relacionados (vimentina presente nas células mesenquimais, desmina nos miócitos e proteínas gliais nas células neurogliais); neurofilamentos (presentes nos neurônios); e por fim as citoqueratinas, encontradas nos epitélios e estruturas deles derivadas.2
Os filamentos intermediários são capazes de se autopolimerizar, formando uma rede citoplasmática responsável pela resistência mecânica das células, sendo, no caso dos epitélios, importante contra os traumas banais que sofrem.3,4
As CQ foram catalogadas a partir de eletroforese bidimensional,5 a qual separa as proteínas não só por seu peso molecular, mas também em função do pH. Com essa técnica observou-se que o padrão obtido nessa eletroforese variava se, por exemplo, fosse realizada a partir de lisado epidérmico ou folicular (Figura 1). Atualmente elas são divididas em dois grupos: as do tipo I, ácidas, incluindo as CQ de 9 a 23, e as do tipo II, básicas, CQ de 1 a 8.4
As CQ perfazem o maior grupo dos filamentos intermediários, sendo, atualmente, descritas mais de 20 diferentes, e são de extrema importância para a compreensão de vários mecanismos nas doenças cutâneas.
De forma semelhante, as tricoqueratinas também são divididas em dois grupos, tendo sido convencionado chamar as do grupo I de hHa1 a hHa8 (de human Hair acidic) e as do grupo II de hHb1 a hHb6 (de human Hair basic), de acordo com sua localização na eletroforese bidimensional.6
Mais recentemente quatro diferentes variantes da CQ 6 foram descritas na bainha radicular interna e denominadas K6irs1 (de inner root sheath), K6irs2, K6irs3 e K6irs4;7,8 outras variantes, denominadas 6a e 6b, têm distribuição diferente nos anexos cutâneos, sendo responsáveis por variabilidade clínica em algumas doenças (veja mutações).9
Sua importância na patogenia de diversas dermatoses deve-se à especificidade da expressão das CQ de acordo com o epitélio envolvido, por exemplo, a epiderme ou o epitélio da córnea, e também porque elas podem ser expressas somente em alguns setores dos epitélios.
Na maioria das vezes, são encontradas aos pares (Tabela 1), formando heterodímeros, ou seja, a união de duas CQ diferentes, constituindo filamentos, os quais são a estrutura tridimensional formadora do citoesqueleto, e ancoram-se nos desmossomas e na placa interna dos hemidesmossomas.
DISTRIBUIÇÃO TECIDUAL ESPECIFICA
As CQ têm distribuição característica de cada epitélio e seus anexos.
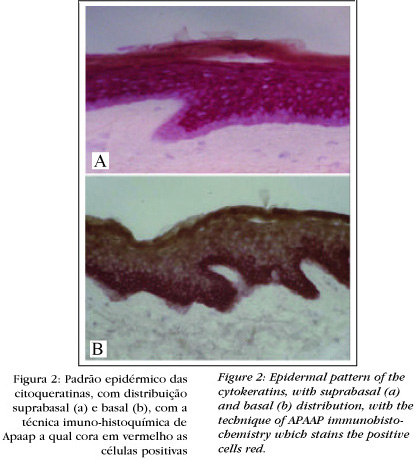
Na epiderme, por exemplo, elas podem ter uma expressão basal (Figura 2) - onde são encontradas as CQ 5 e 14 -, ou suprabasal - CQ 1 e 10. No folículo piloso são encontradas as CQ basais e as CQ hiperproliferativas - 6, 16 e 17-, assim chamadas por também serem encontradas em situações patológicas, como na epiderme da psoríase e em tumores. A CQ 19 é encontrada na camada mais externa da bainha radicular externa, também denominada camada basal dessa bainha, sendo mais específica do folículo piloso (Figura 3). O setor folicular acima da glândula sebácea expressa as mesmas CQ da epiderme.
Outros epitélios como os simples, a córnea e os estratificados não queratinizantes têm também seu padrão de CQ (Tabela 1).
Dessa forma é possível falar em padrões folicular e epidérmico da distribuição das CQ. Esses padrões específicos permitem que as CQ sejam utilizadas como importantes marcadores de diferenciação epitelial.
Como já relatado acima, a CQ 6 e a CQ 16 são expressas na epiderme em situações em que ocorre hiperproliferação, como na psoríase e em tumores epiteliais, sendo por isso também chamadas de CQ hiperproliferativas. Já foi demostrada a indução experimental da CQ 6, quando estimulada a epiderme por citoquinas, como interferon gama, fator de crescimento epitelial (EGF) e fator de necrose tumoral (TNF), bem como pela radiação ultravioleta, sendo que esta última induz também a CQ 19, mostrando aspectos dinâmicos na expressão das CQ.10,11
Todas as CQ têm uma molécula semelhante, constituída por quatro segmentos helicoidais - 1A, 1B, 2A e 2B - intercalados por segmentos curtos não helicoidais, chamados de segmentos ligantes L1, L12 e L2. Na extremidade encontram-se os segmentos variáveis V1 e V2, sendo que as CQ básicas apresentam segmentos H1 e H2 entre os helicoidais e os variáveis4,9,12 (Figura 4). Apesar dessa grande semelhança, foram desenvolvidos anticorpos monoclonais, capazes de marcar apenas uma CQ.
A utilização desses anticorpos monoclonais permite, por exemplo, mostrar quais CQ são encontradas em determinado tumor, podendo-se fazer referência à origem dessas células com base em marcadores moleculares e não só em aspectos morfológicos.
UTILIZAÇÃO EM IMUNO-HISTOQUIMICA
A aplicação de anticorpos monoclonais marcadores de CQ permite investigar a origem de tumores e seu diagnóstico diferencial.
O carcinoma basocelular expressa as CQ basais 5 e 14, a CQ 17 e a CQ 19 (Figura 5), padrão semelhante ao do folículo piloso,13,14 tendo sido sugerida a possibilidade de ele se originar da bainha radicular externa,15 o que se correlaciona com achados clínicos, pois esse tumor não é encontrado nas regiões palmoplantares.
Da mesma forma a identificação da CQ 20 já é utilizada no diagnóstico do carcinoma das células de Merkel,16 bem como na identificação precoce de metástases nos linfonodos-sentinela.17
Também na cirurgia micrográfica de Mohs, a marcação com anticorpos contra CQ permite que se aumente o sucesso desse tipo de tratamento cirúrgico,18 pois células de difícil visualização com a hematoxilina e eosina podem ser identificadas com os anticorpos.
Anticorpos de baixa especificidade, marcadores de diversas CQ, podem ser utilizados no diagnóstico de neoplasias indiferenciadas; uma vez expressando esses marcadores epiteliais, pode-se afirmar tratar-se de carcinoma indiferenciado, diferenciando-se assim, por exemplo, de linfomas.
De maneira semelhante, anticorpos antivimentina são utilizados no diagnóstico de tumores mesenquimais, porém o grande número de citoqueratinas faz com que seu uso no diagnóstico das neoplasias epiteliais seja bem mais amplo do que no caso da vimentina.
MUTAÇÕES
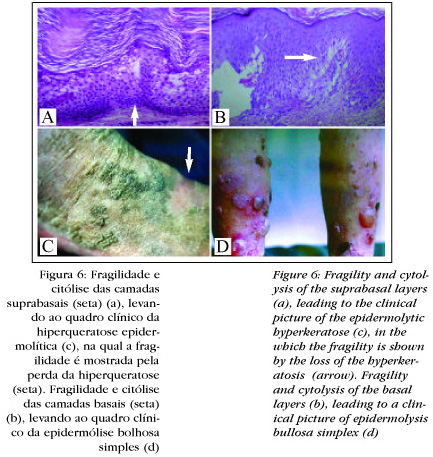
Outra utilização importante desses novos conhecimentos é nas genodermatoses por mutação das CQ. Na medida em que elas são expressas de forma localizada, a doença conseqüente dessa mutação será específica de determinadas células e de determinados segmentos epiteliais. Geralmente estão associadas à citólise, pois a célula desaba por alteração do citoesqueleto.
A alteração da camada basal por mutação, seja da CQ 5 seja da 14, leva à degeneração da camada basal (Figura 6), com fragilidade e formação de bolhas, características da epidermólise bolhosa simples (EBS)19,20 a primeira enfermidade na qual foi demonstrada mutação de uma CQ.21,22 Nas formas disseminadas da doença as mutações localizam-se nas extremidades do domínio helicoidal, ou seja, no início de 1A ou no final de 2B;23 nas formas palmoplantares localizam-se na região L1221 (Figura 4).
Já foi demonstrado, in vitro, que mutação da CQ 14 impede a polimerização normal, tendo menor resistência e elasticidade do que o heteropolímero normal.3 Outra alteração apontou que queratinócitos de pacientes com EBS são mais sensíveis a choque osmótico in vitro e demoram mais para se recuperar do que células normais,22 demonstrando a diminuição de sua resistência, que culmina in vivo com as bolhas.
De forma semelhante à fragilidade e degeneração da camada basal, como as vistas na EBS, alterações das CQ suprabasais levam à degeneração nas camadas altas da epiderme, características da hiperqueratose epidermolítica (HQE) (Figura 6). Também nessa enfermidade foram descritas mutações em CQ, nesse caso da CQ 1 ou CQ 10, que são expressas nessas mesmas camadas da epiderme.24-26 Os pacientes com mutação da CQ 10 tendem a um quadro clínico mais severo, e aqueles com mutação da CQ 1 são acompanhados de hiperqueratose palmoplantar. Nos pacientes com defeito da CQ 10, talvez a CQ 9, presente no estrato lúcido, compense o defeito da CQ 10, já que são do mesmo grupo de CQ ácidas,26 se bem que já foram descritas mutações da CQ 10 com acometimento palmoplantar.27
As mutações da CQ 9, já que é encontrada na epiderme palmoplantar, acompanham-se de degeneração restrita a essa área, típica da queratodermia palmoplantar epidermolítica;28-30 também nessa doença as mutações foram encontradas no início do segmento 1A.30
Seguindo esse mesmo princípio entre a localização específica da expressão normal de uma CQ e aquela da enfermidade decorrente de suas mutações, pôde-se também esclarecer a variabilidade clínica da paquioníquia congênita. Na do tipo 1, caracterizada pela alteração ungueal mais hiperqueratose palmoplantar e leucoderma oral, foram detectadas mutações das CQ 6a e 16, encontradas nessas regiões.31,32 Na do tipo 2, além do engrossamento da lâmina ungueal, ocorrem cistos na puberdade, sendo muitas vezes difícil diferenciar os subtipos na infância.31 Nessa variante foram descritas mutações na CQ 1733,34 e posteriormente em uma família na CQ 6b.
No esteatocistoma múltiplo, cujos cistos são semelhantes aos da paquioníquia congênita tipo 2, também foram descritas mutações na CQ 17 - incluindo mutações idênticas, que podem ser consideradas variantes clínicas, pois em alguns casos há também acometimento ungueal leve31 -, outros fatores genéticos devem estar envolvidos, explicando os fenótipos diferentes de mutações iguais,31 sem que ainda se consiga explicá-los.
Nos últimos anos pôde-se esclarecer a genética molecular de algumas distrofias corneanas com mutações das CQ presentes nesse epitélio. Na distrofia corneana de Meesmann, foram descritas mutações na CQ 3 e 12. Clinicamente são vistas opacidade e vesículas intraepiteliais, e qualquer das duas CQ podem estar envolvidas, levando ao mesmo quadro clínico oftalmológico, de forma muito semelhante ao que ocorre na EBS.35-37
Nos epitélios simples, encontrados no fígado, pâncreas e intestino, verificam-se também enfermidades associadas a mutações, envolvendo o citoesqueleto, descritas recentemente. Na cirrose criptogênica, a qual ocorre sem hepatite viral, alcoolismo ou outra causa conhecida, foram descritas mutações nas CQ 8 e 18 em alguns desses pacientes.38-39
Novas informações nessa área têm ampliado as correlações entre fenótipo e genótipo, e permitido melhor compreensão da patogenia e variabilidade clínica de muitas dermatoses;40,41 o conhecimento dessas mutações pode ser utilizado também no diagnóstico pré-natal a partir de DNA obtido por biópsia de córion,42,43 podendo ser feito ao redor da décima semana de gestação, substituindo a biópsia de pele por fetoscopia feita entre a décima oitava e a vigésima semana. As complicações nesse caso ocorrem entre 4 e 7% dos casos, sendo que na biópsia coriônica apenas em 1%.
As informações obtidas nas últimas duas décadas sobre as CQ trouxeram inúmeros avanços na compreensão de diversas enfermidades cutâneas, demonstrando a importância da pesquisa laboratorial e sua posterior aplicação no cotidiano médico. q
Recebido em 11.12.2003
Aprovado pelo Conselho Editorial e aceito para publicação em 27.01.2004
Questões e Resultados das Questões
1. No citoesqueleto das células epiteliais não encontramos:
a. Queratinas duras.
b. Microtúbulos.
c. Citoqueratinas.
d. Filamentos de actina.
2. Não é função do citoesqueleto:
a. Participar da motilidade celular.
b. Auxiliar no transporte de organelas.
c. Produzir a haste do cabelo.
d. Dar a estrutura tridimensional da célula.
3. Qual das proteínas abaixo não é um filamento intermediário?
a. Vimentina.
b. Laminina.
c. Desmina.
d. Neurofilamentos.
4. Assinale a alternativa incorreta:
a. As citoqueratinas são constituídas por quatro seg mentos helicoidais (1A, 1B, 2A, 2B).
b. A homologia molecular entre as diversas citoquerati nas impede o desenvolvimento de anticorpos mono clonais.
c. Os segmentos helicoidais são intercalados por seg mentos de ligação (L1, L12 e L2).
d. As citoqueratinas básicas têm também os segmentos H1 e H2.
5. Qual afirmação abaixo é incorreta?
a. As citoqueratinas têm distribuição tecidual específica.
b. As citoqueratinas formam em muitos epitélios hete rodímeros.
c. As citoqueratinas ancoram-se nos desmossomas e hemidesmossomas.
d. O padrão de citoqueratinas de um epitélio não sofre variações.
6. Assinale a afirmativa incorreta:
a. As citoqueratinas são divididas em ácidas e básicas.
b. Na bainha radicular interna encontram-se variantes da CQ 6.
c. As citoqueratinas não são capazes de se autopolimerizar.
d.As tricoqueratinas são divididas em ácidas e básicas.
7. Assinale a afirmativa incorreta:
a. A epiderme expressa citoqueratinas diferentes na camada basal e nas camadas suprabasais.
b. O folículo piloso expressa as citoqueratinas basais.
c. Na psoríase não ocorre mudança nas citoqueratinas epidérmicas.
d. O setor folicular acima da glândula sebácea tem um padrão epidérmico de citoqueratinas.
8. Com relação ao carcinoma basocelular, assinale a afirmativa correta:
a. São encontradas as citoqueratinas basais e supraba- sais.
b. São encontradas as citoqueratinas suprabasais.
c. O padrão encontrado é o da bainha radicular interna.
d. O padrão encontrado é o da bainha radicular externa.
9. Em qual das situações abaixo a demarcação imuno-histoquímica das citoqueratinas é negativa?
a. Nos carcinomas indiferenciados.
b. No carcinoma de Merkel.
c. No carcinoma basocelular.
d. No dermatofibrossarcoma protuberante.
10. Em qual das formas abaixo de epidermólise bolhosa foram descritas mutações em citoqueratinas?
a. Epidermólise bolhosa simples
b. Epidermólise bolhosa juncional
c. Epidermólise bolhosa distrófica
d. Epidermólise bolhosa adquirida
11. Assinale a afirmativa incorreta.
a. Na psoríase encontram-se na epiderme as chamadas citoqueratinas hiperproliferativas.
b. A célula de Merkel expressa a CQ 20.
c. A CQ 19 é encontrada em todas as células tumorais do carcinoma basocelular.
d. A bainha radicular externa expressa as chamadas citoqueratinas hiperproliferativas.
12. Em quais citoqueratinas ainda não foi descrita mutação?
a. CQ 1 e 10.
b. CQ 5 e 14.
c. CQ 3 e 12.
d. CQ 19 e 20.
13. A alteração celular mais vista na doenças por mutação das citoqueratinas é:
a. Cariorrexe.
b. Citólise.
c. Espongiose.
d. Acantólise.
14. Em que parte do gen das citoqueratinas basais localiza-se a maioria das mutações da epidermólise bolhosa simples palmoplantar?
a. No início do segmento 1A.
b. No final do segmento 2B.
c. No segmento não-helicoidal L12.
d. No início do segmento 2B.
15. Em qual doença existe variabilidade clínica, dependendo da CQ mutada?
a. Epidermólise bolhosa simples
b. Cirrose criptogênica
c. Paquioníquia congênita
d. Distrofia corneana
16. Na cirrose criptogênica foram descritas mutações nas CQ:
a. CQ 8 e 18.
b. CQ 6 e 16.
c. CQ 1 e 11.
d. CQ 9 e 19.
17. Na paquiníquia congênita foram descritas mutações nas CQ:
a. CQ 6.
b. CQ 16.
c. CQ 17.
d. Todas as anteriores.
18. Na hiperqueratose epidermolítica foram descritas mutações nas CQ:
a. CQ 8 e 18.
b. CQ 6 e 16.
c. CQ 1 e 10.
d. CQ 5 e 14.
19. Assinale a alternativa incorreta:
a. As informações sobre mutações podem ser utilizadas no diagnóstico pré-natal a partir de biópsia coriônica.
b. A alteração histológica da distrofia corneana de Meesmann é semelhante à da epidermólise bolhosa simples.
c. Na queratodermia palmoplantar epidermolítica foram descritas mutações na CQ 9.
d. Até o momento não é possível fazer correlações genofenotípicas.
20. Na distrofia corneana de Meesmann foram descritas mutações nas CQ:
a. CQ 8 e 18.
b. CQ 3 e 12.
c. CQ 1 e 10.
d. CQ 5 e 14.
GABARITO
Malformações Vasculares
2004; 79(1): 07-25
1. b 9. c
2. c 10. a
3. d 11. a
4. c 12. d
5. a 13. c
6. d 14. b
7. b 15. d
8. b
- 1. Langbein L, Rogers MA, Winter H et al The catalog of human hair keratins I. Expression of the nine type I members in the hair follicle. J Biol Chem 1999; 274: 19.874-84.
- 2. Alberts B, Bray D, Johnson A et al O Citoesqueleto. In: Alberts B, Bray D, Johnson A, Lewis J, Raff M, Roberts K, Walter P. Fundamentos da Biologia Celular- Uma introdução à biologia molecular da célula. Porto Alegre: Artmed 1999: 526-60.
- 3. Ma L, Xu J, Coulombe PA, Wirtz D. Keratin filament suspension show unique micromechanical properties. J Biol Chem 1999; 274: 19.145- 51.
- 4. Coulombe PA, Omary MB. 'Hard' and 'soft' principles defining the structure, function and regulation of keratin intermediate filaments. Curr Opin Cell Biol 2002; 14: 110-22.
- 5. Moll R, Franke WW, Schiller DL, Geiger B, Krepler R. The catalog of human cytokeratins: patterns of expression in normal epithelia, tumors and cultured cells. Cell 1982; 31:11-24.
- 6. Langbein L, Rogers MA, Winter H, Praetzel S, Schweizer J. The catalog of human hair keratins II.Expression of the six type II members in the hair follicle and the combined catalog of human type I and II keratins. J Biol Chem 2001; 276: 35123-32.
- 7. Langbein L, Rogers MA, Praetzel S, Winter H, Schweizer J. K6irs1, K6irs2, K6irs3 and K6irs4 represent the inner-root-sheath-specific type II epithelial keratins of the human hair follicle. J Invest Dermatol 2003; 120: 512-22.
- 8. Langbein L, Rogers MA, Praetzel S, Aoki N, Winter H, Schweizer J. A novel epithelial keratin, hK6irs1, is expressed differentially in all layers of the inner root sheath, including specialized Huxley cells (Flügelzellen) of the human hair follicle. J Invest Dermatol 2001; 118: 789-99.
- 9. Smith FJD. The molecular genetics of keratin disorders. Am J Clin Dermatol 2003; 4: 347-364.
- 10. Bernerd F, Del Bino S, Asselineau. Regulation of keratin expression by ultraviolet radiation: differential and specific effects of ultraviolet B and ultraviolet A exposure. J Invest Dermatol 2001; 117: 1421-9.
- 11. Hattori N, Komine M, Yano et al Interferon-?, a strong supressor of cell proliferation, induces upregulation of K6, one of the inflammatory- and proliferation-associated keratins. J Invest Dermatol 2002; 119: 403-10.
- 12. Ishida-Yamamoto A, Takahashi H, Lizuka H. Lessons from disorders of epidermal differentiation-associated keratins. Histol Histopathol 2002; 17: 331-8.
- 13. Schirren CG, Rutten A, Kaudewitz P, Diaz C, McClain S, Burgdorf WH. Trichoblastoma and basal cell carcinoma are neoplasms with follicular differentiation sharing the same profile of cytokeratin intermediate filaments. Am J Dermatopathol 1997; 19: 341-50.
- 14. Kurzen H, Esposito L, Langbein L, Hartschuh W. Cytokeratins as markers of are neoplasms with follicular differentiation: an immunohistochemical study of trichoblastoma and basal cell carcinoma. Am J Dermatopathol 2001; 23: 501-9.
- 15. Asada M, Schaart FM, Almeida Jr. HL, Korge B, Kurokawa I, Asada Y, Orfanos CE. Solid basal cell epithelioma (BCE) possibly originates from the outer root sheath of the hair follicle. Acta Derm Venereol (Stockh) 1993; 93:286-292.
- 16. Leech SN, Kolar AJ, Barret PD, Sinclair SA, Leonard N. Merkel cell carcinoma can be distinguished from metastatic small cell carcinoma using antibodies to cytokeratin 20 and thyroid transcription factor 1. J Clin Pathol 2001; 54: 727-9.
- 17. Su LD, Lowe L, Bradford CR, Yahanda AI, Johnson TM, Sondak VK. Immunostaining for cytokeratin 20 improves detection of micrometastic Merkel cell carcinoma in sentinel lymph nodes. J Am Acad Dermatol 2002; 46: 661-6.
- 18. Smeets NW, Stavast-Kooy AJ, Krekels GA, Daemen MJ, Neumann HA. Adjuvant cytokeratin staining in Mohs micrographic surgery for basal cell carcinoma. Dermatol Surg 2003; 29: 375-7.
- 19. Sasaki Y, Shimizu H, Akiyama M et al A recurrent keratin 14 mutation in Dowling-Meara epidermolysis bullosa simplex . Br J Dermatol 1999; 141: 747-8.
- 20. Liovic M, Stojan J, Bowden PE et al A novel keratin 5 mutation (K5V186L) in a family with EBS-K: a conservative substitution can lead to development of different disease phenotypes. J Invest Dermatol 2001; 116: 964-9.
- 21. Yasukawa K, Sawamura D, McMillan JR, Nakamura H, Shimizu H. Dominant and recessive compound heterozygous mutations in epidermolysis bullosa simplex demonstrate the role of the stutter region in keratin intermediate filament assembly. J Biol Chem 2002; 277: 23670-4.
- 22. D'Alessandro M, Russell D, Morley SM, Davies AM, Lane EB. Keratin mutations of epidermolysis bullosa simplex alter the kinetics of stress response to osmotic shock. J Cell Sci 2002; 115: 4341-51.
- 23. Premaratne C, Klingberg S, Glass I, Wright K, Murrell D. Epidermolysis bullosa simplex Dowling-Meara due to an arginine to cysteine substitution in exon 1 of keratin 14. Aust J Dermatol 2002; 43: 28-34.
- 24. Arin MJ, Longley MA, Anton-Lamprecht I et al A Novel Substitution in Keratin 10 in Epidermolytic Hyperkeratosis. J Invest Dermatol 1999; 112: 506-8
- 25. Arin MJ, Longley MA, Küster W et al An aspargine to threonine substitution in the 1A domain of Keratin 1: a novel mutation that causes epidermolytic hyperkeratosis. Exp Dermatol 1999; 8: 124-7.
- 26. Virtanen M, Gedde-Dahl Jr. T, Mörk NJ, Leigh I, Bowden PE, Vahlquist A. Phenotipic/ Genotipic correlations in patients with epidermolytic hyperkeratosis and the effects of retinoid therapy on keratin expression. Acta Derm Venereol 2001; 81: 163-70.
- 27. Sun XK, Ma LL, Xie YQ, Zhu XJ. Keratin 1 and 10 mutations causing epidermolytic hyperkeratosis in Chinese patients. J Dermatol Sci 2002; 29: 195-200.
- 28. Covello SP, Irvine AD, McKenna KE et al Mutations in Keratin K9 in Kindreds with Epidermolytic Palmoplantar Keratoderma and Epidemiology in Nothern Ireland. J Invest Dermatol 1998; 111: 1207-9.
- 29. Asadi AK, Kotcher LB, Jih MH. The molecular basis of hereditary palmoplantar keratodermas. J Am Acad Dermatol 2002;47:327-43.
- 30. Rugg EL, Common JEA, Wilgos A et al Diagnosis and confirmation of epidermolytic palmoplantar keratoderma by the identification of mutations in keratin 9 using denaturing high-performance liquid chromatography. Br J Dermatol 2002; 146: 952-7.
- 31. Smith FJD, Coleman CM, Bayoumy NM et al Novel Keratin 17 Mutations in Pachionychia Congenita Type 2. J Invest Dermatol 2001; 116: 806-8.
- 32. Connors JB, Rahil AK, Smith FJD, McLean WHI, Milstone LM. Delayed-onset pachyonychia congenita associated with a novel mutation in the central 2B domain of keratin 16. Br J Dermatol 2001; 144: 1058-62.
- 33. Feng YG, Xiao SX, Ren XR, Wang WQ, Liu A, Pan M. Keratin 17 mutation in pachyonychia congenita type 2 with early onset sebaceous cysts. Br J Dermatol 2003; 148: 452-5.
- 34. Hashiguchi T, Yotsumoto S, Shimada H et al A novel mutation in the keratin 17 gene in a japanese case of pachyonychia congenita type 2. J Invest Dermatol 2002; 118:545-7.
- 35. Gupta SK, Hodge WG. A new clinical perspective of corneal dystrophies through molecular genetics. Curr Opin Ophthalmol 1999; 10: 234-41.
- 36. Corden LD, Swenson O, Swenson B et al Molecular genetics of Meesmaann´s corneal dystrophy: ancestral and novel mutations in keratin 12 (K12) and complete sequence of the human KRT12 gene. Exp Eye Res 2000; 70: 41-9.
- 37. Swenson O, Swenson B, Nolle B, Rochels R, Wannke B, Thiel HJ. Mutations in the keratin gene as a cause of Meesmann-Wilke corneal dystrophy and autossomal dominant skin cornification disorders. Klin Monatsbl Augenheilkd 2000; 217: 43-51.
- 38. Ku NO, Wright TL, Terrault NA, Gish R, Omary MB. Mutation of human keratin 18 in association with cryptogenic cirrhosis. J Clin Invest 1997; 99:19-23.
- 39. Ku NO, Gish R, Wright TL, Omary MB. Keratin 8 mutations in patients with cryptogenic liver disease. N Engl J Med 2001; 344:1580-7.
- 40. Almeida Jr. HL. Genética Molecular das Epidermólises Bolhosas. An Bras Dermatol 2002; 77: 519-32.
- 41. Uitto J, Pulkkinen L. Molecular genetics of heritable blistering disorders. Arch Dermatol 2001; 137: 1458-61.
- 42. Rugg EL, Baty D, Shemanko CS et al DNA based prenatal testing for the skin blistering disorder epidermolysis bullosa simplex. Prenat Diagn 2000;20:371-7.
- 43. Pulkkinen L, Uitto J. Mutation analysis and molecular genetics of epidermolysis bullosa. Matrix Biol 1999;18:29-42.
Datas de Publicação
-
Publicação nesta coleção
09 Jun 2004 -
Data do Fascículo
Abr 2004
Histórico
-
Aceito
27 Jan 2004 -
Recebido
11 Dez 2003