Resumos
A doença enxerto contra hospedeiro (DECH) é uma síndrome sistêmica que ocorre em pacientes que recebem linfócitos imunocompetentes. A fisiopatologia envolve uma reação imunológica entre linfócitos transplantados e tecidos do hospedeiro, e ocorre por ataque imune das células T do doador às células do hospedeiro, as quais diferem daquelas pelos antígenos de histocompatibilidade. É, assim, uma complicação primária do transplante de medula óssea (TMO) alogênico. O envolvimento cutâneo é freqüente na DECH e contribui para a morbidade e mortalidade do TMO. O dermatologista tem papel importante na avaliação dos pacientes auxiliando no reconhecimento precoce da DECH e suas complicações e no acompanhamento clínico desses pacientes. Nesta revisão os autores enfatizam as manifestações cutâneas da DECH, tendo como base sua experiência pessoal no acompanhamento de pacientes portadores de DECH transplantados de medula óssea no Centro Nacional de Transplante de Medula Óssea/Inca/MS, no Rio de Janeiro, nos últimos 14 anos.
Doença enxerto contra hospedeiro; Transplante de medula óssea; Transplante alogênico
Graft-versus-host disease (GVHD) is a systemic disease that occurs in patients that receive immunocompetent lymphocytes. Pathophysiology involves an immunologic reaction between transplanted lymphocytes and tissues of the host, through an immune attack of donor T cells against recipient cells that differ from the donor's by histocompatibility antigens. It is a major complication of allogeneic hematopoietic stem cell transplantation. GVHD skin involvement is frequent and contributes to morbidity and mortality of bone marrow transplantation. Dermatologists have an important role on patient's evaluation, providing early diagnosis of GVHD disease and its complications, so as to follow-up these patients. In this review, we emphasize the skin manifestations of GVHD, taking into account our 14-year personal experience at Centro Nacional de Transplante de Medula Óssea/INCA/MS.
Graft vs host disease; Bone marrow transplantation; Transplantation, homologous
ARTIGO DE REVISÃO
Manifestações tegumentares da doença enxerto contra hospedeiro em pacientes transplantados de medula óssea* * Trabalho realizado na Universidade Federal do Rio de Janeiro - UFRJ.
Márcia de Matos SilvaI; Luis Fernando S. BouzasII; Absalom L. FilgueiraIII
IDoutora em Dermatologia pela UFRJ
IIMestre em Hematologia pela Faculdade de Medicina - UFRJ, Diretor do Centro Nacional de Transplante de Medula Óssea do Inca/MS
IIIProfessor titular de Dermatologia da Faculdade de Medicina/UFRJ
Endereço para correspondência Endereço para correspondência Márcia de Matos Silva Rua República Árabe da Síria 451/303 Ilha do Governador RJ 21931-220 Tel/fax: (21) 3353-3970 E-mail: marciamatos@openlink.com.br
RESUMO
A doença enxerto contra hospedeiro (DECH) é uma síndrome sistêmica que ocorre em pacientes que recebem linfócitos imunocompetentes. A fisiopatologia envolve uma reação imunológica entre linfócitos transplantados e tecidos do hospedeiro, e ocorre por ataque imune das células T do doador às células do hospedeiro, as quais diferem daquelas pelos antígenos de histocompatibilidade. É, assim, uma complicação primária do transplante de medula óssea (TMO) alogênico. O envolvimento cutâneo é freqüente na DECH e contribui para a morbidade e mortalidade do TMO. O dermatologista tem papel importante na avaliação dos pacientes auxiliando no reconhecimento precoce da DECH e suas complicações e no acompanhamento clínico desses pacientes. Nesta revisão os autores enfatizam as manifestações cutâneas da DECH, tendo como base sua experiência pessoal no acompanhamento de pacientes portadores de DECH transplantados de medula óssea no Centro Nacional de Transplante de Medula Óssea/Inca/MS, no Rio de Janeiro, nos últimos 14 anos.
Palavras-chave: Doença enxerto contra hospedeiro; Transplante de medula óssea; Transplante alogênico.
INTRODUÇÃO
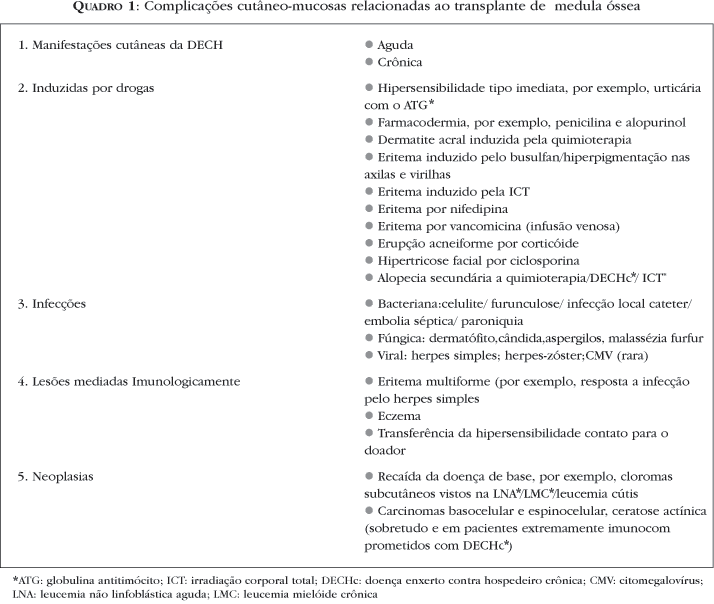
O transplante de medula óssea (TMO) é uma forma de tratamento eficaz contra diversos tipos de doenças, hematológicas ou não. A infusão da medula óssea, entretanto, pode gerar inúmeras complicações com manifestações cutâneas associadas, algumas delas próprias do processo de reconhecimento do enxerto introduzido.1-6 Além disso, já na fase pré-transplante (regime de condicionamento), as drogas utilizadas na ablação da medula levam também a alterações mucocutâneas específicas.7 Da mesma forma, novas drogas imunossupressoras e antibióticos, que permitem mais segurança na realização dos transplantes de medula óssea, podem também gerar complicações dermatológicas (Quadro 1). Assim, o diagnóstico diferencial preciso entre essas diversas manifestações dermatológicas é fundamental para o reconhecimento precoce da complicação mais freqüente e muitas vezes grave do transplante, que é a doença enxerto contra hospedeiro (DECH).
DOENÇA ENXERTO CONTRA HOSPEDEIRO
A doença enxerto contra hospedeiro é a maior complicação do transplante de medula óssea alogênico e uma barreira para ampliar a aplicação do alotransplante.
A DECH foi primeiro descrita em animais experimentais, nos quais se observou que a infusão de células esplênicas geneticamente idênticas, transplantadas de animais com aplasia de medula óssea induzida por radiação, foi seguida por doença grave, cujas manifestações clínicas mais comuns foram astenia, diarréia e lesões cutâneas.8
Os primeiros TMO humanos foram realizados por Thomas et al.9 em 1957. Atualmente centenas de TMOs são realizados anualmente no mundo. A falha na pega do enxerto e a DECH foram as principais razões para que o TMO fosse descontinuado até que técnicas para definir a histocompatibilidade humana fossem criadas.10-14 Em 1966, Billingham15 formulou pré-requisitos para o desenvolvimento da DECH. Primeiro, o enxerto deve conter células imunologicamente competentes; segundo, o hospedeiro deve ser incapaz de apresentar resposta efetiva para destruir as células transplantadas; terceiro, o hospedeiro deve expressar antígenos teciduais que não estão no doador. Assim, de acordo com esses critérios, a DECH pode ocorrer em qualquer situação em que tecidos contendo células imunocompetentes (componentes sangüíneos, medula óssea, órgãos sólidos) sejam transferidos entre indivíduos. A idade do hospedeiro, alotransplantes, o fato de o doador ser do sexo feminino e o hospedeiro do masculino, uso de irradiação no condicionamento e dose subótima de drogas imunossupressoras aumentam o risco para o desenvolvimento da DECH (Quadro 2).
Por volta de 1970, os testes para avaliação da histocompatibilidade e os regimes imunossupressivos reduziram os índices da falha na pega do enxerto. Os transplantes com doadores portadores de antígenos leucocitários humanos idênticos (antígenos de histocompatibilidade ou HLA, também conhecidos como antígenos do complexo de histocompatibilidade maior ou MHC) melhoraram muito o transplante e diminuíram a mortalidade da DECH.14 Regimes imunossupressivos profiláticos para a DECH com metotrexate e ciclosporina também diminuíram a incidência de DECH grave.16 Entretanto, a DECH ainda é o maior problema após o TMO alogênico, ocorrendo em percentual que varia de 40 a 50% dos receptores e sendo responsável por 15 a 40% da mortalidade aguda do TMO.13,14,16,17
A DECH é dividida em formas aguda e crônica, de acordo com tempo e achados clínicos e histopatológicos. É classificada como aguda quando se desenvolve nos primeiros 100 dias após o TMO alogênico e é caracterizada clinicamente pela tríade de exantema, hepatite (icterícia) e gastroenterite (dor abdominal, diarréia). A DECH crônica é uma síndrome multiorgânica, com características semelhantes às das doenças auto-imunes e do colágeno e ocorre geralmente 100 dias após o TMO. Essas distinções são importantes, pois os regimes de tratamento variam, e o prognóstico é diferente para uma e outra forma. A incidência de recaída tumoral diminui com o desenvolvimento da DECH pelo conhecido efeito enxerto contra doença.8
IMUNOFISIOPATOLOGIA DA DOENÇA ENXERTO CONTRA HOSPEDEIRO
A DECH resulta da ativação do linfócito T derivado do doador por antígenos de histocompatibilidade oriundos de tecidos do hospedeiro. Os mecanismos imunológicos que promovem as lesões agudas e crônicas, entretanto, não são idênticos. A teoria atual para a resposta imune da DECH sugere que a DECHa resulte da ativação de linfócitos T alorreativos do enxerto. Já a DECHc envolveria tanto mecanismos alorreativos quanto auto-reativos.19
DOENÇA ENXERTO CONTRA HOSPEDEIRO AGUDA
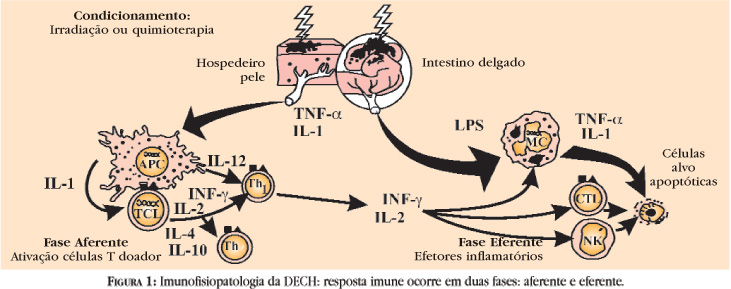
A resposta imune da DECHa ocorre em duas fases (Figura 1), uma aferente e uma eferente. Na fase aferente, células T CD4+ e CD8+ reagem à aloantígenos classe I e II do hospedeiro na superfície das células apresentadoras de antígenos (APC). O exato mecanismo de formação desses aloantígenos ainda não é bem explicado. O regime de condicionamento parece iniciar a resposta imune pelo dano aos tecidos do hospedeiro, como mucosa intestinal, fígado e outros, com indução da liberação de citocinas, em especial interleucina1 (IL1) e fator de necrose tumoral (TNF)-a, e penetração de lipossacarídeos bacterianos entéricos. As células T são estimuladas pela IL-1 e por sinais coestimuladores a produzir interleucina-2 (IL-2). Sob influência da IL-2, as células T CD4+ e CD8+ expandem-se clonalmente e se diferenciam em células efetoras, as quais induzem a resposta enxerto contra hospedeiro. Essas células efetoras são ativadas, por coestimuladores e citocinas proinflamatórias, como interferon gama (IFN-g) e interleucina 12 (IL-12), em células efetoras T helper 1 (incluíndo linfócitos citotóxicos CD4+ e CD8+), as quais direcionam a resposta enxerto contra hospedeiro. As células T alorreativas podem, ainda, transformar-se em células supressoras T helper 2 antígeno-específicas sob a influência das interleucinas 4 e 10 (IL4 e IL10).
A fase eferente da DECHa não é ainda bem compreendida. As células T ativadas produzem uma "tormenta" de citocinas, incluindo IL-2, IL-3, IL-4, IFN-g e outras. Esses mediadores recrutariam e ativariam células efetoras, incluindo linfócitos adicionais, macrófagos, e células "natural killer" (NK), que atacariam tanto os tecidos do doador como do hospedeiro. Aloantígenos MHC classe II são preferencialmente formados na pele, intestino e epitélio do ducto biliar pela ação do IFN-g e podem facilitar o ataque às células epiteliais. As células NK têm sido responsabilizadas, tanto em modelos experimentais como em humanos, pelo dano epitelial da DECH, alvejando células que não exprimam antígenos de superfície autólogos (próprios), e são ativadas durante a DECH pelas citocinas IL-2, IL-12 e IFN-g, produzindo, a partir de então, numerosas outras citocinas como fatores estimuladores de colônias hematopoiéticas, TNF-a e IFN-g. Assim, o início da DECHa é dependente das células NK presentes na medula enxertada, as quais têm sua atividade aumentada.
DOENÇA ENXERTO CONTRA HOSPEDEIRO CRÔNICA
As células T do doador presentes no hospedeiro sofrem, geralmente, seleção tímica, em que clones auto-reativos são eliminados. Entretanto, o timo pós-fetal não é eficiente na eliminação de células T reativas do hospedeiro, podendo estar ainda mais comprometido por diversos fatores, como idade avançada, regimes de condicionamento, DECHa prévia e ciclosporina. Na DECHc, algumas células T maduras do hospedeiro escapam da eliminação e alvejam antígenos de histocompatibilidade, resultando na persistência de clones alo e auto-reativos de células T.
A DECHc é caracterizada pelo dano epitelial mediado por células mononucleares e fibrose. Linfócitos T citotóxicos CD8+ predominam no infiltrado e podem, diretamente, induzir o dano tecidual, porém outras células efetoras (células NK, macrófagos e mastócitos) e citocinas (TNF-a) podem mediar a citotoxicidade. Mediadores solúveis induzem moléculas MHC nos tecidos alvo e estimulam a proliferação e produção de colágeno pelos fibroblastos. A ativação crônica e a degranulação dos mastócitos contribuem para a indução da fibrose na DECHc. A ativação policlonal de células B pode resultar na formação de vários auto-anticorpos, incluindo antinuclear, antiplaquetário, antieritropoiético, antiepitelial e fator reumatóide.
MANIFESTAÇÕES TEGUMENTARES DA DOENÇA ENXERTO CONTRA HOSPEDEIRO
Doença Enxerto Contra Hospedeiro Aguda (DECHa)
Ocorre nos primeiros três meses que se seguem ao TMO, freqüentemente entre o sétimo e o vigésimo primeiro dia. Os principais órgãos acometidos são o sistema imune, pele, fígado, trato gastrointestinal e pulmões.20 As manifestações cutâneas são em geral o primeiro sinal, caracterizadas por eritema nas palmas e plantas, precedido comumente por sensação de queimação ou prurido (Figura 2). Com a progressão da doença, exantema maculopapular envolve tórax, pescoço, bochechas e coloração violácea das orelhas (Figura 3).20,21 Acometimento mucoso é dificilmente distinguível da mucosite induzida pela quimioterapia. Pode haver, ainda, eritrodermia esfoliativa ou quadro cutâneo que se assemelha à necrólise epidérmica tóxica, o qual pode permanecer localizado nas áreas de pressão ou ser disseminado (Figura 4).22
A DECHa pode ser graduada de acordo com a gravidade23 em quatro estádios, e o prognóstico está relacionado com a graduação clínica, como demonstrado nos quadros 3 e 4.
Histologicamente a DECHa é caracterizada por vários graus de dano à epiderme: Grau I - vacuolização dos queratinócitos basais; Grau II - vacuolização dos queratinócitos basais e presença de queratinócitos disceratóticos; Grau III - fendas focais da camada basal; Grau IV - epiderme totalmente separada da derme. A interpretação dos resultados da biópsia da pele, principalmente na fase inicial após o TMO, pode ser difícil, devido aos achados similares encontrados com o uso de altas doses de radio/quimioterapia do regime preparatório pré-transplante ou tratamento com outras drogas.24,25 A situação é ainda complicada pelo fato de freqüentemente haver falta de correlação entre as características clínicas e histológicas.24,26 Por exemplo, a pele em uma área clinicamente afetada pode não ter alteração significativa histologicamente; ou uma área de pele sem alterações clínicas pode mostrar vacuolização de queratinócitos e necrose compatível com DECH.24 Assim, o valor diagnóstico das biópsias cutâneas na fase inicial do TMO tem sido questionado.24,27 Além disso, o valor prognóstico dos achados de biópsia da pele após o TMO também é discutível. Em um relato, os queratinócitos disceratóticos, o número de linfócitos exocitados e a presença de envolvimento folicular não se correlacionaram com melhora clínica.28
O diagnóstico diferencial deve ser feito com reações cutâneas da quimio ou radioterapia, farmacodermias e mesmo com algumas infecções virais, o que é difícil, pois os sintomas clínicos e os aspectos histológicos não são específicos. A presença de envolvimento extracutâneo pode ser útil na diferenciação.
DOENÇA ENXERTO CONTRA HOSPEDEIRO CRÔNICA (DECHc)
Ocorre três meses ou mais após o transplante, resultante de DECH aguda ativa (forma progressiva), após intervalo livre de doença (forma quiescente) ou sem DECH aguda prévia (forma de novo). Quanto à extensão é classificada como localizada, quando só pele e/ou envolvimento hepático estão presentes, e como extensa, quando outros órgãos estão envolvidos. A mortalidade da DECH crônica é superior a 30% em cinco anos pós-transplante.29
O dermatologista precisa estar atento ao espectro da DECH cutânea crônica (Quadro 5), pois ela se manifesta sob várias formas clínicas. As manifestações tegumentares da DECH crônica são múltiplas, freqüentemente mimetizando doenças dermatológicas bem conhecidas As manifestações mais comuns da doença são a forma liquenóide, esclerodermóide e vitiligóide, porém alterações de fâneros com distrofia ungueal e alopecia permanente do couro cabeludo são freqüentes. Ceratose folicular extensa, principalmente no dorso, mostrou-se manifestação comum na experiência dos autores.
Na histologia, ambas mostram alterações de interface com características comuns de linfócitos, vacuolização basal e necrose das células epidérmicas.
DOENÇA ENXERTO CONTRA HOSPEDEIRO CRÔNICA LIQUENÓIDE
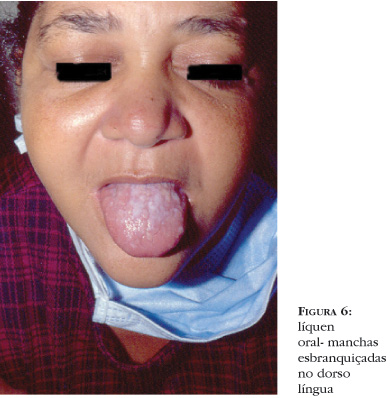
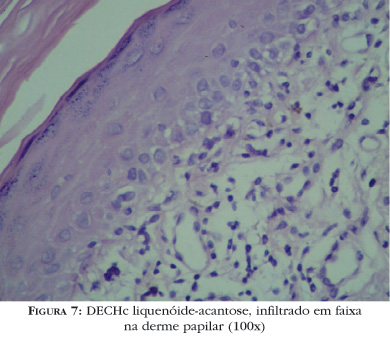
As manifestações clínicas ocorrem em geral precocemente no curso da doença e lembram o líquen plano idiopático (Figura 5). Pápulas violáceas pruriginosas com finas escamas aderentes podem ser observadas nas palmas e plantas, embora a erupção possa confluir, formando placas elevadas com grandes áreas violáceas. As lesões são menos marcadas e anguladas do que as vistas no líquen plano clássico. A região periorbitária, orelhas, palmas e plantas são áreas tipicamente afetadas. Por vezes, no centro das lesões formam-se vesículas, lembrando desidrose quando acometem as palmas. Ao atingir as unhas, ocorre onicoatrofia e piterígeo, e na genitália pode levar a fimose e estreitamento vaginal. Na mucosa oral podem coexistir manchas esbranquiçadas, arboriformes, por vezes exulceradas, geralmente em mucosa jugal e lábios, semelhantes às do líquen plano oral, associadas a xerostomia (Figura 6). Pode ser dermatomal30 ou seguir as linhas de Blaschko.31 Infecções virais de herpes-zóster subclínico, com alterações dos antígenos de histocompatibilidade na zona afetada, têm sido implicadas na patogênese dessa apresentação clínica. Histologicamente, a distinção entre líquen plano idiopático e DECH liquenóide pode ser difícil, pois ambos mostram hiperceratose, hipergranulose, acantose, alteração vacuolar da camada basal, disceratose e infiltrado em banda na derme papilar. O infiltrado na DECH liquenóide é freqüentemente menos intenso e mais perivascular, podendo estar presentes células plasmáticas e eosinófilos32 (Figura 7). A DECH crônica liquenóide pode progredir para DECH esclerodermóide, estabilizar-se ou resolver-se espontaneamente após meses ou anos. Hiperpigmentação pós-inflamatória freqüentemente ocorre como resolução do quadro e pode ocorrer dentro ou fora das pápulas violáceas.
DOENÇA ENXERTO CONTRA HOSPEDEIRO CRÔNICA ESCLERODERMÓIDE
Descrita pela primeira vez em 1979,3 é uma forma de apresentação clínica da DECH crônica menos freqüente do que a DECH liquenóide. É comum desenvolver-se progressivamente após DECH aguda e em locais previamente afetados pela DECH crônica liquenóide. Tem sido descrita também sem DECH cutânea prévia e em locais previamente afetados por herpes-zóster e radioterapia.34
Clinicamente pode ser generalizada ou localizada. As lesões localizadas assemelham-se às da esclerodermia localizada, mas com ausência do anel lilás característico, apresentando-se no tronco (Figura 8) e membros superiores. Lesões iniciais podem ser gutatas ou em confete e/ou apresentar hipo ou hiperpigmentação sobrepondo-se às placas escleróticas. Pode ser precedida por hiperpigmentação periorbicular, que pode predizer a DECH crônica esclerodermóide extensa. Endurecimento generalizado, hiperpigmentação, poiquilodermia, contraturas e ulceração cutânea podem ocorrer (Figura 9). Alterações cutâneas semelhantes às da esclerodermia bolhosa, com centenas de pequenas vesículas surgindo das lesões escleróticas, têm sido descritas na DECH esclerodermóide generalizada.35 Manifestações extracutâneas incluem fenômeno de Raynaud, xeroftalmia, xerostomia e disfagia. A DECH esclerodermóide pode assemelhar-se clinicamente à esclerodermia idiopática, e, embora a distinção seja difícil (Quadro 6), as duas podem ter diferenças histológicas. Alterações na epiderme são mais freqüentes na DECH esclerodermóide, com acantose ou atrofia, células disceratóticas e alterações vacuolares da camada basal.36,37 Diferenças no colágeno dérmico também podem ser notadas. Na DECH esclerodermóide, o espessamento dérmico pode ser menos significante, com depósito de colágeno na derme profunda abaixo do nível das glândulas sudoríparas. Em contraste, a esclerodermia idiopática é caracterizada por depósito de colágeno mais uniforme com espessamento dérmico importante. Anticorpos antinucleares estão freqüentemente ausentes ou são não específicos na DECH esclerodermóide. Anticorpos contra a topoisomerase 1(Scl-70) e PM-Scl, achados em 70% dos pacientes com esclerodermia sistêmica idiopática, podem estar presentes em pacientes com DECH esclerodermóide. Esse pode ser o fator preditivo do envolvimento cutâneo e interno extenso.38
Distúrbios pigmentares
As alterações da pigmentação são freqüentes na DECH crônica e variam com a época do pós-transplante.39 Hiperpigmentação difusa com exacerbação nas flexuras pode ser vista no início da fase crônica, em geral naqueles pacientes que apresentaram DECH aguda exantemática.
Hiperpigmentação reticulada extensa, justaposta a áreas de leucodermia, é freqüente após a DECH liquenóide. Hiperpigmentação periorbital, despigmentação vitiligóide e leucodermia total (Figura 10) têm sido relatadas.40
PROFILAXIA E TRATAMENTO
As estratégias para prevenção e tratamento da DECH geralmente visam interferir com a fase aferente da resposta, numa tentativa de eliminar as células T do doador ou bloquear sua ativação. A profilaxia da DECH é feita com imunossupressores como corticóide, ciclosporina e metotrexate utilizados de forma combinada. Anti-histamínicos orais e corticoterapia tópica são utilizados para casos leves. Recentemente a ciclosporina administrada sob a forma de bochechos tem sido utilizada para o líquen oral. No tratamento da DECH, as drogas de primeira linha são ciclosporina e corticóides, utilizados de forma combinada ou não. Para pacientes resistentes, esquemas com tacrolimus, micofenolato, azatioprina, talidomida e a fotoquimioterapia Puva41-43 são utilizados na tentativa de controlar a doença. A fotoferese extracorpórea tem sua ação na DECH c extensa, refratária às drogas de primeira e segunda linha.44,45
DISCUSSÃO
Apesar dos avanços terapêuticos com relação à imunossupressão pós-transplante, a DECH mantém-se, depois dos processos infecciosos, como a complicação mais freqüente do TMO alogênico, aumentando as taxas de mortalidade e morbidade do procedimento, e tem como órgãos alvo o fígado e as células epiteliais do intestino e pele. A DECH é classificada como aguda quando se desenvolve nos primeiros 100 dias (início em geral em torno do vigésimo dia) após o TMO alogênico e é caracterizada clinicamente por exantema, icterícia, dor abdominal e diarréia. Depois da pele, o fígado é o órgão mais atingido pela DECH a, quando clinicamente se expressa por icterícia colestática. Mais de 30% dos pacientes submetidos a TMO alogênico HLA idêntico e mais de 90% que recebem TMO de doadores não relacionados desenvolvem DECH aguda. A DECH crônica é uma síndrome multiorgânica, com características semelhantes às das doenças auto-imunes e do colágeno, que ocorre ocasionalmente antes dos 100 primeiros dias após o TMO e raramente após 500 dias. O período médio de aparecimento da DECH c é de 201 dias após TMO HLA idêntico, 159 dias após TMO com doador HLA não idêntico relacionado e 133 dias após TMO com doador HLA não relacionado.46 Afeta 50% dos pacientes submetidos a TMO em longo prazo e é letal em percentual que varia de 20 a 40% dos pacientes afetados, apesar dos tratamentos instituídos. Diferenças de histocompatibilidade, tipo de profilaxia para DECH a, DECH a prévia, profilaxia com CSA, infecções herpéticas latentes tanto do doador como no receptor, e pacientes idosos estão associados com aumento do risco de desenvolver DECH c.46
Clinicamente o envolvimento tegumentar da DECH c é caracterizado por hiperpigmentação, hipopigmentação, pápulas violáceas com estrias esbranquiçadas semelhantes às do líquen plano (forma líquenóide). Na mucosa oral, podem ocorrer manchas esbranquiçadas na mucosa jugal, lábios e palato, por vezes associadas a vesículas, exulcerações e xerostomia. Fibrose dérmica e subcutânea pode causar endurecimento da pele, lembrando a morféia localizada ou esclerodermia sistêmica (forma esclerodermóide). As formas liquenóide e esclerodermóide podem ocorrer simultaneamente. Quanto à histopatologia da pele, são reconhecidas duas fases, uma precoce e uma tardia. A fase precoce é caracterizada por alterações epidérmicas indistinguíveis das do líquen plano, com vacuolização da camada basal, necrose de ceratinócitos, hiperceratose e acantose associadas a infiltrado em banda esparso na junção dermoepidérmica composto por células mononucleares.32 A fase tardia é caracterizada por alterações esclerodermóides, com involução das alterações epidérmicas, acompanhada de fibrose da derme e perda dos anexos. A epiderme torna-se atrófica, e a vacuolização da camada basal, os queratinócitos necróticos e os corpos eosinofílicos são raramente observados. A aparência final lembra a da esclerodermia, porém com algumas diferenças. Na esclerodermia, a epiderme é freqüentemente normal, ao contrário de como se mostra na DECH c, quando apresenta alterações residuais na epiderme, com persistência da atrofia e incontinência pigmentar.47 Além do mais, parece que a fibrose começa mais alta, na derme superior, na DECH c.48 Convém lembrar que a histopatologia da pele fornece subsídios subjetivos para avaliação da resposta ao tratamento, mas não é um método adequado para quantificação de resposta.
O tratamento convencional de primeira linha da DECH c é feito com corticóides e ciclosporina, os quais estão associados, com freqüência, a efeitos adversos graves, como síndrome de Cushing, infeções secundárias ou neoplasias. Quando esse esquema terapêutico falha, deve-se recorrer a alternativas terapêuticas de segunda linha, como a talidomida, azatioprina, tacrolimus, o Puva e, mais recentemente, a fotoferese extracorpórea.
CONCLUSÃO
A DECH apresenta uma variedade de formas clínicas, o que torna importante o papel do dermatologista nos centros de transplante, auxiliando no diagnóstico precoce da doença e na diferenciação de outras manifestações cutâneo-mucosas. q
Recebido em 23.01.2003.
Aprovado pelo Conselho Consultivo e aceito para publicação em 25.09.2003.
O arquivo disponível sofreu correções conforme ERRATA publicada no Volume 80 Número 2 da revista.
- 1. Matsuoka LY. Graft versus host disease. J Am Acad Dermatol. 1981; 5: 595-9.
- 2. Thomas ED, Clift DA, Storb R. Indication for marrow transplantation. Ann Rev Med. 1984;35:1-9.
- 3. Ferrara JLM, Deeg HJ. Graft -versus-host disease. New Engl J Med. 1991; 324:667-74.
- 4. Farmer ER. Human cutaneous graft-versus-host disease. J Invest Dermatol.1985; 85:1245-85.
- 5. Mauduit G, Claudy A. Cutaneous expression of graft-versus-host disease in man. Semin Dermatol. 1998;7:149-55.
- 6. Tanaka K, Sullivan KM, Shulman HM, Sale GE, Tanaka A. A clinical review:cutaneous manifestations of acute and chronic graft-versus-host disease following bone marrow transplantation. J Dermatol. 1991;18:11-7.
- 7. Baker BW, Wilson CL, Davis AL, Spearing RL, Hart DN, Heaton DC, et al. Busulfan / cyclophosphamide conditioning for bone marrow transplantation may lead to failure of hair regrowth. Bone Marrow Transpl. 1991;7:43-7.
- 8. Barnes DWM, Loutit JF. Spleen protection: The cellular hypothesis. In: Bacq ZM, editor. Radiobiology symposium. London: Butterworth; 1954. p.134-5.
- 9. Thomas ED, Lochte Jr HL, Lu W C, Ferrebee JW. Intravenous infusion of bone marrow in patients receiving radiation and chemotherapy. N Engl J Med. 1957; 257:491-6.
- 10. Bach FH, Albertini RJ. Bone marrow transplant in a patient with Wiskott Aldrich Syndrome. Lancet. 1968; 2:1364-6.
- 11. Gatti RA, Meuwissen HJ, Allen HD, Hong R, Good RA. Immunologic reconstitution of sex-linked lymphopenic immunological deficiency. Lancet.1968;2:1366-9.
- 12. De Koning J, Van Bekkum DW, Dicke KA, Dooren LJ, Radl J, Van Rood JJ. Transplantation of bone marrow cells and fetal thymus in a infant with lymphopenic immunological deficiency. Lancet. 1969;1:1223-7.
- 13. Bortin MM. A compendium of reported human bone marrow transplants. Transplantation. 1970;9:571-87.
- 14. Bach FH, Van Rood JJ. The major histocompatibility complex: genetics and biology (part 1). N Engl J Med. 1976;295:806-13.
- 15. Billingham RE. The biology of graft-versus-host reactions. Harvey Lect. 1966-67;62:21-78.
- 16. Parkman R, Rappaport J, Rosen F. Human graft-versus-host disease. J Invest Dermatol. 1980; 74:276-9.
- 17. Neudorf S, Filipovich A, Ramsay N, Kersey J.Prevention and treatment of acute graft-versus-host disease. Semin Hematol. 1984; 21: 91-100.
- 18. Weiden PL, Sullivan KM, Flournoy N, Storb R, Thomas ED. Antileukemic efect of chronic graft-versus-host disease: contribution to improve survival after allogenic bone marrow transplantation. N Engl J Med. 1981;304:1529-33.
- 19. Johnson ML, Farmer ER. Graft-versus-host reactions in dermatology. J Am Acad Dermatol. 1998;38:369-92.
- 20. Glucksberg H, Storb R, Fefer A, Buckner CD, Neiman PE, Clift RA, et al. Clinical manifestations of graft-versus-host disease in human recipients of marrow from HLA matched sibling donors. Transplantation. 1984; 18:295-304.
- 21. Deeg HJ, Cottler-Fox M. Clinical Spectrum and pathophysiology of acute graft-versus-host disease. In: Butakoft SJ, Deeg HJ, Ferrara J, Atkinson K, editors. Graft-versus-host disease: Immunology, pathophysiology and treatment. New York: Marcel Dekker;1990. p.331-6.
- 22. Deeg HJ, Storb R. Graft-versus-host disease;pathophysiological and clinical aspects. Annu Rev Med. 1984; 35:11-24.
- 23. Przepiorka D, Weisdorf D, Martin P, et al. Consensus Conference on acute GVHD grading. Bone Marrow Transpl. 1995;15:825-8.
- 24. Elliott CJ, Sloane JP, Sanderson KV, Vincent M, Shepherd V, Powles R. The histological diagnosis of cutaneous graft versus host disease: relationship of skin changes to marrow purging and other clinical variables. Histopathology.1987; 11:145-55.
- 25. Darmstadt GL, Donnenberg AD, Vogelsang GB, Evan RF, Horn TD. Clinical, laboratory and histopathologic indicators of the development of progressive acute graft versus host disease. J Invest Dermatol. 1992; 99:397-402.
- 26. Hymes SR, Farmer ER, Lewis PG, Tutschka PJ, Santos GW. Cutaneous graft versus host reaction: prognostic features seen by light microscopy. J Am Acad Dermatol. 1985;12:468-74.
- 27. Sale GE, Lerner KG, Barker EA, Shulman HM, Thomas ED. The skin biopsy in the diagnosis of acute graft-versus-host disease in man. Am J Pathol. 1977;89:621-33.
- 28. Kohler S, Hendrickson MR, Chao NJ, Smoller BR. Value of skin biopsies in assessing prognosis and progression of acute graft-versus-host disease. Am J Surg Pathol. 1997;21:988-996.
- 29. Breathnach SM. Currente understanding of the aetiology and clinical implications of cutaneous graft-versus-host disease. Br J Dermatol. 1986;114:139-43.
- 30. Freemer CS, Farmer E, Russell LC, Almonte VL, Wagner JE, Vogelsang GB, et al. Lichenoid chronic graft-verus-host disease ocurring in a dermatomal distribution. Arch Dermatol. 1994; 130:70-4.
- 31. Wilson BB, Lockman DW. Linear Lichenoid graft-versus-host disease. Arch Dermatol. 1994; 130:1206-7.
- 32. Shulman HM, Sullivan KM, Weiden PL, McDonald GB, Striker GE, Sale GE, et al. Chronic graft -versus-host disease in man. A long-term clinicopathologic study of 20 Seattle patients. Am J Med.1980;69:204-17.
- 33. Graze PR, Gaie RP. Chronic graft-versus-host disease: a syndrome of disordered immunity. Am J Med. 1979;66:611-20.
- 34. Chosidow O, Bagot M, Vernant J, Roujeau J-C, Cordonnier C, Kuentz Mathieu, et al. Sclerodermatous chronic graft-versus-host disease. J Am Acad Dermatol. 1992;26:49-55.
- 35. Hymes SR, Farmer ER, Burns WH, Morison WL, Tustchka PJ, Walters LL, et al. Bullous scleroderma-like changes in chronic graft-versus-host disease. Arch Dermatol. 1985;121:1189-92.
- 36. Shulman HM, Sale GE, Lerner KG, Barker EA, Weiden PL, Sullivan K, et al. Chronic graft-versus-host disease in man. Am J Pathol. 1978;91: 545-63.
- 37. Shulman H, Sale GE. Pathology of acute and chronic cutaneous graft-versus-host disease.In: Sale GE, Shulman HM, editors.The pathology of bone marrow transplantation. New York: Masson Publishing; 1984. p.40-76.
- 38. Bell AS, Faust H, Muller JM, Kolb HJ, Meurer M, et al. Specificity antinuclear antibodies in scleroderma-like chronic graft-versus-host disease:clinical correlation and histocompatibility locus antigen association. Br J Dermatol. 1996;134:848-54.
- 39. Monteiro DV. Manifestações Tegumentares da doença enxerto-contra-hospedeiro crônica nos transplantados de medula óssea. [Tese]. Rio de Janeiro: Universidade Federal do Rio de Janeiro;1994.
- 40. Nagler A, Goldenhersh MA, Levi-Schaffer F, Bystryns JC, Klaus SN, et al. Total leucoderma: A rare manifestation of cutaneous chronic graft-versus-host disease. Br J Dermatol. 1996;134:780-3.
- 41. Atkinson K, Weller P, Ryman W, Biggs J. PUVA therapy for drug resistant graft-versus-host disease. Bone Marrow Transplant. 1986;1:227-36.
- 42. Vogelsang GB, Wolff D, Altomonte V, Farmer E, Morison WL, Corio R, et al. Treatment of chronic graft-versus-host diseasewith ultraviolet irradiation and psoralen(PUVA). Bone Marrow Transplant. 1996;17:1061-7.
- 43. Bouzas LF. Doença enxerto-contra-hospedeiro crônica em transplante de medula óssea:tratamento com psoraleno e ultravioleta A. [Tese]. Rio de Janeiro: Universidade Federal do Rio de Janeiro; 1996.
- 44. Greinix HT, Volc-Platzer B, Rabitsch W, Gmeinhart B, Guevara-Pineda C, Kalhs P, et al. Successful use of extra corporeal photochemotherapy in the treatment of severe acute and chronic graft-versus-host disease. Blood. 1998; 92:3098-104.
- 45. Bouzas LF, Silva MM, Mota IF, et al. Extracorporeal photopheresis plus UVADEX in chronic graft-versus-host disease (c-GVHD). Preliminary report. J Am SBMT. 2002; 8:84.
- 46. Sullivan KM, Agura E, Anasetti C, Appelbaum F, Badger C, Bearman S, et al. Chronic graft-versus-host disease and other late complications of bone marrow transplantation. Semin Hematol. 1991; 28: 250-259.
- 47. Farmer ER, Hood AF. Graft-versus-host-disease. In: Fitzpatrick A, Eisen K, Wolf I, Freedberg K, editors. Fitzpatrick's dermatology in general medicine. New York: McGraw-Hill; 1983. p.28-39.
- 48. Saurat JH. Cutaneous manifestations of graft-versus-host disease. Int J Dermatol. 1981; 20:249-56.
Datas de Publicação
-
Publicação nesta coleção
25 Nov 2005 -
Data do Fascículo
Fev 2005
Histórico
-
Recebido
23 Jan 2003 -
Aceito
25 Set 2003