Resumos
FUNDAMENTOS - Tacrolimo pomada é eficaz no tratamento da dermatite atópica. OBJETIVOS - Avaliar a eficácia e segurança do tacrolimo pomada 0,03% (Protopic®) no tratamento de pacientes pediátricos com dermatite atópica. MÉTODOS - Estudo multicêntrico, aberto e não comparativo. Incluídos 174 pacientes (dois a 10 anos)com dermatite atópica. Utilizou-se tacrolimo duas vezes ao dia, por seis semanas. O critério primário de eficácia foi a melhora clínica > a 90% avaliada pelo médico (Escala de Avaliação Global da Resposta Clínica). Outros critérios de eficácia foram a redução no índice de área e gravidade do eczema (EASI), a redução do percentual de superfície corporal afetada (%BSA) e a avaliação do prurido pelo paciente (escala analógica visual). Segurança foi avaliada pela ocorrência de eventos adversos relatados pelos pais e pacientes ou pelos investigadores. RESULTADOS - Trinta e três por cento dos pacientes apresentaram melhora clínica >90%. Quando avaliado o escore EASI, houve redução de 45,5% (primeira semana) e 61,8% (sexta semana) quando comparado com o basal (p<0,001). Em relação a %BSA, houve redução de 30,4% e 55,5%, na primeira e na sexta semana. Houve redução do prurido em relação ao basal (p<0,001).Os eventos adversos mais comuns foram - queimação e prurido localizados. CONCLUSÃO - Tacrolimo pomada 0,03% é terapia segura e efetiva no tratamento da dermatite atópica leve a grave em pacientes pediátricos.
Criança; Dermatite; Dermatite atópica; Eczema; Tacrolimo
BACKGROUND: Tacrolimus ointment has been shown to be effective in treatment of atopic dermatitis. OBJECTIVES: To evaluate the efficacy and safety of 0.03% tacrolimus ointment (Protopic®) in pediatric patients with mild, moderate and severe atopic dermatitis. METHODS: Open, non-comparative, multicentric study carried out in Brazil. 174 patients (ages from two to 10) with mild to severe atopic dermatitis were included. Patients were instructed to apply Protopic® twice a day for six weeks. Primary efficacy criterion was clinical improvement > 90% assessed by the physician (Clinical Response Global Evaluation Scale). Other efficacy criteria included reduction of the Eczema Area Severity Index (EASI), decrease of the affected body surface area (%BSA) and evaluation of the itching by the patients or their guardians (visual analogical scale). Safety was evaluated by adverse events reported by patients and/or guardians or by investigators. RESULTS: Thirty-three percent of patients showed clinical improvement > 90%. 45.5% of patients (1st week) decreased EASI and 61.8% (6th week) (p<0,001). %BSA decreased 30.4% and 55.5% in the first and sixth week. Improvement was also significant when measured by itching (p<0,001). Most frequentadverse effects were: burning and itching. CONCLUSION: 0.03% tacrolimus ointment is a safe and effective therapy for mild to severe atopic dermatitis in pediatric patients.
Child; Dermatitis; Dermatitis, atopic; Eczema; Tacrolimus
INVESTIGAÇÃO CLÍNICA, EPIDEMIOLÓGICA, LABORATORIAL E TERAPÊUTICA
Avaliação da eficácia e segurança do tacrolimo pomada 0,03% no tratamento da dermatite atópica em pacientes pediátricos * * Trabalho realizado no Hospital das Clínicas da Universidade Federal de Minas Gerais (UFMG) Belo Horizonte (MG); Santa Casa de Misericórdia de São Paulo São Paulo (SP); Hospital do Servidor Público Estadual de São Paulo São Paulo (SP); Complexo Hospitalar de Guarulhos Guarulhos (SP); Ambulatório de Dermatologia do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo São Paulo (SP); Ambulatório de Dermatologia Pediátrica da Universidade Federal de São Paulo (Unifesp) São Paulo (SP); Hospital Clínicas de Porto Alegre Porto Alegre (RS), Brasil. Conflito de interesse / Conflict of interest: Cintia Sayuri Kurokawa La Scala, gerente médica, Divisão Dermatologia e Pediatria, Produtos Roche Químicos e Farmacêuticos S.A. Responsável pela compilação dos resultados encontrados em cada centro. Suporte financeiro / Financial funding: Produtos Roche Químicos e Farmacêuticos S.A.
Evaluate of the efficacy and safety of tacrolimus ointment 0,03% to treat atopic dermatitis in pediatric patients * * Trabalho realizado no Hospital das Clínicas da Universidade Federal de Minas Gerais (UFMG) Belo Horizonte (MG); Santa Casa de Misericórdia de São Paulo São Paulo (SP); Hospital do Servidor Público Estadual de São Paulo São Paulo (SP); Complexo Hospitalar de Guarulhos Guarulhos (SP); Ambulatório de Dermatologia do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo São Paulo (SP); Ambulatório de Dermatologia Pediátrica da Universidade Federal de São Paulo (Unifesp) São Paulo (SP); Hospital Clínicas de Porto Alegre Porto Alegre (RS), Brasil. Conflito de interesse / Conflict of interest: Cintia Sayuri Kurokawa La Scala, gerente médica, Divisão Dermatologia e Pediatria, Produtos Roche Químicos e Farmacêuticos S.A. Responsável pela compilação dos resultados encontrados em cada centro. Suporte financeiro / Financial funding: Produtos Roche Químicos e Farmacêuticos S.A.
Bernardo GontijoI; Ida A. Gomes DuarteII; José Alexandre de Souza SittartIII; Mario Cezar PiresIV; Roberto TakaokaV; Silmara da Costa P. CestariVI; Tania Ferreira CestariVII; Wilson Tartuce AunVIII; Zilda Najjar P. de OliveiraIX; Cintia S. Kurokawa La ScalaX
I Professor-associado de dermatologia da Faculdade de Medicina da Universidade Federal de Minas Gerais (UFMG). Coordenador do Setor de Dermatologia Pediátrica do Hospital das Clínicas da Universidade Federal de Minas Gerais (UFMG) Belo Horizonte (MG), Brasil.
II Professora adjunta da Faculdade de Medicina de Ciências Médicas da Santa Casa de Misericórdia de São Paulo. Responsável pelo setor de Alergia e Fototerapia da Clínica de Dermatologia da Santa Casa de São Paulo São Paulo (SP), Brasil.
III Diretor do Serviço de Dermatologia do Hospital do Servidor Público Estadual de São Paulo. Mestre e doutor em clínica médica São Paulo (SP), Brasil.
IV Diretor do Serviço de Dermatologia do Complexo Hospitalar de Guarulhos, mestre e doutor pelo Hospital do Servidor Público Estadual de São Paulo São Paulo (SP), Brasil.
V Presidente da Associação de Apoio à Dermatite Atópica. Reserch Fellow Oregon Health Science University. Coordenador do Ambulatório de Dermatite Atópica do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (USP) São Paulo (SP), Brasil.
VI Professora adjunta doutora do Departamento de Dermatologia da Universidade Federal de São Paulo (Unifesp/EPM). Coordenadora responsável do Ambulatório de Dermatologia Pediátrica, Departamento de Dermatologia São Paulo (SP), Brasil.
VII Professora-associada de dermatologia da Universidade Federal do Rio Grande do Sul Hospital Clínicas de Porto Alegre. Professora orientadora do curso de pós-graduação em Pediatria (UFRS) Porto Alegre (RS), Brasil.
VIII Médico chefe da Seção de Imunologia do Serviço de Alergia e Imunologia do Hospital do Servidor Público Estadual "FMO" Iamspe. Diretor secretário da Associação Brasileira de Alergia e Imunopatologia Asbai. Presidente vitalício da Associação Brasileira de Alergia e Imunopatologia (Asbai) São Paulo (SP), Brasil.
IX Professora doutora em dermatologia da Faculdade de Medicina da Universidade de São Paulo (FMUSP). Diretora da Divisão de Dermatologia do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo. Chefe do Ambulatório de Dermatologia Infantil do Departamento de Dermatologia do Hospital das Clínicas São Paulo (SP), Brasil.
X Médica especialista em pediatria, alergologia e imunologia clínica. Mestre em ciências pela Universidade Federal de São Paulo (Unifesp/EPM), gerente médica da Divisão de Dermatologia e Pediatria, Produtos Roche Químicos e Farmacêuticos S.A. São Paulo (SP), Brasil
Endereço para correspondência/ Mailing Address Endereço para correspondência / Mailing Address: Cíntia S. Kurokawa La Scala Gerente Médica Dermatologia e Pediatria Produtos Roche Químicos e Farmacêuticos S.A. Av. Engenheiro Billings, 1729 - Jaguaré 05321 900 - São Paulo-SP. Tel./Fax: 55 (11) 3719-7768 55 11 3719-9394 E-mail: cintia.scala@roche.com
RESUMO
FUNDAMENTOS Tacrolimo pomada é eficaz no tratamento da dermatite atópica.
OBJETIVOS Avaliar a eficácia e segurança do tacrolimo pomada 0,03% (Protopic®) no tratamento de pacientes pediátricos com dermatite atópica.
MÉTODOS Estudo multicêntrico, aberto e não comparativo. Incluídos 174 pacientes (dois a 10 anos)com dermatite atópica. Utilizou-se tacrolimo duas vezes ao dia, por seis semanas. O critério primário de eficácia foi a melhora clínica > a 90% avaliada pelo médico (Escala de Avaliação Global da Resposta Clínica). Outros critérios de eficácia foram a redução no índice de área e gravidade do eczema (EASI), a redução do percentual de superfície corporal afetada (%BSA) e a avaliação do prurido pelo paciente (escala analógica visual). Segurança foi avaliada pela ocorrência de eventos adversos relatados pelos pais e pacientes ou pelos investigadores.
RESULTADOS Trinta e três por cento dos pacientes apresentaram melhora clínica >90%. Quando avaliado o escore EASI, houve redução de 45,5% (primeira semana) e 61,8% (sexta semana) quando comparado com o basal (p<0,001). Em relação a %BSA, houve redução de 30,4% e 55,5%, na primeira e na sexta semana. Houve redução do prurido em relação ao basal (p<0,001).Os eventos adversos mais comuns foram queimação e prurido localizados.
CONCLUSÃO Tacrolimo pomada 0,03% é terapia segura e efetiva no tratamento da dermatite atópica leve a grave em pacientes pediátricos.
Palavras-chave:Criança; Dermatite; Dermatite atópica; Eczema; Tacrolimo
ABSTRACT
BACKGROUND: Tacrolimus ointment has been shown to be effective in treatment of atopic dermatitis.
OBJECTIVES: To evaluate the efficacy and safety of 0.03% tacrolimus ointment (Protopic®) in pediatric patients with mild, moderate and severe atopic dermatitis.
METHODS: Open, non-comparative, multicentric study carried out in Brazil. 174 patients (ages from two to 10) with mild to severe atopic dermatitis were included. Patients were instructed to apply Protopic® twice a day for six weeks. Primary efficacy criterion was clinical improvement > 90% assessed by the physician (Clinical Response Global Evaluation Scale). Other efficacy criteria included reduction of the Eczema Area Severity Index (EASI), decrease of the affected body surface area (%BSA) and evaluation of the itching by the patients or their guardians (visual analogical scale). Safety was evaluated by adverse events reported by patients and/or guardians or by investigators.
RESULTS: Thirty-three percent of patients showed clinical improvement > 90%. 45.5% of patients (1st week) decreased EASI and 61.8% (6th week) (p<0,001). %BSA decreased 30.4% and 55.5% in the first and sixth week. Improvement was also significant when measured by itching (p<0,001). Most frequentadverse effects were: burning and itching.
CONCLUSION: 0.03% tacrolimus ointment is a safe and effective therapy for mild to severe atopic dermatitis in pediatric patients.
Keywords:Child; Dermatitis; Dermatitis, atopic; Eczema; Tacrolimus
INTRODUÇÃO
A dermatite atópica (DA) é doença inflamatória cutânea crônica, com períodos de remissão e exacerbação. O prurido representa sintoma cardinal dessa condição. Acomete predominantemente a faixa etária pediátrica, com 60% dos casos iniciando no primeiro ano de vida e 85% nos primeiros cinco anos.1,2 A prevalência da DA tem aumentado nos últimos anos, e atualmente é estimado o acometimento de até 20% da população mundial.1 Solé et al. demonstraram que a prevalência de eczema atópico e sintomas relacionados é variável no Brasil, com índices mais elevados nas regiões Norte e Nordeste, embora as variantes graves da doença sejam mais freqüentes na Região Sul. A prevalência do eczema flexural no Brasil varia de 5,3% a 13% em crianças e é menor em adolescentes (3,4-7,9%).3
A doença tem etiologia complexa com ativação de mecanismos imunológicos e inflamatórios. O fenótipo clínico característico é resultado de suscetibilidade genética, fatores individuais, defeitos na barreira cutânea e resposta imunológica local e sistêmica.4 A disfunção na ativação das células T com produção de citocinas representa papel central na patogênese da doença.5
A DA pode afetar significativamente a qualidade de vida das crianças por comprometer as interações sociais e familiares, rebaixar a auto-estima, elevar o absenteísmo escolar e causar distúrbios do sono.6
O controle da doença requer abordagem ampla, com medidas ambientais, comportamentais e farmacológicas. A abordagem ao paciente inclui identificação e restrição de alérgenos específicos, educação dos pais e pacientes, hidratação cutânea e manutenção da função da barreira cutânea. 5 Os corticosteróides representam a base do tratamento farmacológico, sendo efetivos e bem tolerados no uso em curto prazo. Os efeitos adversos limitam o uso prolongado dessas medicações, e os esteróides potentes são contra- indicados para uso na face e áreas intertriginosas. Os efeitos adversos locais são relativamente freqüentes e incluem atrofia cutânea, hipopigmentação, estrias, infecções secundárias e foliculite. O uso em áreas corporais extensas ou sob oclusão pode resultar em significativa absorção sistêmica. As crianças são particularmente suscetíveis aos eventos adversos sistêmicos, como supressão do eixo hipotálamo-hipófiseadrenal, doença de Cushing e osteonecrose da cabeça do fêmur, devido à razão entre a superfície de aplicação do corticóide e massa corporal.6,7
O tacrolimo pomada foi lançado no Japão em 1999, nos Estados Unidos em 2000, no Brasil em 2005, e pertence a uma nova classe de drogas não esteroidais, os inibidores tópicos da calcineurina.8 O tacrolimo age primariamente na célula T da pele afetada, prevenindo sua ativação e suprimindo a liberação de citocinas inflamatórias. A molécula de tacrolimo, ao penetrar o citoplasma dos linfócitos, liga-se à proteína intracelular FKBP-12. A molécula FKBP-12 forma, na seqüência, um complexo com cálcio, calmodulina e calcineurina, inibindo a atividade da fosfatase da calcineurina. Isso impede a desfosforilação e a translocação do fator nuclear do linfócito T ativado (NF-AT) citoplasmático, impedindo a união com sua subunidade nuclear. Na ausência desse passo, os linfócitos T não podem sintetizar e secretar citocinas.
Esse bloqueio na síntese de citocinas quebra a cadeia de eventos que resulta nos sinais e sintomas da DA. Assim, o tacrolimo tópico mostra-se efetivo e bem tolerado no tratamento da dermatite atópica leve, moderada e grave de adultos e crianças.5
Este estudo foi desenhado para avaliar a eficácia e segurança do tacrolimo pomada 0,03% em pacientes pediátricos brasileiros com dermatite atópica leve, moderada e grave.
PACIENTES E MÉTODOS
Desenho do estudo
Estudo multicêntrico, aberto, não comparativo, concorrente, conduzido em nove centros no Brasil, de janeiro de 2005 a março de 2006. Em cada centro havia um investigador principal, dermatologista, e dois subinvestigadores, também dermatologistas, cujo nomes estão descritos ao final deste trabalho. Os pacientes foram avaliados no momento de inclusão no estudo (semana 0), nas semanas 1, 3 e 6 do tratamento e na semana 8 (duas semanas após a interrupção da medicação). O protocolo foi aprovado pelos comitês de ética dos respectivos centros e pela Anvisa (Agência Nacional de Vigilância Sanitária). Os pais ou responsáveis pelos pacientes concordaram e assinaram o termo de consentimento antes da inclusão no estudo.
Seleção dos pacientes
Foram incluídos neste estudo pacientes com idade entre dois e 10 anos, com diagnóstico de dermatite atópica leve, moderada ou grave (critérios de Hanifin e Rajka),9 independente da gravidade da doença. Os pacientes foram selecionados de acordo com as restrições em relação ao uso de medicações antes e durante o estudo. Foram consideradas restrições de pré-estudo e tratamento concomitantes de acordo com os critérios a seguir. Os pacientes que seriam incluídos no estudo clínico não poderiam ter utilizado drogas experimentais nos últimos seis meses antes do início do protocolo clínico. Imunossupresores sistêmicos (como, por exemplo, ciclosporina ou metotrexate), tratamentos com fototerapia (UVA, UVB, Puva e laser) e corticosteróides sistêmicos não poderiam ter sido utilizados por no mínimo quatro meses antes do início do estudo, e todos foram proibidos durante todo o protocolo. Dos corticosteróides intranasais e/ou inalados e antagonistas de leucotrienos (por exemplo, o montelucaste), a dose utilizada, pelo paciente deveria estar estável por no mínimo duas semanas antes do início do estudo e foi permitida sua utilização, em dose igual, no decorrer do protocolo. Os anti-histamínicos, os corticosteróide tópicos e outras medicações tópicas poderiam ter sido utilizados até sete dias antes do início do estudo e foram proibidos durante o estudo. Agentes tópicos não medicamentosos também foram proibidos durante o estudo, mas poderiam ter sido utilizados até um dia antes. Outro imunomodulador tópico, como o pimecrolimo, foi proibido durante o estudo e poderia ter sido utilizado até 14 dias antes do início do protocolo. Os anti-histamínicos orais, em doses estáveis foram permitidos antes e durante o estudo.
Foram excluídos do estudo os pacientes com qualquer outra afecção cutânea nas áreas afetadas pela DA, com conhecida hipersensibilidade a macrolídeos ou algum componente da fórmula, com diagnóstico ou história prévia de câncer, portadores do vírus da imunodeficiência humana adquirida (HIV), condições clínicas significativas não controladas, síndrome de Netherton e aqueles com DA infectada.
Escala de avaliação global da resposta clínica, pelo médico
Foi considerado clareamento quando houve melhora clínica de 100%; melhora excelente de 90- 99%; melhora acentuda de 75-89%; melhora moderada de 50-74%; melhora discreta de 30-49%; ausência de melhora de 0-29% e piora quando a porcentagem de melhora foi abaixo de 0%.
Cidades brasileiras envolvidas no estudo
Foram incluídos no estudo pacientes que faziam acompanhamento regular nos centros previamente escolhidos em São Paulo, Guarulhos, Porto Alegre e Belo Horizonte.
Em São Paulo, participaram do estudo os pacientes acompanhados no Hospital das Clínicas da Faculdade de Medicina de São Paulo, Ambulatório de Dermatologia Pediátrica da Unifesp e Hospital do Servidor Público Estadual. Em Guarulhos, os pacientes do Complexo Hospitalar de Guarulhos. Em Belo Horizonte, pacientes do Hospital das Clínicas da UFMG e, em Porto Alegre, o Hospital Clínicas.
Plano de tratamento
Os pacientes aplicaram uma fina camada de tacrolimo pomada 0,03%, duas vezes ao dia, com intervalos de aproximadamente 10-14 horas, sobre as áreas afetadas pela DA, durante seis semanas. Utilizaram emoliente diariamente (Toleriane Corps®, La Roche Posay) nas áreas do corpo não submetidas ao tratamento e, para o banho, o sabonete Lipikar surgras ® (La Roche Posay). O uso de protetores solares foi liberado em todas as áreas corporais.
Análise da eficácia
A eficácia foi avaliada com base na Escala de Avaliação Global da Resposta Clínica pelo médico, ao final do tratamento, na semana 6. O sucesso foi definido como clareamento (melhora de 100%) ou melhora excelente (igual ou superior a 90%).
Os outros parâmetros utilizados foram a redução do índice de área e gravidade do eczema (EASI), a redução do percentual da área de superfície corporal afetada (%BSA) e a alteração na escala de avaliação do prurido pelo paciente (escala analógica visual).10 Todos os parâmetros foram avaliados nas semanas 1, 3 e 6 do tratamento e na semana 8 (duas semanas após o tratamento).
O EASI é calculado considerando-se a gravidade dos sinais da DA (eritema, induração/papulação/ edema, escoriação, liquenificação) e a extensão de área corporal afetada nas quatro regiões do corpo (cabeça e pescoço, tronco, membros superiores e inferiores). O valor do escore pode variar de 0 a 72.
O paciente ou seus pais (para crianças menores de sete anos) avaliaram o prurido em escala analógica visual de 10cm (0 = "coceira insuportável", 10 = "nenhuma coceira").
A segurança do tratamento foi avaliada pela ocorrência de todos os eventos adversos relatados pelos pais e pacientes ou observados pelo investigador, considerando-se a relação de causalidade com o tacrolimo.
Métodos estatísticos
Cálculo do tamanho da amostra
Para o cálculo do tamanho da amostra partiu-se do pressuposto de que a taxa de sucesso do tratamento com tacrolimo pomada 0,03% na população pediátrica era de 37,8%. Tomando-se o tamanho de amostra de 155 pacientes, a taxa de sucesso estimada se afasta da taxa de sucesso populacional em 7,5%, isto é, a taxa de sucesso estimada varia de 30,3% a 45,3%.Considerando-se possível desistência de 10%, o tamanho da amostra foi definido em 174 pacientes. Nesse caso, a taxa de sucesso estimada se afastaria da taxa de sucesso populacional em 7,2%, isto é, a taxa de sucesso estimada deve variar de 30,6% a 45,0%.
Análise estatística
Todos os pacientes que fizeram uso da medicação do estudo e tiveram pelo menos uma avaliação de eficácia ou de segurança após a inclusão no estudo e primeira consulta (período basal) fizeram parte da população denominada intenção de tratamento (ITT).
As análises das variáveis de eficácia e segurança foram realizadas na população ITT, as variáveis foram tabuladas, e a avaliação estatística calculada de acordo com as semanas de tratamento.
Foi utilizada análise de variância para medidas repetidas para avaliação do escore EASI, %BSA e escala analógica de prurido no decorrer das semanas de tratamento.
Patrocínio
Estudo patrocinado pelo laboratório Produtos Roche Químicos e Farmacêuticos S.A., Brasil.
RESULTADOS
Características dos pacientes
Foram triados 174 pacientes, mas quatro foram excluídos por não fazer uso da medicação de estudo (n=3) ou por violação do critério de inclusão (n=1). A amostra ITT foi formada por 170 pacientes na avaliação de segurança e por 169 na avaliação de eficácia. Essa diferença deve-se ao fato de um paciente ter apresentado evento adverso (asma) no quinto dia de aplicação da medicação, interrompendo o tratamento três dias após o início do evento e sem nenhuma avaliação de eficácia posterior à primeira avaliação.
Os pacientes que completaram o estudo de acordo com as regras do protocolo ou que foram retirados do estudo prematuramente por ocorrência de eventos adversos, fizeram parte da população do protocolo (PP), amostra utilizada para avaliação de eficácia (n=143). Vinte e seis pacientes foram retirados do estudo, por violação do protocolo.
As violações ao protocolo identificadas no decorrer do estudo foram uso inadequado do medicamento (período superior a seis semanas) em 11 casos (6,5%), aumento de dose ou introdução de anti-histamínicos em oito (4,7%), e uso de medicações não permitidas (corticosteróides tópicos ou antibióticos) em sete (4,1%).
Para avaliação de segurança da medicação em estudo foram incluídos os pacientes que terminaram o tratamento por completo, total de 138 (81,2%), sendo que 32 (18,8%) tiveram a medicação do estudo interrompida prematuramente (incluído aquele que parou a medicação por crise de asma).
Quanto às razões para interrupção prematura da medicação de estudo, em seis pacientes (3,5%) a interrupção foi devida a evento adverso ou doença intercorrente (dois pacientes apresentaram crise de asma, um broncopneumonia, um piodermite grave e dois prurido intenso) e, em 26 (15,3%), decorrente de violações ao protocolo.
Os pacientes foram incluídos de forma concorrente entre os centros. O centro número 1 (Universidade Federal de Minas Gerais Belo Horizonte) incluiu 20 pacientes (11,8%); o centro 2 (Dermatologia Iamspe São Paulo), 19 pacientes (11,2%); o centro número 3 (Santa Casa de Misericórdia), 22 pacientes (12,9%); o centro número 4 (Hospital Padre Bento Guarulhos), 20 pacientes (11,8%); o centro número 5 (Hospital das Clínicas São Paulo), 14 pacientes (8,2%); o centro número 6 (Hospital das Clínicas São Paulo), 15 pacientes (8,8%); o centro número 7 (Universidade Federal de São Paulo São Paulo) 16 pacientes (9,4%); o centro número 8 (Universidade Federal do Rio Grande do Sul Porto Alegre), 24 pacientes (14,1%); e o centro número 9 (Alergia Iamspe São Paulo), 20 pacientes (11,8%).
Características demográficas e da doença basal
A média de idade do grupo foi de 5,5 anos (variando de dois a 10 anos) com início da doença em 1,7 ano. Considerando a gravidade da doença, a distribuição não foi eqüitativa entre os grupos, e, na maioria dos pacientes (60%), a doença foi classificada como de gravidade moderada, 35,3% grave e 4,7% leve. A média do escore EASI foi 16, e a mediana, 11. A média de %BSA afetada foi 30%, e a mediana, 21%, no momento da inclusão no estudo (tabela 1).
História familiar de atopia (rinite, asma ou dermatite atópica) foi relatada em 83,5% dos pacientes.
Eficácia
Avaliação global da resposta clínica
A taxa de sucesso, definida como o percentual de pacientes com clareamento total ou melhora excelente (>90%) na semana 6, foi de 33% (n=56), marcada melhora (75-89%), na semana 6 foi de 22,3% (n=37), nenhuma melhora foi observada em 6% dos pacientes (n=10) e piora em 13,3% (n=22), na semana 6. Intervalo de confiança de 95% (IC95%) 26,1%- 40,5%. Quando analisada a amostra sem os pacientes que foram excluídos, por violação do protocolo (n=143), a taxa de sucesso (clareamento total ou melhora excelente - >90%) foi 35,7% (n=51), marcada melhora (75-89%) foi 23,9% (n=35), na semana 6 (IC 95%) 28,3%-43,8%. Considerando-se a melhora moderada (>50%), 76,3% alcançaram esse patamar. Nenhuma melhora foi observada em 5,6% dos pacientes (n=8) e piora em 9,9% (n=14), na semana 6.
Escore EASI
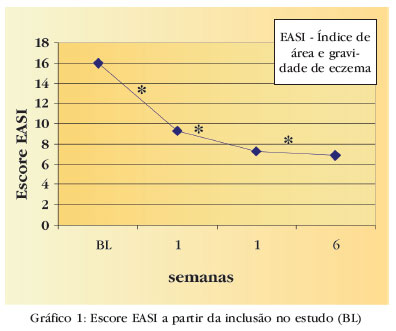
Na avaliação do escore EASI houve variação estatisticamente significante entre as médias nas semanas 0, 1, 3 e 6 (p<0,001). Comparando-se as médias do escore de cada semana em relação ao basal, foi encontrada redução estatisticamente significante em todas elas (p<0,001). Na semana 1 houve redução média de 45,5% no escore EASI (média escore EASI de 9,3) em relação ao basal, e na semana 6 a redução foi de 61,8% (média escore EASI de 6,9). (Gráfico 1). Quando analisada a amostra PP (n=143), houve também variação estatisticamente significante entre as médias nas semanas 0, 1, 3 e 6 (p<0,001). Comparando-se as médias do escore de cada semana em relação ao basal (média escore EASI de 15,2), foi encontrada redução estatisticamente significante em todas elas (p<0,001 em todas as comparações). Na semana 1 houve redução média de 47,4% no escore EASI (média escore EASI de 8,3) em relação ao basal e, na semana 6, redução de 63,2% (média escore EASI de 6,1).
Área de superfície corporal acometida (%BSA)
Na avaliação da redução da %BSA afetada foi encontrada variação estatisticamente significante entre as médias nas semanas 0, 1, 3 e 6 (p<0,001).
Comparando-se as médias do escore de cada semana em relação à avaliação basal, foi encontrada redução estatisticamente significante em todas elas (p<0,001 em todas as comparações). Na semana 1 houve redução média de 30,4% (média BSA 30,3) na %BSA afetada em relação ao basal e, na semana 6, a redução média foi de 55,5% (média BSA 13,9) (Gráfico 2). Quando se analisa a amostra, PP (n=143), houve também variação estatisticamente significante entre as médias nas semanas 0, 1, 3 e 6 (p<0,001). Comparando-se as médias do escore de cada semana em relação ao basal, foi encontrada redução estatisticamente significante em todas elas (p<0,001 em todas as comparações). Na semana 1 houve redução média de 29,8% no escore total BSA (média BSA 28,3) em relação ao basal, e, na semana 6, houve redução média de 56,5% no escore total BSA (média de BSA 12,2) em relação ao basal.
Quando o subgrupo com DA leve foi avaliado, a redução média de %BSA em relação ao basal foi de 54,2% na semana 1 e de 77,8% na semana 6 (dados não apresentados). Não foi realizada avaliação em separado em pacientes com DA moderada e grave.
Avaliação do prurido pelo paciente
Na avaliação do prurido pela escala analógica, foi encontrada variação estatisticamente significante entre as médias nas semanas 0, 1, 3 e 6 (p<0,001). Comparando-se as médias da pontuação de cada semana em relação ao basal (média da escala visual analógica na semana 0 - 3,4; na semana 1- 5,6; na semana 3 6; e na semana 6 - 6,1). Foi encontrado aumento da pontuação estatisticamente significante em todas elas (p<0,001), indicando redução do prurido (Gráfico 3). O mesmo ocorreu quando avaliada a população PP, foi encontrada variação estatisticamente significante entre as médias nas semanas 0, 1, 3 e 6 (p< 0,001). Valores médios da escala analógica visual de 3,5; 5,7; 6 e 6,3 nas semanas 0, 1, 3 e 6, respectivamente.
Parâmetros de eficácia na semana 8
Na visita de acompanhamento 2 semanas após a suspensão do tratamento, observou-se que 18,4% dos pacientes (n=29) permaneceram em remissão ou com melhora excelente (>90%). Marcada melhora, 14,6% (n=23); nenhuma melhora 13,9% (n=22); e piora 47,5% (n=75). A média no escore EASI foi de 7,6 na população ITT e 6,7 na PP. Na avaliação do prurido pelo paciente (escala analógica visual), a média foi de 5,4 (tabela 2). A área de superfície corpórea acometida (BSA) variou de 12,7, ao final do tratamento, para 15,5 duas semanas após a suspensão do tratamento, na população ITT. Na amostra PP, de 11,1 na semana 6 para 14,1 na semana 8.
Os dados obtidos na semana 8 não são apresentados nos gráficos, pois nessa fase nem todos os pacientes retornaram para reavaliação, pois já não faziam uso da medicação de estudo. Os dados foram analisados de forma separada, com medicação (semana 6) e sem medicação (semana 8), como pode ser visualizado na tabela 2.
Segurança
A incidência global de eventos adversos (com ou sem nexo de causalidade estabelecido) foi de 45,3% na semana 1 e 38% na semana 6.
Em relação aos eventos adversos classificados como tendo relação de causalidade, as alterações cutâneas representaram 45,5%. O evento adverso cutâneo mais freqüente foi a "queimação" (17% dos pacientes). A incidência desse evento apresenta redução estatisticamente significativa na semana 6 em relação à semana 1 (Gráfico 4). A sensação de queimação foi referida pelo paciente, relacionada após a aplicação da medicação, nos locais com lesão cutânea. O prurido foi relatado em 9,4% dos pacientes, piodermites em 6,5% e febre em 4,7%. Eritema em 1,8% dos pacientes e tonsilite em 1,8%.
As infecções virais, como herpes simples, herpes- zóster e molusco contagioso, foram referidas num pequeno número de pacientes, 1,8%, 0,6% e 1,8%, respectivamente. Os pacientes com herpes simples (n=3) foram tratados um com aciclovir tópico, outro com aciclovir oral, e outro com ácido fusídico, não sendo interrompido o tratamento. O paciente com herpes-zóster evoluiu com resolução espontânea, sem necessidade de tratamento específico.
Foram observados cinco eventos adversos sérios (2,9%), dos quais quatro resultaram em interrupção do tratamento: asma (dois casos), broncopneumonia (um caso) e piodermite grave (um caso).
DISCUSSÃO
O tacrolimo pomada 0,03% mostrou-se seguro e efetivo para o tratamento da DA leve, moderada e grave em crianças brasileiras de dois a 10 anos de idade. Houve melhora clínica significativa e rápida (observada na primeira semana de tratamento) com redução dos sinais e sintomas da doença, bem como na extensão da superfície corporal afetada.
Houve perda de 18,8% de pacientes, percentual superior ao previamente estimado, de 10%, e que poderia comprometer a avaliação de eficácia. No entanto, somente 14 pacientes (8,1%) foram excluídos do protocolo por utilizar corticosteróides, o que poderia ser devido à piora clínica das lesões, ou seja, não eficácia do tacrolimo. Essa perda tem impacto na avaliação de eficácia, mas que não invalida a conclusão final do estudo.
Em relação às populações estudadas, foram avaliadas a ITT e a PP. A populção ITT compreende todos os pacientes que fizeram uso da medicação do estudo e que tiveram pelo menos uma avaliação de eficácia ou de segurança após o período basal. A avaliação de segurança é melhor avaliada quando se utiliza essa população. Já na avaliação de eficácia, os dados são mais fidedignos quando se analisa a população PP, que de fato seguiu o protocolo, sem violação, sendo retirados prococemente do estudo aqueles que apresentaram eventos adversos.
O critério de eficácia primário utilizado neste estudo foi bastante restritivo (melhora clínica >90%, na avaliação global realizada pelo médico) e, mesmo assim, foi alcançado por 33% dos pacientes ao final do tratamento, atingindo, portanto, a taxa de sucesso estimada para o estudo. Quando se considerou melhora moderada (>50%), o índice foi observado em 71,7% dos pacientes. Apesar de ter sido estimada desistência de 10% dos pacientes, houve 18,8% de pacientes excluídos, fato que, entretanto, não afetou a análise de eficácia, que foi alcançada em 35,7% quando analisada melhora clínica >90%, nessa amostra de pacientes, e 76,3% quando se considerou melhora moderada > 50%).
A redução do escore EASI, redução da %BSA e avaliação da escala de prurido pelo paciente (critérios secundários de eficácia), demonstraram resultados significativos ao final do tratamento. A melhora foi rápida e aparente na primeira semana de tratamento. O EASI também avalia a eficácia e, quando analisada a população efetivamente tratada, que seguiu o protocolo (população PP), houve redução de 63,2% nesse escore, quando comparado com o basal. O mesmo ocorreu com o BSA, com redução de 56,5% do basal.
Considerando-se a gravidade da doença, a maioria dos pacientes (95,3%) apresentava DA moderada e grave, consistente com o perfil de pacientes que são atendidos nos centros de referência em que o estudo foi realizado.
Schachner et al. avaliaram 317 pacientes pediátricos com DA leve e moderada, tratados com tacrolimo pomada 0,03% durante seis semanas. Ao final do tratamento, 50,6% dos pacientes obtiveram melhora clínica >90% pela avaliação global da resposta clínica, redução de 54,8% do escore EASI e de 50,5% no percentual de BSA afetada.11 Esses resultados foram superiores aos observados neste estudo, no qual predominaram pacientes com DA moderada e grave, e a outros publicados na literatura que, como este, avaliaram a eficácia do tacrolimo pomada 0,03% nas variantes mais graves da doença.11, 12
Esses dados indicam que a resposta clínica ao tacrolimo pode ser inversamente proporcional à gravidade da doença, sendo a medicação ainda mais efetiva nos quadros de DA leve e moderada. Uma análise multivariada poderia ser utilizada para esclarecer quais das co-variáveis estariam envolvidas no resultado final; para isso, uma análise estatística detalhada será realizada visando medir o real impacto de cada variável na resposta clínica de cada paciente.
A incidência de infecções cutâneas (bacterianas e virais) observada foi inferior às reportadas em pacientes portadores de DA, e comparável às referidas em outros estudos clínicos de curto e longo prazo com tacrolimo pomada.13-15 Teoricamente, um agente imunomodulador tópico como o tacrolimo pode aumentar o risco de infecções cutâneas, devido a sua ação na resposta imune local, o que não foi evidenciado neste estudo ou em outros publicados na literatura.15,16 Provável explicação é que o controle da doença, promovido pelo tacrolimo, resulta em recuperação da barreira cutânea com redução do risco de infecção local. Rystedt I et al. sugerem associação freqüente entre DA e aumento de infecções respiratórias, não só atribuída à alergia respiratória, que costuma ocorrer na DA, mas refletindo anormalidade imunológica nesses pacientes. Neste estudo com tacrolimo não se encontrou aumento da incidência de infecção respiratória.13-15
Pournaras et al. avaliaram 11 pacientes com DA, tratados com tacrolimo pomada 0,1%, considerando parâmetros de eficácia o escore lesional (índice SCORAD), a perda transepidérmica de água (TEWL) e a densidade de colonização das lesões por Staphylococcus aureus. Durante o tratamento, SCORAD e TEWL mostraram redução significativa no terceiro dia de tratamento, enquanto a redução na colonização pelo S. aureus mostrou- se significativa no sétimo dia. Os autores concluíram que a redução na colonização pelo S. aureus é conseqüência da melhora na superfície cutânea pela ação antiinflamatória da droga e, possivelmente, pelas propriedades emolientes do veículo.17
O veículo pomada tem ação emoliente intrínseca e, embora alguns pacientes prefiram a textura em creme, a maioria dos dermatologistas recomenda pomada para pacientes com DA, pois auxilia na hidratação por redução da TEWL, principalmente nas lesões crônicas. Adicionalmente, os excipientes dos cremes podem irritar a pele sensível do paciente atópico. 11
Neste estudo, os pacientes foram orientados a utilizar também um emoliente (Toleriane®, La Roche Posay) após o banho, uma vez que essa abordagem não farmacológica é considerada de primeira linha no manejo da DA e deve ser adjuvante aos tratamentos tópicos antiinflamatórios, desde que aplicado com intervalo de uma hora entre eles.
Os eventos adversos cutâneos mais freqüentes foram queimação (17%) e prurido (9,4%). Houve redução significativa da ardência após uma semana de tratamento, provavelmente pela melhora das lesões cutâneas. Em revisão realizada por Rustin, a sensação de queimação e prurido foi de intensidade leve a moderada, transitória, com duração de 15 a 20 minutos e ocorreu nos primeiros dias de tratamento. A melhora da sensação é referida quando há melhora das lesões cutâneas. Em estudos clínicos, a incidência de eventos adversos no local de aplicação parece estar relacionada à gravidade da doença, ou seja, pacientes com doença mais grave, quando comparados com doença leve, relatam mais esses eventos adversos.16
Foram relatados cinco eventos adversos sérios, mas apenas em um paciente foi relacionado ao uso de tacrolimo (abscesso periocular).
CONCLUSÃO
Neste estudo brasileiro, demonstrou-se que o tacrolimo pomada 0,03% tem rápido início de ação e representa terapia tópica não esteroidal, segura e efetiva para o tratamento da dermatite atópica leve, moderada e grave em pacientes pediátricos.
Estudos com população maior e análise multivariada poderiam contribuir com dados que auxiliariam a avaliação de pacientes com diferentes graus de gravidade da DA.
Recebido em 26.10.2007.
Aprovado pelo Conselho Consultivo e aceito para publicação em 29.09.2008.
Como citar este artigo: Gontijo B, Duarte IAG, Sittart JAS, Pires MC, Takaoka R, Cestari SCP, Cestari TF, Aun WT, Oliveira ZNP, La Scala CSK. Avaliação da eficácia e segurança do tacrolimo pomada 0,03% no tratamento da dermatite. An Bras Dermatol. 2008;83(6):511-9.
- 1. Leung DY, Soter NA. Cellular and immulologic mechanisms in atopic dermatitis. J Am Acad Dermatol. 2001;44 (1 Suppl):S1-12.
- 2. Hanifin JM. Atopic dermatitis in infants and children. Pediatr Clin North Am. 1991;38:763-9.
- 3. Solé D, Camelo-Nunes IC, Waldalsen GF, Mallozi MC, Naspitz CK, Brazilian ISAAC Group. Prevalence of atopic eczema and related symptoms in Brazilian schoolchildren: results from the International Study of Asthma and Allergies in Childhood (ISAAC) phase 3. J Investig Allergol Immunol. 2006;16:367-76.
- 4. Leung DY, Boguniewicz M, Howell MD, Nomura I, Hamid QA. New insights into atopic dermatitis. J Clin Invest. 2004;113:651-7.
- 5. Alomar A, Berth-Jones J, Bos JD, Giannetti A, Reitamo S, Ruzicka T, et al The role of topical calcineurin inhibitors in atopic dermatitis. Br J Dermatol.2004;151:3-27.
- 6. Paller A, Eichenfield LF, Leung DY, Stewart D, Appell M. A 12-week study of tacrolimus ointment for the treatment of atopic dermatitis in pediatric patients. J Am Acad Dermatol. 2001;44(1 Suppl):S47-57.
- 7. Fisher DA. Adverse effects of topical corticosteroid use. West J Med. 1995;162:123-6.
- 8. Hanifin JM, Rajka G. Diagnostic features of atopic dermatitis. Acta Dermatol Vener. 1980;92:44-7.
- 9. Schachner LA, Lamerson C, Sheehan MP, Boguniewicz M, Mosser J, Raimer S, et al Tacrolimus ointment 0.03% is safe and effective for the treatment of mild to moderate atopic dermatitis in pediatric patients: results from a randomized, double-blind, vehicle-controlled study. Pediatrics. 2005;116:334-42.
- 10. Charman C, Williams H. Outcome measures of disease severity in atopic eczema. Arch Dermatol. 2000;136:763-9.
- 11. Kapp A, Allen BR, Reitamo S. Atopic dermatitis management with tacrolimus ointment (Protopic) . J Dermatol Treat. 2003;14(Suppl 1):5-16.
- 12. Bonifazi E, Garofalo L, Pisani V, Meneghini CL. Role of some infectious agents in atopic dermatitis. Acta Derm Venereol Suppl (Stockh). 1985;114:98-100.
- 13. Rystedt I, Strannegard IL, Strannegard O. Recurrent viral infections in patients with past or present atopic dermatitis. Br J Dermatol. 1986;114:575-82.
- 14. Fleischer AB, Ling M, Eichenfield L, Satoi Y, Jaracz E, Rico J, Maher RM. Tacrolimus ointment for the treatment of atopic dermatitis is not associated with increase in cutaneous infections. J Am Acad Dermatol. 2002;47:562-70.
- 15. Pournaras CC, Lubbe J, Saurat JH. Staphylococcal colonization in atopic dermatitis treatment with topical tacrolimus (Fk506). J Invest Dermatol. 2001;116:480-1.
- 16. Rustin MH. The safety of tacrolimus ointment for the treatment of atopic dermatitis: a review. Br J Dermatol. 2007;157:861-73.
- 17. Grimalt R, Mengeaud V, Cambazard F, Study Investigators' Group. The steroid-sparing effect of an emollient therapy in infants with atopic dermatitis: a randomized controlled study. Dermatology. 2007;214:61-7.
Datas de Publicação
-
Publicação nesta coleção
05 Mar 2009 -
Data do Fascículo
Dez 2008
Histórico
-
Aceito
29 Set 2008 -
Recebido
26 Out 2007