Resumos
FUNDAMENTOS - A alta frequência das micoses cutâneas justifica a necessidade de avaliar a possível contribuição da determinação do perfil de susceptibilidade aos antifúngicos in vitro. OBJETIVO - Avaliar se existe variabilidade nos isolados fúngicos quanto à susceptibilidade in vitro de fungos filamentosos, previamente isolados de micoses cutâneas, frente aos antifúngicos fluconazol, cetoconazol, itraconazol e terbinafina. MÉTODOS - Os fungos foram isolados e identificados por meio da metodologia clássica e o teste de susceptibilidade aos antifúngicos foi realizado segundo o método de microdiluição em caldo, de acordo com protocolo preconizado pelo Clinical Laboratory Standards Institute (CLSI), documento M38-A. RESULTADOS - Das 80 amostras de fungos filamentosos identificadas, o gênero Trichophyton representou 81%. As quatro drogas analisadas apresentaram grande variação nos gêneros Trichophyton e Microsporum. O gênero Fusarium foi resistente a todas as drogas testadas. A terbinafina foi o antimicótico mais eficaz contra a maioria dos isolados fúngicos. CONCLUSÃO - Houve uma grande variabilidade nos perfis de resposta aos antifúngicos testados. O estabelecimento de um método-teste de referência permitirá ao clínico maior objetividade na escolha de uma terapia adequada.
Antimicóticos; Antimicóticos; Arthrodermataceae; Micoses
BACKGROUND - The high frequency of cutaneous mycosis justify the need to evaluate the possible contribution of in vitro profile of susceptibility to antifungal agents. OBJECTIVE - To evaluate whether there is variability in in vitro susceptibility by filamentous fungi, previously isolated from cutaneous mycosis, to fluconazole, ketoconazole, itraconazole and terbinafine. METHODS - Fungi were isolated and identified by classical methods and the antifungal susceptibility test was performed using the method of broth microdilution, according to a protocol recommended by the Clinical Laboratory Standards Institute (CLSI), through M38-A document. RESULTS - Amongst the 80 filamentous fungi identified, Trichophyton genus represented 81%. The four examined drugs showed great variation for Trichophyton spp and Microsporum spp. Fusarium spp was resistant to all tested drugs. Terbinafine was the most effective drug against the majority of the isolated fungi. CONCLUSION - There was great variability in response profiles to the tested antifungals. The definition of a reference test method will offer higher objectivity for physicians to choose the appropriate therapy.
Antifungal Agents; Antifungal Agents; Arthrodermataceae; Mycoses
INVESTIGAÇÃO
Resposta in vitro de fungos agentes de micoses cutâneas frente aos antifúngicos sistêmicos mais utilizados na dermatologia* * Trabalho realizado no Laboratório de Ensino e Pesquisa em Análises Clínicas Universidade Estadual de Maringá (Lepac/UEM) Maringá (PR), Brasil. Conflito de interesse: Nenhum Suporte financeiro: Este estudo recebeu auxílio financeiro da Fundação Araucária e do Laboratório de Ensino e Pesquisa em Análises Clínicas Universidade Estadual de Maringá (Lepac/UEM) Maringá (PR), Brasil. Como citar este artigo: Almeida LMM, Souza EAF, Bianchin DB, Svidzinski TIE. Resposta in vitro de fungos agentes de micoses cutâneas frente aos antifúngicos sistêmicos mais utilizados na dermatologia. An Bras Dermatol. 2009;84(3):249-55.
Lívia Maria Martins de AlmeidaI; Eliane Alves de Freitas SouzaII; Débora Bertoluzzi BianchinIII; Terezinha Inez Estivalet SvidzinskiIV
IAcadêmica do curso de Medicina da Universidade Estadual de Maringá (UEM) Maringá (PR), Brasil
IIAcadêmica do curso de Medicina da Universidade Estadual de Maringá (UEM) Maringá (PR), Brasil
IIIFarmacêutica bioquímica, especialista, micologia médica Universidade Estadual de Maringá (UEM) Maringá (PR), Brasil
IVDoutora, professora associada da disciplina de Micologia Médica da Universidade Estadual de Maringá (UEM) Maringá (PR), Brasil
Endereço para correspondência Endereço para correspondência: Profa. Dra. Terezinha Inez Estivalet Svidzinski Universidade Estadual de Maringá Departamento de Análises Clínicas Programa de Pós-Graduação em Análises Clínicas Av. Colombo, 5.790, bl J90, sala 11, zona 7 87020 900 Maringá Paraná Tel./fax: 44 3261 4809 3261 4860 E-mail: tiesvidzinski@uem.br
RESUMO
FUNDAMENTOS - A alta frequência das micoses cutâneas justifica a necessidade de avaliar a possível contribuição da determinação do perfil de susceptibilidade aos antifúngicos in vitro.
OBJETIVO Avaliar se existe variabilidade nos isolados fúngicos quanto à susceptibilidade in vitro de fungos filamentosos, previamente isolados de micoses cutâneas, frente aos antifúngicos fluconazol, cetoconazol, itraconazol e terbinafina.
MÉTODOS Os fungos foram isolados e identificados por meio da metodologia clássica e o teste de susceptibilidade aos antifúngicos foi realizado segundo o método de microdiluição em caldo, de acordo com protocolo preconizado pelo Clinical Laboratory Standards Institute (CLSI), documento M38-A.
RESULTADOS Das 80 amostras de fungos filamentosos identificadas, o gênero Trichophyton representou 81%. As quatro drogas analisadas apresentaram grande variação nos gêneros Trichophyton e Microsporum. O gênero Fusarium foi resistente a todas as drogas testadas. A terbinafina foi o antimicótico mais eficaz contra a maioria dos isolados fúngicos.
CONCLUSÃO Houve uma grande variabilidade nos perfis de resposta aos antifúngicos testados. O estabelecimento de um método-teste de referência permitirá ao clínico maior objetividade na escolha de uma terapia adequada.
Palavras-chave: Antimicóticos; Antimicóticos/Análise; Arthrodermataceae; Micoses
INTRODUÇÃO
As micoses cutâneas são infecções fúngicas localizadas nas camadas superficiais da pele e seus anexos1 e podem ser causadas por dermatófitos, leveduras ou fungos filamentosos não dermatófitos (FFND). Estudos epidemiológicos indicam que as micoses cutâneas estão entre as doenças de maior incidência no mundo,2 acometendo todas as faixas etárias e gerando gastos de milhões de dólares em tratamentos todos os anos.3 A distribuição e frequência das micoses cutâneas e seus agentes etiológicos podem variar segundo a região geográfica e o nível sócio-econômico da população,2,4 destacando-se, entre os fatores predisponentes, ocupação profissional, hábitos e costumes individuais. Dessa forma, torna-se importante conhecer sua epidemiologia para se obter um controle dessas infecções.5
As micoses cutâneas variam quanto às formas clínicas e agentes causais; porém, a maioria dos autores relata como agentes etiológicos mais frequentes os dermatófitos (80 90%), seguidos pelas leveduras (5 17%) e FFND (3 12%).2 As infecções por dermatófitos afetam aproximadamente 40% da população mundial e representam 30% de todas as infecções micóticas cutâneas, sendo mais comuns as que comprometem pele e unhas.
Grande parte da procura pelos ambulatórios e consultórios dermatológicos se deve às micoses superficiais e cutâneas.6 As micoses cutâneas, sobretudo as onicomicoses, algumas vezes são de difícil tratamento, e as recidivas costumam ser frequentes, o que, em parte, pode ser atribuído à falta de adesão ao tratamento pelo alto custo dos medicamentos, tratamento prolongado, má utilização ou descontinuidade do fármaco, ineficácia ou resistência à droga e efeitos colaterais, como hepatotoxicidade e manifestações gastrointestinais. O sucesso do tratamento está vinculado tanto ao correto diagnóstico e prescrição adequada quanto à total adesão ao tratamento pelo paciente, o que muitas vezes implica em persistência e alterações de hábitos, que devem ser orientados pelos profissionais.7
Dentre as micoses cutâneas, as que apresentam as maiores dificuldades de tratamento são as que comprometem as unhas. A monoterapia para tratamento de onicomicose pode ser falha em grande parte das vezes,8,9 e a razão disso não está completamente entendida.8 No entanto, alguns fatores podem estar relacionados ao insucesso, dentre eles a dificuldade de se obterem concentrações adequadas da droga no local infectado; alterações vasculares periféricas; o lento crescimento das unhas, especialmente as dos pés, tornando-as vulneráveis a uma reinfecção; e o surgimento da resistência antifúngica, que, segundo Baran, pode resultar em fungos que não respondem ao espectro de ação de nenhuma droga.8
Os principais grupos de antifúngicos sistêmicos comumente utilizados para o tratamento de micoses superficiais e cutâneas são os imidazóis (cetoconazol), triazóis (fluconazol e itraconazol) e alilamina (terbinafina). Apesar de atualmente haver uma variabilidade maior de opções de antifúngicos, tanto tópicos quanto sistêmicos, o arsenal terapêutico ainda é bastante restrito, e é clara a necessidade de novos antifúngicos mais eficazes e menos tóxicos.9 Muitas dessas drogas pertencem ao mesmo grupo de ação farmacológica e possuem o mesmo mecanismo de ação; contudo, os fungos respondem de forma significativamente diferente quanto à susceptibilidade a elas.10,11 Por ser complexa a escolha apropriada do antifúngico, é necessário conhecer informações sobre o próprio fungo, bem como sua interação com as drogas antifúngicas.12 No entanto, o tratamento é usualmente prescrito de forma empírica, sem a confirmação micológica e muitas vezes ministrado por um tempo inadequado de seguimento.
Ainda hoje o diagnóstico laboratorial das micoses é pouco utilizado. Entretanto, considerando-se a similaridade das manifestações clínicas por infecções fúngicas com as de outras etiologias, destaca-se a importância da caracterização laboratorial para se proporcionar um tratamento eficaz,2,13 o que também permitirá a redução dos custos gerados pela terapia empírica.2 Torna-se cada vez mais importante conhecer o perfil de sensibilidade das cepas clínicas e o espectro de ação dos antifúngicos, pois a detecção de resistência poderia ser de suma importância na hora de escolher uma alternativa terapêutica ou outra.14 Além disso, os exames laboratoriais podem ajudar a distinguir uma reinfecção por um mesmo agente de uma outra infecção por um agente novo e fornecer evidências se o próprio fungo é responsável pela falha do tratamento ou se há uma limitação do agente antifúngico. 15,16 Nos últimos anos têm-se padronizado várias técnicas para detecção de resistência in vitro que mostram boa correlação com a evolução clínica dos pacientes.
Atualmente, o teste de susceptibilidade para fungos filamentosos pode ser realizado em laboratórios seguindo o documento M38-A sugerido pelo NCCLS (National Committee for Clinical Laboratory Standards), agora denominado CLSI (Clinical and Laboratory Standards Institute), que, embora não seja exclusivo para dermatófitos, padroniza o TSA (teste de susceptibilidade antifúngica) para fungos filamentosos utilizando duas metodologias (macro e microdiluição em caldo), ambas com boa reprodutibilidade interlaboratorial.17,18
O objetivo deste trabalho foi avaliar se existe variabilidade nos isolados quanto à susceptibilidade in vitro de fungos filamentosos, previamente isolados de micoses cutâneas, frente aos antifúngicos fluconazol, cetoconazol, itraconazol e terbinafina pelo método de microdiluição em caldo, tendo como base o documento M38-A do CLSI.
MATERIAIS E MÉTODOS
Este estudo experimental foi realizado com amostras fúngicas provenientes do banco de fungos filamentosos do Setor de Micologia Médica Laboratório de Ensino e Pesquisa em Análises Clínicas (Lepac) da Universidade Estadual de Maringá, Paraná, Brasil.
Foram analisados todos os fungos filamentosos (n = 80) isolados e identificados como agentes de micoses cutâneas (pele, pelos e unhas), atendendo encaminhamentos médicos no período de três meses, assim distribuídos: Trichophyton mentagrophytes (35), Trichophyton rubrum (21), Trichophyton tonsurans (06), Trichophyton raubitscheki (03), Microsporum canis (08), Microsporum gypseum (02), Microsporum ferrugineum (01), Fusarium oxysporum (01), Fusarium solani (01), Fusarium incarnatum (01) e Fusarium verticillioides (01). As amostras foram mantidas em água destilada estéril a 4º C até o momento do uso.
As concentrações inibitórias mínimas (CIMs) foram determinadas para fluconazol FLC (Pfizer), cetoconazol CTC (Janssen-Cilag), itraconazol ITC (Sporanox® Janssen-Cilag) e terbinafina TRB (Galena e Química Farmacêutica), e o método empregado foi o da microdiluição em caldo de acordo com o protocolo recomendado pelo CLSI, documento M38-A (2002). Cada droga foi preparada de modo a ser testada em 10 concentrações com os seguintes limites: 0,12 μg/mL a 64 μg/mL para FLC, 0,06 μg/mL a 32 μg/mL para TRB e 0,03 μg/mL a 16 μg/mL para ITC e CTC. Esses antifúngicos foram escolhidos por que já dispõem de protocolos para o teste e por corresponderem aos mais utilizados, por via oral, na prática clínica. Os resultados podem servir de base para as possíveis prescrições de medicamentos tópicos.
Para preparação do inóculo, as amostras fúngicas foram cultivadas em tubos contendo ágar Sabouraud dextrosado (SDA) e incubadas a 25º C por 72 horas (gênero Fusarium) ou sete dias (dermatófitos). As colônias fúngicas foram cobertas com 5 mL de salina a 0,85% esterilizada e a seguir homogeneizadas gentilmente com pipeta Pasteur. A mistura de hifas e conídios foi transferida para tubos cônicos esterilizados e deixada em repouso por 20 minutos para sedimentação. O sobrenadante foi removido por aspiração, transferido para outro tubo, e a densidade do inóculo foi ajustada para 68 70% de transmitância em 530 nm, em espectrofotômetro (Bausch & Lomb). Essa suspensão foi diluída em meio RPMI 1640, de modo a obter uma concentração final próxima de 104 UFC/mL. Essa concentração foi conferida por meio do plaqueamento de 10 μL do inóculo preparado em ágar SDA e contagem do número de colônias.
Cada droga antifúngica foi distribuída, em diluições seriadas, nas colunas de 1 a 10 em microplacas de 96 poços. Para o ensaio, foram adicionados 100 μL do inóculo aferido, e as placas foram incubadas a 25º C sem agitação.
Em cada placa do teste foram incluídos controle positivo, representado pelo crescimento de cada isolado na ausência de droga (coluna 11), e controle negativo, que corresponde a ausência de droga e de fungo (coluna 12). Além disso, um microrganismo padrão Candida parapsilosis ATCC 22019 foi testado em todas as placas, com todas as diluições de cada droga, a fim de garantir a reprodutibilidade e acurácia do teste.
As CIMs foram determinadas após 72 horas de incubação para o gênero Fusarium e após 7 dias para os dermatófitos, pela observação visual da inibição de crescimento em cada poço e comparação com o crescimento observado no poço do controle positivo. As CIMs para FLC e CTC foram definidas como a concentração na qual ocorreu redução de 50% do crescimento fúngico. Para ITC e TRB considerou-se como CIM a menor concentração da droga que resultou em 100% de inibição do crescimento do microrganismo.
CIM90 foi definida como a CIM capaz de inibir 90% dos isolados de uma mesma espécie.
RESULTADOS
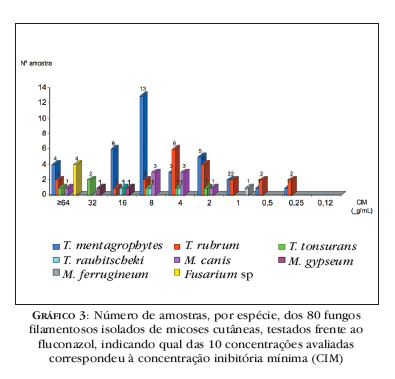
Das 80 amostras testadas, o gênero Trichophyton representou 81%; Microsporum, 14%; e o gênero Fusarium, 5%. Foi possível demonstrar uma grande variabilidade quanto à resposta in vitro desses agentes frente aos quatro antifúngicos mais utilizados na terapêutica de micoses cutâneas. As espécies de Trichophyton (com exceção de T. raubitscheki) mostraram grande variação das CIMs relativas às quatro drogas analisadas, assim como as amostras de M. canis (exceto frente à TRB). As espécies de Fusarium não exibiram variabilidade, pois apresentaram CIM elevada para todas as drogas analisadas.
A CIM do ITC foi baixa para a maioria dos isolados fúngicos (em torno de 0,25 0,5 μg/mL), mas frente às oito amostras de T. mentagrophytes (23%) e 11 das de T. rubrum (52%) a CIM foi elevada (≥ 16μg/mL) (Gráfico 1).
A tendência das amostras frente ao CTC foi de apresentarem uma CIM de mediana (1 2 μg/mL) a alta; no entanto, as duas amostras de M. gypseum apresentaram CIM elevada, de 8 μg/mL (Gráfico 2).
As amostras fúngicas apresentaram importante variação quanto às CIMs do FLC, sendo que a maioria teve resposta em torno de 4 8 μg/mL (Gráfico 3).
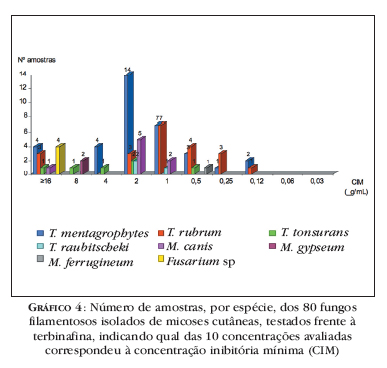
A TRB foi a droga que apresentou CIM mais baixa (0,06 Ìg/mL) para a maioria das amostras, porém 48% dos isolados de T. rubrum revelaram CIM elevada (≥ 32 μg/mL) (Gráfico 4).
O gênero Fusarium sp não mostrou resposta in vitro a nenhum dos antifúngicos testados, uma vez que todas as amostras cresceram mesmo na presença das concentrações mais elevadas recomendadas para teste.
Analisando o gênero Trichophyton, para T. mentagrophytes e T. tonsurans a CIM90 foi elevada para todas as drogas testadas. T. rubrum também apresentou CIM90 elevada para a maioria dos antifúngicos, sendo sua melhor resposta ao FLC (CIM90 = 16 μg/mL). Ao contrário, T. raubitscheki respondeu bem às drogas testadas.
Quanto ao gênero Microsporum sp, M. canis só respondeu bem à TRB (CIM90 = 1 μg/mL); já as outras espécies apresentaram boa resposta para TRB e ITC.
DISCUSSÃO
A micologia médica tem passado por muitas mudanças. A profilaxia antifúngica e a terapia empírica têm contribuído para alterações epidemiológicas, com a aparição de cepas com resistência secundária aos antifúngicos e a substituição de algumas espécies sensíveis por outras com resistência intrínseca.11,14 Nesse contexto, os testes de sensibilidade em micologia têm apresentado grande importância,19 apesar de a correlação entre os testes in vitro e a resposta terapêutica in vivo ainda não estar totalmente definida, uma vez que o tratamento depende de variáveis ligadas à clínica do hospedeiro.14,16
Os testes in vitro para avaliar a susceptibilidade antimicrobiana são fundamentais para uma adequada antibioticoterapia. Eles contribuem na escolha da melhor alternativa de tratamento, reduzindo a possibilidade de falha terapêutica. No entanto, diferentemente do que acontece com as bactérias e leveduras, na atualidade não existem métodos de referência padronizados para medir a atividade in vitro de fungos filamentosos, dermatófitos ou não, frente aos antifúngicos. 5,15,18,20 O documento M38-A do CLSI, direcionado para fungos filamentosos, ainda não determina valores de corte (sensível, intermediário ou resistente), nem inclui protocolos para dermatófitos. Essa é uma das razões que contribuem para que o tratamento seja empírico, uma vez que o TSA não está padronizado para dermatófitos.
Apesar disso, é importante o conhecimento das características biológicas dos principais agentes, pois a identificação já permite direcionar o tratamento. Como exemplo, Fusarium mostrou CIM elevada para todas as drogas avaliadas, confirmando os resultados de Guillermetti e cols., 200721 e Azor e cols., 2007.22 Um problema importante que dificulta o tratamento das infecções invasivas por Fusarium é a sua elevada taxa de resistência generalizada aos antifúngicos.23,24 Aparentemente a resistência é uma característica intrínseca desse gênero, o que dificultaria também o tratamento das infecções cutâneas, sinalizando para a necessidade da busca de novas opções de tratamento antifúngico.
Fusarium pertence ao grupo dos FFND e é amplamente distribuído no solo, plantas, ar e água.22 As espécies que mais frequentemente causam patogenicidade ao homem são F. solani, considerado mais resistente ao tratamento, seguido por F. oxysporum.23 As infecções por Fusarium frequentemente são relatadas em pacientes imunodeprimidos, mas no estudo de Paz e cols., 2004, 76% das infecções eram em imunocompetentes; no de Guilhermetti e cols., 2007, todos os isolados de Fusarium foram obtidos de pessoas imunocompetentes.21,25
Para fungos antropofílicos, como T. rubrum e T. tonsurans, por terem maior adaptação ao ser humano, eram esperadas CIMs mais altas, como de fato ocorreram. Um dado importante observado neste trabalho foi a resposta de T. rubrum frente à terbinafina: 48% das amostras responderam à CIM mais baixa (0,06 μg/mL); porém, 48% foram altamente resistentes, pois não foram inibidas nem na mais alta concentração avaliada, ou seja, CIM ≥ 32 μg/mL. Isso torna claro que, além da identificação, a utilização de métodos eficazes para testar a sensibilidade antifúngica de rotina será obrigatória num futuro próximo, facilitando a instituição da terapêutica.
Entre as 35 amostras de T. mentagrophytes avaliadas, observou-se grande variação quanto à susceptibilidade aos antifúngicos. A tendência de resposta foi para CIMs intermediárias; no entanto, oito amostras foram inibidas apenas pela CIM mais alta de itraconazol, e outras quatro exibiram esse comportamento para todas as drogas, sugerindo serem resistentes a todos os antifúngicos testados. Essa intensa variabilidade pode estar relacionada às variedades dessa espécie: aparentemente as zoofílicas responderiam melhor que as antropofílicas. Porém é importante lembrar que o comportamento in vitro frente aos antifúngicos não tem implicação direta na resposta terapêutica in vivo. Ainda assim é interessante conhecer a característica inerente do microrganismo de não responder homogeneamente aos antifúngicos.
O fluconazol caracteriza-se por sua boa biodisponibilidade, baixa ligação a proteínas e alto tempo de meia-vida.19 Porém, foi o antifúngico que apresentou maior variabilidade, as CIMs variando de 0,25 a ≥ 64 μg/mL para as 80 amostras avaliadas. Na prática o tratamento com fluconazol é associado com bons índices de cura, apesar de algumas limitações.26
A terbinafina é um dos mais novos agentes antifúngicos e possui atividade in vitro direcionada para uma ampla gama de dermatófitos e FFND, embora apresente baixa atividade contra leveduras.19 Neste estudo, foi o antifúngico que apresentou melhor performance dentre as drogas avaliadas, sendo que 67% das amostras foram inibidas na CIM mais baixa (0,06 Ìg/mL). Porém, é importante destacar que 24% dos fungos analisados foram sensíveis apenas à concentração mais alta (CIM = 32 μg/mL). Alguns casos de resistência à terbinafina em dermatófitos têm sido relatados, 27 mas de modo geral a resposta é boa. É um dos antifúngicos mais recomendados para o tratamento, sobretudo de onicomicoses, tanto para uso tópico, quanto oral, incluindo a pulsoterapia. 28
Enfim, este foi um estudo voltado exclusivamente aos microrganismos, mas que corrobora as constatações de autores que comprovam na clínica a eficácia do tratamento sistêmico com itraconazol, terbinafina e fluconazol, drogas consideradas de escolha na terapia de infecções fúngicas da pele e unhas.29 Apesar disso, autores chamam a atenção para a necessidade da abordagem diferenciada em populações especiais, como idosos, crianças, gestantes e indivíduos imunocomprometidos. 30
CONCLUSÃO
O presente estudo demonstrou que existe grande diversidade em relação à susceptibilidade às drogas antifúngicas entre os fungos filamentosos isolados de infecções cutâneas. Embora os resultados dos testes in vitro não tenham correspondência obrigatória com a resposta in vivo, não é mais permitido negar a variabilidade de resposta dos fungos aos diversos agentes antifúngicos. Esse fato, associado à identificação do fungo responsável pela micose cutânea, permitiria ao clínico maior objetividade na escolha de uma terapia adequada e facilitaria a individualização do tratamento, permitindo inclusive alterações de posologia ou da opção pelo grupo de droga.
Considerando a comprovação in vitro da resistência intrínseca de algumas espécies de fungos a determinados antifúngicos, tornou-se evidente a necessidade de métodos de referência, devidamente padronizados e validados, para que os testes de susceptibilidade aos antifúngicos sejam amplamente utilizados na prática clínica. O método de microdiluição em caldo, apesar de trabalhoso, é viável e vem apresentando boa reprodutibilidade interlaboratorial. É evidente que, na prática, o sucesso terapêutico depende de um conjunto de variáveis. Aliados às informações sobre o agente, outros fatores clínicos desempenham papel de relevância e devem ser levados em conta, como: tipo, localização e tempo da lesão; predisposição genética; disciplina e aderência do paciente ao tratamento. Nesse sentido, clínicos e micologistas devem atuar em sincronia, adequando-se às novas exigências da medicina moderna, visando a aperfeiçoar a abordagem para aumentar as chances de sucesso terapêutico e satisfação do paciente.
Recebido em 24.07.2008.
Aprovado pelo Conselho Consultivo e aceito para publicação em 24.04.09.
- 1. Oliveira JAA, Barros JA, Cortez ACA, Oliveira JSRL. Micoses superficiais na cidade de Manaus, AM, entre março e novembro/2003. An Bras Dermatol. 2006;81:238-43
- 2. Perón MLDF, Teixeira JJV, Svidzinski TIE. Epidemiologia e etiologia das dermatomicoses superficiais e cutâneas na Região de Paranavaí- Paraná, Brasil. Rev Bras Anal Clin. 2005;37:77-81
- 3. Abdel-Rahman SM, Herron J, Fallon-Friedlander S, Hauffe S, Horowitz A, Rivière GJ. Pharmacokinetics of terbinafine in young children treated for tinea capitis. Pediatr Infect Dis J. 2005;24:886-91
- 4. Lupi O, Tyring SK, McGinnis MR. Tropical dermatology: fungal tropical diseases. J Am Acad Dermatol. 2005;53:931-51
- 5. Torres BF. Sensibilidad antifúngica de los dermatófitos [tesis]. España: Universitat Rovira i Virgili Réus; 2005
- 6. Lopes JO, Alves SH, Mari CRD, Oliveira LTO, Brum LM, Westphalen JB, et al A ten-year survey of onychomycosis in the Central Region of the Rio Grande do Sul, Brazil. Rev Inst Med Trop Sao Paulo. 1999;41:147-97
- 7. Campanha AM, Tasca RS, Svidzinski TIE. Dermatomicoses: Frequência, diagnóstico laboratorial e adesão de pacientes ao tratamento em um Sistema Público de Saúde, Maringá-PR, Brasil. Lat Am J Pharm. 2007;26:442-8
- 8. Baran R, Kaoukhov A. Topical antifungal drugs for the treatment of onychomycosis: an overview of current strategies for monotherapy and combination therapy. J Eur Acad Dermatol Venereol. 2005;19:219
- 9. Sigurgeirsson B, Paul C, Curran D, Evans EGV. Prognostics factors of mycological cure following treatment of onychomicosis with oral antifungal agents. Br J Dermatol. 2002;147:12413
- 10. Soares MMSR, Cury AE. In vitro activity of antifungal and antiseptic agents against dermatophyte isolates from patients with tinea. Braz J Microbiol. 2001;32:130-4
- 11. Roberts DT, Taylor WD, Boyle J. Guidelines for treatment of onychomycosis. Br J Dermatol. 2003; 148:40210
- 12. Campbell AW, Anyanwu EC, Morad M. Evaluation of the drug treatment and persistence of onychomycosis. ScientificWorldJournal. 2004;4:760-77
- 13. Souza EAF, Almeida LMM, Guilhermetti E, Mota VA, Rossi RM, Svidzinski TIE. Freqüência de onicomicoses por leveduras em Maringá, Paraná, Brasil. An Bras Dermatol. 2007;82:151-6
- 14. Estrella MC, Tudela JRT. żPueden basarse las indicaciones de los antifúngicos en los estudios de sensibilidad? Rev Iberoam Micol. 2002;19:133-8.13
- 15. Elewski BE. Onychomycosis: Pathogenesis, Diagnosis, and Management. Clin Microbiol Rev. 1998;11:415-29
- 16. Rex JH, Pfaller MP, Walsh TJ, Chaturvedi V, Espinel- Ingroff A, Ghannoum MA, et al Antifungal susceptibility testing: practical aspects and current challenges. Clin Microbiol Rev. 2001;14:643-58
-
17National Committee for Clinical Laboratory Standards. Reference Method for Broth Dilution Antifungal Susceptibility Testing of Filamentous Fungi. Aproved Standard M38-A. National Committee for Clinical Laboratory Standards, Wayne, Pa, 2002
- 18. Esteban A, Abarca ML, Cabañes FJ. Comparison of disk diffusion method and broth microdilution method for antifungal susceptibility testing of dermatophytes. Med Mycol. 2005;43:61-6
- 19. Cetinkaya Z, Kiraz N, Karaca S, Kulac M, Ciftci IH, Aktepe OC, et al. Antifungal susceptibilities of dermatophytic agents isolated from clinical specimens. Eur J Dermatol. 2005;15:258-61.
- 20. Ghannoum MA, Chaturvedi V, Espinel-Ingroff A, Pfaller MA, Rinaldi MG, Lee-Yang W, et al. Intra- and interlaboratory study of a method for testing the antifungalsusceptibilities of dermatophytes. J Clin Microbiol. 2004;42:29779.
- 21. Guilhermetti E, Takahachi G, Shinobu CS, Svidzinski TIE. Fusarium spp. as agents of onychomycosis in immunocompetent hosts. Int J Dermatol. 2007;46:822-6.
- 22. Azor M, Gene J, Cano J, Guarro J. Universal In Vitro antifungal resistance of genetic clades of the Fusarium solani species complex. Antimicrob Agents Chemother. 2007;51:1500-3.
- 23. Selleslag D. A case of fusariosis in an immunocompromised patient successfully treated with liposomal amphotericin B. Acta Biomed. 2006;77:32-5.
- 24. Pastor FJ, Guarro J. El papel del voriconazol en el tratamiento de las micosis emergentes. Rev Iberoam Micol. 2007;24:228-32.
- 25. Paz RN, Strahilevitz J, Shapiro M, Keller N, Goldschmied-Reouven A, Polacheck I, et al. Clinical and epidemiological aspects of infections caused by Fusarium species: collaborative study from Israel. J Clin Microbiol. 2004;42:3456-61.
- 26. Kaur R, Kashyap B, Bhalla P. Onychomycosis-epidemiology, diagnosis and management. Indian J Med Microbiol. 2008;26:108-16.
- 27. Darkes MJM, Scott LJ, Goa KL. Terbinafine A review of its use in onychomycosis in adults. Am J Clin Dermatol. 2003;4:39-65.
- 28. Takahata Y, Hiruma M, Shiraki Y, Tokuhisa Y, Sugita T, Muto M. Treatment of dermatophyte onychomycosis with three pulses of terbinafine (500 mg day)1 for a week). Mycoses. 2008;52:72-6.
- 29. Korting HC, Schöllmann C. The significance of itraconazole for treatment of fungal infections of skin, nails and mucous membranes. J Dtsch Dermatol Ges. 2009;7:11-9.
- 30. Baran R, Hay RJ, Garduno JI. Review of antifungal therapy, part II: treatment rationale, including specific patient populations. J Dermatolog Treat. 2008;19:168-75.
Datas de Publicação
-
Publicação nesta coleção
04 Ago 2009 -
Data do Fascículo
Jul 2009
Histórico
-
Aceito
24 Abr 2009 -
Recebido
24 Jul 2008