Resumos
O nevo atípico (displásico) é considerado um fator importante associado com o risco aumentado de desenvolvimento do melanoma cutâneo. Acredita-se que nevos atípicos sejam lesões precursoras do melanoma cutâneo. Podem estar presentes em pacientes com múltiplos nevos melanocíticos (síndrome do nevo atípico) ou isolados e em poucas quantidades em um contexto não familial. Aparecem, geralmente, na puberdade e prevalecem em indivíduos jovens. Têm predileção por áreas expostas ao sol, especialmente, o tronco. O grande desafio em relação ao nevo atípico reside na controvérsia em se definir sua nomenclatura, diagnóstico clínico, critérios dermatoscópicos, diagnóstico histopatológico e aspectos moleculares. Esta revisão tem por objetivo trazer o conhecimento, facilitar o entendimento e responder às questões duvidosas concernentes ao nevo atípico.
Dermoscopia; Histologia; Nevos e melanomas
Atypical nevum (dysplastic) is considered an important factor associated with increased risk of developing cutaneous melanoma. It is believed that atypical nevi are precursor lesions of cutaneous melanoma. They may be present in patients with multiple melanocytic nevi (atypical nevus syndrome) or isolated and in small numbers in a non-familial context. The disease usually begins at puberty and predominates in young people. It has a predilection for sun-exposed areas, especially the trunk. The major challenge in relation to atypical nevi lies in the controversy of defining its nomenclature, clinical diagnosis, dermoscopic criteria, histopathological diagnosis and molecular aspects. This review aims at bringing knowledge, facilitating comprehension and clarifying doubts about atypical nevus.
Dermoscopy; Histology; Nevi and melanomas
REVISÃO
Nevo displásico (nevo atípico)* * Trabalho realizado no Departamento de Oncologia Cutânea do Hospital A. C. Camargo - São Paulo (SP), Brasil.
Gisele Gargantini RezzeI; Alexandre LeonII; João DupratIII
IMestre e doutora em Ciências (área de Oncologia); dermatologista assistente do Departamento de Oncologia Cutânea do Hospital A. C. Camargo - São Paulo (SP), Brasil
IIDoutor em Ciências (área de Oncologia) - Fundação Antonio Prudente; dermatologista assistente do Departamento de Oncologia Cutânea do Hospital A. C. Camargo - São Paulo (SP), Brasil
IIIDoutor em Cirurgia pela Universidade de São Paulo (USP); diretor do Departamento de Oncologia Cutânea do Hospital A. C. Camargo; diretor clínico do Hospital A. C. Camargo - São Paulo (SP), Brasil
Endereço para correspondência Endereço para correspondência: Gisele Gargantini Rezze Rua Barata Ribeiro, 380 - Conj. 34 - Bela Vista 01308-000 São Paulo - SP Tel./Fax: (11) 3120 5045 E-mail: ggrezze@hotmail.org.br
RESUMO
O nevo atípico (displásico) é considerado um fator importante associado com o risco aumentado de desenvolvimento do melanoma cutâneo. Acredita-se que nevos atípicos sejam lesões precursoras do melanoma cutâneo. Podem estar presentes em pacientes com múltiplos nevos melanocíticos (síndrome do nevo atípico) ou isolados e em poucas quantidades em um contexto não familial. Aparecem, geralmente, na puberdade e prevalecem em indivíduos jovens. Têm predileção por áreas expostas ao sol, especialmente, o tronco. O grande desafio em relação ao nevo atípico reside na controvérsia em se definir sua nomenclatura, diagnóstico clínico, critérios dermatoscópicos, diagnóstico histopatológico e aspectos moleculares. Esta revisão tem por objetivo trazer o conhecimento, facilitar o entendimento e responder às questões duvidosas concernentes ao nevo atípico.
Palavras-chave: Dermoscopia; Histologia; Nevos e melanomas
INTRODUÇÃO
O primeiro relato de famílias com múltiplos nevos melanocíticos (comuns e atípicos) e incidência aumentada de melanoma cutâneo foi publicado por Clark e col. em 1978. Originalmente, utilizou-se o termo síndrome B-K (iniciais do último nome de cada paciente estudado das duas famílias descritas por Clark) para caracterizar esses pacientes com muitos nevos.1 Em 1980, Greene e col. empregaram, para casos semelhantes, o termo síndrome do nevo displásico (SND).2 Nesse mesmo ano, Elder e col. descreveram a presença dos nevos atípicos em um contexto não familial e nomearam-na síndrome do nevo displásico esporádico.3 Em 1983, Lynch e col. introduziram o termo síndrome FAMMM (familial atypical multiple mole melanoma syndrome).1 Posteriormente, Ackerman e Magana Garcia chamaram essas lesões melanocíticas adquiridas de nevos de Clark.4
Atualmente, vários nomes são utilizados na literatura para designar o nevo displásico, incluindo nevo B-K, nevo de Clark, nevo atípico e nevo com desordem arquitetural.5,6 O termo nevo atípico foi recomendado pelo consenso dos National Institutes of Health (NHI) em 1992.7
Muitos estudos definem a presença do nevo atípico como um fator importante associado ao risco aumentado de desenvolvimento do melanoma cutâneo.8 Acredita-se, também, que os nevos melanocíticos comuns e os nevos atípicos sejam lesões precursoras do melanoma cutâneo. A maior evidência a favor dessa teoria é a associação entre nevos e melanomas observada clínica e histologicamente.9
Clark e Elder (1984) propuseram um modelo de desenvolvimento e progressão dos melanomas, com base em modelos experimentais, observações clínicas e histopatológicas, composto por seis etapas: melanócito precursor; nevos comuns adquiridos ou congênitos, com presença de melanócitos normais; nevos displásicos, com atipia estrutural e arquitetural; melanoma de crescimento radial, melanomas primários não tumorigênicos sem capacidade de metastatização; melanoma de crescimento vertical, melanomas primários que invadem a derme e com capacidade potencial de metastatização; e melanoma metastático. Nesse modelo, o nevo atípico seria considerado lesão precursora dos melanomas cutâneos.1,10,11
O grande desafio em relação ao nevo atípico reside na controvérsia em se definir sua nomenclatura, seu diagnóstico clínico, seus critérios dermatoscópicos, seu diagnóstico histopatológico e seus aspectos moleculares.6,12,13
CARACTERÍSTICAS EPIDEMIOLÓGICAS
Os nevos atípicos têm maior prevalência na população jovem (indivíduos com menos menos de 30-40 anos anos) e seu aparecimento, geralmente, se inicia na puberdade.6,14 Os nevos atípicos são lesões dinâmicas e podem se tornar progressivamente mais ou menos atípicas, mas a maioria se mantém estável ou regride ao longo da vida. Novos nevos atípicos podem aparecer após os 30 anos de idade, mas não é o evento mais comum.6
A predileção dos nevos atípicos por regiões expostas ao sol (especialmente, o tronco), sua associação positiva com antecedente de queimaduras solares na infância e/ou na adolescência e sua ocorrência em pessoas com pele sensível à exposição solar sugerem que o seu desenvolvimento pode ser relacionado a uma exposição solar aguda e intensa.6
A incidência do nevo atípico clínico na população em geral, em estudos publicados na literatura médica, varia entre 1,5% a 18%. Em um estudo realizado na Pensilvânia, em 1995, a incidência de melanoma mostrou-se quinze vezes maior em pacientes com nevos atípicos clínicos, em comparação com os membros da população em geral (154 v. 10 por 100.000/ano).7 Crutcher e Sagebiel observaram prevalência de 4,9% na população de Napa Valley (Califórnia, EUA), porém, com diagnóstico clínico e histológico de nevo atípico.14 A frequência dos nevos atípicos em pacientes com antecedente de melanoma é mais alta, variando de 34% a 59%.6
Muitas famílias são afetadas por uma herança familial autossômica dominante que caracteriza a síndrome do nevo atípico - melanoma FAMMM. Essa síndrome é definida pela ocorrência de melanoma em, pelo menos, um parente de primeiro ou segundo grau, pela presença de grande quantidade de nevos (geralmente, mais de 50), sendo alguns clinicamente atípicos e com características histológicas distintas.6,7,14 Pessoas com essa síndrome têm um risco mais de 150 vezes maior de desenvolver melanoma em relação à população em geral.6,15
Os números de nevos comuns e de nevos atípicos são importantes fatores independentes de risco para o desenvolvimento do melanoma cutâneo.16 Se um indivíduo apresenta de 100 a 115 lesões névicas, o risco de desenvolvimento do melanoma é de sete a doze vezes maior em relação a um indivíduo com apenas dez a 15 nevos comuns, no máximo.9,17,18 O risco de desenvolver melanoma cutâneo é seis vezes maior para um indivíduo com cinco nevos atípicos do que para um indivíduo que não apresenta nenhuma lesão atípica.9,17
Na literatura, podem-se encontrar relatos nos quais o risco relativo varia de 3,9% a 8,8%, com base, unicamente, na realização do diagnóstico clínico de nevo atípico em um contexto não familial. No estudo conduzido por por Titus-Ernstoff e col., encontrouse um risco relativo de 6,2%, considerando-se o diagnóstico clínico e histopatológico.14
CARACTERÍSTICAS CLÍNICAS
A ausência de um consenso quanto ao diagnóstico clínico do nevo atípico resultou em diferentes definições clínicas. Uma delas se baseia na presença de, pelo menos, três das cinco características a seguir: (1) diâmetro maior que 5mm; (2) bordas mal definidas; (3) margens irregulares; (4) múltiplas cores; (5) presença de componentes maculares e papulares (Figura 1).13,19
A regra do ABCD(E) também pode ser útil no diagnóstico do nevo atípico. A lesão é considerada atípica quando apresenta Assimetria em relação à forma (A), Bordas irregulares (B), múltiplas Cores (C), Diâmetro maior do que 5mm (D) e Elevação de parte da lesão, conferindo aspecto maculopapular (E).12
O nevo atípico pode estar presente em qualquer região do corpo, incluindo as áreas consideradas duplamente cobertas, como mamas, região glútea e couro cabeludo, mas é mais comumente encontrado na região superior do tronco posterior (Figura 1).7
A síndrome do nevo atípico clássica foi descrita por Clark e col. e caracteriza-se pela tríade: presença de 100 ou mais nevos, com, pelo menos, um nevo com diâmetro maior do que 8mm e um nevo com características clínicas de atipia, em pacientes com antecedente familial de melanoma cutâneo.6 De acordo com Kopf e col., a síndrome do nevo atípico pode ser classificada em cinco diferentes tipos: (1) tipo A, nevo atípico esporádico sem melanoma; (2) tipo B, nevo atípico familial sem melanoma; (3) tipo C, nevo atípico esporádico com melanoma; (4) tipo D-1, nevo atípico familial com uma pessoa na família com melanoma; (5) tipo D-2, nevo atípico familial com dois ou mais membros da família com melanoma.20
A definição dessa síndrome também é controversa, mas uma das mais amplamente utilizadas, atualmente, é a proposta pelo NHI em 1992: ocorrência de melanoma em, pelo menos, um parente de primeiro ou segundo grau, grande quantidade de nevos - mais de 50 - sendo alguns clinicamente atípicos e com características histológicas distintas.7
CRITÉRIOS DERMATOSCÓPICOS
A definição de critérios dermatoscópicos que auxiliem no diagnóstico do nevo atípico com precisão também é considerada um desafio. Em 1993, Pehamberger e col. propuseram um modelo diagnóstico dermatoscópico para as lesões melanocíticas denominado Análise de Padrões, com acurácia diagnóstica para o melanoma de 76%, comparada à 59% quando realizado o exame clínico a olho nu21,22,23 Esse modelo utiliza algumas características dermatoscópicas que são mais comumente encontradas nos nevo atípicos em comparação com aquelas encontradas no melanoma.22,23 O nevo atípico seria caracterizado pela presença de uma rede pigmentar irregular, discreta e/ou focalmente proeminente, com terminação abrupta ou gradual; presença de pigmentação difusa irregular podendo ser intensa e heterogênea centralmente, com terminação abrupta na periferia da lesão; áreas de despigmentação, quando presentes, geralmente são irregulares e periféricas; os glóbulos marrons, quando presentes, apresentam tamanho e formato variados e distribuídos irregularmente; os pontos pretos, que são raros, estão distribuídos regularmente; as estrias radiadas, os pseudópodes e o véu azul-acinzentados geralmente estão ausentes (Figura 2).21,22,23
Os principais critérios para diferenciar os nevos atípicos dos nevos comuns são: a rede pigmentar e os glóbulos marrons. Nos nevos atípicos, a rede pigmentar geralmente se apresenta irregular, focalmente proeminente e com terminação abrupta na periferia em algumas regiões, e nos nevos comuns, a rede pigmentar apresenta-se regular com esmaecimento para a periferia da lesão. Em relação aos glóbulos marrons, nos nevos atípicos se apresentam de tamanho e formato variados e distribuição irregular, e nos nevos comuns, eles são uniformes quanto ao tamanho e ao formato, com distribuição regular geralmente na região central da lesão.21,22
Em 2001, Hofmann-Wellenhof e colaboradores realizaram um estudo morfológico na tentativa de se determinar à dermatoscopia critérios outros que pudessem facilitar o diagnóstico entre os nevos atípicos e os melanomas iniciais. Foram incluídas 800 lesões clinicamente compatíveis com nevo atípico e 4 subtipos distintos foram descritos:13,20
1. Nevo atípico com hipopigmentação central: uma variante do tipo reticular-homogênea, com uma área central hipopigmentada sem a presença de outras estruturas dermatoscópicas e rede pigmentar em toda a periferia (Figura 3).13,20
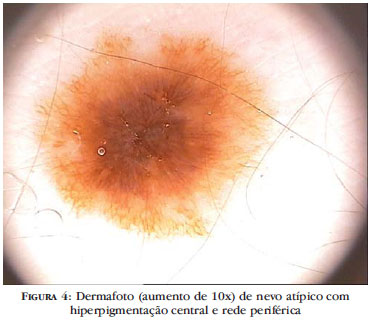
2. Nevo atípico com hiperpigmentação central: este tipo também é chamado de nevo hipermelanótico ou black nevus e representa uma variante composta por rede pigmentar periférica e hiperpigmentação central (black lamella) (Figura 4).13,20
3. Nevo atípico com hipo e hiperpigmentação multifocal: é caracterizado por áreas de hipopigmentação entremeadas por areas de hiperpigmentação conferindo aspecto manchado (Figura 5). 13,20
4. Nevo atípico com pigmentação excêntrica: este tipo é o de maior importância, pois inclui o melanoma inicial como diagnóstico diferencial. É caracterizado pela presença de uma hiperpigmentação periférica que alcança a borda da lesão. Esta área pode ser caracterizada por uma mancha (blotche) hiperpigmentada ou por um aspecto reticular hiperpigmentado (Figura 6).13,20
Entretanto, Fikrle e Pzinger realizaram um estudo no qual a classificação de Hofmann-Wellenhof foi aplicada em 180 lesões melanocíticas, entre elas nevos melanocíticos comuns, atípicos, melanomas in situ e melanomas invasivos finos, todas com confirmação histológica. Utilizando-se este método, infelizmente, não foi possível uma distinção significativa entre os nevos atípicos e os melanomas iniciais. Concluíram que o exame clínico somado à dermatoscopia leva ao aumento da confiança diagnóstica e ajudam na correta decisão em relação aos casos considerados difíceis.24
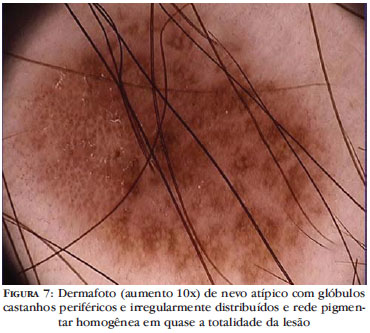
Mais recentemente, na tentativa de diferenciar nevos atípicos de melanoma fino, Annessi e colaboradores chegaram a um modelo dermatoscópico final composto de cinco variáveis: áreas de hipopigmentação marrom-claras periféricas, pigmentação de distribuição irregular, padrão de regressão, glóbulos marrons de formato e distribuição irregular e rede pigmentar com terminação abrupta na periferia. A presença destas características sugere o diagnóstico de melanoma fino (Figura 7). As lesões com áreas de hipopigmentação marrom-claras na periferia apresentavam risco 30 vezes maior para o diagnóstico de melanoma fino comparadas às lesões com ausência desta característica dermatoscópica.25
HISTOPATOLOGIA
O diagnóstico histológico do nevo atípico é baseado na identificação de anormalidades citológicas e arquiteturais específicas (displasia melanocítica) e atualmente não existe um critério que seja universalmente aceito.1,6,7,14
De acordo com Clark e Elder, a displasia melanocítica histológica apresenta algumas características a seguir (Figura 8).1,26,27
1. Hiperplasia lentiginosa dos melanócitos: caracterizada pela confluência dos melanócitos na zona da membrana basal; células melanocíticas se estendendo além das papilas dérmicas; "fenômeno do ombro" (extensão periférica do componente juncional além do componente dérmico).
2. Atipia melanocítica epitelióide: células melanocíticas grandes com grande quantidade de citoplasma e pigmentação finamente distribuída conferindo aspecto leitoso.
3. Fibrose lamelar: fibroblastos alongados separados por camadas de matriz extra-celular densa e/ou fibrose eosinofílica concêntrica ao redor das cristas epidérmicas.
4. Infiltrado linfocitário perivascular na derme papilar.
A degeneração dos nevos melanocíticos (evento natural que ocorre ao longo do tempo - chamados de "nevos antigos") contribui para a aparência citológica de displasia dos melanócitos e confusão diagnóstica. Por outro lado, a presença de uma displasia intensa pode levar ao diagnóstico de melanoma in situ. Assim, Mihm e Barnhill tentaram elaborar uma graduação composta por seis diferentes diagnósticos baseados na histologia: (1) nevo melanocítico comum; (2) nevo melanocítico com características de nevo atípico; (3) nevo atípico com pouca atipia citológica; (4) nevo atípico com moderada atipia citológica;
(5) nevo atípico com intensa atipia; (5) melanoma primário. Entretanto, neste estudo a concordância diagnóstica entre os patologistas experientes variou de 35% a 58% enquanto entre os patologistas menos treinados variou de 16% a 65%.28 No estudo de Brochez e colaboradores, um grupo de lesões histologicamente diagnosticadas como nevos atípicos por um grupo de patologistas experientes foram diagnosticadas como melanomas em 21% dos casos por outro grupo de patologistas igualmente experientes. Os melanomas finos e in situ foram diagnosticados como nevos atípicos em 12% dos casos.29 Estes trabalhos reforçam o fato de que a distinção histológica entre o nevo atípico e o melanoma é um desafio e que o diagnóstico histológico está longe de ser considerado padrão ouro (gold standard).7,12
A criação de um modelo diagnóstico baseado em critérios maiores e menores facilitou o diagnóstico histológico do nevo atípico e por isso é amplamente utilizado. Os critérios maiores são: 1. proliferação de nevomelanócitos atípicos na região da membrana basal se estendendo por três cristas epidérmicas em relação ao componente intradérmico; 2. proliferação melanocítica intraepidérmica (lentiginosa ou epitelióide). Os critérios menores são: 1. fibrose concêntrica eosinofílica envolvendo as cristas epidérmicas ou fibroplasia lamelar; 2. neovascularização; 3. resposta inflamatória dérmica; 4. fusão de cristas. O diagnóstico é realizado quando houver 2 critérios maiores e pelo menos 2 critérios menores.6
CORRELAÇÃO CLÍNICOPATOLÓGICA
Em relação aos nevos atípicos, a presença de características clínicas de atipia se correlaciona imperfeitamente com a presença de displasia histológica. Em um estudo envolvendo 101 pacientes com melanoma esporádico, a lesão clínica mais atípica foi removida cirurgicamente e a presença de displasia foi verificada histologicamente em 7% dos casos nos quais a lesão apresentava apenas uma característica clínica de displasia, 23% nos casos com duas características clinicas de atipia e 62% nos casos com três delas.6,29
Em um estudo populacional em Utah (população caucasina), Piepkorn e colaboradores retiraram um ou dois nevos atípicos de cada paciente e houve uma prevalência de 53% com displasia histológica. Encontraram uma relação estatisticamente significativa entre o número total de lesões melanocíticas e a displasia histológica. Este dado sugere que a displasia melanocítica não está randomicamente distribuída, mas que algumas pessoas apresentam uma predisposição ao aparecimento destas lesões,6,30
Em uma série de 940 nevos melanocíticos benignos, Annessi e colaboradores, classificaram 53% dos nevos como clinicamente benignos e encontraram 78% de atipia histológica, demonstrando a discrepância entre o diagnóstico clínico e histopatológico.25 Neste mesmo estudo, separaram as lesões névicas em dois grupos, sendo o grupo A composto por nevos com diâmetro entre 3 e 5mm e o grupo B por nevos maiores de 5mm. Na comparação entre os grupos, observou-se uma maior discrepância diagnóstica clinicopatológica (grupo A: displasia clínica de 21% e displasia histológica de 68,3% e grupo B: displasia clínica de 67,4% e displasia histológica de 83,2%) no grupo de lesões com diâmetro menor (grupo A). Ainda neste estudo, estabeleceram a sensibilidade e especificidade do diagnóstico clínico do nevo atípico, sendo 58,4% e 66,6% respectivamente.31
BIOLOGIA MOLECULAR
É freqüente a ocorrência de nevos atípicos em pacientes com história pessoal e familiar de melanoma, na síndrome clínica conhecida como melanoma familial. Devido à esta forte correlação, admiti-se que o gene CDKN2A seja nevogênico.32 O fenótipo característico descrito nestas famílias é relacionado à contagem elevada de nevos melanocíticos benignos e de nevos atípicos.33 Nesta síndrome o gene CDKN2A é o mais implicado, podendo-se detectar mutações germinativas em pacientes afetados numa freqüência que pode variar de 20% a 40%, dependendo do número de pacientes afetados na família, da idade média de diagnóstico, da ocorrência de casos de carcinoma pancreático, de tumores do sistema central e de melanomas primários múltiplos.34 O gene CDKN2A é considerado um gene supressor de tumor, atuando nos dois pontos de checagem do ciclo celular através dos seus transcritos principais, p16 e p14. O p16 atua no ponto de restrição G1, é codificado pelos éxons exons 1α, 2 e 3, sendo sua expressão regulada por um promotor independente. O segundo produto deste gene, p14, atua no ponto de restrição G2, é codificado por um éxon 1 alternativo, exon1β, e pelo éxon 2, porém numa janela de leitura diferente, gerando uma proteína sem qualquer semelhança com o p16.35 Em famílias estudadas na América do Norte, Europa e Australia, as mutações germinativas responsáveis pela ocorrência do melanoma e pelo fenotipo da síndrome do nevo atípico, afetam principalmente o éxon 2, que é comum aos dois transcritos deste gene, p16 e p14.36 Em um estudo de Leon e colaboradores (2008), realizado no Hospital A C Camargo, em São Paulo, com 40 famílias brasileiras, foi encontrado uma taxa de detecção de mutação de 25%, sendo que estas mutações foram descobertas em freqüências semelhantes nas diferentes regiões do gene (dados não publicados). Outro gene, CDK4, pode também estar relacionado a síndrome do melanoma familial e por conseqüência a ocorrência de nevos atípicos, porém de importância bem menor, atingindo cerca de 1% das famílias afetadas.37 Nestes casos, as mutações estão restritas ao códon 24, com uma substituição do aminoácido arginina por histidina ou cisteina, levando a inativação do CDK4.38 As mutações germinativas neste gene não foram detectadas nas famílias brasileiras (dados não publicados).
CONDUTA
De acordo com as evidências, o diagnóstico clínico do nevo atípico não necessita de confirmação histológica. Apesar da reconhecida associação entre o nevo atípico e o risco de desenvolvimento do melanoma cutâneo, a maioria dos nevos atípicos não progride para o melanoma. A excisão profilática destes nevos parece não ter custo-benefício e pode inferir a falsa sensação de segurança para o paciente, pois o risco permanece. Alguns profissionais justificam a excisão de nevos atípicos em localizações de difícil seguimento, porém não existem dados na literatura que ratifiquem esta conduta.6
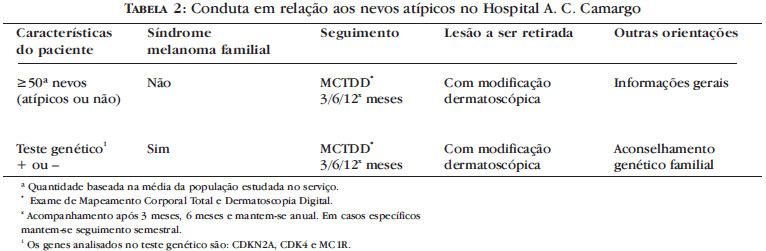
Algumas recomendações de como abordar o paciente portador de nevo(s) atípico(s) foram publicadas pelo NIH e pelo Melanoma Working Group, the Netherlands (Tabela 1) e são largamente utilizadas.6,7
Estas recomendações incluem: 1. história pessoal detalhada (informações sobre quaisquer lesões da pele, melanoma(s) prévio(s), câncer da pele não melanoma, excisão de lesões prévias e diagnóstico histopatológico, episódios de queimaduras solares na infância e/ou adolescência); 2. história familiar de melanoma ou nevos atípicos (detalhando o grau de parentesco); 3. exame clínico completo da pele incluindo áreas duplamente cobertas e couro cabeludo); 4. exame dermatoscópico de todas as lesões melanocíticas (exame de mapeamento corporal total e dermatoscopia digital para acompanhamento, se disponível); 5. orientações para o paciente quanto à exposição solar - evitar exposição nos períodos de maior intensidade dos raios ultra-violeta, usar roupas protetoras, óculos escuros e filtro solar com fator de proteção 15 ou mais.6
Os pacientes com nevos atípicos múltiplos apresentam um risco aumentado de desenvolver o melanoma ocular. Assim, alguns profissionais recomendam a realização de um exame oftalmológico completo uma vez por ano para os pacientes com a síndrome do nevo atípico.7 Ainda na avaliação dos pacientes com diagnóstico de nevo atípico, recomenda-se especial atenção para a história familiar de melanoma. Quando existe comprovação de dois ou mais casos em parentes de primeiro ou segundo grau está indicado a realização do teste genético do gene CDKN2A quando disponível.6
O seguimento de 254 pacientes de alto risco para o desenvolvimento de melanoma cutâneo através do exame de mapeamento corporal total e dermatoscopia digital foi realizado por Rezze e Soares de Sá e colaboradores no Departamento de Oncologia Cutânea do Hospital A C Camargo de São Paulo, no período de 05/2003 a 11/2007 (dados não publicados). Foram mapeadas o total de 13038 lesões melanocíticas (mèdia de 50 lesões por paciente) e, durante o acompanhamento, foram verificadas modificações dermatoscópicas em 289. Destas, 225 eram nevos melanocíticos comuns, 46 nevos atípicos, 13 lesões não névicas e 5 melanomas cutâneos. A incidência de melanoma na população estudada foi de 1,96 para cada 100 pacientes e nas lesões modificadas de 1,73%. Neste trabalho foi possível sugerir que a dermatoscopia digital é uma ferramenta útil no seguimento dos pacientes de alto risco para o desenvolvimento do melanoma cutâneo (dentre estes, os pacientes portadores de nevos atípicos), permitindo o diagnóstico precoce desta neoplasia, fundamental para a cura e aumento da sobrevida dos pacientes. Com base nos dados obtidos, neste mesmo serviço, foi elaborado um guia para o seguimento dos pacientes de alto risco de desenvolvimento do melanoma (Tabela 2).39
Recebido em 08.11.2009.
Aprovado pelo Conselho Consultivo e aceito para publicação em 17.06.2010.
Conflito de interesse: Nenhum
Suporte financeiro: Nenhum
- 1. Clark Jr WH, Elder DE, Guerry Dt, Epstein MN, Greene MH, Van Horn M. A study of tumor progression: the precursor lesions of the superficila spreading and nodular melanoma. Hum Pathol. 1984;15:1147-65.
- 2. Greene MH, Clark WH Jr, Tucker MA, Elder DE, Kraemer KH, Fraser MC, et al. Precursor naevi in cutaneous malignant melanoma: a proposed nomenclature. Lancet. 1980;2:1024.
- 3. Elder DE, Goldman LI, Goldman SC, Greene MH, Clark WH Jr. Dysplastic nevus syndrome: a phenotypic association of sporadic cutaneous melanoma. Cancer. 1980;46:1787-94.
- 4. Ackerman AB, Magana-Garcia M. Naming acquired melanocytic nevi. Unna's, Miescher's, Spitz's Clark's. Am J Dermatopathol. 1990;12:193-209.
- 5. Fung MA. Terminology and management of dysplasticnevi: responses from 145 dermatologists. Arch Dermatol. 2003;139:1374-5.
- 6. Naeyaert JM, Brochez L. Clinical practice. Dysplastic nevi. N Engl J Med. 2003;349:2233-40.
- 7. NHI consensus Conference: diagnosis and treatment of early melanoma. JAMA. 1992;251:1314-09.
- 8. Hussein MR. Melanocytic dysplastic naevi occupy the middle ground between benign melanocytic naevi and cutaneous malignant melanomas: emerging clues. J Clin Pathol. 2005;58:453-6.
- 9. Skender-Kalnenas TM, English DR, Heenan PJ. Benign melanocytic lesions: risk markers or precursors of cutaneous melanoma? J Am Acad Dermatol. 1995;33:1000-7.
- 10. Li G, Herlyn M. Dynamics of intercellular communication during melanoma development. Mol Med Today. 2000;6:163-9.
- 11. Chammas R, Duarte APM, Otake AH, Costa M. Genética e biologia molecular do melanoma e de sua progressão. In: Oliveira Filho RS, editor. Melanoma cutâneo localizado e linfonodo sentinela. São Paulo: Lemar; 2003. p.1-19.
- 12. Roesch A, Burgdorf W, Stolz W, Landthaler M, Vogt T. Dermatoscopy of "dysplastic nevi": a beacon in diagnos tic darkness. Eur J Dermatol. 2006;16:479-93.
- 13. Hofmann-Wellenhof R, Blum A, Wolf IH, Piccolo D, Kerl H, Garbe C, Soyer HP. Dermoscopic classification of atypical melanocytic nevi (Clark nevi). Arch Dermatol. 2001;137:1575-80.
- 14. Arumi-Uria M. Dysplastic nevus: the eye of the hurricane. J Cutan Pathol. 2008;35 Suppl 2:16-9.
- 15. Platz A, Ringborg U, Hansson J. Hereditary cutaneous melanoma. Semin Cancer Biol. 2000;10:319-26.
- 16. Thomas NE, Edmiston SN, Alexander A, Millikan RC, Groben PA, Hao H, et al. Number of nevi and early-life ambient UV exposure are associated with BRAF-mutant melanoma. Cancer Epidemiol Biomarkers Prev. 2007;16:991-7.
- 17. Gandini S, Sera F, Cattaruzza MS, Pasquini P, Abeni D, Boyle P, et al. Meta-analysis of risk factors for cutaneous melanoma: I. Common and atypical naevi. Eur J Cancer. 2005;41:28-44.
- 18. Grulich AE, Bataille V, Swerdlow AJ, Newton-Bishop JA, Cuzick J, Hersey P, McCarthy WH. Naevi and pigmentary characteristics as risk factors for melanoma in a high-risk population: a case-control study in New South Wales, Australia. Int J Cancer. 1996;67:485-91.
- 19. Garbe C, Büttner P, Weiss J, Soyer HP, Stocker U, Krüger S, et al. Associated factors in the prevalence of more than 50 common melanocytic nevi, atypical melanocytic nevi, and actinic lentigines: multicenter case-control study of the Central Malignant Melanoma Registry of the German Dermatological Society. J Invest Dermatol. 1994;102:700-5.
- 20. Hofmann-Wellenhof R, Soyer PH. Atypical (Dysplastic) Nevus. In: Soyer HP, Argenziano G, Hofmann-Wellenhof R, Johr RH, ed. Color Atlas of Melanocytic Lesions of the Skin. v.1. Berlin: Springer-Verlag Berling Heidelberg; 2007. p87-96.
- 21. Pehamberger H, Steiner A, Wolff K. In vivo epiluminescence microscopy of pigmented skin lesions. I. Pattern analysis of pigmented skin lesions. J Am Acad Dermatol. 1987;17:571-83.
- 22. Soares de Sa BC, Rezze GG. Dermatoscopia dos nevos atípicos. In: Rezze GG, Soares de Sa BC, Neves RI, eds. Atlas de dermatoscopia Aplicada ("Atlas on Dermoscopy"). São Paulo: Lemar; 2004. v. 1. p. 103-7.
- 23. Rezze GG, Sá BCS, Neves RI. Dermatoscopia: o método de análise de padrões. An Bras Dermatol. 2006;81:261-8.
- 24. Fikrle T, Pizinger K. Dermatoscopic differences between atypical melanocytic naevi and thin melanomas. Melanoma Res. 2006;16:45-50.
- 25. Annessi G, Bono R, Sampogna F, Faraggiana T, Abeni D. Sesitivity, specificity and diagnostic accuracy of three dermoscopic algorithmic methods in the diagnosis of doubtful melanocytic lesions. J Am Acad Dermatol. 2007;56:759-67.
- 26. Elder DE. The dysplastic nevus. Phatology. 1985; 17: 291-7.
- 27. Clark Jr. WH, Reimer RR, Greene M, Ainsworth AM, Mastrangelo MJ. Origin of familial malignant-melanomas from heritable melanocytic lesions. The B-K mole syndrome. Arch Dermatol. 1978;114:732-8.
- 28. Duncan LM, Berwick M, Bruijn JA, Byers HR, Mihm MC, Barnhill RL. Histopathologic recognition and grading of dysplastic melanocytic nevi: an interobserver agreement study. J Invest Dermatol. 1993;100:S318-321.
- 29. Brochez L, Verhaeghe E, Grosshans E, Haneke E, Piérard G, Ruiter D, Naeyaert JM. Inter-observer variation in the histopathological diagnosis of clinically suspicious pigmented skin lesions. J Pathol. 2002;196:459-66.
- 30. Piepkorn M, Meyer LJ, Goldgar D, Seuchter SA, Cannon-Albright LA, Skolnick MH, Zone JJ. The dysplastic melanocytic nevus: a prevalent lesion that correlates poorly with clinical phenotype. J Am Acad Dermatol. 1989;20:407-15.
- 31. Annessi G, Cattaruzza MS, Abeni D, Baliva G, Laurenza M, Macchini V, et al. Correlation between clinical atypia and histologic dysplasia in acquired melanocytic nevi. Correlation between clinical atypia and histologic dysplasia in acquired melanocytic nevi. J Am Acad Dermatol. 2001;45:77-85.
- 32. Bertram CG, Gaut RM, Barrett JH, Pinney E, Whitaker L, Turner F, et al. An assessment of the CDKN2A variant Ala148Thr as a nevus/melanoma susceptibility allele. J Invest Dermatol. 2002;119:961-5.
- 33. Bataille V, Bishop JA, Sasieni P, Swerdlow AJ, Pinney E, Griffiths K, Cuzick J. Risk of cutaneous melanoma in relation to the numbers, types and sites of naevi: a case-control study. Br J Cancer. 1996;73:1605-11.
- 34. Goldstein AM, Chan M, Harland M, Gillanders EM, Hayward NK, Avril MF, et al. High-risk melanoma susceptibility genes and pancreatic cancer, neural system tumors, and uveal melanoma across GenoMEL. Cancer Res. 2006;66:9818-28.
- 35. Pho L, Grossman D, Leachman SA. Melanoma genetics: a review of genetic factors and clinical phenotypes in familial melanoma. Curr Opin Oncol. 2006;18:173-9.
- 36. Goldstein AM, Chan M, Harland M, Hayward NK, Demenais F, Bishop DT, et al. Features associated with germline CDKN2A mutations: a GenoMEL study of melanoma-prone families from three continents. J Med Genet. 2007;44:99-106.
- 37. Goldstein AM, Chidambaram A, Halpern A, Holly EA, Guerry IV D, Sagebiel R, et al. Rarity of CDK4 germline mutations in familial melanoma. Melanoma Res. 2002;12:51-5.
- 38. Majore S, De Simone P, Crisi A, Eibenschutz L, Binni F, Antigoni I, et al. CDKN2A/CDK4 molecular study on 155 Italian subjects with familial and/or primary multiple melanoma. Pigment Cell Res. 2008;21:209-11.
- 39. Rezze GG, Leon A. Nevo Displasico. In: Belfort FA, Wainstain AJA, eds. Melanoma diagnostico e tratamento. São Paulo: Lemar; 2009. v. 1. p. 99-110.
Datas de Publicação
-
Publicação nesta coleção
27 Jan 2011 -
Data do Fascículo
Dez 2010
Histórico
-
Recebido
08 Nov 2009 -
Aceito
17 Jun 2010