Resumos
A dermatite seborreica é uma doença eritêmato-escamativa de caráter crônico-recidivante que acomete entre 1 e 3% da população geral dos Estados Unidos. Possui dois picos de incidência - o primeiro, durante os três primeiros meses de vida, e o segundo, a partir da puberdade, atingindo seu ápice entre os 40 e 60 anos de idade. Os indivíduos HIV positivos têm maior prevalência da doença, que apresenta maior intensidade e tendência à refratariedade ao tratamento. Doenças neurológicas e outras doenças crônicas também estão associadas ao desenvolvimento da dermatite seborreica. Como mecanismo fisiopatogênico, reconhece-se que o fungo Malassezia sp., presente na pele de indivíduos suscetíveis, leve a uma irritação não-imunogênica a partir da produção de metabólitos à base de ácidos graxos insaturados deixados na superfície cutânea. Este artigo faz uma revisão da literatura sobre dermatite seborreica, com ênfase nos aspectos imunogenéticos, formas clínicas e tratamento.
Dermatite; Dermatite seborreica; Eczema
Seborrheic dermatitis is a chronic relapsing erythematous scaly skin disease, the prevalence of which is around 1 to 3% of the general population in the United States. It has two incidence peaks, the first in the first three months of life and the second beginning at puberty and reaching its apex at 40 to 60 years of age. The prevalence of seborrheic dermatitis is higher in HIV-positive individuals and the condition tends to be more intense and refractory to treatment in these patients. Neurological disorders and other chronic diseases are also associated with the onset of seborrheic dermatitis. The currently accepted theory on the pathogenesis of this disease advocates that yeast of Malassezia spp., present on the skin surface of susceptible individuals, leads to a non-immunogenic irritation due to the production of unsaturated fatty acids deposited on the skin surface. This article provides a review of the literature on seborrheic dermatitis, focusing on immunogenetics, the clinical forms of the disease and its treatment.
Dermatitis; Dermatitis, seborrheic; Eczema
EDUCAÇÃO MÉDICA CONTINUADA
Dermatite seborreica* * Trabalho realizado no Serviço de Dermatologia da Universidade Federal do Rio de Janeiro (UFRJ) - Rio de Janeiro (RJ), Brasil.
Ana Luisa Sobral Bittencourt SampaioI; Ângela Cristina Akel MameriII; Thiago Jeunon de Sousa VargasIII; Marcia Ramos-e-SilvaIV; Amanda Pedreira NunesV; Sueli Coelho da Silva CarneiroVI
IMédica, mestranda do Programa de Pós-Graduação em Clínica Médica da Faculdade de Medicina da Universidade Federal do Rio de Janeiro (UFRJ) - Rio de Janeiro (RJ), Brasil
IIMestre (Dermatologia) pela Universidade Federal do Rio de Janeiro (UFRJ) - Chefe da Dermatologia da Clínica Medicina Especializada (MESP) - Vitória (ES), Brasil
IIIResearch fellowship pela Ackerman Academy of Dermatopatology - Médico, preceptor e chefe do Departamento de Dermatopatologia do Serviço de Dermatologia do Hospital Federal de Bonsucesso (HFB) - Rio de Janeiro (RJ), Brasil
IVDoutora em Medicina (Dermatologia) pela Universidade Federal do Rio de Janeiro (UFRJ) - Professora-associada e chefe do Serviço de Dermatologia do Hospital Universitário Clementino Fraga Filho - Universidade Federal do Rio de Janeiro (HUCFF - UFRJ) - Rio de Janeiro (RJ), Brasil
VAcadêmica da Faculdade de Medicina - Universidade Federal do Rio de Janeiro (UFRJ) - Rio de Janeiro (RJ), Brasil
VIDoutorado em Medicina (Dermatologia) pela Universidade Federal do Rio de Janeiro (UFRJ) - Professora-adjunta de Dermatologia da Faculdade de Ciências Médicas da Universidade do Estado do Rio de Janeiro (UERJ) - Docente-colaboradora e dermatologista do Hospital Universitário Clementino Fraga Filho - Universidade Federal do Rio de Janeiro (HUCFF - UFRJ) - Rio de Janeiro (RJ), Brasil
Endereço para correspondência Endereço para correspondência: Ana Luisa Sobral Bittencourt Sampaio Rua Almirante João Cândido Brasil, 72/102 -Tijuca 20511-020 Rio de Janeiro, RJ E-mail: analuisasbs@gmail.com
RESUMO
A dermatite seborreica é uma doença eritêmato-escamativa de caráter crônico-recidivante que acomete entre 1 e 3% da população geral dos Estados Unidos. Possui dois picos de incidência - o primeiro, durante os três primeiros meses de vida, e o segundo, a partir da puberdade, atingindo seu ápice entre os 40 e 60 anos de idade. Os indivíduos HIV positivos têm maior prevalência da doença, que apresenta maior intensidade e tendência à refratariedade ao tratamento. Doenças neurológicas e outras doenças crônicas também estão associadas ao desenvolvimento da dermatite seborreica. Como mecanismo fisiopatogênico, reconhece-se que o fungo Malassezia sp., presente na pele de indivíduos suscetíveis, leve a uma irritação não-imunogênica a partir da produção de metabólitos à base de ácidos graxos insaturados deixados na superfície cutânea. Este artigo faz uma revisão da literatura sobre dermatite seborreica, com ênfase nos aspectos imunogenéticos, formas clínicas e tratamento.
Palavras-chave: Dermatite; Dermatite seborreica; Eczema
INTRODUÇÃO, HISTÓRICO E EPIDEMIOLOGIA
A dermatite seborreica (DS) é uma doença inflamatória crônica comum, que acomete cerca de 1 a 3% da população geral dos EUA, sendo 3 a 5% em adultos jovens. A prevalência da DS nos indivíduos HIV positivos varia entre 20 e 83%.1 Possui dois picos de incidência: um no recém-nascido, até os três meses de vida, e outro na fase adulta, aproximadamente entre os 30 e 60 anos de idade.2 A apresentação bimodal da doença (ao nascimento e pós-puberal) sugere que ela esteja relacionada a hormônios sexuais. Os homens são acometidos com maior frequência em todas as faixas etárias e não há predileção racial.
Malassez foi a primeira pessoa a descrever elementos fúngicos leveduriformes em escamas do couro cabeludo, provavelmente representativas da doença que viria a ser conhecida como DS após a descrição original de Unna em 1887.3,4,5 Em 1952, Leone relacionou o Pityrosporum ovale (posteriormente designado Malassezia sp.) à pitiríase do couro cabeludo, ao eczema seborreico figurado e a várias outras dermatoses escamosas.6,7
Nos anos 50, o foco das pesquisas sobre DS foi investigar sua associação a deficiências vitamínicas, como as vitaminas B2, B6, B12 e a biotina.8-16 No entanto, até hoje não há comprovação da associação entre DS e deficiência nutricional.17 Sudan defendeu a teoria de que a nicotina atua como hapteno na fisiopatogenia da DS.18-22 Atualmente, trabalhos têm apontado para a importância do papel da Malassezia sp., presente na flora normal do homem, na gênese das lesões de DS em pacientes suscetíveis.17,23-25 Sua participação foi sugerida pelo fato de a doença responder ao tratamento com antifúngicos.17
Além da infecção pelo vírus HIV, algumas doenças neurológicas também cursam com maior incidência de DS, como a doença de Parkinson. Pacientes parkinsonianos em tratamento com levodopa apresentam melhora da DS.26-31 A maior incidência de DS no paciente com Parkinson parece estar relacionada ao aumento da secreção de hormônios sexuais masculinos e seus efeitos sobre as glândulas sebáceas e não a uma disfunção autonômica (disautonomia), como se pensava anteriormente.32 Foi também observada prevalência maior da DS no parkinsonismo induzido por neurolépticos, na craniosinostose, na polineuropatia amiloidótica familial, no traumatismo craniano, no trauma medular, nos acidentes vasculares encefálicos (AVE), na epilepsia e na paralisia do nervo facial.25,33-38 Já foi descrita ocorrência de DS apenas no lado plégico de pacientes com AVE, após descompressão de malformação de Chiari I, ou na área afetada pela siringomielia.38-40
Ercis et al., em 1996, relataram que 30,9% dos indivíduos com síndrome de Down apresentam DS, embora Daneshpazhooh et al. tenham mostrado prevalência de apenas 3%.41,42
Outras doenças sistêmicas cursam com maior incidência de DS, como o infarto agudo do miocárdio, pancreatite alcoólica e alcoolismo.43-47
ETIOPATOGENIA
Malassezia sp.
A Malassezia spp. é um fungo lipofílico constituinte da flora normal da pele do ser humano. Sua primeira descrição ocorreu em meados de 1840, por Eichsted e Sluyter, que a relacionaram à pitiríase versicolor. Em 1853, Robin a denominou Microsporum furfur e Malassez, em 1874, descreveu-a em escamas do couro cabeludo.3,48
O gênero Malassezia foi descrito por Baillon em 1889 e tem prioridade taxonômica sobre o gênero Pityrosporum, determinado por Sabouraud, em 1904, para o mesmo grupo de micro-organismos. A classificação atual inclui o gênero Malassezia na família Cryptococcaceae, da classe dos Blastomicetos.49
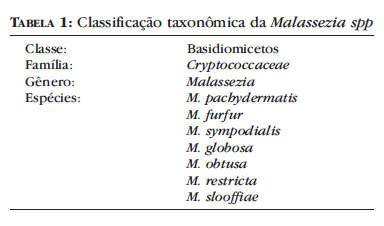
A Malassezia é um fungo dimórfico de grande pleomorfismo que, por ter sido inicialmente classificado a partir de critérios morfológicos, foi denominado Pityrosporum ovale (células ovais com gemulação de base larga) e orbiculare (células redondas com gemulação de base estreita). Mais tarde, concluiu-se que ambas as formas eram variantes morfológicas da mesma espécie. Atualmente, por meio de métodos sorológicos e genéticos, o gênero Malassezia é dividido em sete espécies: M. furfur, M. pachydermatis, M. sympodialis, M. globosa, M. obtusa, M. restricta e M. slooffiae (Tabela 1).49,50
Embora Unna tenha descrito a doença dermatite seborreica em 1887, foi Malassez, em 1874, quem primeiro observou o fungo nas escamas do couro cabeludo.3,4,5 Posteriormente, Moore e Kile relacionaram a Malassezia sp. diretamente à doença.48
A Malassezia sp. está relacionada tanto a doenças infecciosas, nas quais o micro-organismo é o agente etiológico direto, quanto a doenças inflamatórias de etiologia multifatorial, nas quais o crescimento exagerado da Malassezia sp. funciona como um fator desencadeante ou agravante em pacientes suscetíveis. No primeiro grupo, estão incluídas a pitiríase versicolor, a foliculite por Malassezia (ou foliculite pitirospórica), pneumonia por Malassezia sp., sepse associada a cateter venoso profundo de pacientes em nutrição parenteral total e peritonite em indivíduos submetidos à diálise peritoneal ambulatorial. No segundo, temos a DS como principal exemplo, acompanhada da dermatose confluente e reticulada de Gourgerot e Carteaud, da psoríase e da dermatite atópica.51-53
Cada uma destas doenças possui manifestações clínicas e histológicas diversas que não podem ser explicadas apenas pela presença de determinada espécie de Malassezia na pele, tendo como fatores contribuintes o perfil imunológico do indivíduo e a hereditariedade.54
Ainda não está perfeitamente definida a fisiopatologia exata da dermatite seborreica. Porém, hoje a regra é a associação da doença à presença do fungo Malassezia sp. na pele dos indivíduos acometidos. Sabe-se que este é encontrado na pele de todos os indivíduos, podendo ser encontrado em maior quantidade naqueles que apresentam DS.55-57 Entretanto, Bergbrant e Faergman, em 1989, não encontraram diferença na quantidade de Malassezia sp. quando compararam indivíduos portadores de DS com controles sadios, assim como pele lesional com pele sã.58 Estes achados sugerem que há outros mecanismos fisiopatogênicos relacionados à reação anormal à Malassezia sp. e não necessariamente relacionados à sua quantidade.
Em 1984, Bourlond et al. demonstraram que o P. ovale (diga-se Malassezia sp.) pode ser encontrado em qualquer superfície contendo escamas (DS, ceratose actínica, nevos e verrugas virais) e que a multiplicação de tal fungo nestes locais torna sua demonstração mais fácil.59
Diversos estudos foram conduzidos para se definir qual é a espécie de Malassezia mais prevalente na DS. Nakabayashi et al. relatam ter encontrado 35% de M. furfur e 22% de M. globosa nos indivíduos com DS.60,61 Rendic et al. encontraram M. globosa em 67% da amostra, seguida de M. furfur e M. sympodialis.62 Gupta e Gaitanis relataram maior quantidade de M. globosa.63,64 Tajima foi o único autor a relatar a M. restricta como a mais frequente.65
Nakabayashi e Sei observaram que as crianças com DS têm maior quantidade de Malassezia (M. furfur e M. globosa) do que as não-acometidas pela doença.66 Bergbrant considera que a quantidade de P. ovale (leia-se Malassezia sp.) na pele não é o fator determinante para a reação inflamatória, mas, sim, a quantidade de lipídios na superfície cutânea e a reação imune do indivíduo à presença do fungo. Ele ainda observou a relação da doença à hereditariedade, sazonalidade e estresse mental e com a redução da função das células T.58,67,68 Para corroborar as evidências de a Malassezia sp. contribuir para a inflamação cutânea na DS, Plotkin em 1996, e De Angelis, em 2007, descreveram a produção de uma lipase por este fungo, que é essencial para o seu crescimento in vitro e in vivo.69,70 A hipótese seria a de que o fungo se utiliza dos lipídios da superfície cutânea, produzindo ácidos graxos insaturados e saturados que, deixados no ambiente (superfície cutânea do indivíduo), induzem resposta inflamatória.71,72
O sebo da pele permitiria o crescimento do P. ovale (leia-se Malassezia) e, assim, o desenvolvimento da DS; portanto, a manutenção de reservatórios de sebo residual (como a higiene inadequada) poderia predispor ao surgimento da doença, como ocorre nos pacientes neuropatas.73
Uma evidência concreta da relação da Malassezia com a DS é a resposta ao tratamento com antifúngicos.72,74,75
Em 2007, Dawson defendeu que o desenvolvimento da DS depende de três fatores: produção de sebo, metabolismo da Malassezia e suscetibilidade do indivíduo.76
HISTOPATOLOGIA
A histopatologia da DS depende do estágio clínico em que se encontra. Desta forma, nas fases aguda e subaguda nota-se um infiltrado inflamatório composto principalmente por linfócitos e histiócitos, associado à espongiose e hiperplasia psoriasiforme leves a moderadas, associadas à paraceratose ao redor dos óstios foliculares (paraceratose "em ombro") (Figuras 1 e 2). Já durante a fase crônica, além dos achados acima, há marcada hiperplasia psoriasiforme, com dilatação dos capilares e vênulas do plexo superficial, o que determina bastante semelhança com a psoríase.77 Os achados histopatológicos da psoríase vulgar são semelhantes, exceto pela espongiose.78
IMUNOGENÉTICA
Faergemann descreveu que há aumento no número de células T natural killer (NK), além de baixos títulos de anticorpos da classe IgG nos pacientes com DS em relação aos controles. Há queda da ativação linfocitária dos indivíduos com DS, quando em contato com a Malassezia sp., redução da produção de IL-2 e IFN-γ e aumento da produção de IL-10.79 Em estudo subsequente, o mesmo autor demonstrou maior quantidade de células NK1+ e CD16+ associadas à ativação do complemento nas lesões de DS, quando comparadas à pele não-acometida dos mesmos pacientes ou à pele de indivíduos sem DS, o que sugere a presença de intensa resposta imune irritativa não-alérgica.80
Parry e Shape, em 1988, não observaram anticorpos circulantes contra o fungo nem sensibilização sistêmica, levando à conclusão de que não é a alteração na resposta humoral à Malassezia sp. e, sim, uma alteração narespsta imune celular.81,82 Neuber et al. também verificaram que na DS há alteração da imunidade celular.83
Watanabe et al. demonstraram que a M. furfur não leva à produção de citocinas pelos queratinócitos, enquanto as outras espécies de Malassezia o fazem. Além disso, relataram que, dependendo da espécie de Malassezia, há estímulo à produção de determinado perfil de interleucinas inflamatórias e, assim, caracterização de uma doença distinta. Por exemplo, quando há produção de IL-8, há atração de neutrófilos e, clinicamente, a foliculite por Malassezia; da mesma forma, a não-produção de MCP-1, um quimiotático para monócitos, determina clinicamente a DS.84
Não foi encontrado aumento da produção de anticorpos (IgM e IgG) anti-Malassezia nos pacientes com DS; este foi observado significativamente nos pacientes com dermatite atópica. Este fato sugere que não há resposta imune humoral anti-Malassezia sp. na DS.79,82,85
Passi et al. encontraram níveis séricos reduzidos de vitamina E, de ácidos graxos poli-insaturadoseda atividade da glutationa peroxidase eritrocítica nos pacientes com DS (tanto nos HIV positivos quanto nos negativos), e sugeriram a relação destes achados à patogenia da doença.86
Ianosi, em 2007, descreveu o infiltrado inflamatório da DS: pobre em CD20+ e rico em CD45Ro.87
SISTEMA HLA
Mesmo havendo evidências de que a hereditariedade seja fator de predisposição para a DS, a única descrição de tipagem do HLA nos pacientes com dermatite seborreica ocorreu em 1976 por Tsuji. Ele tipificou o HLA de pacientes com psoríase vulgar, pustulose palmoplantar, dermatite seborreica e indivíduos sadios. Encontrou aumento das frequências de HLA-Al e HLA-BW37 nos pacientes com psoríase vulgar; e de HLA-AW30 e/ou AW31 e HLA-B12 na dermatite seborreica.88 O grupo de pesquisa representado pelos autores está conduzindo estudos a fim de elucidar o papel da imunogenética na DS.
DIAGNÓSTICO CLÍNICO
A DS possui características distintas, dependendo da faixa etária acometida: na forma pediátrica é autolimitada, enquanto no adulto, a doença tem curso crônico.89 As lesões são placas eritematosas e escamativas, de graus variáveis de extensão e intensidade.
A DS na infância ocorre com maior prevalência nos três primeiros meses de vida (10% em meninos e 9,5% em meninas), sendo a escamação do couro cabeludo a forma clínica mais comum (42%).90 Caracterizase, logo após o nascimento, pelo surgimento de escamas amareladas, aderentes e de extensão variável. Pode também ocorrer na face e nas dobras, tais como regiões retroauriculares, pescoço, axilas e região inguinal. A criança com DS pode apresentar uma forma rara, generalizada que, frequentemente, é associada a imunodeficiências.17
A DS do adulto é uma dermatose crônica, de curso recidivante, que varia desde um eritema leve a moderado até lesões papulosas, exsudativas e/ou escamativas, com períodos de exacerbação relacionados ao estresse ou privação de sono.17,91
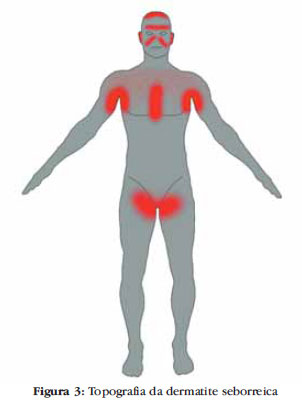
As áreas afetadas e a prevalência correspondente de cada uma são: face (87,7%), couro cabeludo (70,3%), tórax (26,8%), membros inferiores (2,3%), membros superiores (1,3%) e outros locais (5,4%), como as dobras (Figura 3).92 As lesões são máculas ou finas placas de limites bem definidos, que podem assumir as colorações rosa, amarela clara ou eritematosa, com escamas finas, brancas e secas ou até amareladas úmidas ou oleosas. Podem ser limitadas a pequenas áreas do corpo, porém, há relatos de formas generalizadas e até mesmo de eritrodermia.93-96 A presença de prurido é variável. As lesões podem ter como complicação principal a infecção bacteriana secundária, causando piora do eritema e do exsudato, desconforto local e linfonodomegalias reacionais próximas às áreas acometidas.
As lesões têm predileção pelas áreas de elevada produção de sebo, como o couro cabeludo, face, pavilhões auriculares, regiões retroauricular e pré-esternal, pálpebras e dobras (Figuras 4-10).
As lesões do couro cabeludo variam desde uma leve escamação (pityriasis simplex capillitii) até crostas melicéricas bem aderidas ao couro cabeludo e aos fios, podendo ou não causar áreas de alopecia (pseudo tinea amiantacea). Na face, é característico o envolvimento das regiões glabelar e malar, dos sulcos nasolabiais e das sobrancelhas. O acometimento das pálpebras leva à blefarite. A área da barba em homens também pode ter lesões de DS. Nas dobras (axilas, umbigo, regiões ingunal, inframamária e anogenital), as lesões adquirem aparência úmida, macerada, com eritema na base e ao redor. Pode evoluir com fissuras e infecção secundária. Na região pré-esternal, podem ser mais eritematosas e de escama, com conformação arciforme (psoriasiforme) - na borda da lesão - ou petaloide - escama sobre a lesão.
DIAGNÓSTICO DIFERENCIAL
A DS pode ter, como diagnósticos diferenciais, a psoríase, a dermatite atópica (principalmente a forma pediátrica da DS), a tinea capitis, o linfoma cutâneo e a histiocitose de células de Langerhans.17 Também existe um tipo de dermatite similar à DS que pode ser induzida por drogas (ouro, buspirona, clorpromazina, etionamida, griseofulvina, haloperidol, IL2, interferon-α, lítio, methoxalen, metildopa, fenotiazinas, psoralenos, estanozolol, dentre outros) ou por deficiência nutricional (riboflavina, piridoxina, niacina e zinco).97,98
A forma da infância da DS é semelhante à dermatite atópica (DA), porém, os locais de acometimento (dobras na DS e superfícies extensoras na DA) e a ausência de prurido na DS as diferenciam. A dermatite de contato pela fralda poupa as dobras, enquanto a DS predomina nestas. Já a psoríase na infância é muito semelhante à DS nesta faixa etária, sendo quase impossível sua separação.
Existe uma discussão sobre a diferença entre a DS do couro cabeludo e uma entidade chamada pityriasis simplex capillitii, escamação leve e seca do couro cabeludo, que pode ser apenas a escamação fisiológica da camada córnea ou por uso de cosméticos em excesso, como cremes ou géis de cabelo. Também há a difícil distinção entre a DS e a psoríase do couro cabeludo. As lesões de psoríase são placas mais bem delimitadas e espessas, com escamas brancas secas.89
Na face, as lesões de DS são parecidas com as de lúpus eritematoso cutâneo agudo (erupção malar bilateral) e com a rosácea. Nas áreas de dobras, devem ser diferenciadas dos eczemas de contato por irritante primário, da psoríase invertida, das dermatofitoses e do eritrasma. A histiocitose de células de Langerhans pode acometer as dobras e o couro cabeludo com grande semelhança clínica com a DS, mas a presença de um componente purpúrico nas lesões favorece o diagnóstico da primeira.89
DERMATITE SEBORREICA E HIV
Eisenstat descreveu, pela primeira vez, em 1984, a relação da DS com a AIDS. A prevalência da DS nos indivíduos HIV positivos varia de acordo com diferentes autores: para Soeprono et al., 85% dos indivíduos com AIDS têm DS; Berger observou-a em 36%99; Goodman et al. em 32% e Blanes et al. em 31% dos pacientes.92-102
A Malassezia sp. também está envolvida no desenvolvimento da doença. Não foi verificado aumento na quantidade de P. ovale (leia-se Malassezia sp.) na superfície cutânea, quando comparados indivíduos com ou sem AIDS, porém, parece que mais importante do que a quantidade de fungos na superfície cutânea é o subtipo específico existente.103,104 Rincón e colaboradores observaram o predomínio da Malassezia globosa em indivíduos com pitiríase versicolor (67%) e nos HIV positivos com DS (85%), enquanto nos indivíduos com DS HIV negativos, as espécies de Malassezia que predominaram foram a M. furfur e a M. restricta, isoladas em 72% e 26%, respectivamente.105
Vidal et al. descreveram que o perfil lipídico da pele dos indivíduos com AIDS é diferente daqueles sem AIDS, porém, não determinaram sua relação com o desenvolvimento da DS.106 Passi S. et al. (1991) relatam que a concentração total de lipídios na superfície cutânea de indivíduos HIV positivos e HIV negativos com dermatite seborreica é semelhante. Porém, descrevem que há alterações significativas nas frações dos lipídios nos pacientes HIV positivos, como uma redução do esqualeno e um aumento do colesterol e de ésteres do colesterol.107
A DS costuma ocorrer em indivíduos HIV positivos com contagem de linfócitos T CD4+ entre 200 e 500, sendo considerada uma manifestação cutânea precoce na AIDS.108 A resposta ao tratamento antirretroviral é variável, havendo relatos conflitantes na literatura: alguns autores observam melhora da DS com o início do tratamento antirretroviral, enquanto outros relatam piora.109,110 Há, ainda, relatos de piora durante a síndrome de reconstituição imune111 ou relatos de que o tratamento antirretroviral não altera a prevalência nem o curso da DS.111,112
Quanto à histopatologia, os achados da DS nos HIV positivos são semelhantes aos encontrados nos HIV negativos, porém, suas lesões tendem a apresentar maior acometimento folicular e mais plasmócitos em meio ao infiltrado inflamatório.17,78,101
A clínica da DS é típica, acometendo áreas ricas em glândulas sebáceas, acompanhadas ou não de prurido. Crianças com AIDS também apresentam DS.113 Entretanto, caso a doença apareça pela primeira vez ou tenha uma exacerbação em um indivíduo HIV positivo que antes possuía uma forma leve, isso pode indicar soroconversão do estado latente para o sintomático.104 A DS também pode apresentar-se mais extensa, com maior intensidade e refratária ao tratamento convencional. Nestes casos, há benefício com o uso dos antifúngicos orais ou com associação de drogas, como antifúngicos e corticosteroides de baixa potência tópicos.114 Também há relatos de melhora clínica com o uso de antirretrovirais.109,115
TRATAMENTO
Por se tratar de uma doença inflamatória crônica, em resposta a uma provável presença de um fungo (Malassezia sp.) na pele e do seu metabolismo através da utilização dos lipídios da pele, o objetivo do tratamento consiste no controle da inflamação, da proliferação do micro-organismo e da oleosidade. Diversas classes de medicamentos são utilizadas, de maneira que é vasto o arsenal terapêutico para controle da DS. A primeira regra é esclarecer os pacientes sobre o caráter crônico recidivante da doença. Assim, o indivíduo, ciente do curso da doença, demonstra maior confiança e aderência ao tratamento. 116
Os medicamentos mais utilizados, segundo levantamento realizado por Peyrí et al., são os corticosteroides (59,9 %) e os antifúngicos derivados imidazólicos (35,1 %). Foram também citados os cremes hidratantes em 30,7%, os inibidores tópicos da calcineurina (27,2 %) e, em 5,1%, outros tratamentos farmacológicos, como anti-histamínicos sistêmicos e diversas terapias naturais. 92
A seguir, são citados os medicamentos para tratamento da DS separados de acordo com as modalidades terapêuticas:
sabonetes: os sabonetes disponíveis são os de cetoconazol a 2% e de enxofre, com ou sem ácido salicílico. Os sabonetes à base de óleo de melaleuca (tea tree oil) têm se mostrado eficazes contra a DS devido ao seu potencial antifúngico.117 Estes também existem sob a forma de xampus.
xampus: os xampus usados para o controle da DS são classificados de acordo com seu efeito.
Os antiproliferativos: à base de coaltar e seus derivados - são antimitóticos e citostáticos, causando reduç ão da divisão celular na epiderme, que é a causa da formação das escamas. Outros exemplos são os de sulfeto de selênio (1 e 2,5%) e de piritionato de zinco (1 e 2%). Os antifúngicos são aqueles à base de cetoconazol a 2%, ciclopirox a 1%, e também o sulfeto de selênio e piritionato de zinco. Os ceratolíticos: à base de ácido salicílico (2 a 6%) com ou sem enxofre (2 a 5%) - provocam remoção das escamas aderentes; antiinflamatórios: com corticosteroides (propionato de clobetasol) - têm efeitos semelhantes aos usados como soluções capilares.118 A combinação de várias classes de medicamentos em um mesmo produto ou a terapia rotacional são as opções que produzem maior eficácia e menor recidiva.
Medicações tópicas:
 antifúngicos tópicos: o cetoconazol, bem como outros derivados imidazólicos, e antifúngicos de outras classes farmacológicas, como o ciclopirox todos podendo ser usados sob a forma de loções, cremes ou pomadas, sempre que houver recidiva da DS. Embora seja alvo de discussão o efeito antiandrogênico destes medicamentos, a dose necessária para que este efeito ocorra é bastante alta (equivalente a 600 a 800mg/dia de cetoconazol oral), sendo improvável que esta dose seja alcançada com o tratamento tópico.119 Por outro lado, existem indícios de que alguns antifúngicos têm efeitos anti-inflamatórios comparáveis ao efeito da hidrocortisona.120 Por exemplo, foi demonstrado in vitro que a ciclopirox olamina inibe a ação da 5-lipoxigenase e da cicloxigenase.121
antifúngicos tópicos: o cetoconazol, bem como outros derivados imidazólicos, e antifúngicos de outras classes farmacológicas, como o ciclopirox todos podendo ser usados sob a forma de loções, cremes ou pomadas, sempre que houver recidiva da DS. Embora seja alvo de discussão o efeito antiandrogênico destes medicamentos, a dose necessária para que este efeito ocorra é bastante alta (equivalente a 600 a 800mg/dia de cetoconazol oral), sendo improvável que esta dose seja alcançada com o tratamento tópico.119 Por outro lado, existem indícios de que alguns antifúngicos têm efeitos anti-inflamatórios comparáveis ao efeito da hidrocortisona.120 Por exemplo, foi demonstrado in vitro que a ciclopirox olamina inibe a ação da 5-lipoxigenase e da cicloxigenase.121
 corticosteroides tópicos: podem ser usados sob a forma de loções, soluções capilares, espumas e xampus. Provocam melhora rápida dos sintomas - eritema, escamação e prurido - porém, as recidivas são frequentes. Devem ser utilizados durante o menor tempo possível em virtudes dos efeitos colaterais que ocorrem com o uso prolongado.
corticosteroides tópicos: podem ser usados sob a forma de loções, soluções capilares, espumas e xampus. Provocam melhora rápida dos sintomas - eritema, escamação e prurido - porém, as recidivas são frequentes. Devem ser utilizados durante o menor tempo possível em virtudes dos efeitos colaterais que ocorrem com o uso prolongado.
 anti-inflamatórios inibidores da calcineurina tacrolimus (0,03 e 0,1%) e pimecrolimus (1%). Uma alternativa aos corticosteroides tópicos, tanto o tacrolimus quanto o pimecrolimus possuem efeito antiinflamatório na DS igual ou superior aos corticosteroides tópicos de baixa potência, sem os efeitos colaterais que estes apresentam. Podem ser usados uma ou duas vezes por dia.122-124 São bem tolerados e podem ser usados nas formas de DS resistentes da face.125,126 Também induzem à remissão mais prolongada que os corticosteroides tópicos.127
anti-inflamatórios inibidores da calcineurina tacrolimus (0,03 e 0,1%) e pimecrolimus (1%). Uma alternativa aos corticosteroides tópicos, tanto o tacrolimus quanto o pimecrolimus possuem efeito antiinflamatório na DS igual ou superior aos corticosteroides tópicos de baixa potência, sem os efeitos colaterais que estes apresentam. Podem ser usados uma ou duas vezes por dia.122-124 São bem tolerados e podem ser usados nas formas de DS resistentes da face.125,126 Também induzem à remissão mais prolongada que os corticosteroides tópicos.127
 outras opções terapêuticas citadas na literatura são: metronidazol 1% gel,128 comumente usado no tratamento da rosácea; o tacalcitol (1a-24 (R)-dihydroxycholecalciferol D3) creme duas vezes ao dia - medicamento para tratamento da psoríase; succinato de lítio tópico - atua como anti-inflamatório; peróxido de benzoíla - bactericida, usado para tratamento da acne inflamatória.128-131
outras opções terapêuticas citadas na literatura são: metronidazol 1% gel,128 comumente usado no tratamento da rosácea; o tacalcitol (1a-24 (R)-dihydroxycholecalciferol D3) creme duas vezes ao dia - medicamento para tratamento da psoríase; succinato de lítio tópico - atua como anti-inflamatório; peróxido de benzoíla - bactericida, usado para tratamento da acne inflamatória.128-131
Medicamentos administrados por via oral também podem ser usados, principalmente em caso de DS extensa e refratária a medicações tópicas. Os antifúngicos usados e suas respectivas doses são:132
cetoconazol 200mg/dia por 14dias
itraconazol 100mg/dia por 21 dias
terbinafina 250mg/dia por 4 semanas
Há alguns anos, foi defendido o uso da isotretinoína oral como regulador da seborreia e, por isso, sugeriu-se o seu uso no controle da DS. O estudo feito usou doses muito baixas da medicação (2,5mg, três vezes por semana a até 5mg/dia) com boa eficácia.133 Recentemente, foi publicado um caso de hiperplasia sebácea com boa resposta à isotretinoína.134 Cada vez menos têm sido publicados estudos científicos sobre o uso da isotretinoína para a dermatite seborreica, tendo o último ocorrido em 2003.133 Além disso, houve relato de surgimento de erupção na face, semelhante à DS, em indivíduos em uso desta medicação durante tratamento de acne.135
Recebido em 18.11.2010.
Aprovado pelo Conselho Editorial e aceito para publicação em 24.03.2011.
Conflito de interesse: Nenhum
Suporte financeiro: Nenhum
QUESTÕES
Sobre a clínica da dermatite seborreica:
Gupta e Gaitanis relataram maior quantidade de M. globosa
Tajima também encontrou maior quantidade de M. globosa
- 1. Schechtman RC, Midgley G, Hay RJ. HIV disease and Malassezia yeasts: a quantitative study of patients presenting with seborrhoeic dermatitis. Br J Dermatol. 1995;133:694-8.
- 2. Gupta AK, Madzia SE, Batra R. Etiology and management of Seborrheic dermatitis. Dermatology. 2004;208:89-93.
- 3. Inamadar AC PA. The genus Malassezia and human disease. Indian J Dermatol Venereol Leprol. 2003;69:265-70.
- 4. Moore M. Dermatite seborreica: cultivo do organismo caudador da dermatite produzida experimentalmente. An Bras Dermatol. 1936;11:7-10.
- 5. Unna P. Das seborrhoische Ekzem. Monatsschr Prakt Dermatol. 1897;6:827-46.
- 6. Leone R. [Presence and significance of Pityrosporon ovale in pityriasis of the scalp, in figured seborrheic eczema and in various squamous dermatoses. Note III. Cultural, biological and biochemical properties of Pityrosporon ovale, with special reference to the affinity for lipidic substances.]. Minerva Dermatol. 1952;27:123-7.
- 7. Leone R. [Presence and significance of Pityrosporon ovale in pityriasis of the scalp, in figured seborrheic eczema and in various squamous dermatoses. Note I. Quantitative research on the presence of Pityrosporon ovale in pityriasis of the scalp, in figured seborrheic eczema and in various squamous dermatoses.]. Minerva Dermatol. 1952;27:93-9.
- 8. Palacky AF, Strycek R. [Modifications in blood proteins in erythroderma and seborrhoeic dermatitis and their relation to biotin deficiency]. Pediatr Listy.1950;5:270-3.
- 9. Gougerot H, Grupper C, Plas G. [Cutaneous-mucosal ariboflavinosis; rosacea of cornea and medio-facial seborrheic dermatitis.]. Bull Soc Fr Dermatol Syphiligr. 1950;57:277-80.
- 10. Andrews GC, Post CF, Domonkos AN. Seborrheic dermatitis; supplemental treatment with vitamin B12. N Y State J Med. 1950;50:1921-5.
- 11. Kiessling W. [Clinical results with internal and intramuscular administration of biotin]. Dermatol Wochenschr. 1951;124:1246-9.
- 12. Treger J, Moys A, Muzikova M. [Effect of intracutaneous biotin in eczema seborrhoeicum]. Bratisl Lek Listy. 1951;31:562-8.
- 13. Avcin M. [Dermatitis seborrheica and biotin deficiency in infants]. Zdrav Vestn.1952;21:15-21.
- 14. Schreiner AW, Rockwell E, Vilter RW. A local defect in the metabolism of pyridoxine in the skin of person with seborrheic dermatitis of the "sicca" type. J Invest Dermatol. 1952;19:95-6.
- 15. Nisenson A. Seborrheic dermatitis of infants and Leiners's disease: a biotin deficiency. J Pediatr. 1957;51:537-48.
- 16. Nisenson A, Barness LA. Treatment of seborrheic dermatitis with biotin and vitamin B complex. J Pediatr. 1972;81:630-1.
- 17. Schwartz RA, Janusz CA, Janniger CK. Seborrheic dermatitis: an overview. Am Fam Physician. 2006;74:125-30.
- 18. Sudan BJ. Nicotine skin patch treatment and adverse reactions: skin irritation, skin sensitization, and nicotine as a hapten. J Clin Psychopharmacol. 1995;15:145-6.
- 19. Sudan BJ. Abrogation of facial seborrhoeic dermatitis with homoeopathic high dilutions of tobacco: a new visible model for Benveniste's theory of 'Memory of water'. Med Hypotheses. 1993;41:440-4.
- 20. Sudan BJ. Ketoconazole, leukotrienes, Paf-acether and nicotine as a hapten: the possible aetiology of seborrhoeic dermatitis. Med Hypotheses. 1987;23:33-8.
- 21. Sudan BJ. Seborrhoeic dermatitis induced by nicotine of horsetails (Equisetum arvense L.). Contact Dermatitis. 1985;13:201-2.
- 22. Sudan BJ, Brouillard C, Sterboul J, Sainte-Laudy J. Nicotine as a hapten in seborrhoeic dermatitis. Contact Dermatitis. 1984;11:196-7.
- 23. Stone OJ. Seborrheic dermatitis--hyperreactive inflammation to saprophytes. Dermatol Int. 1968;7:14-6.
- 24. Mastrolonardo M, Diaferio A, Logroscino G. Seborrheic dermatitis, increased sebum excretion, and Parkinson's disease: a survey of (im)possible links. Med Hypotheses. 2003;60:907-11.
- 25. Pierard GE. Seborrheic dermatitis today, gone tomorrow? The link between the biocene and treatment. Dermatology. 2003;206:187-8.
- 26. Parish LC. L-dopa for seborrheic dermatitis. N Engl J Med. 1970;283:879.
- 27. Appenzeller O, Harville D. Effect of L-dopa on seborrhea of Parkinsonism. Lancet. 1970;2:311-2.
- 28. Burton JL, Shuster S. Effect of L-dopa on seborrhoea of Parkinsonism. Lancet. 1970;2:311.
- 29. Burton JL, Shuster S. Effect of L-dopa on seborrhoea of parkinsonism. Lancet. 1970;2:19-20.
- 30. Potter J, Wyburn-Mason R. Effect of L-dopa on seborrhoea of parkinsonism. Lancet. 1970;2:660.
- 31. Wyburn-Mason R. Effect of L-dopa on seborrhoea of parkinsonism. Lancet. 1970;2:154.
- 32. Martignoni E, Godi L, Pacchetti C, Berardesca E, Vignoli GP, Albani G, et al. Is seborrhea a sign of autonomic impairment in Parkinson's disease? J Neural Transm. 1997;104:1295-304.
- 33. Binder RL, Jonelis FJ. Seborrheic dermatitis in neuroleptic-induced parkinsonism. Arch Dermatol. 1983;119:473-5.
- 34. Binder RL, Jonelis FJ. Seborrheic dermatitis: a newly reported side effect of neuroleptics. J Clin Psychiatry. 1984;45:125-6.
- 35. Moris G, Ribacoba R, Solar DN, Vidal JA. SUNCT syndrome and seborrheic dermatitis associated with craneosynostosis. Cephalalgia. 2001;21:157-9.
- 36. Rocha N, Velho G, Horta M, Martins A, Massa A. Cutaneous manifestations of familial amyloidotic polyneuropathy. J Eur Acad Dermatol Venereol. 2005;19:605-7.
- 37. Rubin-Asher D, Zeilig G, Klieger M, Adunsky A, Weingarden H. Dermatological findings following acute traumatic spinal cord injury. Spinal Cord. 2005;43:175-8.
- 38. Tronnier H. [On an unilaterally localized seborrhoic eczema in syringomyelia.]. Z Haut Geschlechtskr. 1964;37:207-17.
- 39. Bettley FR, Marten RH. Unilateral seborrheic dermatitis following a nerve lesion. AMA Arch Derm. 1956;73:110-5.
- 40. Chen TM, Fitzpatrick JE. Unilateral seborrheic dermatitis after decompression of Chiari I malformation and syringomyelia J Am Acad Dermatol. 2006;55:356-7.
- 41. Ercis M, Balci S, Atakan N. Dermatological manifestations of 71 Down syndrome children admitted to a clinical genetics unit. Clin Genet. 1996;50:317-20.
- 42. Daneshpazhooh M, Nazemi TM, Bigdeloo L, Yoosefi M. Mucocutaneous findings in 100 children with Down syndrome. Pediatr Dermatol. 2007;24:317-20.
- 43. Tager A, Berlin C, Schen RJ. Seborrhoeic Dermatitis in Acute Cardiac Disease. Br J Dermatol. 1964;76:367-9.
- 44. Barba A, Piubello W, Vantini I, Caliari S, Cocchetto R, Vallaperta P, et al. Skin lesions in chronic alcoholic pancreatitis. Dermatologica. 1982;164:322-6.
- 45. Rao GS. Cutaneous changes in chronic alcoholics. Indian J Dermatol Venereol Leprol. 2004;70:79-81.
- 46. Naegeli B. [A case from practice (218). Alcoholic sensorimotor polyneuropathy and myopathy in chronic alcoholism. Seborrheic dermatitis]. Schweiz Rundsch Med Prax. 1991;80:650-2.
- 47. Parish LC, Fine E. Alcoholism and skin disease. Int J Dermatol. 1985;24:300-1.
- 48. Moore M, Kile RL. Pityrosporum ovalis as a causative agent of seborrheic dermatitis. Science. 1935;81:277-8.
- 49. Aspiroz MC, Moreno LA, Rubio MC. [Taxonomy of Malassezia furfur: state of the art]. Rev Iberoam Micol. 1997;14:147-9.
- 50. Guého E MG, Guillot J. The genus Malassezia with description of four new species. Antonie Van Leeuwenhoek. 1996;69:337-55.
- 51. Goodfield MJ, Saihan EM, Crowley J. Experimental folliculitis with Pityrosporum orbiculare: the influence of host response. Acta Derm Venereol. 1987;67:445-7.
- 52. Faergemann J. Pityrosporum infections. J Am Acad Dermatol. 1994;31:S18-20.
- 53. Faergemann J. Pityrosporum ovale and skin diseases. Keio J Med. 1993;42:91-4.
- 54. Terui T, Kudo K, Tagami H. [Cutaneous immune and inflammatory reactions to Malassezia furfur]. Nihon Ishinkin Gakkai Zasshi. 1999;40:63-7.
- 55. Faergemann J, Fredriksson T. Tinea versicolor with regard to seborrheic dermatitis. An epidemiological investigation. Arch Dermatol. 1979;115:966-8.
- 56. McGinley KJ, Leyden JJ, Marples RR, Kligman AM. Quantitative microbiology of the scalp in non-dandruff, dandruff, and seborrheic dermatitis. J Invest Dermatol. 1975;64:401-5.
- 57. Faergemann J. Tinea versicolor and Pityrosporum orbiculare: mycological investigations, experimental infections and epidemiological surveys. Acta Derm Venereol Suppl (Stockh). 1979:1-23.
- 58. Bergbrant IM, Faergemann J. Seborrhoeic dermatitis and Pityrosporum ovale: a cultural and immunological study. Acta Derm Venereol. 1989;69:332-5.
- 59. Bourlond A, Votion V, Armijo F, Minne G. [Pityrosporum ovale in keratotic lesions of seborrheic areas]. Ann Dermatol Venereol. 1984;111:1081-5.
- 60. Nakabayashi A, Sei Y, Guillot J. Identification of Malassezia species isolated from patients with seborrhoeic dermatitis, atopic dermatitis, pityriasis versicolor and normal subjects. Med Mycol. 2000;38:337-41.
- 61. Nakabayashi A. [Identification of causative species in malassezia-associated dermatoses]. Nihon Ishinkin Gakkai Zasshi. 2002;43:65-8.
- 62. Rendic E, Diaz C, Fich F. [Characterization of species of the gender Malassezia in patients with seborrheic dermatitis and subjects without skin lesions]. Rev Med Chil. 2003;131:1295-300.
- 63. Gupta AK, Kohli Y, Summerbell RC, Faergemann J. Quantitative culture of Malassezia species from different body sites of individuals with or without dermatoses. Med Mycol. 2001;39:243-51.
- 64. Gaitanis G, Velegraki A, Alexopoulos EC, Chasapi V, Tsigonia A, Katsambas A. Distribution of Malassezia species in pityriasis versicolor and seborrhoeic dermatitis in Greece. Typing of the major pityriasis versicolor isolate M. globosa. Br J Dermatol. 2006;154:854-9.
- 65. Tajima M, Sugita T, Nishikawa A, Tsuboi R. Molecular analysis of Malassezia microflora in seborrheic dermatitis patients: comparison with other diseases and healthy subjects. J Invest Dermatol. 2008;128:345-51.
- 66. Nakabayashi A, Sei Y. [Relationship between Malassezia Yeast and Infantile Seborrhoeic Dermatitis]. Nihon Ishinkin Gakkai Zasshi. 2001;42:218-20.
- 67. Bergbrant IM. Seborrhoeic dermatitis and Pityrosporum ovale: cultural, immunological and clinical studies. Acta Derm Venereol Suppl (Stockh). 1991;167:1-36.
- 68. Bergbrant IM, Faergemann J. The role of Pityrosporum ovale in seborrheic dermatitis. Semin Dermatol. 1990;9:262-8.
- 69. Plotkin LI, Squiquera L, Mathov I, Galimberti R, Leoni J. Characterization of the lipase activity of Malassezia furfur. J Med Vet Mycol. 1996;34:43-8.
- 70. DeAngelis YM, Saunders CW, Johnstone KR, Reeder NL, Coleman CG, Kaczvinsky JR Jr, et al. Isolation and expression of a Malassezia globosa lipase gene, LIP1. J Invest Dermatol. 2007;127:2138-46.
- 71. Ro BI, Dawson TL. The role of sebaceous gland activity and scalp microfloral metabolism in the etiology of seborrheic dermatitis and dandruff. J Investig Dermatol Symp Proc. 2005;10:194-7.
- 72. Bergbrant IM. Seborrhoeic dermatitis and Pityrosporum yeasts. Curr Top Med Mycol. 1995;6:95-112.
- 73. Cowley NC, Farr PM, Shuster S. The permissive effect of sebum in seborrhoeic dermatitis: an explanation of the rash in neurological disorders. Br J Dermatol. 1990;122:71-6.
- 74. Wishner AJ, Teplitz ED, Goodman DS. Pityrosporum, ketoconazole, and seborrheic dermatitis. J Am Acad Dermatol. 1987;17:140-1.
- 75. Hay RJ, Graham-Brown RA. Dandruff and seborrhoeic dermatitis: causes and management. Clin Exp Dermatol. 1997;22:3-6.
- 76. Dawson TL Jr. Malassezia globosa and restricta: breakthrough understanding of the etiology and treatment of dandruff and seborrheic dermatitis through whole-genome analysis. J Investig Dermatol Symp Proc. 2007;12:15-9.
- 77. Braun-Falco O, Heilgemeir GP, Lincke-Plewig H. [Histological differential diagnosis of psoriasis vulgaris and seborrheic eczema of the scalp]. Hautarzt. 1979;30:478-83.
- 78. Houck G, Saeed S, Stevens GL, Morgan MB. Eczema and the spongiotic dermatoses: a histologic and pathogenic update. Semin Cutan Med Surg. 2004;23:39-45.
- 79. Faergemann J. Pityrosporum yeasts--what's new? Mycoses. 1997;40 Suppl 1:29-32.
- 80. Faergemann J, Bergbrant IM, Dohse M, Scott A, Westgate G. Seborrhoeic dermatitis and Pityrosporum (Malassezia) folliculitis: characterization of inflammatory cells and mediators in the skin by immunohistochemistry. Br J Dermatol. 2001;144:549-56.
- 81. Parry ME, Sharpe GR. Seborrhoeic dermatitis is not caused by an altered immune response to Malassezia yeast. Br J Dermatol. 1998;139:254-63.
- 82. Ashbee HR, Fruin A, Holland KT, Cunliffe WJ, Ingham E. Humoral immunity to Malassezia furfur serovars A, B and C in patients with pityriasis versicolor, seborrheic dermatitis and controls. Exp Dermatol. 1994;3:227-33.
- 83. Neuber K, Kroger S, Gruseck E, Abeck D, Ring J. Effects of Pityrosporum ovale on proliferation, immunoglobulin (IgA, G, M) synthesis and cytokine (IL-2, IL-10, IFN gamma) production of peripheral blood mononuclear cells from patients with seborrhoeic dermatitis. Arch Dermatol Res.1996;288:532-6.
- 84. Watanabe S, Kano R, Sato H, Nakamura Y, Hasegawa A. The effects of Malassezia yeasts on cytokine production by human keratinocytes. J Invest Dermatol. 2001;116:769-73.
- 85. Ashbee HR, Ingham E, Holland KT, Cunliffe WJ. Cell-mediated immune responses to Malassezia furfur serovars A, B and C in patients with pityriasis versicolor, seborrheic dermatitis and controls. Exp Dermatol. 1994;3:106-12.
- 86. Passi S, Morrone A, De Luca C, Picardo M, Ippolito F. Blood levels of vitamin E, polyunsaturated fatty acids of phospholipids, lipoperoxides and glutathione peroxidase in patients affected with seborrheic dermatitis. J Dermatol Sci. 1991;2:171-8.
- 87. Ianosi S, Stoicescu I, Ianosi G, Neagoe D, Georgescu CV. The study of CD20 and CD45.Ro antibodies in the inflammatory infiltrate involved in acne and seborrheic dermatitis. Rom J Morphol Embryol. 2007;48:285-9.
- 88. Tsuji K, Nose Y, Ito M, Ozala A, Matsuo I. HLA antigens and susceptibility to psoriasis vulgaris in a non-Caucasian population. Tissue antigens. 1976;8:29-33.
- 89. Fritsch PO, Reider N. Other Eczematous Eruptions. In: Bolognia JL, Jorizzo JL, Rapini RP, editors. Dermatology. Spain: Mosby Elsevier; 2008. p.197-200.
- 90. Foley P, Zuo Y, Plunkett A, Merlin K, Marks R. The frequency of common skin conditions in preschool-aged children in Australia: seborrheic dermatitis and pityriasis capitis (cradle cap). Arch Dermatol.. 2003;139:318-22.
- 91. Misery L, Touboul S, Vincot C, Dutray S, Rolland-Jacob G, Consoli SG, et al. [Stress and seborrheic dermatitis]. Ann Dermatol Venereol. 2007;134:833-7.
- 92. Peyri J, Lleonart M. [Clinical and therapeutic profile and quality of life of patients with seborrheic dermatitis]. Actas Dermosifiliogr. 2007;98:476-82.
- 93. Sarkar R, Sharma RC, Koranne RV, Sardana K. Erythroderma in children: a clinicoetiological study. J Dermatol.. 1999;26:507-11.
- 94. Sarkar R, Garg VK. Erythroderma in children. Indian J Dermatol Venereol Leprol. 2010;76:341-7.
- 95. Al-Dhalimi MA. Neonatal and infantile erythroderma: a clinical and follow-up study of 42 cases. J Dermatol. 2007;34:302-7.
- 96. Cherny S, Mraz S, Su L, Harvell J, Kohler S. Heteroduplex analysis of T-cell receptor gamma gene rearrangement as an adjuvant diagnostic tool in skin biopsies for ery throderma. J Cutan Pathol. 2001;28:351-5.
- 97. Yamamoto T, Tsuboi R. Interleukin-2-induced seborrhoeic dermatitis-like eruption. J Eur Acad Dermatol Venereol. 2008;22:244-5.
- 98. Valia RG. Etiopathogenesis of seborrheic dermatitis. Indian J Dermatol Venereol Leprol. 2006;72:253-5.
- 99. Berger RS, Stoner MF, Hobbs ER, Hayes TJ, Boswell RN. Cutaneous manifestations of early human immunodeficiency virus exposure. J Am Acad Dermatol. 1988;19:298-303.
- 100. Eisenstat BA, Wormser GP. Seborrheic dermatitis and butterfly rash in AIDS. N Engl J Med. 1984;311:189.
- 101. Soeprono FF, Schinella RA, Cockerell CJ, Comite SL. Seborrheic-like dermatitis of acquired immunodeficiency syndrome. A clinicopathologic study. J Am Acad Dermatol. 1986;14:242-8.
- 102. Blanes M BI, Merino E, Portilla J, Sánchez-Payá J, Betlloch I. Current prevalence and characteristics of dermatoses associated with human immunodeficiency virus infection. Actas Dermosifiliogr. 2010;101:702-9.
- 103. Hakansson C, Faergemann J, Lowhagen GB. Studies on the lipophilic yeast Pityrosporum ovale in HIV-seropositive and HIV-seronegative homosexual men. Acta Derm Venereol. 1988;68:422-6.
- 104. Schoefer H, Sachs DL, Ochsendorf F. HIV- associated skin and mucocutaneous dis eases. In: Hoffman C, Rockstroh JK, Kamps BS, editors. HIV medicine. 15th ed. Paris, Cagliari, Wuppertal: Flying Publisher: 2007. p.596.
- 105. Rincón S, Celis A, Sopó L, Motta A, Cepero de García MC. Malassezia yeast species isolated from patients with dermatologic lesions. Biomedica. 2005;25:189-95.
- 106. Vidal C, Girard PM, Dompmartin D, Bosson JL, Mettra C, Groslambert P, et al. Seborrheic dermatitis and HIV infection. Qualitative analysis of skin surface lipids in men seropositive and seronegative for HIV. J Am Acad Dermatol. 1990;23:1106-10.
- 107.Passi S, Picardo M, Morrone A, De Luca C, Ippolito F. Skin surface lipids in HIV seropositive and HIV sero-negative patients affected with seborrheic dermatitis. J Dermatol Sci. 1991;2:84-91.
- 108. Nnoruka EN, Chukwuka JC, Anisuiba B. Correlation of mucocutaneous manifestations of HIV/AIDS infection with CD4 counts and disease progression. Int J Dermatol. 2007;46 Suppl 2:14-8.
- 109. Dunic I, Vesic S, Jevtovic DJ. Oral candidiasis and seborrheic dermatitis in HIV-infected patients on highly active antiretroviral therapy. HIV Med. 2004;5:50-4.
- 110. Hardcastle NJ, Tunbridge AJ, Shum KW, Dockrell DH, Green ST. Alopecia in association with severe seborrhoeic dermatitis following combination antiretroviral therapy for acute retroviral syndrome. J Eur Acad Dermatol Venereol. 2005;19:631-3.
- 111. Smith K, Kuhn L, Coovadia A, Meyers T, Hu CC, Reitz C, et al. Immune reconstitution inflammatory syndrome among HIV-infected South African infants initiating antiretroviral therapy. AIDS. 2009;23:1097-107.
- 112. Schaub NA, Drewe J, Sponagel L, Gilli L, Courvoisier S, Gyr N, et al. Is there a relation between risk groups or initial CD4 T cell counts and prevalence of seborrheic dermatitis in HIV-infected patients? Dermatology.1999;198:126-9.
- 113. Prose NS. Cutaneous manifestations of HIV infection in children. Dermatol Clin. 1991;9:543-50.
- 114. Dann FJ, Tabibian P. Cutaneous diseases in immunodeficiency vírus-infected patients referred to the UCLA Immunossupression skin Clinic: reasons for referral and management of select diseases. Cutis. 1995;55:85-8.
- 115. Wiwanitkit V. Prevalence of dermatological disorders in Thai HIV-infected patients correlated with different CD4 lymphocyte count statuses: a note on 120 cases. Int J Dermatol. 2004;43:265-8.
- 116. Elewski B. Safe and effective treatment of seborrheic dermatitis. Cutis. 2009;83:333-8.
- 117. Satchell AC, Saurajen A, Bell C, Barnetson RS. Treatment of dandruff with 5% tea tree oil shampoo. J Am Acad Dermatol. 2002;47:852-5.
- 118. Wolwerton SE, editor. Compreensive dermatologic drug therapy. 2nd ed. Philadelphia: Saunders Elsevier; 2007. p.720-3.
- 119. Wilson J. Hormônios adrenocorticotrófico, esteróides adrenocorticais e seus análogos sintéticos; inibidores da síntese e das ações dos hormônios adrenocorticais In: Hardman JG, Limbird LE, editores. As bases farmacológicas da terapêutica. 9. ed. México-DF: Mc Graw Hill; 1996. p.1099.
- 120. Faergemann J. Treatment of seborrhoeic dermatitis of the scalp with ketoconazole shampoo. A double-blind study. Acta Derm Venereol. 1990;70:171-2.
- 121. Hanel H, Smith-Kurtz E, Pastowsky S. [Therapy of seborrheic eczema with an anti fungal agent with an antiphlogistic effect]. Mycoses. 1991;34 Suppl 1:91-3.
- 122. Reitamo S, Ortonne JP, Sand C, Cambazard F, Bieber T, Fölster-Holst R, et al. A multicentre, randomized, double-blind, controlled study of long-term treatment with 0,1% tacrolimus ointment in adults with moderate to severe atopic dermatitis. Br J Dermatol. 2005;152:1282-9.
- 123. Rigopoulos D, Ioannides D, Kalogeromitros D, Gregoriou S, Katsambas A. Pimecrolimus cream 1% vs. betamethasone 17-valerate 0.1% cream in the treatment of seborrhoeic dermatitis. A randomized open-label clinical trial. Br J Dermatol. 2004;151:1071-5.
- 124. Cicek D, Kandi B, Bakar S, Turgut D. Pimecrolimus 1% cream, methylprednisolone aceponate 0.1% cream and metronidazole 0.75% gel in the treatment of seborrhoeic dermatitis: a randomized clinical study. J Dermatolog Treat. 2009;20:344-9.
- 125. Warshaw EM, Wohlhuter RJ, Liu A, Zeller SA, Wenner RA, Bowers S, et al. Results of a randomized double-blind, vehicle-controlled efficacy trial of pimecrolimus cream 1% for the treatment of moderate to severe facial seborrheic dermatitis. J Am Acad Dermatol. 2007;57:267-64.
- 126. Ozden MG, Tekin NS, Ilter N, Ankarali H. Topical pimecrolimus 1% for resistent seborrheic dermatitis of the face: an open-label study. Am J Clin Dermatol. 2010;11: 51-4.
- 127. Shin H, Kwon OS, Won CH, Kim BJ, Lee YW, Choe YB, et al. Clinical efficacies of topical agents for the treatment of seborrheic dermatitis of the scalp: a comparative study. J Dermatol. 2009;36:131-7.
- 128. Parsad D, Pandhi R, Negi KS, Kumar B. Topical metronidazole in seborrheic dermatitis-a double-blind study. Dermatology. 2001;202:35-7.
- 129. Nakayama J. Four cases of sebopsoriasis or seborrheic dermatitis of the face and scalp successfully treated with 1a-24 (R)-dihydroxycholecalciferol (tacalcitol) cream. Eur J Dermatol. 2000;10:528-32.
- 130. Boyle J, Burton JL, Faergemann J. Use of topical lithium succinate for seborrhoeic dermatitis. Br Med J (Clin Res Ed). 1986;292:28.
- 131. Bonnetblanc JM, De Prost Y, Bazex J, Maignan-Gayrard P. [Treatment of seborrheic dermatitis with benzoyl peroxide]. Ann Dermatol Venereol. 1990;117:123-5.
- 132. Scaparro E, Quadri G, Virno G, Orifici C, Milani M. Evaluation of the efficacy and tolerability of oral terbinafine (Daskil) in patients with seborrhoeic dermatitis. A multicentre, randomized, investigator-blinded, placebo-controlled trial. Br J Dermatol. 2001 Apr;144(4):854-7.
- 133. Geissler SE, Michelsen S, Plewig G. Very low dose isotretinoin is effective in controlling seborrhea. J Dtsch Dermatol Ges. 2003;1:952-8.
- 134. Yu C SM, Stevens G, Liskanich R, Horowitz D. Isotretinoin as monotherapy for sebaceous hyperplasia. J Drugs Dermatol. 2010;9:699-701.
- 135. Barzilai A, David M, Trau H, Hodak E. Seborrheic dermatitis-like eruption in patients taking isotretinoin therapy for acne: retrospective study of five patients. Am J Clin Dermatol. 2008;9:255-61.
Datas de Publicação
-
Publicação nesta coleção
23 Jan 2012 -
Data do Fascículo
Dez 2011
Histórico
-
Recebido
18 Nov 2010 -
Aceito
24 Mar 2011