Resumos
A origem da transformação de fase da alumina tem sido alvo de intensos estudos devido a interesses tecnológicos associados às fases cristalinas envolvidas. Entretanto, há dúvidas quanto sua origem, principalmente quando se trata da influência de aditivos na temperatura da transição. Este trabalho tem como objetivo um maior esclarecimento dos mecanismos pelos quais ocorre a transição, partindo do estudo do efeito do íon Mn como aditivo. O íon Mn provoca diminuição notável da temperatura de transição <FONT FACE=Symbol>gð®að</FONT>, sendo esta observada a 1012 ºC para 10% mol de Mn, enquanto que a 1100 ºC para alumina pura preparada pelo método Pechini. A presença de um tamanho crítico comum tanto para a transformação em Al2O3 como Al2O3-10%Mn, juntamente com resultados de DRX apontando a solubilização do Mn na rede da alumina antes da transição, reforçam a natureza da transformação numa associação de fatores energéticos e cinéticos. Um tamanho crítico é fundamental para transformação, tendo sua origem na razão de energia de superfície e de rede, mas seu alcance é controlado por fatores cinéticos, que são modificados pela inclusão de aditivos.
alumina; transição; aditivo; energia; manganês
Despite the large number of studies concerning alumina phase transitions, many contradictions about their origins and the influence of additives still remain. In the present work, alumina doped with Mn is used as a reference system to study the mechanisms by which phase transformations occur. The introduction of Mn ions decreases the temperature of the <FONT FACE=Symbol>gð®að</FONT> transition, which is observed around 1012 ºC with 10 mol% of Mn while at 1100 ºC for alumina synthesized by the Pechini's route. The presence of a critical particle size similar for both doped and undoped material and the formation of solid solution Mn with alumina indicate that the transition is dependent on energetic factors as well as on kinetic factors. A critical particle size controlled by the ratio between surface energy and bulk energy is required for transformation to occur, but grain growth, which highly depends on the additives, determines when the system will reach such critical value.
alumina; phase transition; additive; manganese
Efeito do íon Mn como aditivo na transição de fase g ®a da alumina
Study of the influence of the Mn ion on the g®a alumina phase transition
R. H. R. Castro; D. Gouvêa
Departamento de Engenharia Metalúrgica e de Materiais, Escola Politécnica, Universidade de São Paulo, Avenida Prof. Mello Moraes, 2463, S. Paulo, SP, 05508-900
RESUMO
A origem da transformação de fase da alumina tem sido alvo de intensos estudos devido a interesses tecnológicos associados às fases cristalinas envolvidas. Entretanto, há dúvidas quanto sua origem, principalmente quando se trata da influência de aditivos na temperatura da transição. Este trabalho tem como objetivo um maior esclarecimento dos mecanismos pelos quais ocorre a transição, partindo do estudo do efeito do íon Mn como aditivo. O íon Mn provoca diminuição notável da temperatura de transição gð®að, sendo esta observada a 1012 ºC para 10% mol de Mn, enquanto que a 1100 ºC para alumina pura preparada pelo método Pechini. A presença de um tamanho crítico comum tanto para a transformação em Al2O3 como Al2O3-10%Mn, juntamente com resultados de DRX apontando a solubilização do Mn na rede da alumina antes da transição, reforçam a natureza da transformação numa associação de fatores energéticos e cinéticos. Um tamanho crítico é fundamental para transformação, tendo sua origem na razão de energia de superfície e de rede, mas seu alcance é controlado por fatores cinéticos, que são modificados pela inclusão de aditivos.
Palavras-chave: alumina, transição, aditivo, energia, manganês.
ABSTRACT
Despite the large number of studies concerning alumina phase transitions, many contradictions about their origins and the influence of additives still remain. In the present work, alumina doped with Mn is used as a reference system to study the mechanisms by which phase transformations occur. The introduction of Mn ions decreases the temperature of the gð®að transition, which is observed around 1012 ºC with 10 mol% of Mn while at 1100 ºC for alumina synthesized by the Pechini's route. The presence of a critical particle size similar for both doped and undoped material and the formation of solid solution Mn with alumina indicate that the transition is dependent on energetic factors as well as on kinetic factors. A critical particle size controlled by the ratio between surface energy and bulk energy is required for transformation to occur, but grain growth, which highly depends on the additives, determines when the system will reach such critical value.
Keywords: alumina, phase transition, additive, manganese.
INTRODUÇÃO
A síntese de óxidos metálicos freqüentemente fornece materiais com estruturas diferentes das fases termodinamicamente estáveis. Este caso se aplica ao óxido de alumínio (Al2O3) que, de modo semelhante à zircônia (ZrO2) tetragonal e a ítria (Y2O3) monoclínica, surge usualmente como aluminas de transição, tais como gama, teta e eta-alumina, durante o processo de síntese [1, 2]. O surgimento destas fases metaestáveis é por vezes aceito como um fator depreciador da energia total do sistema a partir de um decréscimo na energia de superfície. Assim, fases metaestáveis, ou de transição, cujas energias de superfície são usualmente menores que as das fases estáveis, seriam priorizadas pela utilização de sínteses gerando produtos com elevadas áreas específicas. No entanto, algumas dúvidas quanto às evoluções destes sistemas para as fases termodinamicamente estáveis surgem particularmente na discussão da morfologia durante a transição e da influência de aditivos no fenômeno.
O efeito da energia superficial nestas transformações foi alvo de amplos tratados na literatura [1, 3, 4]. Particularmente para estudos sobre óxido de zircônio, um tamanho crítico de partícula foi introduzido, a partir do qual a estrutura se transforma. Isto é, sendo a energia livre de superfície da estrutura tetragonal menor que da estrutura monoclínica, se um monocristal coalescido é sujeito a um processo de subdivisão, resultará uma competição entre a mudança na energia livre da rede cristalina e a energia de superfície associada à transformação. Em algum ponto, ao passo que a razão de átomos de superfície e da rede se aproxima de um valor crítico, a forma tetragonal será estável mesmo numa temperatura T<<Tci, onde Tci significa a temperatura de transição de um cristal infinito. Pode-se quantificar a discussão equacionando a variação de energia livre de um monocristal e igualando a zero no valor crítico de partícula. Para um cristal esférico de raio r:
onde DGvol e DGsup se referem às mudanças na energia livre por unidade de volume e por unidade de área, respectivamente, associadas à transição; rc denota o valor do raio crítico da partícula necessário para transição.
Assim como para a zircônia, diferenças marcantes nas estruturas das fases da alumina geram energias superficiais distintas, sugerindo a aplicabilidade do modelo também a este sistema. Simulações em dinâmica molecular das superfícies dos polimorfos g-Al2O3 e a-Al2O3 apontam as energias de superfície de alfa significativamente maiores que aquelas para gama, independentemente do plano de exposição [5]. Considerando, no entanto, os resultados para exposição preferencial das superfícies de menor energia [a-Al2O3 (0001); g-Al2O3 (001)] e aplicando a discussão acima apresentada, gama deve tornar-se energeticamente estável quando a área superficial exceder ~125 m2/g. Baseado nestes cálculos preliminares, o modelo do tamanho crítico foi aplicado à transição da fase gama para a fase estável alfa [1, 6]. Apresentando medidas reais das energias de superfície das fases envolvidas nas transições, demonstrou-se uma área superficial crítica (tamanho de partícula crítico) para a presença da estrutura gama de ~100 m2/g, abaixo da qual ocorre a transição para estrutura alfa [1].
Ademais à elegância do modelo acima apresentado e satisfatoriamente demonstrado, observações experimentais, particularmente quanto à microestrutura das partículas durante a transição, colocam dúvidas quanto ao modo como ocorre efetivamente a transformação. A aparente dependência da nucleação de a-Al2O3 no tamanho do cristal de g-Al2O3 pode levar à aplicação de um modelo de nucleação martensítica à transformação ou até um modelo de nucleação por difusão [7, 8], resumindo o escopo da energia à afirmação de que a transição é termodinamicamente favorável devido a alta estabilidade da rede cristalina na fase transformada.
Transformações martensíticas geralmente encontram efeitos de tamanho de grão e de cristal devido à natureza cooperativa dos movimentos atômicos envolvidos [8]. Como átomos da superfície, do contorno de grão e contidos nos defeitos não são tão tensionados como os átomos da rede cristalina, estes resistem a um processo cooperativo. Pequenos cristais contêm um número de átomos de superfície por unidade de volume maior que cristais maiores e, deste modo, são menos propensos a transformações martensíticas. Cristais menores também contêm menor potencial de nucleação de defeitos, o que aumenta a probabilidade de catalisar um processo de nucleação (nucleação heterogênea). A teoria de transformação martensítica, entretanto, é aplicada apenas ao mecanismo de nucleação. O crescimento de a-Al2O3 após a transformação deve proceder-se por crescimento por difusão, levando à microestrutura vermicular característica de alfa [9].
Sugere-se, no entanto, improvável a presença de dois mecanismos de transformação envolvendo o mesmo fenômeno. Deste modo, a observação de um tamanho crítico de partículas pode ainda ser relacionada à processos de difusão governando a transformação desde o início [7]. Sendo a nucleação por difusão mais favorável em superfícies e contornos, a-Al2O3 seria esperado nuclear na superfície de cristais de g-Al2O3 ou em pescoços entre cristais. Assim, um tamanho crítico de cristal pode ser necessário para a nucleação por difusão, pois os cristais g-Al2O3 devem coalescer suficientemente para produzir sítios potenciais de nucleação de a-Al2O3. Esta explicação vem satisfazer a observação marcante do tamanho de partícula médio consideravelmente maior da fase nucleada já nos primeiros momentos da transformação se comparada com a fase inicial.
Apesar da coerência individual de cada modelo proposto para a transformação, sendo, numa análise preliminar, todos satisfatórios, quando tratando da influência de aditivos no fenômeno, a literatura trata os efeitos dos aditivos como simples controladores de mecanismos de transporte de massa. A maneira pela qual estes aditivos agem exatamente, entretanto, é incerta e díspar, sendo dadas explicações isoladas para cada íon aditivo estudado, apesar do número de esforços no sentido de sistematizar o quadro [10, 11, 12].
Foi proposto que alguns aditivos que diminuem a temperatura da reação de transformação (Zn, Ti+Cu, Ti+Mn, Cu, V, e Li) devem formar uma fase líquida a temperaturas menores que a temperatura normal de transformação [12]. Desde que o processo deveria ocorrer por nucleação de crescimento, este deve ser acelerado pela fase líquida que permite um aumento no transporte de massa via mecanismo de solução-precipitação. Alguns estudos endossam a hipótese de fase líquida no efeito do íon Cu2+ como aditivo de controle de temperatura, o qual pode estar relacionado com uma fase líquida numa temperatura eutética em Cu2O-CuO-Al2O3 derivada da presença inicial de CuAl2O3 [13]. No entanto, estes mesmos estudos mostram que o efeito do íon Mn2+ não está relacionado com a formação de fase líquida, mas com a formação de grãos de Mn2O3 e MnAl2O4 que funcionariam como sítios de nucleação heterogêneos. Ainda outros estudos com outros diferentes aditivos foram realizados, dos quais Fe3+ e Ti4+ identificaram-se como marcantes aceleradores [14, 15], mas o mecanismo de atuação não é esclarecido.
Centrando o estudo no íon Mn, a literatura reporta a temperatura de início de cristalização da a-alumina sendo decrescida à 900 oC com a adição de 7% em mol de óxido de manganês [16]. Este trabalho aponta por análises de difração de raios X que não há formação de fase secundária do manganês durante a calcinação da alumina dopada com Mn e tampouco solubilização do íon na rede do óxido matriz, o que se opõe a resultados previamente estabelecidos [13] e desacredita uma teoria de nucleação heterogênea por fases secundárias assim como formação de fase líquida. O trabalho propõe, em contraponto, que haja segregação do aditivo para a superfície do grão, semelhante ao que acontece para pós de SnO2 dopados com Mn, Fe e Mg [17, 18], sendo este fenômeno ligado ao caráter covalente tanto das ligações Sn-O quanto das Al-O [19]. No caso do SnO2, a segregação dos aditivos foi reportada como intimamente ligada à diminuição na tensão superficial dos cristais, observando um aumento na área de superfície do material com um aumento da concentração de aditivo [18]. Para a alumina, o excesso superficial do aditivo estaria ligado a um controle da energia do sistema e, portanto, da temperatura de transição.
Estes últimos dados abrem discussão da real influência dos aditivos na transição de fase g®a da alumina. O presente trabalho tem como objetivo o estudo da influência do íon Mn na transição, considerando a possibilidade de modificação de energias superficiais e fatores cinéticos relacionados. Os íons Mn são adicionados à alumina sintetizada por um processo de precursores poliméricos, e o efeito na temperatura de transição, bem como área específica (tamanho crítico) e difração de raios X, são correlacionados de modo a fundamentar a ação global do aditivo.
MATERIAIS E MÉTODOS
Para produção da alumina foi utilizado método baseado na patente de Pechini [16], que propõe uma via de preparação química de óxidos que limita a adição de contra íons inorgânicos e permite a cristalização lenta das partículas. O precursor polimérico foi preparado pela adição de Al(NO3)3 anidro P.A. (Synth - >98%) a uma solução de ácido cítrico anidro P.A. (Synth >99,5%) e etileno glicol P.A. (Synth) na proporção 23,32%, 44,21% e 29,47 % em massa, respectivamente. Seguiu-se um processo de polimerização a 120 oC, decomposição química a 450 oC por 4 horas, desaglomeração e calcinação a 500 oC por 15 horas.
Aluminas contendo 3, 5 e 10% em mol de Mn foram preparadas pela inclusão do aditivo na forma de carbonato de manganês (II) P.A. (Alfa Aesar 99,9%) na etapa anterior a decomposição química, levando à incorporação do aditivo na fase líquida e, logo, à boa homogeneidade de distribuição do aditivo.
Para determinação da temperatura de transição do pó puro e contendo Mn foi realizada análise térmica diferencial (DTA) à taxa de 10 oC por minuto em atmosfera de ar sintético partindo da temperatura ambiente até 1300 oC. Foi utilizado para os ensaios o equipamento de Análise Térmica Simultânea STA-409E - Netzsch.
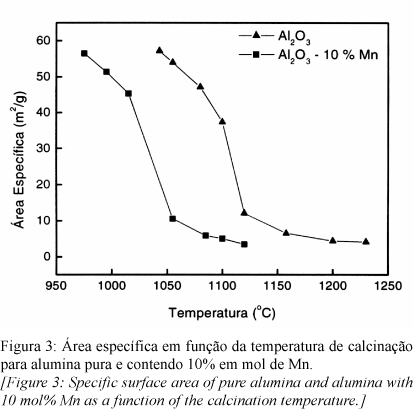
Determinada a temperatura de transição para cada pó, amostras de alumina pura e contendo 10% em mol de Mn calcinadas a 500 oC/15 h foram aquecidas em um forno tubular partindo da temperatura ambiente até as temperaturas de interesse a 10 oC/min, sem patamar, de acordo com os resultados de DTA, de modo a obter as estruturas durante a transição. Assim, para alumina pura, foram calcinados pós a 1055, 1080, 1100, 1120, 1158, 1200 e 1230 oC. Para alumina 10% em mol Mn, amostras foram calcinadas a 975, 995, 1015, 1055, 1085, 1100 e 1120 oC.
Cada amostra calcinada teve então sua área específica determinada pelo método BET (Micromeritics Gemini III 2375 Surface Area Analyser), após tratamento a 180 oC em vácuo por 12 horas.
Análises de difração de raios X (DRX) foram realizadas em amostras de alumina pura calcinadas segundo o procedimento descrito à 1080 oC e alumina 10 % Mn à 975 oC, num difratômetro de raios X Bruker-AXS D8 Advance, utilizando tubo de Cu com passo de 0,05°/5 s no intervalo de 2q de 20 a 80o e contendo padrão interno de Si.
RESULTADOS E DISCUSSÃO
Dados experimentais confirmam a ação do íon Mn como redutor da temperatura da transformação de g-Al2O3 para a-Al2O3. O efeito do aditivo é progressivo com a concentração, como apontado na Fig. 1, na qual o aumento do teor do íon provoca deslocamento do pico exotérmico característico da transição para temperaturas mais baixas, alcançando 1058 oC com 10 % em mol do aditivo. A Fig. 2 compila os valores dos picos exotérmicos em função da concentração de Mn na alumina. Nota-se que o comportamento da Fig. 2 é praticamente linear, estando o coeficiente angular ligeiramente diminuído em módulo quando a concentração atinge 10% em mol, apontando um possível ponto de estabilização em concentrações mais elevadas. Esta estabilização pode e deve estar relacionada à distribuição e saturação do aditivo na matriz, assim como observado para o SnO2 [18].
O mecanismo de atuação do aditivo na redução da temperatura de transição pode ser analisado avaliando, primeiramente, as hipóteses apresentadas na literatura sobre os reguladores do fenômeno. Supondo a hipótese de segregação do aditivo na superfície da g-alumina [16], o valor da energia livre por volume da rede não seria alterado, pois as ligações não são rompidas ou distorcidas, mantendo-se a simetria da rede. Assim, a energia livre de rede do material puro e contendo o aditivo seria a mesma. A energia de superfície, por sua vez, seria minimizada pelo excesso do aditivo na região e alteraria o tamanho crítico da transição, desde que este é fundamentalmente dependente da relação entre as energias de superfície e de rede [1, 3]. Observando os dados de área específica na Fig. 3, nota-se uma variação abrupta da área no início da transição (comparando com as análises de DTA na Fig. 1) para alumina pura e contendo 10% em mol de Mn. Ademais, estudando os valores da transição, a área crítica para início (70 oC antes do valor máximo do pico) da transformação para alumina pura gira em torno de 47,1 m2/g, ao passo que a área crítica do material contendo o aditivo para estágio equivalente da transição é 45,3 m2/g. Aplicando o modelo de tamanho crítico com partículas esféricas, fixando o valor da energia de rede como constante, o resultado implica em valores também semelhantes das energias de superfície de cada material (sMn~1,02 spuro). Isto é, a hipótese de variação de energia superficial para este sistema é falsa, a menos que acompanhada por variação proporcional de energia na rede, com uma constante de proporcionalidade dependendo de fatores exclusivamente geométricos. Esta situação concorda com uma solubilização do aditivo na rede, ao invés da segregação na superfície, ocupando posições de átomos de alumínio e gerando, se necessário, vacâncias de oxigênio para manter neutralidade de carga do sistema ou, no caso extremo, a formação de um novo espinélio.
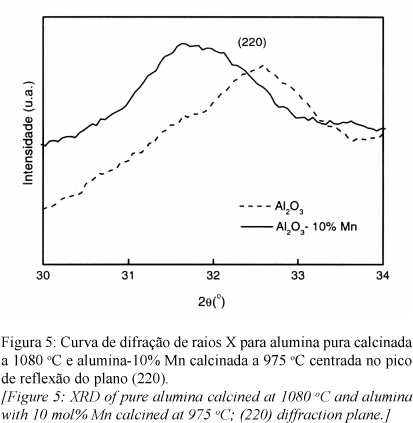
Esta possibilidade foi estudada por difração de raios X, analisando o deslocamento de picos na curva de DRX, tendo como padrão Si. O pó analisado foi "congelado" na situação imediatamente anterior à transição, determinada pela curva de DTA. Assim, a alumina pura calcinada a 1080 oC e a alumina-10% Mn a 975 oC foram estudadas. A análise de DRX de ambos os pós apresentam como fase principal uma alumina de transição adicionada, no caso da alumina pura, de uma pequena porção de a-alumina já transformada (Fig. 4).
A estrutura da g-Al2O3 ainda é foco de alguma discussão; no entanto, é comumente aceita como um espinélio defeituoso. Tais defeitos têm de ocorrer, pois a estequiometria da Al2O3 não comporta uma estrutura espinélio. Se todas as posições catiônicas da estrutura espinélio fossem completadas com átomos de alumínio, haveria um excesso de alumínio. Assim, algumas posições devem permanecer vazias. Sítios catiônicos de dois tipos aparecem no espinélio: tetraédricos e octaédricos. A questão que permanece é onde as vacâncias prevalecem. Estudos experimentais são contraditórios quanto ao assunto [5, 20], no entanto, simulações considerando a presença de vacâncias apenas em sítios tetraédricos suportam esta possibilidade [21]. Assim, a estrutura pode ser derivada do espinélio normal AB2O4, no qual cátions B trivalentes ocupam metade dos sítios octaédricos e cátions A divalentes ocupam 1/8 das posições tetraédricas. Se a fórmula Al2O3 é expressa como Al2,67O4 e é assumido que dois íons Al ocupam sítios octaédricos e 0,67 ocupam sítios tetraédricos, o restante 0,33 de vacâncias catiônicas deve estar preferencialmente localizados em sítios tetraédricos [22].
O difratograma na Fig. 4 aponta a presença de reflexões características dos planos do espinélio g-Al2O3 tanto para alumina pura como para alumina contendo manganês [23]. Uma observação mais detalhada das curvas de DRX revela uma influência considerável do aditivo Mn na estrutura do espinélio, sendo notada solubilização do íon na rede, o que poderia interferir em fatores cinéticos para a transformação de fase da alumina como veremos. A Fig. 5 ressalta um deslocamento do pico de reflexão do plano (220) com a inclusão do aditivo. Através de refinamentos Rietveld de DRX e simulações computacionais [23] propôs-se a associação das zonas de reflexão com sub-redes de alumínios tetraédricos, octaédricos e sub-redes de oxigênio presentes no espinélio. Desta maneira, o plano (220) é relacionado exclusivamente a sub-rede de Al tetraédricos, o que caracteriza uma substituição acentuada do Mn nestes sítios. Os íons Al destes sítios são preferencialmente divalentes, podendo ter algum grau de desordem e troca com cátions trivalentes de posições octaédricas [24]. Para possuir raio iônico semelhante ao Al2+, Mn deve aparecer também como cátion divalente, sendo esta substituição neutra, não devendo surgir vacâncias de oxigênio relacionadas.
Apesar da ausência de reflexões particulares dos sítios da sub-rede de Al octaédrico, reflexões com participação pronunciada destes sítios também apontam deslocamentos, como por exemplo os planos (440) e (222). O plano (222) (Fig. 6) foi correlacionado à ação conjunta dos sítios octaédricos e sub-rede de oxigênio [23]. Observando o deslocamento para ângulos menores, bem como diminuição da intensidade do pico, acredita-se que haja substituição do Mn nos sítios octaédricos e ainda uma diminuição na ordenação da sub-rede, tornando a estrutura mais semelhante à alumina de transição h-alumina do que g-alumina propriamente dita. Estes dois isomorfos apresentam pequenas diferenças quanto às temperaturas das transições. Assim, foi proposto que mesmo g-Al2O3 possuindo uma sub-rede de oxigênio mais ordenada que h-Al2O3, os sítios tetraédricos pouco ocupados de coordenação 48 na estrutura h, tanto em distribuição e ocupação, mais aproximados dos sítios tetraédricos de a-Al2O3 que os sítios tetraédricos mais ocupados de coordenação 8 da g-Al2O3, fazem com que a temperatura de transição de h seja mais baixa [23]. Esta hipótese é uma possível explicação para o sistema, mas pouco provável quando observado o tamanho de partícula crítico semelhante para os dois isomorfos neste trabalho.
A semelhança dos raios de Al3+ e Mn4+ indica que a substituição dos sítios octaédricos deva ocorrer com este grau de oxidação do manganês. Assim, vacâncias de oxigênio devem se formar para manter a neutralidade do sistema. Estas vacâncias seriam, portanto, responsáveis pelo aumento da difusão no sistema e conseqüente aumento do crescimento de grão, como observado nas análises de área superficial, onde o pó contendo o aditivo tem tamanho de partícula maior numa temperatura de calcinação menor.
A coincidência dos valores críticos de transição observada para as estruturas contendo ou não o aditivo desacredita a origem destes na nucleação heterogênea ou transformação martensítica, como proposto. Os fatos vêm reforçar a origem da transformação numa associação de fatores energéticos e cinéticos. O tamanho crítico é fundamental para transformação, tendo sua origem na razão de energia de superfície e de rede do material, mas o alcance da configuração crítica pelo sistema é controlado por fatores cinéticos, que são modificados pela inclusão de aditivos tais como o íon Mn.
O efeito do Mn é progressivo com a concentração, desde que a substituição na rede e desordenação da sub-rede do oxigênio é gradual. Uma saturação da rede pelo aditivo causaria a diminuição do efeito deste como agente redutor da temperatura de transição, desde que a cinética não seria mais alterada, já que a quantidade de defeitos é estável.
Após o alcance do tamanho crítico, as partículas devem sofrer transformação martensítica, ocorrendo reorientação das ligações, de maneira a minimizar a energia da rede a qual tem seu volume progressivamente aumentado [23, 25]. Tratando-se de reação exotérmica, desde que a minimização da energia da rede cristalina sobressai ao aumento da energia de superfície, a energia liberada é responsável por um aumento local da difusão dos átomos, os quais conduzem a um crescimento de grão acelerado, fazendo com que os picos de alfa-alumina no difratograama de raios X surjam inicialmente já definidos e finos [3].
CONCLUSÃO
A temperatura de transição g®a da alumina foi controlada pela adição de Mn. Com 10% em mol de Mn a temperatura foi diminuída para 1012 oC. Um tamanho crítico de partícula para a transição foi observado, sendo seu valor semelhante tanto para alumina pura quanto para alumina contendo 10% Mn. Esta observação associada à solubilização do aditivo na rede da alumina de transição, demonstrada por análises de difração de raios X, indica a dependência da transição tanto com fatores termodinâmicos como cinéticos. Isto é, um tamanho crítico de partícula para transição, dependente da razão entre a energia de superfície e da rede, é fundamental para ocorrência do processo, mas o alcance deste tamanho de partícula pelo sistema é dependente da cinética de crescimento de partícula, que por sua vez é dependente da ação de aditivos. No caso do Mn, o aditivo aumenta a difusão no sistema quando solubilizado, diminuindo a temperatura de transição, já que as partículas crescem mais rapidamente.
AGRADECIMENTOS
À FAPESP (Fundação de Amparo à Pesquisa do Estado de São Paulo), Processos 96/09604-9, 99/10798-0 e 01/10053-7, pelo apoio financeiro.
Rec. 09/10/02,
Ac.31/01/03
- [1] J. M. McHale, A. Navrotsky, A. J. Perrotta, J. Phys. Chem. B 101 (1997) 603.
- [2] E. Dörre, "Alumina: processing, properties, and applications", Springer-Verlag Berlin, Alemanha, 1984.
- [3] R. C. Garvie, M. F. Goss, J. Mater. Sci. 21 (1986) 1253.
- [4] J. E. Bailey, Z. M. Librant, D. Lewis, L. J. Porter, Trans. J. Brit. Ceram. Soc. 71, 1(1972) 25.
- [5] S. Blonski, S. H. Garofalini, Surf. Sci. 295 (1993) 263.
- [6] J. M. McHale, A. Navrotsky, A. J. Perrota, Science 277 (1997) 788.
- [7] R. B. Bagwell, G. L. Messing, P. R. Howell, J. Mater. Sci. 36 (2001) 1833.
- [8] P. M. Kelly, L. R. Francis Rose, Prog. Mater. Sci. 47 (2002) 463.
- [9] F. W. Dynys, J. Am. Ceram. Soc. 65, 9 (1982) 442.
- [10] M. Ozawa, O. Kato, S. Suzuki, J. Mater. Sci. Lett. 15 (1996) 564.
- [11] D. L. Bye, G. T. Simpkin, J. Am. Ceram. Soc. 57, 8 (1974) 367.
- [12] L. A. Xue, I. W. Chen, J. Mater. Sci. Lett. 11 (1992) 443.
- [13] K. Okada, A. Hattori, J. Am. Ceram. Soc. 83, 4 (2000) 928.
- [14] R. A. Shkrabina, N. A. Koryabkina, V. A. Ushakov, M. F. Lausberg, E. M. Moroz, Z. R. Ismagilov, Kinetics and Catalysis 37, 1 (1996) 117.
- [15] B. E. Yoldas, J. Mater. Sci. 11 (1976) 465.
- [16] D. Gouvêa, R. L. Villalobos, J. D. T. Capocchi, Mater. Sci. Forum 299 (1999) 91.
- [17] J. A. Cerri, E. R. Leite, D. Gouvêa, E. Longo, J. Am. Ceram. Soc. 79, 3 (1996) 799.
- [18] G. J. Pereira, R. H. R. Castro, P. Hidalgo, D. Gouvêa, Appl. Surf. Sci. 195 (2002) 277.
- [19] D. Gouvêa, A. Smith, J. P. Bonnet, Eur. J. Solid State Inorg. Chem. 33, 10 (1996) 1015.
- [20] V. Jayaram, C. G. Levi, Acta Metall. 37 (1989) 569.
- [21] L. J. Alvarez, J. F. Sanz, M. J. Capitán, J. A. Odriozola, Chem. Phys. Lett. 192 (1992) 463.
- [22] G. Urretavizcaya, A. L. Cavalieri, J. M. Porto López, I. Sobrados, J. Sanz, J. Mater. Synth. Proces. 6, 1 (1998) 1.
- [23] R-S. Zhou, R. L. Snyder, Acta Cryst. B47 (1991) 617.
- [24] Y-M. Chiang, D. Birnie, W. D. Kingery, "Physical Ceramics - Principles for Ceramic Science and Engineering", John Wiley & Sibs, Inc., 1997.
- [25] B. C. Lippens, J. H. DeBoer, Acta Cryst. 17 (1964) 1312.
Datas de Publicação
-
Publicação nesta coleção
27 Maio 2003 -
Data do Fascículo
Mar 2003
Histórico
-
Aceito
31 Jan 2003 -
Recebido
09 Out 2002