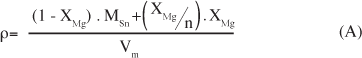Resumos
Um dos maiores desafios na síntese de nanopartículas é a instabilidade da estrutura relativa ao aumento de energia advindo da grande área de superfície específica desta classe de materiais. O conhecimento dos mecanismos pelos quais a estabilidade pode ser alcançada é de fundamental importância para o controle de seu crescimento e para potenciais aplicações. Fenômenos de segregação superficial em sistemas bi-componentes envolvem diminuição de energia do sistema devido ao excesso de superfície - conhecido como fenômeno de tensoatividade. Apesar de muito bem conhecidos em tecnologias de emulsões e em fenômenos que envolvem molhabilidade, o uso destes conceitos para estabilização da superfície sólido-vapor e controle de nanopartículas é menos expressivo. Embora a segregação seja conhecida para vários sistemas de óxidos nanoparticulados, sua quantificação visando o controle é limitada pela dificuldade de obtenção de resultados confiáveis. Neste trabalho foi realizada a quantificação da segregação de MgO na superfície de nanopartículas de SnO2 através da análise química dos pós antes e após lavagem em meio ácido para lixiviação do MgO superficial. Foi demonstrado que a solubilidade do MgO no bulk do SnO2 é preferencial em concentrações inferiores a 5% em mol de MgO, existindo, no entanto, uma distribuição do MgO ao longo da superfície e do bulk, gerando um efeito tenso-ativo e restringindo o crescimento das partículas de SnO2. Para concentrações maiores que 5% em mol, a maior parte do MgO foi detectada na superfície das nanopartículas de SnO2, sendo o controle tenso-ativo mais expressivo. Apesar dos resultados serem restritos para o sistema SnO2-MgO, esta técnica pode ser extrapolada para o controle de quaisquer sistemas onde o elemento segregado é solúvel em condições específicas.
segregação; SnO2; nanopartículas; tensoatividade
Particle size stability is a fundamental requirement in the synthesis and application of nanoparticles. High specific surface area induces an increase of total energy and promotes particle growth. Therefore, there is a need for understanding how to stabilize the surfaces in order to control the particle size and consequent applications in nanotechnology. Surface excess or segregation on the surfaces is usually known to decrease the surface energy by tensoactivity, being widely used in wetting and emulsion technology. However, these principles have been less tested and refined to promote the solid-gas interface stability on nanoparticles technology. Moreover, the quantitative determination of surface excess on nanoparticles is not an easy task and a possible reason is the lack of knowledge of the segregation phenomenon. In this work, quantification of the spontaneous surface segregation of MgO into tin oxide nanoparticles synthesized by a chemical method was carried out exploring the difference of solubility between MgO and SnO2. A chemical analysis by XRF before and after an acid washing demonstrated that, even at 5 mol % of MgO, most of additive was preferentially located in SnO2 bulk, with few surface excess. On the other hand, for MgO amounts larger than 5% most of the additive was on tin oxide surface. Despite the results of quantification are restricted to MgO-doped SnO2 system, the selectivity solubility technique should be effective to quantify any system with different solubility characters.
segregation; SnO2; nanoparticles; tensoactivity
D. GouvêaI; R. H. R. CastroII; G. J. PereiraII
ILaboratório de Processos Cerâmicos, Departamento de Engenharia Metalúrgica e de Materiais, Escola Politécnica da Universidade de S. Paulo, Av. Prof. Mello Moraes 2463, S. Paulo, SP 05508-900. dgouvea@usp.br
IIDepartamento de Engenharia de Materiais, Centro Universitário FEI, Av. Humberto de Alencar Castelo Branco 3972 S. Bernardo do Campo, SP 09850-901
RESUMO
Um dos maiores desafios na síntese de nanopartículas é a instabilidade da estrutura relativa ao aumento de energia advindo da grande área de superfície específica desta classe de materiais. O conhecimento dos mecanismos pelos quais a estabilidade pode ser alcançada é de fundamental importância para o controle de seu crescimento e para potenciais aplicações. Fenômenos de segregação superficial em sistemas bi-componentes envolvem diminuição de energia do sistema devido ao excesso de superfície - conhecido como fenômeno de tensoatividade. Apesar de muito bem conhecidos em tecnologias de emulsões e em fenômenos que envolvem molhabilidade, o uso destes conceitos para estabilização da superfície sólido-vapor e controle de nanopartículas é menos expressivo. Embora a segregação seja conhecida para vários sistemas de óxidos nanoparticulados, sua quantificação visando o controle é limitada pela dificuldade de obtenção de resultados confiáveis. Neste trabalho foi realizada a quantificação da segregação de MgO na superfície de nanopartículas de SnO2 através da análise química dos pós antes e após lavagem em meio ácido para lixiviação do MgO superficial. Foi demonstrado que a solubilidade do MgO no bulk do SnO2 é preferencial em concentrações inferiores a 5% em mol de MgO, existindo, no entanto, uma distribuição do MgO ao longo da superfície e do bulk, gerando um efeito tenso-ativo e restringindo o crescimento das partículas de SnO2. Para concentrações maiores que 5% em mol, a maior parte do MgO foi detectada na superfície das nanopartículas de SnO2, sendo o controle tenso-ativo mais expressivo. Apesar dos resultados serem restritos para o sistema SnO2-MgO, esta técnica pode ser extrapolada para o controle de quaisquer sistemas onde o elemento segregado é solúvel em condições específicas.
Palavras-chave: segregação, SnO2, nanopartículas, tensoatividade.
ABSTRACT
Particle size stability is a fundamental requirement in the synthesis and application of nanoparticles. High specific surface area induces an increase of total energy and promotes particle growth. Therefore, there is a need for understanding how to stabilize the surfaces in order to control the particle size and consequent applications in nanotechnology. Surface excess or segregation on the surfaces is usually known to decrease the surface energy by tensoactivity, being widely used in wetting and emulsion technology. However, these principles have been less tested and refined to promote the solid-gas interface stability on nanoparticles technology. Moreover, the quantitative determination of surface excess on nanoparticles is not an easy task and a possible reason is the lack of knowledge of the segregation phenomenon. In this work, quantification of the spontaneous surface segregation of MgO into tin oxide nanoparticles synthesized by a chemical method was carried out exploring the difference of solubility between MgO and SnO2. A chemical analysis by XRF before and after an acid washing demonstrated that, even at 5 mol % of MgO, most of additive was preferentially located in SnO2 bulk, with few surface excess. On the other hand, for MgO amounts larger than 5% most of the additive was on tin oxide surface. Despite the results of quantification are restricted to MgO-doped SnO2 system, the selectivity solubility technique should be effective to quantify any system with different solubility characters.
Keywords: segregation, SnO2, nanoparticles, tensoactivity.
INTRODUÇÃO
As propriedades de um sólido dependem basicamente do efeito conjugado de suas propriedades fisíco-químicas e de sua microestrutura, ou em alguns casos, sua nanoestrutura. Em materiais particulados, as principais características estruturais (micro ou nano) são o tamanho de cristalito, a distribuição de tamanho de partículas, o estado de aglomeração das partículas e a área de superfície específica (ASE). Para materiais nanométricos em particular, as interfaces são relativamente extensas, podendo ser formadas entre as fases: sólida e gasosa, sólida e líquida - em uma dispersão, ou ainda entre partículas sólidas formando contornos de grão. Considerando que materiais com elevadas áreas de interfaces estão fora do equilíbrio termodinâmico, pois apresentam um significativo excesso de superfície, pode-se imaginar que várias propriedades termodinâmicas do sistema podem não apresentar o comportamento esperado (ditado pelo bulk em materiais micro e macrométricos). Como as propriedades são fortemente dependentes da superfície, uma pequena mudança em sua composição pode alterá-las significativamente. A distribuição heterogênea de aditivos em sistemas bi-componentes é uma das formas nas quais esta alteração pode ocorrer de forma controlada. Por exemplo, grande parte dos materiais cerâmicos é composta de misturas de óxidos que se apresentam na forma de partículas nanométricas. Exemplos de alguns sistemas tecnologicamente relevantes são: zircônia-ítria [1], zircônia-magnésia [2, 3], alumina-zircônia [4], aditivos em óxido de zinco nanométrico [5, 6] e em dióxido de estanho [7, 8]. Vários trabalhos têm sido publicados tratando destes sistemas com o objetivo de demonstrar que a estabilidade das partículas nanométricas produzidas pelo método Pechini tem origem em distribuições heterogêneas dos aditivos quando solúveis no bulk ou na superfície [9-12]. Concluiu-se a partir dos trabalhos que nos sistemas onde a solubilidade de um dos componentes não é uniforme ocorre fenômenos de superfície ligados à estabilidade termodinâmica do crescimento das partículas, além de fenômenos de modificação da temperatura de transição de fase [3, 4] e da evolução da sinterização [13-16].
A maior dificuldade em estudar sistemas nanométricos que apresentam modificações superficiais devido à distribuição dos aditivos é sua quantificação. O método usualmente utilizado para tal objetivo é o XPS (espectroscopia de emissão de raios X). Contudo, esta técnica apresenta alto custo de operação, além de ser de difícil acesso, sendo que não existem modelos adaptados para a interpretação de resultados onde o aditivo está solúvel na estrutura com uma distribuição heterogênea de composição ao longo da partícula. Deste modo, torna-se necessária uma técnica química para quantificação do elemento formador de excesso de superfície. Isto é, a presença de um componente do sistema preferencialmente na superfície de uma partícula torna-o acessível a ácidos e bases que podem promover a remoção deste componente via solubilização seletiva. Neste trabalho, o sistema MgO-SnO2 foi utilizado para demonstrar e quantificar a formação de excesso de superfície de MgO na matriz de SnO2. Os sistemas à base de SnO2 preparados por métodos químicos são geralmente nanométricos e potencialmente interessantes para estudos do efeito da superfície nas propriedades nanométricas. Isto porque os sistemas à base de SnO2 usualmente não apresentam transições de fases, não reagem facilmente formando fases compostas, a atividade da superfície na modificação e no controle de tamanho das partículas é relativamente de fácil detecção, e a solubilidade do SnO2 é muito baixa em meios ácidos ou básicos [9, 17, 18]. Ademais, vários resultados mostram a existência de uma distribuição heterogênea espontânea dos íons aditivos quando SnO2 nanométrico é preparado pelo método Pechini, existindo um excesso de superfície, seja de cátions ou ânions [10, 15, 17, 19, 20]. Ao contrário do SnO2, que reconhecidamente possui alta estabilidade química e baixa solubilidade, o MgO apresenta alta solubilidade em meios aquosos ácidos [18], tornando-se um excelente candidato para remoção por lavagem química caso esteja localizado na superfície do SnO2 após a síntese. O presente trabalho tem como objetivo quantificar a presença de MgO na superfície do SnO2 preparado pelo método Pechini após sua segregação espontânea já reportada anteriormente [12]. Para isso foram utilizadas técnicas de dosagem química por fluorescência de raios X (FRX) antes e após a lavagem dos pós nanométricos em solução de ácido nítrico. Com a lavagem foi constatada a remoção exclusivamente dos íons magnésio da superfície imediatamente em contato com a solução e, assim, foi possível determinar qual a quantidade segregada na superfície e calcular a quantidade de MgO em solução sólida no SnO2.
MATERIAIS E MÉTODOS
A rota química de obtenção dos pós de SnO2 puro e contendo aditivos em diferentes concentrações molares foi o método derivado da patente proposta por Pechini [20]. Os materiais utilizados foram: etileno glicol HOCH2CH2OH (Synth), ácido cítrico HOC(CH2CO2H)2CO2H (Synth), cloreto de estanho SnCl2.H2O (Synth), solução de amônia 2 N (Synth P.A.) e ácido nítrico HNO3 (Synth P.A.), além de carbonato de magnésio MgCO3 (Synth). A preparação do citrato de estanho foi feita a partir de uma solução contendo ácido cítrico (0,25 mol/L) e cloreto de estanho (0,5 mol/L). A precipitação ocorre quando o pH da solução atinge o valor de 3, resultando em um pó branco [20]. O precipitado de citrato de estanho é então filtrado e lavado abundantemente (3 L de água para cada 100 g de sólido), sendo seco em estufa a 60 °C durante 24 h. Esta rota foi proposta inicialmente [20], fornecendo o produto cuja fórmula é Sn2(C6O7H4 ).H2O. A preparação da mistura precursora foi feita através da adição de ácido cítrico em etileno glicol previamente aquecido a aproximadamente 70 °C. Nesta temperatura, a dissolução foi completa, mas sem o início da reação de polimerização. O citrato de estanho foi então introduzido na solução em quantidade de 20,6% em massa, sendo dissolvido em uma mistura de 47,7% em massa de ácido cítrico e 31,7% em massa de etileno glicol. Como o citrato de estanho é pouco solúvel no etileno glicol, uma solução concentrada de HNO3 foi adicionada lentamente para se obter uma dissolução completa. Neste ponto, vapores de gás NOx foram observados, e a emissão gasosa é associada com a oxidação do estanho (II) em estanho (IV) [20]. Pequenas quantidades de água foram adicionadas para controlar a forte reação exotérmica, quando necessário. A temperatura foi mantida a aproximadamente 120 °C durante a dissolução, formando um polímero viscoso (resina). A adição de magnésio foi realizada através de uma solução de MgCO3 em meio ácido obtido a partir da solução aquosa de ácido nítrico. Esta solução foi introduzida diretamente na resina de citrato de estanho e aquecida a 70 °C para garantir a homogeneidade da distribuição do aditivo. As composições preparadas são indicadas segundo a composição molar (1-x) SnO2 + x MgO, onde x variou entre 0 e 0,1, ou seja de 0 a 10% molar de MgO. O precursor líquido foi inicialmente aquecido a 450 °C durante 4 h e desaglomerado em almofariz de ágata. Em seguida, o material foi calcinado por 15 h a 500 °C para obtenção de um pó nanométrico.
Os pós calcinados foram caracterizados quanto à estrutura cristalina e possível formação de segunda fase através de análises de difração de raios X (DRX) em um difratômetro Bruker-AXS D8 Advance, com radiação Kα do cobre (λ=1,5404 Å). As medidas foram feitas com passo de 0,02° por 5 s no intervalo 20° < 2θ < 80°.
Resultados reportados previamente de medidas de mobilidade eletroacústica dinâmica fornecem evidências que íons de Mg presentes na estrutura do SnO2 podem ser dissolvidos em pH abaixo de 9 [12]. Para garantir que todo o Mg2+ em contato com a solução de ácido nítrico fosse solubilizado, foi utilizada neste trabalho para o processo de lavagem química uma solução de HNO3 concentrado para garantir que o pH seja mantido muito abaixo de 9 durante todo o processo de lavagem. A primeira etapa de lavagem foi realizada durante 5 h em todos os pós, utilizando em média 15 mL de ácido nítrico concentrado com um volume de sólidos de aproximadamente 5 mL. Ao fim das 5 h houve sedimentação espontânea dos pós sob lavagem, quando foi adicionado aproximadamente 20 mL de H2O deionizada para diluição e remoção do ácido por separação de fases. Este processo foi repetido 6 vezes até que a sedimentação se tornasse bastante dificultada, semelhante à dispersão de SnO2 em água. Após essa etapa de remoção do ácido remanescente, os pós foram levado à estufa durante 12 h para secagem. Os pós lavados e os não lavados foram submetidos à análise química por espectrometria de fluorescência de raios X no equipamento Philips PW2404. Os dados foram normalizados em relação ao sinal do SnO2. Assim, para todas as concentrações, antes e após a lavagem, foi denominado "sinal FRX" a razão entre a porcentagem detectada de MgO em relação à porcentagem detectada de SnO2. Com os resultados dos pós não-lavados, foi obtida uma curva de calibração.
A avaliação microestrutural dos pós foi feita por meio de medidas de área de superfície específica, ASE, com experimentos de adsorção-desorção de N2 (método BET). No caso das análises de ASE as amostras foram tratadas para a remoção de gases adsorvidos (principalmente vapor de água) que potencialmente prejudicariam as análises. Esta etapa foi realizada em baixa pressão (~60 mTorr) a 250 °C no equipamento VacPrep 061 da Micromeritics. As medidas foram efetuadas em um aparelho Gemini III 2375 Surface Area Analyser do mesmo fabricante. O cálculo do tamanho médio de partículas, DASE, foi feito a partir das medidas de ASE - DASE = 6/ (ASE.ρ), considerando aproximação esférica das partículas. Como o MgO é menos denso que o SnO2, pode ocorrer alteração da densidade final do material obtido. Assim, a densidade teórica foi estimada pela seguinte equação:
onde MSn e MMg são as massas molares dos respectivos óxidos, n é o número de mols de aditivo por mol de óxido referente ao cátion aditivo e Vm é o volume molar, que sempre é considerado como igual ao do SnO2 puro (Vm = 21,67 cm3/g) desde que não é esperada forte distorção dos parâmetros de rede [12]. Espectroscopia de infravermelho de todos os pós foi realizada com a técnica de refletância difusa (DRIFT). O equipamento utilizado foi o Magna 560 (Nicolet) e a preparação dos pós consistiu em secagem em estufa por 6 h a 60 °C.
RESULTADOS E DISCUSSÃO
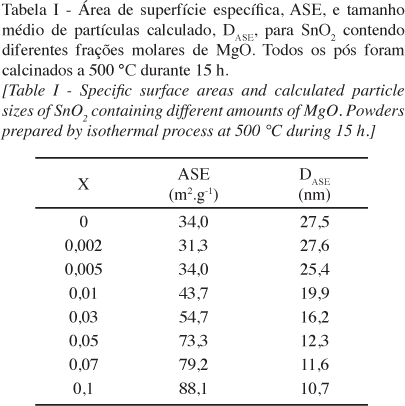
Os resultados de ASE e de tamanho médio de partículas calculados para os pós de SnO2 contendo diferentes adições de MgO mostram que a presença do aditivo favorece o aumento da ASE, refletido na diminuição do tamanho de DASE (Tabela I).
Este efeito já foi descrito anteriormente na literatura para o SnO2 contendo diferentes aditivos catiônicos e aniônicos, inclusive o MgO [10-12]. Como foram detectados na superfície por diferentes técnicas, estes aditivos foram então considerados como tenso-ativos na fase sólida, que tem como conseqüência a diminuição da energia de superfície em função da segregação dos íons [11]. Isto é, apesar do sistema não se encontrar em equilíbrio termodinâmico, as equações fundamentais da termodinâmica de superfície podem ser aplicadas de modo qualitativo. Portanto, se existe uma solubilização heterogênea em um sistema bi-componente sem aparecimento de uma segunda fase, o excesso de superfície leva a uma diminuição da energia de superfície segundo a equação de Gibbs:
onde Γ2 é excesso de superfície do componente 2 em 1 e é dado em mol/m2, Γ é a energia de superfície por unidade de área (J/m2) do componente 1 e c2 a concentração total do componente 2. Ou seja, se há excesso de superfície de 2 em 1 haverá uma diminuição sistemática da energia de superfície com o aumento da concentração de 2 em 1. Como o tamanho final de partículas é diretamente proporcional à energia de superfície e ao coeficiente de difusão, como descrito pela equação de maturação de Ostwald [11], no caso de solubilização haveria aumento do coeficiente de difusão e do tamanho final das partículas devido à formação de defeitos. Já no caso de segregação (formação de excesso de superfície), ocorreria diminuição da energia de superfície como demonstrado na equação B e, por conseqüência, diminuição do tamanho final de partícula. Estes dois comportamentos são observados nos resultados da Tabela I. De fato, esta aproximação só é válida se apenas uma fase estiver presente durante a cristalização do material. Para o sistema estudado neste trabalho, as análises de DRX mostram que somente SnO2 é formado durante a cristalização de todas as composições de SnO2 dopado com MgO apresentadas, e a diferença observada entre os difratogramas se dá unicamente devido ao alargamento dos picos devido à diminuição do tamanho de cristalito (Fig. 1).
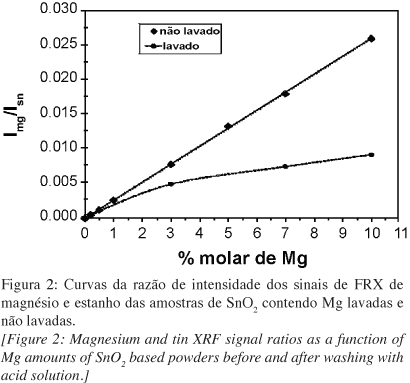
Apesar da presença do MgO na superfície ser evidenciada pelo aumento da AES em função de sua concentração, cabe notar que a evolução desta área com o aumento na concentração de aditivo não é regular, principalmente em concentrações baixas. Isso indica que o comportamento de solubilização do MgO é competitivo entre o bulk e a superfície. Ou seja, da concentração de MgO introduzida no sistema, parte dela está em solução sólida e parte em excesso de superfície. Para determinar a quantidade efetiva de aditivo em cada alíquota, foi realizada lavagem química do aditivo superficial e realizados ensaios de fluorescência de raios X para quantificação. As curvas da razão das intensidades do sinal de Mg e do sinal Sn nas análises de fluorescência em função da quantidade nominal de Mg introduzida nos pós de SnO2 antes e depois da lavagem são mostrados na Fig. 2.
Os resultados dos materiais não lavados apresentam uma relação linear entre a quantidade introduzida e a razão dos sinais. Desta forma, esta curva pode ser considerada uma "curva de calibração" e demonstra a qualidade das amostras preparadas e a eficiência do método. Por outro lado, após a lavagem, a quantidade de Mg2+ com relação ao Sn4+ diminui significativamente, e principalmente para as amostras com maior teor de Mg2+. O resultado indica que o Mg2+ é solubilizado com relação ao Sn e que o material solubilizado pode vir das primeiras camadas superficiais do material. Como já demonstrado para outros sistemas [9], não foram observadas partículas de segunda fase por microscopia eletrônica de transmissão e pode-se esperar que o material solubilizado seja o Mg2+ segregado na superfície do SnO2. Neste ponto, conhecendo a quantidade total de Mg introduzido e supondo que somente o Mg da superfície foi solubilizado, pode-se calcular a porcentagem de aditivo superficial e a quantidade solúvel em camadas mais profundas (bulk).
A Fig. 3 apresenta os resultados em porcentagem da quantidade total na superfície ou no bulk em função da concentração de MgO introduzida para cada composição. A solubilidade para pequenas concentrações de MgO é muito maior no bulk que na superfície. Para a quantidade de 0,2 %, praticamente 100% do MgO encontra-se solubilizado em camadas cristalinas mais profundas dos grãos de SnO2, não podendo ser dissolvido pela solução ácida. A solubilização preferencial no interior do grão pode explicar a redução da área de superfície específica observada para esta concentração. Com o aumento da concentração total de MgO, porcentagens cada vez maiores de MgO encontram-se na superfície. Este dado é consistente com o aumento da ASE ocorrendo sistematicamente até 10% de MgO. Para concentração próxima de 5% em mol de MgO, 50% deste encontra-se preferencialmente na superfície, enquanto que 50% encontra-se solúvel no bulk. A partir da concentração de 5% a maioria do MgO encontra-se nas primeiras camadas cristalinas das partículas de SnO2 a partir da superfície. As variações de concentração tanto na superfície quanto no bulk parecem atingir um patamar próximo a 10% em mol de MgO.
Para avaliar o efeito da remoção do MgO na microestrutura dos pós, os materiais lavados em solução de ácido nítrico tiveram suas ASE medidas e comparadas com as mesmas amostras sem o tratamento (Tabela II). Nenhuma mudança significativa foi observada dentro da tolerância de 5% da precisão das medidas de ASE pelo método BET. Este resultado mostra que se, algum magnésio foi solubilizado durante o tratamento de lixiviação, nenhuma alteração significativa da microestrutura foi observada mesmo do ponto de vista de formação de rugosidade superficial nas partículas de SnO2. Somente alguma diminuição de tamanho médio das partículas é observada para as maiores concentrações de MgO estudadas, mas ainda dentro dos erros das medidas.
Apesar da modificação não ser observável pelos ensaios de área específica, em se tratando de modificações químicas da superfície, a eliminação do Mg2+ da superfície do SnO2 deve acarretar em alterações das ligações químicas das hidroxilas adsorvidas na superfície quando o material interage com a umidade do ambiente. Isto é, em condições usuais de trabalho, moléculas de H2O interagem com a superfície de óxidos para compensação de ligações química semi-completadas. Estas interações levam à formação de hidroxilas superficiais, que têm a energia de suas ligações dependente da química da superfície na qual está adsorvida. Nesta condição, os espectros de DRIFT podem comprovar a modificação superficial dos pós. Na Fig. 4 comparam-se os espectros de FTIR dos pós preparados pelo método Pechini a 500 °C 15 h do SnO2, do MgO, do SnO2 contendo 7% de MgO e este último após lavagem ácida.
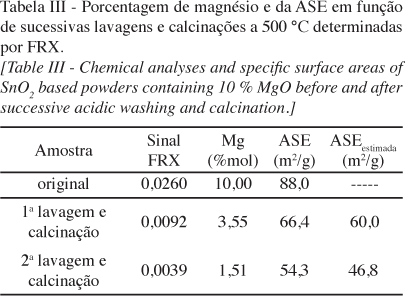
A presença da vibração de estiramento da hidroxila a 3477 cm-1 não é percebida para o SnO2 contendo 7% MgO, enquanto que a mesma é verificada na superfície do SnO2 e também do SnO2 7% MgO lavado. Isto indica que, após a lavagem do Mg, a superfície do SnO2 é revelada. Outra evidência é que a banda a 1388 cm-1, característica de formação de carbonato de magnésio, desaparece da superfície do SnO2 após a lavagem. Como esta espécie existe somente na superfície [21] na forma de carbonato adsorvido, uma vez que o Mg2+ é lixiviado da superfície as vibrações desaparecem. Apesar de não serem observadas modificações microestruturais causadas pela remoção do Mg superficial, o efeito desta modificação pode ser percebido na evolução do material sob novo tratamento térmico. Isto é, foi descrito na seção experimental deste trabalho que todos os pós sintetizados foram calcinados a 500 ºC por 15 h para garantir equilíbrio do tamanho de partícula. No entanto, cabe notar que este equilíbrio é dependente da energia de superfície segundo a equação de coalescimento de Ostwad [22]. Assim, caso haja remoção do Mg como excesso de superfície, a energia de superfície aumentará, induzindo modificação no tamanho final das partículas através de um efeito tensoativo reverso. A Tabela III mostra os dados de AES para o pó de SnO2 contendo 10% de MgO antes e após duas seqüências de lavagem. Inicialmente (antes das lavagens), o pó apresentava uma área de 88 m2/g. Após a primeira lavagem, ocorreu a remoção de Mg conforme já mencionado na Tabela II. Isto é, o pó passou a conter apenas cerca de 3,5% de Mg, estando este 100% distribuído no bulk das partículas (desde que o material foi lavado superficialmente). No entanto, imediatamente após a lavagem o pó não se encontrava em equilíbrio como após a calcinação inicial de 15 h. Para verificar o novo equilíbrio, o pó foi re-calcinado a 500 ºC por 15 h e re-avaliado. De fato, após a re-calcinação a área do pó foi reduzida para 66 m2/g, revelando a mudança na superfície. Quando são comparadas a área deste material lavado com aquela de um material já inicialmente fabricado com 3,5% Mg (estimada na Tabela III por interpolação), nota-se que as áreas são relativamente consistentes. Isso pode indicar que após a re-calcinação houve uma re-distribuição dos íons de Mg que estavam preferivelmente no bulk do SnO2 para alocarem-se na superfície. Este novo equilíbrio teria relação com a diminuição de energia do sistema causada pelo excesso de superfície de Mg. Caso esta hipótese de re-distribuição seja verdadeira, uma segunda lavagem deve dissolver a mesma quantidade de Mg que quando submetendo um pó contendo inicialmente 3,5% MgO à mesma lavagem. De fato, a Tabela III indica que cerca de 40% do Mg é lixiviado após a segunda lavagem, o que é consistente com os dados apresentados nas Figs. 2 e 3 sobre as lavagens em pós inicialmente sintetizados com concentrações semelhantes. Isso demonstra que o pó atingiu o novo equilíbrio pela redistribuição dos íons, demonstrando a relevância dos íons formadores de excesso de superfície na microestrutura final de um nanomaterial.
CONCLUSÕES
Pós nanométricos de SnO2 contendo MgO foram preparados pelo método Pechini nas concentrações de 0 a 10% em mol de MgO a 500 °C por 15 h. A evolução da área de superfície específica mostra uma forte estabilização devido à presença do MgO na superfície do SnO2. Através de lavagens ácidas foi possível solubilizar o MgO presente na superfície dos diferentes pós de SnO2 e através de análises química por FRX determinar as quantidades do aditivo na superfície e no bulk do material. Para concentrações até 5% em mol de MgO a maioria do aditivo encontra-se no bulk e para quantidades acima deste valor a superfície apresenta maior quantidade de MgO que no bulk, demonstrando saturação da rede e estabilização do aditivo na superfície. A segregação deve reduzir a energia de superfície do pó fazendo com que haja estabilização do tamanho de partículas. Medidas de energia de superfície serão realizadas através de calorimetria de dissolução para comprovação do fenômeno.
AGRADECIMENTOS
À CAPES pela bolsa e à FAPESP pelos recursos obtidos nos projetos Temático 05/53241-9, Auxílio Individual 03/12721-2, Jovem Pesquisador 05/55335-0.
Rec. 27/10/2008, Ac. 13/12/2008
- [1] S. Ii, H. Yoshida, K. Matsui, N. Ohmichi, Y. Ikuhara, J. Am. Ceram. Soc. 89, 9 (2006) 2952.
- [2] P. J. B. Marcos, D. Gouvêa, Cerâmica 50, 313 (2004) 38.
- [3] R. H. R. Castro, P. J. B. Marcos, A. Lorriaux, M. C. Steil, L. Gengembre, P. Roussel, D. Gouvea, Chem. Mater. 20, 10 (2008) 3505.
- [4] R. H. R. Castro, S. V. Ushakov, L. Gengembre, D. Gouvea, A. Navrotsky, Chem. Mater. 18, 7 (2006) 1867.
- [5] G. J. Pereira, D. Gouvea, S. M. Hiraoka, Influence of tin oxide addition in the morphologic characteristics of zinc oxide powders synthesized by Pechini's method, in Advanced Powder Technology Iv, Zurich-Uetikon, Trans Tech Publ. Ltd. (2005) 704.
- [6] B. S. Han, Y. R. Uhm, G. M. Kim, C. K. Rhee, J. Nanosci. Nanotechnol. 7, 11 (2007) 4158.
- [7] R. H. R. Castro, P. Hidalgo, H. E. M. Perez, F. J. Ramirez-Fernandez, D. Gouvea, Sens. Actuator B-Chem. 133, 1 (2008) 263.
- [8] P. Hidalgo, R. H. R. Castro, A. C. V. Coelho, D. Gouvea, Chem. Mater. 17, 16 (2005) 4149.
- [9] R. H. R. Castro, P. Hidalgo, J. A. H. Coaquira, J. Bettini, D. Zanchet, D. Gouvea, Eur. J. Inorg. Chem. 11 (2005) 2134.
- [10] M. C. Esteves, D. Gouvea, P. T. A. Sumodjo, Appl. Surf. Sci. 229, 1-4 (2004) 24.
- [11] R. H. R. Castro, P. Hidalgo, R. Muccillo, D. Gouvea, Appl. Surf. Sci. 214, 1-4 (2003) 172.
- [12] G. J. Pereira, R. H. R. Castro, P. Hidalgo, D. Gouvea, Appl. Surf. Sci. 195, 1-4 (2002) 277.
- [13] R. H. R. Castro, G. J. Pereira, D. Gouvea, Appl. Surf. Sci. 253, 10 (2007) 4581.
- [14] D. Gouvea, A. Smith, J. P. Bonnet, J. A. Varela, J. Eur. Ceram. Soc. 18, 4 (1998) 345.
- [15] D. Gouvea, A. Smith, D. S. Smith, J. P. Bonnet, J. A. Varela, J. Am. Ceram. Soc. 80, 10 (1997) 2735.
- [16] J. A. Cerri, E. R. Leite, D. Gouvea, E. Longo, J. A. Varela, J. Am. Ceram. Soc. 79, 3 (1996) 799.
- [17] D. Gouvea, A. Smith, J. P. Bonnet, Eur. J. Solid State Inorg. Chem. 33, 10 (1996) 1015.
- [18] J. Nowotny, L.-C. Dufour, Surface and Near-Surface Chemistry of Oxide Materials, Elsevier, Nova York, EUA (1988) p. 713.
- [19] D. Gouvea, J. A. Varela, A. Smith, J. P. Bonnet, Eur. J. Solid State Inorg. Chem. 33, 4 (1996) 343.
- [20] D. Gouvea, J. A. Varela, E. Longo, A. Smith, J. P. Bonnet, Eur. J. Solid State Inorg. Chem. 30, 9 (1993) 915.
- [21] R. Philipp, K. Fujimoto, J. Phys. Chem. 96, 22 (1992) 9035.
- [22] Y.-M. Chiang, D. Birnie, W. D. Kingery, Physical Ceramics - Principles for Ceramic Science and Engineering, John Wiley & Sons Inc., Nova York, EUA (1997) p.
Quantificação da segregação de MgO em pós nanométricos de SnO2 preparados por método químico
Datas de Publicação
-
Publicação nesta coleção
05 Jul 2010 -
Data do Fascículo
Dez 2009
Histórico
-
Aceito
13 Dez 2008 -
Recebido
27 Out 2008