Resumos
Muitos resíduos valiosos gerados na fabricação de jóias se perdem pela falta de conhecimento técnico para a recuperação dos metais preciosos utilizados na sua elaboração. Esse trabalho apresenta os resultados experimentais, em escala de bancada laboratorial, do uso de uma rota hidrometalúrgica para tratar sucatas de jóias de ouro empregando amostras com teores acima e abaixo de 10% de Ag. A rota adotada consistiu de uma lixiviação preliminar das amostras com HNO3 para extrair a prata, seguida de uma lixiviação com água-régia do resíduo sólido de ouro da lixiviação anterior para solubilizar o ouro contido. Alguns parâmetros típicos da etapa de lixiviação foram avaliados com o emprego de um planejamento estatístico de experimentos pelo método fatorial completo a dois níveis experimentais. As condições experimentais ótimas para a máxima extração metálica foram determinadas pelo método estatístico do passo ascendente. Os licores de lixiviação foram tratados visando à recuperação do ouro e da prata. A recuperação da prata (94%) ocorreu pela calcinação do AgCl, obtido com a adição de NaCl ao licor de HNO3, e a recuperação de ouro (98,7%) deu-se pela precipitação com a adição de FeSO4 ao licor de água-régia.
Ouro; prata; metais preciosos; recuperação; lixiviação; hidrometalurgia
A great amount of scrap metal waste is lost in the manufacturing of gold jewelry due the lack of available knowledge for precious metal recovery in small jewelery shops. This study presents the experimental results on a bench laboratory scale of a hydrometallurgical route to treat gold jewelry scrap using samples with proportions that are higher and lower than 10% Ag. The adopted route consisted of preliminary sampling, leaching with HNO3 to extract the silver, followed by aqua regia leaching of a gold solid residue from the previous leaching stage to dissolve the contained gold. Some typical parameters of the leaching stage were evaluated with the use of a statistical planning of experiments by "The complete Factorial Method" with two experimental levels. The optimum experimental conditions for the maximum metallic extraction were determined by "the ascending path method for statistical optimization". The leaching liquors were treated, aiming for the gold and silver recovery. The silver recovery (94%) occurred by the AgCl calcination obtained with the NaCl added to the HNO3 liquor, and the gold recovery (98.7%) was obtained by the precipitation with the FeSO4 added to the aqua regia liquor.
Gold; silver; precious metals; scrap jewelry treatment; leaching; hydrometallurgy
METALURGIA & MATERIAIS
Reciclagem de sucata de jóias para a recuperação hidrometalúrgica de ouro e prata
Scrapped jewel recycling for the gold and silver hydrometallurgical recovery
Carol Elizabeth Barrientos RojasI; Afonso Henriques MartinsII
IMestre, Curso de Pós-Graduação em Engenharia Metalúrgica e de Minas. CPGEM/UFMG - E-mail: cebarrientos@gmail.com
IIProfessor Associado, D.Sc. Curso de Pós-Graduação em Engenharia Metalúrgica e de Minas. CPGEM/UFMG - E-mail: ahmartin@demet.ufmg.br
Resumo
Muitos resíduos valiosos gerados na fabricação de jóias se perdem pela falta de conhecimento técnico para a recuperação dos metais preciosos utilizados na sua elaboração. Esse trabalho apresenta os resultados experimentais, em escala de bancada laboratorial, do uso de uma rota hidrometalúrgica para tratar sucatas de jóias de ouro empregando amostras com teores acima e abaixo de 10% de Ag. A rota adotada consistiu de uma lixiviação preliminar das amostras com HNO3 para extrair a prata, seguida de uma lixiviação com água-régia do resíduo sólido de ouro da lixiviação anterior para solubilizar o ouro contido. Alguns parâmetros típicos da etapa de lixiviação foram avaliados com o emprego de um planejamento estatístico de experimentos pelo método fatorial completo a dois níveis experimentais. As condições experimentais ótimas para a máxima extração metálica foram determinadas pelo método estatístico do passo ascendente. Os licores de lixiviação foram tratados visando à recuperação do ouro e da prata. A recuperação da prata (94%) ocorreu pela calcinação do AgCl, obtido com a adição de NaCl ao licor de HNO3, e a recuperação de ouro (98,7%) deu-se pela precipitação com a adição de FeSO4 ao licor de água-régia.
Palavras-chave: Ouro, prata, metais preciosos, recuperação, lixiviação, hidrometalurgia.
Abstract
A great amount of scrap metal waste is lost in the manufacturing of gold jewelry due the lack of available knowledge for precious metal recovery in small jewelery shops. This study presents the experimental results on a bench laboratory scale of a hydrometallurgical route to treat gold jewelry scrap using samples with proportions that are higher and lower than 10% Ag. The adopted route consisted of preliminary sampling, leaching with HNO3 to extract the silver, followed by aqua regia leaching of a gold solid residue from the previous leaching stage to dissolve the contained gold. Some typical parameters of the leaching stage were evaluated with the use of a statistical planning of experiments by "The complete Factorial Method" with two experimental levels. The optimum experimental conditions for the maximum metallic extraction were determined by "the ascending path method for statistical optimization". The leaching liquors were treated, aiming for the gold and silver recovery. The silver recovery (94%) occurred by the AgCl calcination obtained with the NaCl added to the HNO3 liquor, and the gold recovery (98.7%) was obtained by the precipitation with the FeSO4 added to the aqua regia liquor.
Keywords: Gold, silver, precious metals, scrap jewelry treatment, leaching, hydrometallurgy.
1. Introdução
O ouro (Au), a prata (Ag) e outros metais preciosos são empregados na confecção de jóias sob a forma de ligas com outros metais. Esses metais preciosos são escassos na natureza, embora a sua quantidade explorável aumente a cada ano como resultado da mineração, no entanto a proporção é menor em comparação com a oferta disponível (Molina, 2008).
Na última década, o setor de jóias, no Brasil, tem alcançado melhoras substanciais nos níveis de qualidade e competitividade, desenvolvendo seu potencial de exportação. A produção do ouro se dá em quase todo o Brasil, em especial nos estados de Minas Gerais, Pará, Bahia, Mato Grosso, Goiás e Tocantins. As mineradoras são responsáveis por 65% da produção do ouro. O maior número de empresas processadoras de ouro, para uso em jóias, encontra-se nos estados de São Paulo, Minas Gerais, Rio Grande do Sul, Rio de Janeiro, Amazonas e Paraná (IBGM, 2009).
Adicionado ao alto custo dos metais preciosos, muitos resíduos valiosos são gerados na fabricação das jóias, os quais se perdem pela falta de conhecimento para sua recuperação. A sucata de jóias com alto teor de ouro é aquela onde o teor de ouro é maior ou igual a 20%. O resíduo produzido pelos joalheiros é composto por resíduos nas bancadas como limalhas e recortes, o resíduo de casting (processo onde o metal líquido é solidificado dentro de uma fôrma), jóias defeituosas (conhecidas também como sucata), sedimentos dos procedimentos de eletrorrecuperação ou eletrorrefino, entre outros (Corti, 2002).
Esses resíduos com alto teor de ouro são passíveis de tratamento, já que são formados, praticamente, só por metais, sendo que alguns deles são desejáveis, já que formam parte da liga inicial e outros indesejáveis, uma vez que são incorporados por acidente, durante a manipulação, sendo considerados, então, como impurezas (Barrientos, 2003). As impurezas podem alterar a quilatagem (k) (a quilatagem indica a proporção do ouro puro e dos outros metais contidos na liga numa relação de 24 partes). Por exemplo, uma jóia de 18 k, das 24 partes, 18 são de ouro puro e 6 são de liga. As impurezas também alteram as propriedades mecânicas das jóias até o ponto de não poderem ser mais trabalhadas, sendo a recuperação sua única destinação (Loewen, 1995). Levando em consideração esses aspectos, avaliou-se uma rota hidrometalúrgica para a recuperação do ouro e da prata contidos em sucatas de jóias à base de ouro, visando a conferir uma abordagem de engenharia a um tratamento empírico, que pode ser empregado por joalherias de pequeno porte (Barrientos, 2009).
A rota adotada consistiu de uma lixiviação preliminar das amostras com HNO3 para extrair a prata, seguida de uma lixiviação com água-régia (mistura de HCl e HNO3 numa relação 3:1, respectivamente) do resíduo sólido da lixiviação anterior para solubilizar o ouro contido. Os licores de lixiviação foram tratados, visando à recuperação do ouro e da prata.
2. Materiais e métodos
As amostras empregadas, nos experimentos, foram jóias usadas e defeituosas de ouro de 10k amarelo e tricor (ouro de três cores ou tonalidades; amarelo, branco e vermelho; a cor depende do teor do metal empregado na liga; com a cor vermelha, a jóia tem mais cobre e, com a cor branca, a jóia tem mais prata e paládio) adquiridas no mercado. As amostras de sucata foram separadas, inicialmente, em seis grupos: correntes, pulseiras, anéis, pingentes, brincos e outros (grupo formado por aquelas peças que não integraram os demais grupos). Em seguida, as peças de cada grupo foram separadas segundo características similares de tamanho, tipo e cor; formando-se 17 subgrupos. As peças mais representativas de cada subgrupo foram, inicialmente, analisadas por Microscopia Eletrônica de Varredura acoplada a Espectrômetro de Raios X Dispersivo em Energia (MEV/EDS), para identificar os metais presentes e seus respectivos teor na liga. Tomou-se, como referência, o teor de prata (10%), já que um teor acima de 10% forma uma camada de AgCl sobre a sucata impedindo que a água-régia solubilize a amostra. Agruparam-se, em dois grandes grupos: o grupo A, com teor de prata acima de 10% e o grupo B, com teor de prata abaixo de 10%. De cada grupo, caracterizaram-se limalhas pelos métodos de Difração de Raios X (DRX), Fluorescência de Raios X (FRX) e pelo método de MEV/EDS. Amostras dos licores das lixiviações com HNO3 e água-régia foram caracterizadas por espectrometria de absorção atômica (AA).
Realizou-se uma lixiviação inicial com HNO3, para extrair a prata a partir das limalhas homogeneizadas de ambos os grupos A e B. O resíduo sólido da lixiviação com HNO3 foi lixiviado com água-régia para extrair o ouro contido. Nas etapas de lixiviação, foram avaliadas algumas variáveis consideradas mais importantes, tais como o tempo de lixiviação, a temperatura da solução aquosa de lixiviação e a relação sólido/líquido (massa da amostra/volume da solução de lixiviação).
Os experimentos de lixiviação seguiram um planejamento estatístico de experimentos tecnológicos pelo método fatorial completo a dois níveis experimentais e respostas replicadas (Box et al., 1988). Os resultados experimentais foram processados pelo método de otimização estatística do passo ascendente (Duckworth, 1960) com o objetivo de atingir o máximo percentual de extração metálica. Na lixiviação com HNO3, a otimização foi realizada para maximizar a extração da prata, enquanto que a lixiviação com água-régia visou a maximizar a extração do ouro. Os licores de lixiviação foram tratados visando à recuperação da prata e do ouro, avaliando os métodos empregados em função da simplicidade de operação, custo dos métodos, assim como os resultados de pureza obtidos. Para a prata, empregaram-se os licores de lixiviação com HNO3 e avaliaram-se os métodos: cementação com pó de zinco, precipitação com sulfato ferroso e calcinação do AgCl, este obtido a partir da adição de NaCl ao licor. Para o ouro, os licores da lixiviação com água-régia foram tratados por cementação com pó de zinco e precipitação com sulfato ferroso (Barrientos, 2009). Os produtos da recuperação da prata e do ouro foram caracterizados antes e após a fundição dos mesmos. As Tabelas 1 e 2 mostram o planejamento estatístico dos experimentos pelo método fatorial para a lixiviação com HNO3 e para a lixiviação com água-régia, respectivamente.
Os experimentos de lixiviação foram efetuados em um béquer de vidro borossilicato com capacidade nominal de 150ml acoplado a uma placa aquecedora com controle de agitação magnética. A unidade experimental foi montada no interior de uma capela de laboratório com ventilação forçada e a temperatura do sistema de lixiviação foi monitorada através do uso de um termômetro de mercúrio (-10/+110°C). Para a recuperação do ouro e da prata, os experimentos foram realizados em uma capela de laboratório com ventilação forçada. Empregou-se um béquer de vidro de borossilicato acoplado a uma placa com intensidade de agitação constante por duas horas e, posteriormente, a solução foi deixada em repouso durante a noite (overnight). Uma representação esquemática das etapas gerais do procedimento experimental empregado é mostrada na Figura 1.
3. Resultados e discussão
3.1 Caracterização das amostras
Inicialmente, as amostras foram caracterizadas por MEV/EDS com o objetivo de determinar os teores dos metais presentes nas ligas das jóias. Com os resultados obtidos, dois grupos de amostras foram formados: amostra A com teores de Ag acima de 10% e amostra B com teores de Ag abaixo de 10% (Barrientos, 2009). As amostras A e B foram formadas tendo como base o fato de que teores de Ag acima de 10% não são recomendados para uma lixiviação com água-régia porque a presença de Ag produz uma camada que recobre o material da amostra, o qual impede que esta seja lixiviada. O grupo A foi formado, unicamente, por subgrupos de jóias de ouro amarelo. O grupo B foi formado, na sua maioria, por subgrupos de jóias de ouro tricor.
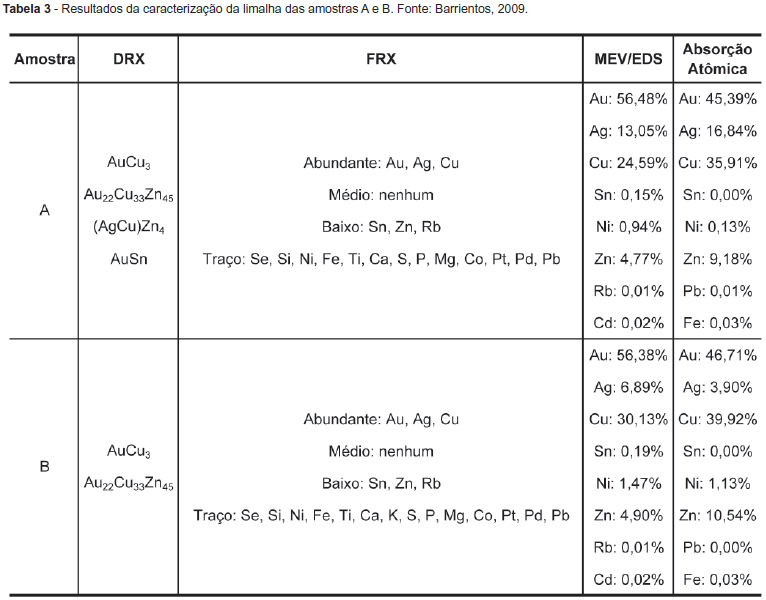
Com o objetivo de identificar os metais e determinar os seus teores, limalhas de amostras homogeneizadas dos grupos A e B foram caracterizadas pelos métodos de DRX, FRX e MEV/EDS. Os licores de lixiviação foram caracterizados, quimicamente, por AA. Na Tabela 3 são mostrados os resultados da caracterização das limalhas das amostras A e B.
Os resultados mostraram que as amostras A e B contêm os mesmos metais formadores da liga, apresentando diferença nos teores. Os resultados de DRX mostraram que a amostra A assim como a amostra B possuem as espécies AuCu3 e Au22Cu33Zn45, indicando que ambas as amostras contêm Au, Cu e Zn entre os principais metais que formam a liga. De acordo com os resultados de FRX, ambas as amostras têm Au, Ag e Cu em altos teores. Os principais metais, na liga, foram identificados por MEV/EDS como sendo Au, Ag, Cu, Zn, Sn e Ni, concluindo-se, também, que as ligas não contêm Cd nem Rb. A caracterização química por AA mostrou que a amostra A tem um teor acima de 10% de Ag (16,84% Ag) e a amostra B possui teor abaixo de 10% (3,90%). Com essa caracterização química, definiu-se que os principais metais que formam as ligas de ambas as amostras são Au, Ag e Cu. As amostras A e B contêm também Zn e Ni, que são empregados na elaboração das ligas de jóias de ouro. Embora o Fe seja um metal considerado como impureza e que poderia estar presente pelo uso do alicate no corte das limalhas, seu teor, em ambas as amostras, foi de apenas 0,03%.
3.2 Lixiviação das amostras
A metodologia de lixiviação empregada consistiu de uma lixiviação inicial das limalhas de amostras homogeneizadas dos grupos A e B com HNO3 para extrair a prata, seguida de uma lixiviação com água-régia para extrair o ouro contido no resíduo sólido da etapa anterior.
3.2.1 Lixiviação com HNO3
Na lixiviação com HNO3, obtiveram-se três produtos: (a) licor de lixiviação que continha os metais solubilizados da amostra, (b) prata precipitada na forma de AgCl pela adição de NaCl ao licor e (c) resíduo sólido de ouro que não reagiu com o HNO3. Amostras do licor gerado em cada experimento foram encaminhadas para análise química por espectrometria de absorção atômica, visando a determinar a concentração de ouro, prata e cobre, que são os metais com maior teor na liga. A amostra A apresentou teores de prata solubilizados no licor de lixiviação numa faixa de 60,46 a 100% e a amostra B, de 70,82 a 100% (vide Figura 2).
De acordo com os resultados do método fatorial, para um grau de confiança estatística de 95%, a única variável que teve influência sobre o percentual de extração de prata para a amostra A foi a temperatura (variável A), apresentando uma influência negativa, ou seja, o percentual de extração de prata diminuiu quando a temperatura foi aumentada do nível experimental inferior (25°C) para o nível experimental superior (60°C). Para a amostra B, a ordem decrescente de influência positiva na resposta experimental foi dada pelo tempo de lixiviação (variável B) e a temperatura (variável A).
A otimização dos resultados experimentais pelo método estatístico do passo ascendente determinou as condições para a máxima extração da prata (100%) e do cobre (100%), utilizando 0,5g de sucata de jóias. As condições ótimas foram: 32ml de HNO3, 1,5 horas (90min) e uma temperatura de 42°C para a amostra A e 45ml de HNO3, 2,25h (135min) e 43°C para a amostra B. Esses resultados mostraram que, em ambas as amostras, se requer uma temperatura média de 42°C para se atingir, a máxima extração de prata e cobre. Além disso, para a amostra B, foi necessário um maior volume de HNO3 e de tempo de lixiviação em comparação com a amostra A.
3.2.2 Lixiviação com água-régia
O resíduo sólido de ouro empregado nos testes foi resultado da lixiviação com HNO3 para 8g de cada amostra (A e B) nas condições ótimas. O uso de uma massa maior de amostra foi necessário para gerar uma massa de resíduo sólido de ouro que pudesse ser empregada nos experimentos de lixiviação com água-régia. O único produto obtido na lixiviação com água-régia foi o licor de lixiviação devido à total solubilização da amostra. Alíquotas de amostras dos licores da lixiviação com água régia foram caracterizadas, quimicamente, por espectrometria de absorção atômica (AA), visando a determinar a concentração de ouro, prata e cobre. Segundo os resultados apresentados na Figura 3, a amostra A apresentou teores de ouro solubilizado, no licor de lixiviação, numa faixa de 50 a 100% e a amostra B, de 86,86 a 100%.
Pelo método fatorial, determinou-se que, para um grau de confiança estatística de 95%, para a amostra A, as variáveis que possuem influência positiva em ordem decrescente sobre o percentual de extração de ouro são o tempo de lixiviação (variável B) e a temperatura (variável A). Para a amostra B, nenhuma variável apresentou influência sobre a resposta experimental a esse grau de confiança. Assim, outros valores de grau de confiança estatística foram testados e determinou-se que, para um grau de confiança estatística de 70%, a temperatura (variável A) passou a exercer influência positiva significativa sobre a extração de ouro na lixiviação com água-régia.
As condições ótimas determinadas pelo método do passo ascendente, para a máxima lixiviação do resíduo sólido de ouro (próximo a 100%) e para um volume de 0,04L de água-régia, foram: 0,141g resíduo sólido de ouro, 51min e 43°C para a amostra A e 0,057g de resíduo sólido de ouro, 47min e 43°C para a amostra B. Esses resultados mostraram que, para ambas as amostras, se requer uma temperatura média de 43°C, para atingir a máxima extração de ouro (98%). Além disso, observou-se que, para a amostra A, necessitou-se de uma massa maior de amostra na relação sólido/líquido nas condições otimizadas, isto é, sem a presença da prata, na amostra A, o sistema de lixiviação tornou-se mais susceptível à ação da água-régia, possibilitando que uma maior massa de amostra fosse solubilizada. Os tempos de lixiviação, em ambas as amostras, foram próximos.
3.3 Recuperação da prata
Os três métodos selecionados para avaliar a recuperação da prata presente nos licores da etapa de lixiviação com HNO3 foram cementação com pó de zinco, precipitação com FeSO4 e calcinação do AgCl, obtido pela adição de NaCl ao licor de HNO3. O objetivo da avaliação dos três métodos baseou-se nos melhores resultados conseguidos, simplicidade de operação, no custo do método, assim como na pureza da prata obtida. Visando a identificar a pureza dos produtos obtidos e, assim, a determinar o melhor método para a recuperação da prata, os produtos foram caracterizados antes e depois da fundição. Os produtos foram caracterizados por MEV/EDS e os resultados obtidos são apresentados na Tabela 4.
Segundo os resultados do MEV/EDS, no produto obtido na precipitação com FeSO4, observou-se um aumento no teor de Ag de 70% do produto em pó para 93,70% do produto fundido. E do produto de AgCl, obtido pela adição, este de NaCl ao licor de HNO3, o teor de Ag aumentou de 69,62% do produto em pó para, aproximadamente, 94%, para o produto fundido (calcinação). Para ambos os casos, o principal contaminante foi o Sn, com teores aproximados de 2%, uma vez que o Sn precipita como cloreto junto com a prata. O pior resultado obtido foi para a cementação com pó de zinco metálico, 45% de Ag. A precipitação com FeSO4 e o AgCl alcançou teores de prata similares nos produtos em pó (70%) e fundidos (94%). Portanto pode-se concluir, pelo teor de prata atingido, que o melhor método, para recuperar a prata, foi a calcinação do AgCl, a partir da precipitação com a adição de NaCl, que é um reagente de baixo custo e simples de ser empregado.
3.4 Recuperação do ouro
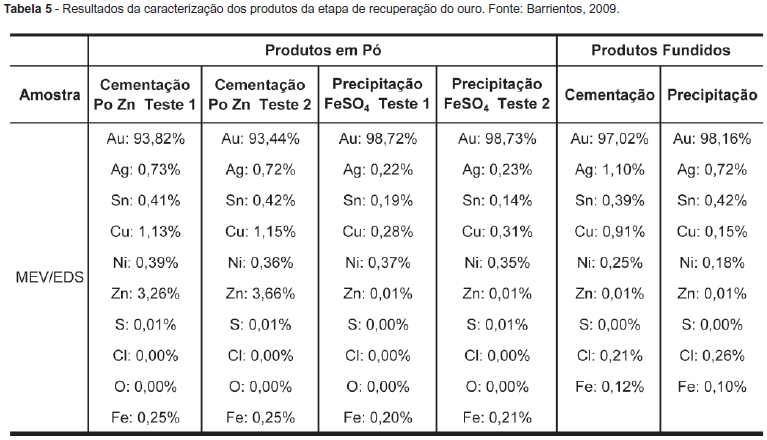
A recuperação do ouro presente nos licores da etapa de lixiviação com água-régia deu-se através de cementação com pó de zinco e precipitação com sulfato ferroso. Com relação à prata, visou-se a identificar a pureza dos produtos obtidos e a determinar o melhor método para a recuperação do ouro. Os produtos dos métodos empregados foram caracterizados antes e depois da etapa de fundição por MEV/EDS e os resultados são mostrados na Tabela 5.
Os resultados do MEV/EDS, para a cementação de ouro com pó de Zn, mostraram que o teor de Au aumentou de 93,5% do produto em pó para 97% do produto fundido. No Zn, a impureza de maior teor, no produto em pó, diminuiu para 0,01%. Para a precipitação com FeSO4, o teor de Au diminuiu de 98,72% do produto em pó para 98,16% do produto fundido e o teor de Ni (a maior impureza no produto em pó) reduziu-se pela metade. Em ambos os casos, o teor de Ag aumentou depois da fundição da amostra. Na precipitação com FeSO4, o teor de Sn também aumentou. O teor mais baixo foi obtido no produto em pó da cementação com pó de Zn (93,5% de Au). Os melhores resultados foram obtidos no produto em pó da etapa de precipitação com FeSO4 (98,72% de Au) antes da fundição, uma vez que a amostra pode ter sido contaminada durante a fundição. Portanto pode-se concluir, pelos resultados obtidos, que o método mais indicado para recuperar o ouro foi a precipitação com FeSO4. Além disso, os resultados mostraram que a etapa de fundição dos produtos em pó deve ser realizada em ambiente fechado e limpo para evitar a contaminação com outros metais.
4. Conclusões
A partir dos resultados obtidos foi possível concluir que:
a. As ligas originais das amostras A e B apresentaram os mesmos metais, tendo uma pequena diferença nos valores dos teores.
b. Os principais metais na liga de sucata de jóias de 10k, determinados pela análise química por espectrometria de absorção atômica, foram Au, Ag e Cu, sendo que os teores encontrados, para a amostra A, foram: 45,39% de Au, 16,84% de Ag e 35,91% de Cu e, para a amostra B, foram: 46,71% de Au, 3,90% de Ag e 39,92% de Cu.
c. Na lixiviação com HNO3, as condições ótimas para uma total lixiviação da prata e do cobre, para a amostra A, foram 32ml de HNO3, 1,5 horas (90 minutos) e 42°C. Para a amostra B, as condições ótimas foram 45ml de HNO3, 2,25 horas (135 minutos) e 43°C.
d. As condições ótimas para a lixiviação com água-régia, para a amostra A, foram 0,140g de resíduo sólido de ouro previamente lixiviado com HNO3, 0,85 horas (51 minutos) e 43°C. Para a amostra B, as condições ótimas foram 0,056g de resíduo sólido de ouro, 0,78h (47 minutos) e 43°C.
e. A temperatura foi a variável que apresentou influência significativa em ambas as amostras nas duas etapas da lixiviação.
f. Para a recuperação da prata, o método de calcinação, a partir de AgCl, obteve um teor de 94% de Ag, sendo que os principais contaminantes foram o Au e o Sn com teores de 2%, proximadamente.
g. A precipitação com FeSO4 apresentou os melhores resultados para a recuperação do ouro, obtendo-se teores de 98,7% de Au, sendo que a prata foi a impureza de maior teor (0,72%). Verificou-se um aumento no teor da prata após a etapa da fundição do produto em pó da precipitação com FeSO4. Os resultados mostraram que a etapa de fundição do produto em pó deve ser realizada em ambiente fechado e limpo para evitar a contaminação com outros metais.
5. Agradecimentos
Os autores agradecem ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) pelo apoio ao desenvolvimento deste trabalho experimental.
6. Referências bibliográficas
Artigo recebido em 10/07/2009
Aprovado em 29/09/2009.
- BARRIENTOS, C. Evaluación de dos métodos de recuperación y refinación de los metales preciosos a nivel laboratorio a partir de los desperdicios con alto contenido de oro Guatemala: Facultad de Ingeniería, USAC, 2003. 125p. (Monografia, Engenharia Química).
- BARRIENTOS, C. E. Reciclagem de sucata de jóias para a recuperação hidrometalúrgica de ouro e prata Belo Horizonte: Escola de Engenharia da Universidade Federal de Minas Gerais, 2009. 186p. (Dissertação de Mestrado em Engenharia Metalúrgica)
- BOX, G. P., HUNTER, W. G., HUNTER, P. J. Statistics for experimenters New York-USA: Ed. John Wiley & Sons Inc. , 1988. 653p.
- CORTI, C. W. Recovery and refining of gold jewelry scraps and wastes The Santa Fe Symposium on Jewelry Manufacturing Technology. United States of America, 2002. 20p.
- DUCKWORTH, W. E. Statistical techniques in technological research. Ed. Methuen & Co. Ltd., 1960. 303p.
- IBGM - Brazilian Gems & Jewellery Trade Association. The gems and jewellery sector in Brazil Setembro 2009. Disponível em: www.ibgm.com.br/index.cfm?saction=download&file...pdf
- LOEWEN, R. Small scale refining of jewelers wastes United States of America: Met-Chem Research Inc., 1995. 250p.
- MOLINA, J. R., El dólar Vs. el oro comprando petróleo República Bolivariana de Venezuela: outubro 2008. Disponível em: http://aporrea.org/tiburon/a65665.html
Datas de Publicação
-
Publicação nesta coleção
14 Jun 2010 -
Data do Fascículo
Jun 2010
Histórico
-
Recebido
10 Jul 2009 -
Aceito
29 Set 2009