Resumos
OBJETIVO:O 3º Consenso Brasileiro para pesquisa de autoanticorpos em Células HEp-2 (FAN) teve como propósito avaliar as dificuldades de implantação do 2º Consenso ocorrido no ano de 2002, discutir estratégias para controlar a qualidade do ensaio e promover a atualização das associações clínicas dos diversos padrões. MÉTODOS:Participaram do encontro em Goiânia nos dias 13 e 14 de abril de 2008 pesquisadores e especialistas de diversos centros universitários e laboratórios clínicos de diferentes regiões do Brasil, com o propósito de discutir e aprovar as recomendações que visam à melhor padronização, interpretação e utilização do ensaio pelos clínicos. Representantes comerciais de diferentes empresas produtoras de insumos para realização do teste de FAN foram convidados como ouvintes. RESULTADOS E CONCLUSÕES: O 3º Consenso enfatizou a necessidade do controle de qualidade em imunofluorescência dada a heterogeneidade de microscópios e reagentes disponíveis no mercado, promoveu adequações na terminologia utilizada para classificar os diferentes padrões e, finalmente, atualizou as associações clínicas com finalidade de facilitar cada vez mais o melhor uso do ensaio pelos clínicos.
autoanticorpos; células HEp-2; anticorpos antinúcleo; imunofluorescência
OBJECTIVE: The Third Brazilian Consensus for autoantibodies Screening in HEp-2 cells had as purpose the evaluation of difficulties in the accomplishment of the 2nd Consensus recommendations that took place in the year of 2002, the discussion of strategies for quality control of the assay and the promotion of an update of the clinical associations of the several immunofluorescent patterns. METHODS:Several ANA experts from university centers and private laboratories in different areas in Brazil joined the workshop in Goiânia on 2008 April 13 and 14 with the purpose of discussing and approving the recommendations for standardization, interpretation and use of the test by physicians. Commercial representatives of different ANA slide brands were also invited as listeners to the workshop. RESULTS AND CONCLUSIONS: The 3rd Consensus emphasized the need for quality control in indirect immunofluorescent since there is a considerable heterogeneity of available microscopes and reagents. It also promoted adaptations in the previously approved terminology used to classify the different patterns and finally updated the clinical associations of the several patterns with the purpose of providing guidance for interpretation of the assay by clinical pathologists and assistant physicians.
autoantibodies; HEp-2 cells; Antinuclear antibodies; immunofluorescent
ARTIGO ORIGINAL
3º Consenso Brasileiro para pesquisa de autoanticorpos em células HEp-2 (FAN). Recomendações para padronização do ensaio de pesquisa de autoanticorpos em células HEp-2, controle de qualidade e associações clínicas
Alessandra DellavanceI; Alexandre Gabriel JúniorII; Barbara NuccitelliIII; Ben Hur TalibertiIV; Carlos Alberto von MühlenV; Carlos David Araújo BicharaVI; Cláudio Henrique Ramos dos SantosVII; Cleonice BuenoVIII; Cristiane Martinez YanoIX; Cristóvão Luis Pitangueira MangueiraX; Darlene Gonçalves CarvalhoXI; Elizângela CardosoXII; Eloísa BonfáXIII; Flávia Ikeda e AraújoXIV; Gustavo Gabriel RassiXV; Hugo Mendonça MundimXVI; Izidro BendetXVII; Jozélia RegoXVIII; Lisiane Maria Enriconi dos Anjos VieiraXIX; Luis Eduardo Coelho AndradeXX; Maria Ordália Ferro BarbosaXXI; Mitiko SugiyamaXXII; Mittermayer Barreto SantiagoXXIII; Natasha SlhessarenkoXXIV; Nilzio Antônio da SilvaXXV; Paulo Luiz Carvalho FrancescantonioXXVI; Renata JarachXXVII; Roberto SudaXXVIII; Roger Abramino LevyXXIX; Silvia Oliveira SampaioXXX; Suzane Pretti Figueiredo NevesXXXI; Wilson de Melo CruvinelXXXII; Wilton Silva dos SantosXXXIII; Yanna K. de M. NóbregaXXXIV
IPós-graduanda em nível de Doutorado na disciplina de Reumatologia pela Universidade Federal de São Paulo (UNIFESP); Assessora científica do Setor de Imunologia do Fleury Medicina Diagnóstica
IIPós-doutorado pela Scripps Medical Center La Jolla La USA; Coordenador médico da AFIP-Medicina Laboratorial e Centro Imuno-Reumatológico de São Paulo
IIIBiomédica do Padrão Laboratório Clínico
IVPós-doutorado na Reumaklinik Aachen-Alemanha; Professor titular de clínica médica da Universidade Federal de Uberlândia; Coordenador do serviço de reumatologia do HCUFU
VProfessor de Reumatologia da Faculdade de Medicina da PUCRS; Doutor em Medicina pela Faculdade de Medicina da Rheinisch-Westfalische Technische Hochschule/Aachen, Alemanha; Pós-Doutorado no The Scripps Research Institute, La Jolla, EUA; Diretor Técnico do Metanalysis Centro de Diagnósticos Médicos, Porto Alegre
VIMédico e Biomédico; Especialista em Patologia Clínica; Especialista em Saúde Pública; Mestrando em Biologia de Agentes Infecciosos e Parasitários/UFPA; Supervisor Técnico do Laboratório Amaral Costa; Professor de Patologia Clínica do CESEP/PA
VIIAssessor científico da NewLife Comércio de Produtos Laboratoriais
VIIILaboratórios de Investigação Médica do Hospital das Clínicas da FMUSP
IXMestra em Medicina Tropical pela Universidade Federal de Goiás; Professora assistente da disciplina de Imunologia da Universidade Católica de Goiás
XMédico Patologista Clínico e Reumatologista; Doutor em Patologia pela Faculdade de Medicina da Universidade de São Paulo (FMUSP); Médico da Seção de Imunologia da Divisão de Laboratório Central (LIM 03) do Hospital das Clínicas da FMUSP; Gerente Médico do Departamento de Patologia Clínica (Diretoria de Medicina Diagnóstica e Preventiva) do Hospital Israelita Albert Einstein
XIMédica Patologista Clínica - Imunologia do Instituto Hermes Pardini
XIIBiologia Celular e Molecular; Suporte Técnico Científico da Biometrix Diagnóstica
XIIIProfessora Titular de Reumatologia da Faculdade de Medicina da Universidade de São Paulo
XIVMestra em Ciências Ambientais e Saúde pela Universidade Católica de Goiás (UCG); Professora Assistente I de Imunologia do curso de Biomedicina da Universidade Católica de Goiás; Coordenadora do Laboratório de Apoio Didático do Departamento de Biomedicina UCG
XVMédico Patologista Clínico do Laboratório Atalaia
XVIExame Medicina Laboratorial. Distrito Federal
XVIIMédico Patologista Clínico e Virologista; Pós-graduação em Biologia Parasitária pela FIOCRUZ; Consultor Científico do Setor de Imunoensaios do Sérgio Franco Medicina Diagnóstica
XVIIIMédica Reumatologista e Coordenadora do Laboratório de Imuno-Reumatologia do Hospital das Clínicas da Faculdade de Medicina da Universidade Federal de Goiás
XIXMestra em Ciências Médicas pela Universidade Federal de Santa Catarina; Professora da Universidade do Sul de Santa Catarina; Professora da Universidade do Vale do Itajaí; Patologista Clínica do Laboratório Médico Santa Luzia
XXProfessor associado - livre docente da disciplina de Reumatologia na UNIFESP; Coordenador do Programa de Pós-Graduação da disciplina de Reumatologia da Universidade Federal de São Paulo; Assessor médico do Setor de Imunologia do Fleury Medicina e Saúde
XXIMestra em Biomedical Science pela San Francisco State University, Califórnia; Bioquímica dos Laboratórios Saúde e Hospital e Maternidade e Jardim América
XXIIAssessora científica da Hemagen Diagnósticos
XXIIIPós-Doutorado pela University of Calgary; Médico Reumatologista da Universidade Federal da Bahia; Professor adjunto da Fundação Bahiana para Desenvolvimento das Ciências e Chefe do serviço de reumatologia do Hospital Santa Izabel
XXIVMédica Patologista Clínica; Mestra em Medicina (Pediatria) pela Universidade de São Paulo; Professora da Universidade Federal de Mato Grosso
XXVDoutor em Medicina (Reumatologia) pela Universidade de São Paulo; Professor Titular de Reumatologia da Faculdade de Medicina da Universidade Federal de Goiás
XXVIMestre em Ciências Ambientais e Saúde pela Universidade Católica de Goiás (UCG); Professor Assistente I de Imunologia dos cursos de Biomedicina e Medicina da Universidade Católica de Goiás; Coordenador do 3º Consenso Brasileiro para pesquisa de autoanticorpos
XXVIIMestra em Medicina Tropical pela Universidade Federal de Goiás; Biomédica do Padrão Laboratório Clínico
XXVIIIAssessor Científico da Alka
XXIXDoutor em Ciências Biológicas (Biofísica) pela Universidade Federal do Rio de Janeiro; Estatutário da Universidade do Estado do Rio de Janeiro; Professor Adjunto de Reumatologia da UERJ; Coordenador do Centro de Autoimunidades do Hospital Pró-cardíaco RJ e Consultor científico do Diagnósticos da América SA
XXXDoutora em Imunologia pelo Instituto de Ciências Biomédicas da Universidade de São Paulo; formada pela Faculdade de Medicina da USP-SP (FMUSP) com Especialização em Reumatologia pela FMUSP; Médica do setor de Imunologia do Laboratório Diagnósticos da América SA
XXXIMédica Patologista Clínica; Doutora em Ciências pela Fundação Oswaldo Cruz; Professora Adjunta da Faculdade de Medicina da Universidade Federal de Minas Gerais; Coordenadora de Setor de Soro-Imunologia do Serviço de Medicina Laboratorial do Hospital das Clínicas-UFMG
XXXIIPós-graduando em nível de Doutorado na disciplina de Reumatologia pela Universidade Federal de São Paulo (UNIFESP); Professor Assistente de Imunologia nos cursos de Biomedicina e Medicina da Universidade Católica de Goiás (UCG); Secretário do 3º Consenso Brasileiro para pesquisa de autoanticorpos
XXXIIIMédico Reumatologista; Coordenador do Laboratório de Reumatologia do Hospital Universitário de Brasília e Doutor em Reumatologia pela UNIFESP
XXXIVMestra em Patologia Molecular/Imunologia pela Universidade de Brasília (UnB); professora da União Educacional do Planalto Central e do Centro Universitário Unieuro; Assessora Científica da Imunotech Sistemas Diagnósticos Importação e Exportação
Endereço para correspondência Endereço para correspondência: Laboratório de Apoio Didático Departamento de Biomedicina - Universidade Católica de Goiás Avenida Universitária, 1069 Setor Universitário, CEP:74605-010 Goiânia - Goiás. Tel.: (62) 3946-1393 E-mail: lad@ucg.br
RESUMO
OBJETIVO:O 3º Consenso Brasileiro para pesquisa de autoanticorpos em Células HEp-2 (FAN) teve como propósito avaliar as dificuldades de implantação do 2º Consenso ocorrido no ano de 2002, discutir estratégias para controlar a qualidade do ensaio e promover a atualização das associações clínicas dos diversos padrões.
MÉTODOS:Participaram do encontro em Goiânia nos dias 13 e 14 de abril de 2008 pesquisadores e especialistas de diversos centros universitários e laboratórios clínicos de diferentes regiões do Brasil, com o propósito de discutir e aprovar as recomendações que visam à melhor padronização, interpretação e utilização do ensaio pelos clínicos. Representantes comerciais de diferentes empresas produtoras de insumos para realização do teste de FAN foram convidados como ouvintes.
RESULTADOS E CONCLUSÕES: O 3º Consenso enfatizou a necessidade do controle de qualidade em imunofluorescência dada a heterogeneidade de microscópios e reagentes disponíveis no mercado, promoveu adequações na terminologia utilizada para classificar os diferentes padrões e, finalmente, atualizou as associações clínicas com finalidade de facilitar cada vez mais o melhor uso do ensaio pelos clínicos.
Palavras-chave: autoanticorpos, células HEp-2, anticorpos antinúcleo, imunofluorescência.
INTRODUÇÃO
Perspectiva histórica da pesquisa de autoanticorpos em HEp-2 no Brasil
A evolução científico-tecnológica promove mudanças em exames laboratoriais que afetam parâmetros importantes para a interpretação clínica, como os valores preditivos positivo e negativo, a sensibilidade e a especificidade. Um ótimo exemplo desse tipo de situação é o exame para pesquisa de anticorpos antinúcleo (ANA) pela técnica de imunofluorescência indireta (IFI), também conhecido como fator antinúcleo (FAN), hoje denominado "pesquisa de anticorpos contra antígenos celulares" (PAAC) em soro de pacientes com suspeita de doença autoimune. Trata-se de um excelente exame de rastreamento de autoanticorpos que ao longo das últimas décadas foi tecnicamente modificado de forma a conferir sensibilidade progressivamente maior. Como consequência, a pesquisa de anticorpos contra antígenos celulares passou também a apresentar menor especificidade.1
O aumento na sensibilidade do teste de PAAC-IFI em HEp-2, entretanto, trouxe também um prejuízo na especificidade, pois alguns indivíduos sem evidência clínica ou laboratorial aparentes de doença autoimune também passaram a apresentar resultados positivos em células HEp-2, exigindo uma interpretação bastante criteriosa dos achados sorológicos.2 A alta frequência de resultados positivos do teste em indivíduos saudáveis ou com manifestações clínicas vagas tem trazido à tona uma situação denominada por alguns de "Síndrome do Anticorpo Antinúcleo Idiopático".1 A perda de especificidade do teste agravou-se também pelo fato de que uma vasta gama de especialistas médicos passou a utilizá-lo. Inicialmente, os reumatologistas e nefrologistas eram os grandes usuários desse exame e, em decorrência de sua familiaridade com o mesmo e das características de sua clientela, tinham maior chance de solicitar o exame a quem realmente tivesse quadro autoimune.
Hoje, o PAAC-IFI em HEp-2 é um exame solicitado com menos critério por grande variedade de especialistas, que obviamente atendem uma clientela distinta, na qual o diagnóstico de doença reumática autoimune é menos prevalente. Assim, a chance de resultados positivos em indivíduos saudáveis ou com apresentações clínicas pouco expressivas tornou-se maior. Alguns elementos são importantes para a valorização adequada do teste do PAAC-IFI em HEp-2. Em primeiro lugar, o exame deve ser solicitado apenas quando houver suspeita convincente de doença autoimune. Sua solicitação frente a um paciente com queixas vagas, frequentemente trará mais confusão ao raciocínio clínico, visto que um resultado positivo não implica necessariamente autoimunidade. Um segundo ponto a ser considerado é o título do PAAC-IFI em HEp-2: em geral, os pacientes autoimunes tendem a apresentar títulos moderados (1/160 e 1/320) e elevados (> 1/640), enquanto os indivíduos sadios com PAAC-IFI em HEp-2 positivo tendem a apresentar baixos títulos (1/80).3 Entretanto, em ambas as situações pode haver exceções.4 Um outro ponto importante é o padrão de fluorescência que fornece uma indicação da identidade do(s) autoanticorpo(s) em questão5 e deve ser analisado com bastante cautela, levando-se em consideração a experiência e expertise do observador bem como a capacidade de se reproduzir o padrão por parte do kit que pode ser de diferentes fabricantes.
Autoanticorpos contra alguns antígenos têm associação bastante específica com determinadas doenças autoimunes ou ao estado de autoimunidade em si, enquanto outros ocorrem indiscriminadamente em indivíduos autoimunes e não autoimunes. Dessa forma, determinados padrões de fluorescência são mais específicos de doença autoimune enquanto outros ocorrem com frequência em indivíduos sadios ou em pacientes com outras enfermidades não autoimunes.1
Outro ponto a se considerar é que o nível de autoimunidade fisiológica, ou basal, pode flutuar na dependência de sobrecargas a que o sistema imunológico seja exposto. Está bem demonstrada a presença de autoanticorpos desencadeada transitoriamente por infecções, por medicamentos e por neoplasias. Tem sido demonstrada claramente alta prevalência de autoanticorpos em pacientes infectados pelo vírus da imunodeficiência humana (HIV) e por outros vírus linfotrópicos.6 Portanto, outra consideração a ser feita ante um paciente com um achado positivo de PAAC-IFI em HEp-2 refere-se à possibilidade de infecções virais recentes, uso de medicamentos e processos neoplásicos.
Várias evidências demonstram que os autoanticorpos frequentemente precedem a eclosão clínica das doenças autoimunes.7 Um teste de PAAC-IFI em HEp-2 positivo pode preceder o aparecimento clínico do LES em até nove anos. Cerca de 80% dos pacientes com LES apresentam PAAC-IFI em HEp-2 positivo antes do aparecimento dos primeiros sintomas. O mesmo é válido, embora em menor porcentagem, para os vários autoanticorpos específicos dessa enfermidade, como anti-DNA nativo e anti-Sm. Portanto, outra possibilidade a se considerar em presença de um achado clinicamente inconsistente de PAAC-IFI em HEp-2 positivo é a de que o paciente poderá vir a desenvolver uma doença autoimune nos próximos anos. No entanto, alguns indivíduos podem seguir décadas com autoanticorpos circulantes sem desenvolver qualquer sinal de enfermidade autoimune.8
Perante um resultado positivo de PAAC-IFI em HEp-2 é imprescindível que se caracterize essa reatividade, buscando a presença de anticorpos peculiares de patologias autoimunes através de técnicas específicas. Essa avaliação deve ser subsidiada por evidência clínica ou laboratorial de doença autoimune sistêmica. Além do exame clínico apurado, é importante verificar possíveis alterações em hemograma, urina I, proteína C-reativa e velocidade de hemossedimentação (VHS), que podem ser considerados extensões do exame clínico. Em alguns casos, pode ser válido investigar enzimas hepáticas e musculares. Sintomas vagos, como artralgia e astenia, com exames laboratoriais gerais normais não são suficientes para oferecer subsídio para um achado laboratorial de PAAC-IFI em HEp-2 em título baixo e com padrão de fluorescência pouco específico. Nesses casos, o exercício do bom senso com o acompanhamento da situação clínica do paciente em consultas regulares pode ser a melhor conduta.
Os dois primeiros Consensos contribuíram para o aperfeiçoamento das leituras e interpretação dos padrões de PAAC-IFI em HEp-2 a partir da criação de critérios morfológicos a serem seguidos durante a leitura do teste, da combinação dos critérios formando os grupos principais (núcleo, nucléolo, citoplasma, aparelho mitótico e mistos), levando-se em consideração a grande diversidade de terminologias que eram utilizadas para caracterizar os diferentes padrões. Foram ainda abordadas as informações sobre as principais associações clínicas dos diferentes padrões e sugerida uma nova denominação para o teste que expressasse a sua dimensão diagnóstica.
Após o segundo Consenso, surgiram questões que necessitariam de maior discussão e de melhor orientação. Um dos problemas observados diz respeito à classificação do padrão nuclear homogêneo quanto à reatividade dos nucléolos e em relação à classificação dos padrões mistos englobando múltiplas reatividades dentro do mesmo grupo, por exemplo, um padrão com dois ou mais autoanticorpos contra antígenos nucleares. Outro aspecto relevante foi a necessidade de alertar quanto à heterogeneidade dos substratos a começar pelo título dos conjugados. Uma vez que alguns laboratórios não estão habituados a titular o conjugado contra um padrão absoluto ou consensual, um mesmo teste realizado em kits de marcas diferentes pode apresentar títulos divergentes. Esses problemas, em seu conjunto, são responsáveis pela heterogeneidade de resultados entre os vários laboratórios e precisam ser mais bem discutidos.
Finalmente, ao longo dos anos sentiu-se necessidade de revisar as associações clínicas dos diferentes padrões estabelecidas no 2º Consenso. Desse modo, o 3º Consenso Brasileiro para pesquisa de autoanticorpos em Células HEp-2 teve como propósito avaliar as dificuldades de implantação do 2º Consenso ocorrido no ano de 2002, discutir estratégias para controlar a qualidade do ensaio e promover a atualização das associações clínicas dos padrões de fluorescência.
MÉTODO DE TRABALHO
Participaram do encontro em Goiânia nos dias 13 e 14 de Abril de 2008 pesquisadores e especialistas de diversos centros universitários e laboratórios clínicos de diferentes regiões do Brasil com o propósito de discutir e aprovar as recomendações que visam a melhor padronização, interpretação e utilização do ensaio pelos clínicos. Representantes comerciais de diferentes empresas produtoras de insumos para realização do teste de PAAC-IFI em HEp-2 foram convidados como ouvintes.
Os problemas abordados pelo grupo foram a necessidade de controlar a qualidade do ensaio, a definição de alguns aspectos controversos na classificação proposta no 2º Consenso, o relato de novos padrões de fluorescência e a revisão das associações clínicas. Os problemas foram apresentados para os componentes da assembléia e discutidos amplamente com vistas à obtenção de consenso entre os diversos participantes. As discussões foram embasadas por prévia revisão da literatura referente aos diversos temas, bem como apresentação de dados próprios pelos participantes.
RECOMENDAÇÕES GERAIS
A classificação dos nucléolos no padrão nuclear homogêneo passa a ser não reagente
O 3º Consenso reitera a classificação atual dos padrões de fluorescência nos quatro compartimentos celulares (citoplasma, núcleo, nucléolo e aparelho mitótico). Ademais, foram feitas algumas definições para situações de possível ambiguidade ou indefinição. Nos casos em que o núcleo é uniformemente corado e não se destaca a região do nucléolo, os membros do Consenso entendem que não há reatividade precípua contra o nucléolo, portanto, o mesmo deve ser descrito como "não reagente". Obviamente, o nucléolo será também descrito como "não reagente" nos casos em que o mesmo se mostrar não corado. Quando da existência de um padrão nuclear, o nucléolo somente será descrito como "reagente" quando sua coloração sobressair sobre a coloração do núcleo (Figura 1B). Registra-se o exemplo abaixo do laudo do padrão nuclear homogêneo:
-
Paciente: F.C.O.F.
-
Ensaio: Pesquisa de Anticorpos contra Antígenos Celulares (PAAC)
-
Núcleo: reagente.
-
Nucléolo: não reagente.
-
Citoplasma: não reagente.
-
Aparelho mitótico: não reagente.
-
Placa metafásica cromossômica: positiva
-
Padrão: nuclear homogêneo
Padrões mistos
Foi retificada a definição de Padrões Mistos. Foram categorizados como padrões mistos todos os casos em que foram observadas a coloração de compartimentos celulares distintos (núcleo, nucléolo, citoplasma ou aparelho mitótico) ou de diferentes padrões de fluorescência em um mesmo compartimento celular. Assim, por exemplo, o padrão NuMA-1 é considerado um padrão misto, pois cora o núcleo e o aparelho mitótico. Outro exemplo é representado por um soro com uma mistura de autoanticorpos que corem simultaneamente o núcleo com padrão pontilhado fino e padrão pontilhado centromérico.
Padrão nuclear pontilhado com pontos isolados
O 3º Consenso alterou a deliberação do 2º Consenso quanto à necessidade de subclassificação do número de pontos no padrão nuclear pontilhado do tipo pontos isolados em maior que 10 e menor que 10. A denominação do padrão ficou estabelecida como Padrão nuclear pontilhado do tipo pontos isolados. Essa mudança decorre do fato de que o número de corpos nucleares corados por anticorpos anti-p80-coilina e anti-sp-100 sofre considerável variação conforme o substrato celular em uso. Embora, o observador experiente consiga, na maior parte dos casos, sugerir com segurança o autoanticorpo mais provável, o número de pontos por núcleo não é um critério absoluto.
Padrões não caracterizados ou com características novas
Os membros do Consenso reconhecem que há padrões não caracterizados ou com características não definidas conforme a classificação existente. Nesses casos, a recomendação é que se descreva morfologicamente o padrão observado e que se acrescente uma observação especificando que o mesmo não faz parte da nomenclatura do Consenso e que suas associações imunológicas e clínicas ainda não estão definidas. Nesses casos, é de fundamental importância que o laboratório teste o suposto novo padrão em kit comercial de marca diferente daquela em que originalmente observou o padrão, evitando assim que condições artefatuais induzam uma falsa interpretação.
Foram comunicados dois novos padrões de fluorescência por participantes do Consenso. Vários outros membros testemunharam já haver observado esses padrões.
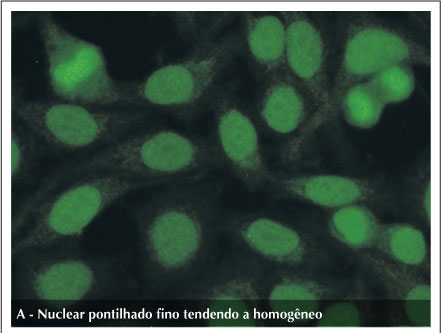
O primeiro trata-se de um padrão nuclear pontilhado fino, aproximando-se da textura homogênea, e com placa metafásica corada da mesma forma. Sua associação clínica e identidade imunológica não estão definidas. Sua importância deriva do fato de que pode ser facilmente confundido com o padrão pontilhado fino denso e com o padrão homogêneo (Figura 1).
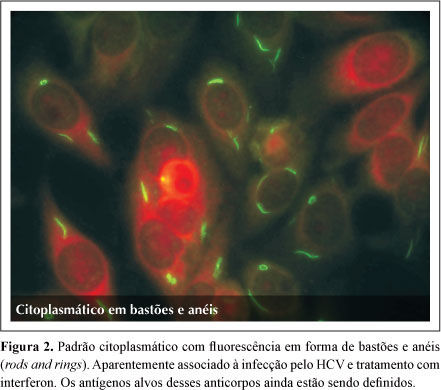
O segundo trata-se de um padrão citoplasmático em forma de pequenos bastões (rods) e círculos (rings) que, aparentemente, está associado à infecção pelo HCV. Há estudos em curso por alguns grupos de pesquisa com a finalidade de estabelecer sua identidade imunológica (Figura 2).
Como ainda não estão definitivamente caracterizados, esses dois novos padrões foram considerados preliminares e o 3° Consenso recomendou que os mesmos fossem completamente caracterizados e apresentados na próxima versão do Consenso.
Substratos a base de células geneticamente modificadas
O 3º Consenso não realizou estudos sistematizados com substratos geneticamente modificados, sendo este estudo possível objeto de debate nos próximos encontros.
CONTROLE DE QUALIDADE
O 3º Consenso incentiva e recomenda a busca por programas de controle de qualidade. Essa recomendação visa fazer frente às dificuldades em garantir a qualidade do teste, dada a necessidade de profissionais com treinamento especializado, heterogeneidade dos kits comerciais e não padronização de equipamentos ópticos entre laboratórios. Entre os programas de qualidade institucionais, foram citados o do College of American Pathologists (CAP) e o programa educativo PAAC-IFI em HEp-2 da Controlab. Também foram citados programas e reagentes para controle de qualidade de empresas privadas, como o PCQAUTO da GMK Diagnósticos, o Conexão HEp-2 da Hemagen Diagnósticos e a lâmina FITC-QC® da ALKA Tecnologia em Diagnósticos.
Foi recomendada ainda a realização por parte dos laboratórios da titulação do conjugado como medida fundamental para ajustar a quantidade de fluorocromo de acordo com a potência da lâmpada, equiparando os diferentes serviços. Foi ressaltando ainda que esse procedimento deve ser realizado para cada novo kit de lote diferente. A manutenção dessa titulação nos kits do mesmo lote pode ser realizada a partir do uso de controles de baixa intensidade. Nesse quesito, ressalta a utilidade de lâminas comerciais com micro-esferas pré-calibradas para diversas intensidades de fluorescência e que podem ser utilizadas para treinamento e calibração interna da leitura.
Com o intuito de estimular a obtenção de resultados fidedignos, o 3º Consenso recomenda que os laboratórios adiram aos programas de controle de qualidade e façam sistematicamente o controle de qualidade técnico. É de fundamental importância recordar que a reação de IFI depende de cinco fatores: o sistema óptico (microscópio), a potência da lâmpada (20, 50 ou 100W), a concentração do conjugado, os soros controles de reatividade mínima (1/80) e o observador.
A concentração do conjugado permite equiparar sistemas ópticos diferentes, lâmpadas de potências diferentes e a leitura do observador. Exemplo, se a potência da lâmpada é baixa, é recomendada a utilização de um conjugado mais concentrado para se obter a mesma fluorescência de uma lâmpada de potência maior. Para estabelecer a concentração ideal do conjugado (título do conjugado), devemos utilizar a técnica de titulação em bloco em que várias diluições do conjugado são cruzadas com diversas concentrações de um soro de referência, procurando a maior diluição do conjugado capaz de reproduzir o título nominal do soro de referência.
O soro de referência pode acompanhar o kit pronto e o laboratório passará a se referenciar ao sistema óptico, lâmpada e leitor de acordo com o padrão estabelecido pelo fabricante. O soro de referência pode também ser adquirido comercialmente, obtido de instituições de controle de qualidade ou ainda o laboratório poderá enviar o seu soro a um laboratório de sua referência e, de posse dos resultados, passar a se referenciar a esse laboratório. Uma vez feita a primeira referência, o laboratório poderá armazenar semanalmente alíquotas de soros de títulos determinados no próprio laboratório.
O laboratório deverá manter em sua soroteca amostras para controle com título de reatividade mínima (1/80), a serem diluídas em 1/40, 1/80, 1/160 e 1/320. A cada bateria diária o laboratório deverá processar o controle baixo e deverá considerar a bateria válida se a variação de títulos for de mais ou menos uma diluição. Se for observada inconformidade do controle; por exemplo, se uma amostra com título médio de 1/80 apresentar-se como negativo, a bateria deverá ser invalidada. Utilizando o controle de reatividade mínima (1/80), uma bateria de testes somente será validada com a leitura de um título a mais ou a menos de 80. No caso de ocorrer queda superior a 1(um) título, é provável que o sistema tenha entrado em instabilidade. Recomenda-se, então, que seja verificado, primeiramente, se houve problema na alíquota armazenada, nesse caso repetindo o teste com a alíquota armazenada na semana anterior. Se ao término da repetição o título encontrado foi o previsto, chegaremos à conclusão de que a alíquota do controle em uso havia se deteriorado. Se a nova alíquota apresentou também queda do título de mais de uma diluição, deveremos checar o sistema óptico (deterioração do filtro UV, inundação da objetiva com glicerina tamponada e desempenho da lâmpada). Caso não seja encontrada alteração nesses componentes e no número de horas de uso da lâmpada, a causa mais provável será degradação do conjugado, que deve então ser submetido a novo processo de titulação, como descrito anteriormente.
Observações
-
Recomenda-se controle do conjugado a cada 15 dias.
-
Quando um novo
kit for aberto, deve ser realizada nova titulação do conjugado.
-
As objetivas e os filtros do microscópio interferem na definição do título do conjugado, devendo ser checados rotineiramente.
-
Além da checagem do tempo de lâmpada, é necessário checar se a lâmpada está centrada. Isso pode ser feito utilizando uma folha de papel branca colocada na mesa do microscópio e observado com objetiva de 10 se a lâmpada está centrada. Caso seja observado escurecimento de parte do campo, o manuseio dos botões de centragem direita e esquerda, superior e inferior e foco da lâmpada deverão ser acionados a fim de realizar o ajuste.
ASSOCIAÇÕES CLÍNICAS E DESCRIÇÃO DOS PADRÕES
Os membros do 3º Consenso procederam a uma ampla discussão para validação e reavaliação das associações clínicas e imunológicas referentes aos padrões de PAAC-IFI em HEp-2. As recomendações advindas dessa atividade estão listadas na Tabela 1.
Em sua vasta maioria, as associações anteriormente descritas foram acordadas por unanimidade entre os participantes do Consenso. Nos raros casos em que não houve unanimidade, acatou-se a opinião majoritária.
Essa iniciativa reflete a vigorosa atividade de pesquisa no campo de autoanticorpos em geral, e de anticorpos antinúcleo em particular, em nosso país. Deve ser enfatizado que essa atividade tem proporcionado uma evolução progressiva e marcante de nossa comunidade científica e profissional, firmando uma posição nacional independente em relação à forma de realizar e interpretar o ensaio para determinação de autoanticorpos em células HEp-2. Essa característica tem beneficiado também os clínicos que lançam mão desse exame laboratorial e, por conseguinte, os pacientes que a eles recorrem. Finalmente, é necessário que fique claro que esse é um processo de amadurecimento contínuo e progressivo e que o mesmo depende da interação de toda a comunidade envolvida com as várias etapas do processo.
AGRADECIMENTOS
-
Sociedade Brasileira de Reumatologia (SBR)
-
Sociedade Brasileira de Patologia Clínica e Medicina Laboratorial (SBPC)
-
Sociedade Brasileira de Análises Clínicas (SBAC)
-
Conselho Regional de Biomedicina 3ª região (CBRM-3)
Recebido em 17/11/2008.
Aprovado, após revisão, em 14/01/09.
O 3º Consenso Brasileiro recebeu auxílio dos Fundos de Auxílio à Pesquisa, da Sociedade Brasileira de Reumatologia.
-
1Dellavance A, Andrade LEC. Como interpretar e valorizar adequadamente o teste de anticorpos antinúcleo. J Bras Patol Med Lab 2007;43(3):157-68.
-
2Forslid J, Heigl Z, Jonsson J, Scheynius A. The prevalence of antinuclear antibodies in healthy young persons and adults, comparing rat liver tissue sections with HEp-2 cells as antigen substrate. Clin Exp Rheumatol 1994;12(2):137-41.
-
3Tan EM, Feltkamp TE, Smolen JS, Butcher B, Dawkins R, Fritzler MJ, et al. Range of antinuclear antibodies in "healthy" individuals. Arthritis Rheum1997;40(9):1601-11.
-
4Leser PG, Dellavance A, Barbosa SH, Guis G, Rodrigues SH, Sato EI. Distinctive features of antinuclear antibodies observed in health and in subjects with autoimmune rheumatic disease. In: Conrad K, Bachmann MO, Chan EKL, Fritzler MJ, Humble RL, Sack U. editors. From animal models to human genetics: research on the induction and pathogenicity of autoantibodies. Dresden: Pabst 2004. 493-510.
-
5Fritzler MJ, Pauls JD, Kinsella TD, Bowen TJ. Antinuclear, anticytoplasmic and anti-Sjögren's syndrome antigen A (SS-A/Ro) antibodies in female blood donors. Clin Immunol Immunopathol 1985;36:120-8.
-
6Massabki PS, Accetturi C, Nishie IA, da Silva NP, Sato EI, Andrade LE. Clinical implications of autoantibodies in HIV infection. Aids 1997;11(15):1845-50.
-
7Arbuckle MR, McClain MT, Rubertone MV, Scofield RH, Dennis GJ, James JA, et al. Development of autoantibodies before the clinical onset of systemic lupus erythematosus. N Engl J Med 2003;349(16):1526-33.
-
8Deane PMG, Liard G, Siegel DM, Baum J. The outcome of children referred to a pediatric rheumatology clinic with a positive antinuclear antibody test but without an autoimmune disease. Pediatrics 1995;95(6):892-5.
-
9Borg AA, Dawes PT, Mattey DL. Autoantibodies to nuclear lamins and to intermediate filament proteins. J Rheumatol 1993;20:1988-90.
-
10Rubin RL. Autoimmune reactions induced by procainamide and hydralazine. In Kammuller M, Bloksma M, Siemen W (eds): Autoimmunity and Toxicology: Immune Dysregulation Induced by Drugs and Chemicals. Amsterdam, Elsevier 1988.
-
11Amoura Z, Koutouzov S, Chabre H, Cacoub P, Amoura I, Musset L, et al. Presence of antinucleosome autoantibodies in a restricted set of connective tissue diseases: antinucleosome antibodies of the IgG3 subclass are markers of renal pathogenicity in systemic lupus erythematosus. Arthritis Rheum 2000;43(1):76-84.
-
12Notman DD, Kurata N, Tan EM. Profiles of antinuclear antibodies in systemic rheumatic diseases. Ann Intern Med 1975;83(4):464-9.
-
13Barcellos KS, Nonogaki S, Enokihara MM, Teixeira MS, Andrade LE. Differential expression of Ro/SSA 60 kDa and La/SSB, but not Ro/SSA 52 kDa, mRNA and protein in minor salivary glands from patients with primary Sjögren's syndrome. J Rheumatol 2007;34(6):1283-92.
-
14Ochs RL, Muro Y, Si Y, Ge H, Chan EK, Tan EM. Autoantibodies to DFS 70 kd/transcription coactivator p75 in atopic dermatitis and other conditions. J Allergy Clin Immunol 2000;105(6):1211-20.
-
15Andrade LEC, Chan EKL, Raska I, Peebles CL, Roos G, Tan EM. Human autoantibody to a novel protein of the nuclear coiled body: immunological characterization and cDNA cloning of p80-coilin. J Exp Med 1991;173:1407-19.
-
16Lohse AW, zum Büschenfelde KH, Franz B, Kanzler S, Gerken G, Dienes HP. Characterization of the overlap syndrome of Primary Biliary Cirrhosis (PBC) and Autoimmune Hepatitis: evidence for it being a hepatitic form of PBC in genetically susceptible individuals. Hepatology 1999;29(4):1078-84.
-
17Fritzler MJ, Kinsella TD. The CREST syndrome: a distinct serologic entity with anticentromere antibodies. Am J Med 1980;69(4):520-6.
-
18Göring HD, Panzner M, Lakota W, Zeiner A. Association of Scleroderma and Primary Biliary Cirrhosis - results of a systematic study on a dermatological clientele. Hautarzt 1998;49:361-66.
-
19Takasaki Y, Deng JS, Tan EM. A nuclear antigen associated with cell proliferation and blast transformation. J Exp Med 1981;154:1899-909.
-
20Targoff IN. Autoantibodies in polymyositis. Rheum Dis Clin North Am 1992;18:455-82.
-
21Reimer G, Raska I, Tan EM, Scheer U. Human autoantibodies: probes for nucleolus structure and function. Virchows Arch B Cell Pathol Incl Mol Pathol 1987;54:131-43.
-
22Agarwal N, Handa R, Acharya SK, Wali JP, Dinda AK, Aggarwal P. A study of autoimmune markers in hepatitis C infection. Indian J Med Res 2001;113:170-4.
-
23Leibovitch L, George J, Levi Y, Bakimer R, Shoenfeld Y. Anti-actin antibodies in sera from patients with autoimmune liver diseases and patients with carcinomas by ELISA. Immunol Lett 1995;48(2):129-32.
-
24Krapf AR, Von Mühlen CA, Krapf FE, Nakamura RM, Tan EM. Atlas of immunofluorescent autoantibodies. Munich, Urban & Schwarzenberg, 1996.
-
25Massabki PS, Accetturi C, Nishie IA, Silva NP, Sato EI, Andrade LE: Clinical implications of autoantibodies in HIV infection. AIDS (archive) 11:1845-50, 1997.
-
26Yang Y, Fujita J, Tokuda M, Bandoh S, Ishida T. Clinical features of several connective tissue diseases with anti-Golgi antibody. Ann Rheum Dis 2001;60:986-987.
-
27Eystathioy T, Chan EK, Tenenbaum SA, Keene JD, Griffith K, Fritzler MJ. A phosphorylated cytoplasmic autoantigen, GW182, associates with a unique population of human mRNAs within novel cytoplasmic speckles. Mol Biol Cell 2002;13:1338-51.
-
28Bonfa E, Golombek SJ, Kaufman LD, Skelly S, Weissbach H, Brot N, et al. Association between lupus psychosis and anti-ribosomal P protein antibodies. N Engl J Med 1987;317(5):265-71.
-
29Alderuccio F, Toh BH, Barnett AJ, Pedersen JS. Identification and characterization of mitochondria autoantigens in progressive systemic sclerosis: identily with the 72,000 Dalton autoantigen in primary biliary cirrhosis. J Immunol 1986;137(6):1855-9.
-
30Chou MJ, LaI MY, Lee SL. Reactivity of anti-mitochondrial antibodies in primary biliary cirrhosis and systemic sclerosis. J From Med Ass 1992;91(11):1075-80.
-
31Krapf A, Von Mühlen CA, Krapf F, Nakamura RMM, Tan EM. Human autoimmune diseases and autoantibodies. Bol Com Íbero-Americano Reumatol 1999;9:55-8.
-
32Andrade LEC, Chan EKL, Peebles CL, Tan EM. Two major autoantigen-antibody systems of the mitotic spindle apparatus. Arthritis Rheum 1996;39:1643-53.
-
33Francoeur AM, Peebles CL, Gompper PT, Tan EM. Identification of Ki (Ku, p70/p80) autoantigens and analysis of anti-Ki autoantibody reactivity. J Immunol 1986;136(5):1648-53.
-
34Jarzabek-Chorzelska M, Balszczyk M, Jablonska S, Chorzelski T, Kumar V, Beutner EH. Scl -70 antibody, a specific marker of systemic sclerosis. Br J Dermatol 1986;115(4):393-401.
-
35Isshi K, Hirohata S. Differential roles of the anti-ribosomal P antibody and antineuronal antibody in the pathogenesis of central nervous system involvement in systemic lupus erythematosus. Arthritis Rheum 1998;41(10):1819-27.
- 38. Carballo OG, von Mühlen CA, Nakamura R, de la Torre IG, Francescatonio PLC. Atlas Anti-Nucleocitoplasmaticos (HEp-2). Talleres Gráficos TBS, Buenos Aires, 2006.
- 36. von Mühlen CA, Nakamura RM. Clinical and laboratory evaluation of systemic rheumatic diseases. In McPherson & Pincus (eds): Clinical diagnosis and management by laboratory methods. Philadelphia, W.B. Saunders, 2006.
- 37. Dellavance A, Gabriel Jr A, Nuccitelli B, Taliberti BH, von Mühlen CA, Bichara CDA, et al. Pesquisa de auto-anticorpos em células HEp-2. Editora UCG, Goiânia, 2008.
Datas de Publicação
-
Publicação nesta coleção
13 Abr 2009 -
Data do Fascículo
Abr 2009
Histórico
-
Recebido
17 Nov 2008 -
Aceito
14 Jan 2009