Resumos
OBJETIVO:Analisar a prevalência, padrões e títulos do Fator Antinuclear (FAN) por imunofluorescência indireta (IFI) em células HEp-2 em um hospital universitário após a adoção do I e II Consensos Nacional para Padronização dos Laudos de FAN em Células HEp-2. MÉTODO: Foi realizado um estudo transversal, em que foram revisados os laudos de FAN por IFI originários de solicitações encaminhadas ao Serviço de Patologia Clínica do Hospital de Clínicas de Porto Alegre (SPC/HCPA) entre 2002 e 2005. RESULTADOS:Foram analisados 12.095 testes de FAN no período entre 2002 e 2005. As solicitações com resultado reagente foram de 2.577 (21,30%), com média anual de 644±233). Houve um aumento significativo na proporção de resultados reagentes posterior à adoção dos Consensos (p < 0,001). A Reumatologia foi a especialidade que mais solicitou exames por paciente atendido, mas houve um declínio nesse número nos anos posteriores à adoção do Consenso, ocorrido em 2004 (p < 0,001). O padrão de imunofluorescência de FAN mais frequentemente encontrado foi o padrão nuclear pontilhado fino, presente em 52,3% dos resultados reagentes (453/866), e os títulos mais encontrados foram 1/80 e 1/160 (27,8% e 29,4%, respectivamente). CONCLUSÃO:Após a adoção do Consenso Nacional de Padronização de Laudos de FAN, observou-se um aumento de exames com resultados reagentes, na sua maioria, com títulos baixos e padrão nuclear pontilhado fino. Na Reumatologia, observou-se uma diminuição no número de solicitações desse exame. As potenciais causas para essas observações são discutidas, mas seu real impacto sobre a situação clínica do paciente e seu tratamento merece ser mais bem estudado.
autoanticorpo; fator antinuclear; células HEp-2; imunofluorescência indireta
OBJECTIVE: To evaluate the prevalence of patterns and titers of antinuclear antibodies (ANA) detected by indirect immunofluorescence (IIF) technique on HEp-2 cells in a university hospital following the introduction of I and II Brazilian Consensuses for Standardization of ANA in HEp-2 Cells. METHODS:A transversal study was performed between 2002 and 2005 during which all ANA orders to Serviço de Hospital de Clínicas de Porto Alegre (SPC/HCPA) and cognate results were reviewed. RESULTS:12.095 tests of ANA were revised. The number of positive results during this period was 2.577 (21.30%), annual mean 644 (SD: 233). A marked increase in the number of positive results was observed following the introduction of the Consensuses (p < 0.001). Rheumatology was the medical specialty which requested the highest number of ANA testing per patient although a significant decrease of these numbers was observed after the introduction of the Consensus in 2004 (p < 0,001). Nuclear fine speckled immunofluorescence labeling was the most frequently ANA pattern observed, 52.3% (453/866), and low ANA titers (1/80 and 1/160) more commonly detected (27.8% and 29.4%, respectively). CONCLUSION: Following the introduction of the Brazilian Consensus for standardization of ANA in HEp-2 cells an increased number of positive results was observed, mostly in low titers and with nuclear fine speckled immunofluorescence pattern. Moreover, there were decreasing numbers of ANA orders by rheumatologists in the same period. Potential causes for these observations are discussed but the real impact in the clinical condition of the patient and therapy deserves to be better studied.
autoantibody; antinuclear antibodies; HEP-2 cells; indirect immunofluorescent
ARTIGO ORIGINAL
Experiência da adoção do I e II Consensos Brasileiros de Fator Antinuclear por Imunofluorescência Indireta em Células HEp-2 em um hospital universitário
Claudia Cilene Fernandes Correia LaurinoI; Priscila Schmidt LoraII; João Carlos T. BrenolIII; Denis Maltz GrutckiIV; Ricardo Machado XavierV
IFarmacêutica, PhD em Ciências Aplicadas a Pediatria, Serviço de Reumatologia HCPA/UFGS
IIFarmacêutica Bioquímica, Mestranda do Programa de Pós-Graduação em Ciências Médicas, Faculdade de Medicina /UFRGS
IIIProfessor Associado, Doutor em Clínica Médica, UFRGS
IVAcadêmico Faculdade de Medicina/UFRGS
VProfessor Adjunto, Doutor em Imunologia, Chefe do Serviço de Reumatologia, HCPA/UFRGS
Endereço para correspondência Endereço para correspondência: Dr. Ricardo Machado Xavier Serviço de Reumatologia do Hospital de Clínicas de Porto Alegre Rua Ramiro Barcelos 2350, sala 645, Porto Alegre, RS Telefone (51)2101-8340. CEP: 90035-003 E-mail: rmaxavier@hcpa.ufrgs.br
RESUMO
OBJETIVO:Analisar a prevalência, padrões e títulos do Fator Antinuclear (FAN) por imunofluorescência indireta (IFI) em células HEp-2 em um hospital universitário após a adoção do I e II Consensos Nacional para Padronização dos Laudos de FAN em Células HEp-2.
MÉTODO: Foi realizado um estudo transversal, em que foram revisados os laudos de FAN por IFI originários de solicitações encaminhadas ao Serviço de Patologia Clínica do Hospital de Clínicas de Porto Alegre (SPC/HCPA) entre 2002 e 2005.
RESULTADOS:Foram analisados 12.095 testes de FAN no período entre 2002 e 2005. As solicitações com resultado reagente foram de 2.577 (21,30%), com média anual de 644±233). Houve um aumento significativo na proporção de resultados reagentes posterior à adoção dos Consensos (p < 0,001). A Reumatologia foi a especialidade que mais solicitou exames por paciente atendido, mas houve um declínio nesse número nos anos posteriores à adoção do Consenso, ocorrido em 2004 (p < 0,001). O padrão de imunofluorescência de FAN mais frequentemente encontrado foi o padrão nuclear pontilhado fino, presente em 52,3% dos resultados reagentes (453/866), e os títulos mais encontrados foram 1/80 e 1/160 (27,8% e 29,4%, respectivamente).
CONCLUSÃO:Após a adoção do Consenso Nacional de Padronização de Laudos de FAN, observou-se um aumento de exames com resultados reagentes, na sua maioria, com títulos baixos e padrão nuclear pontilhado fino. Na Reumatologia, observou-se uma diminuição no número de solicitações desse exame. As potenciais causas para essas observações são discutidas, mas seu real impacto sobre a situação clínica do paciente e seu tratamento merece ser mais bem estudado.
Palavras-chave: autoanticorpo, fator antinuclear, células HEp-2, imunofluorescência indireta.
INTRODUÇÃO
A pesquisa do Fator Antinuclear (FAN), cujo nome historicamente refere-se ao fato de os primeiros autoantígenos observados serem direcionados contra estruturas nucleares e nucleolares1 teve sua origem no fenômeno da célula LE (lúpus eritematoso).2 Em 1957, Holborow et al.3 desenvolveram a técnica de imunofluorescência indireta (IFI), o princípio dessa técnica é a ligação dos anticorpos aos epítopos antigênicos das células, sendo a detecção feita por um segundo anticorpo marcado com substâncias fluorescentes e analisados em microscópio de fluorescência. Posteriormente, Beck,4 usando cortes histológicos de fígado do rato, demonstrou os padrões de imunofluorescência homogêneo, pontilhado e nucleolar nos núcleos dessas células, quando incubadas com soros de pacientes, com uma variedade de doenças reumáticas.
O uso de linhagens de células humanas como substrato na IFI tornou-se popular após os trabalhos de Tan et al.4,5 Dentre as várias culturas testadas, as células HEp-2 obtiveram hegemonia, sendo hoje o padrão de excelência em todo o mundo.5,6 HEp-2 são células imortalizadas, originadas de carcinoma de laringe humana (epitelioma humano tipo 2 - clone CCl 23 ATCC), cultivadas em monocamadas, apresentando um ciclo de crescimento de aproximadamente 36 horas, o que permite observar as células em todas as fases do ciclo celular em uma mesma lâmina.7 Mesmo os antígenos preferencialmente identificados na divisão celular são facilmente caracterizados, como por exemplo, antígenos centroméricos8 e antígenos associados ao fuso mitótico.9
A leitura do FAN por IFI deve levar em conta as características importantes dessa metodologia, como a distribuição topográfica intracelular do autoantígeno correspondendo ao padrão de imunofluorescência, fornecendo uma ideia da natureza do autoantígeno e, em alguns casos, permitindo a identificação precisa da especificidade do autoanticorpo,9 como no caso dos anticorpos anticentrômero8 e anti-PCNA.10 No entanto, a natureza do exame possibilita a ocorrência de interferências, como o tipo do microscópio (a lente, a objetiva, e a luz) utilizado, o substrato celular, o conjugado e, em particular, a subjetividade na interpretação do observador.
A ausência de uma nomenclatura definitiva para a descrição dos laudos acarretou problemas na utilização clínica e laboratorial do teste, pelas dificuldades no controle de qualidade e na padronização dos resultados. Embora alguns padrões fossem similares, recebiam denominações diferentes. Em 2000 houve a iniciativa da formação do primeiro Consenso Brasileiro para Padronização dos Laudos de FAN em células HEp-2. Especialistas brasileiros com experiência em FAN, reuniram-se e definiram consensualmente pareceres para os distintos padrões: nucleares, nucleolares, citoplasmáticos e aparelho mitótico.11 Foram feitas recomendações sobre os critérios para a leitura de uma lâmina, bem como as titulações e o sistema óptico utilizado.
Em 2003 houve um segundo consenso12 onde se validou os algoritmos de decisão para leitura dos padrões do FAN na IFI vistos na primeira edição do Consenso Brasileiro, adicionando ainda um novo algoritmo relacionado aos padrões mistos. Tentou-se estabelecer as possíveis associações de cada padrão com uma doença específica ou manifestação clínica.
A partir de 2004, foram adotadas pelo Serviço de Patologia Clínica do Hospital de Clínicas de Porto Alegre SPC/HCPA as recomendações do I e II Consensos Nacionais para Padronização dos Laudos de FAN em células HEp-211,12 seguindo os algoritmos de decisões para demonstrar os dados encontrados, bem como os critérios morfológicos observados durante a leitura. O resultado informatizado do exame foi adaptado para a nova formatação e os examinadores foram treinados para a leitura desse exame durante o período de um ano.
Apesar do sucesso na ampla adoção das recomendações dos consensos pelos laboratórios de análises clínicas, com clara diminuição na variabilidade dos laudos, não temos conhecimento de estudos avaliando seu desempenho na melhoria do diagnóstico e na prática clínica.
O objetivo do presente trabalho é descrever a experiência da adoção do consenso em um hospital universitário geral em termos de prevalência de resultados reagentes e dos seus diversos padrões de IFI encontrados. Também se procurou avaliar a influência no perfil de solicitação das especialidades clínicas que mais requerem esse exame.
MATERIAIS E MÉTODOS
Casuística
Neste trabalho, foi realizado um estudo transversal. Foram revisados todos os resultados de pesquisa de FAN por IFI encaminhadas ao SPC/HCPA, no período de janeiro de 2002 a dezembro de 2005, utilizando o sistema informatizado de aplicativos para gestão hospitalar (AGH) do HCPA. No ano de 2005, também foram revisados os padrões e os títulos dos exames com resultado reagente, tendo em vista representar o período posterior a um ano de treinamento dos profissionais que fazem as leituras das lâminas de IFI do FAN no SPC/HCPA, de acordo com as novas especificações sugeridas pelos Consensos.
Imunofluorescência Indireta (IFI)
A pesquisa de FAN por IFI em células HEp-2 (Wama Diagnóstica, Brasil) é realizada no SPC/HCPA de acordo com o seguinte protocolo: as células são previamente fixadas e incubadas para triagem com os soros dos pacientes diluídos com título de 1/80 em tampão salina fosfato pH 7,2 (PBS) por 30 minutos em câmara úmida à temperatura ambiente. Em seguida, as lâminas são lavadas duas vezes por 10 minutos em PBS e incubadas por 30 minutos com anticorpo secundário antigamaglobulina humana conjugada com isotiocianato de fluoresceína (FITC) em câmara escura à temperatura ambiente. Após a incubação, as lâminas são lavadas em PBS e montadas com glicerina tamponada e lamínula. A leitura é feita em microscópio de fluorescência, modelo Olympus BX 50 sob aumento de 500 vezes. Os soros com resultado reagente em 1/80 são titulados em 1:80, 1:160, 1:320, 1:640, 1:1280, no mesmo tampão e sobre as mesmas condições descritas anteriormente.9
Para realização dos testes são usados soros controles positivos e soros controles negativos, fornecidos pelo kit de FAN.
Controle de qualidade
A cada rotina de realização dos testes FAN são realizados controles internos negativos e positivos, sendo esses referentes aos padrões centromérico e homogêneo, fornecidos pelo fabricante. Também é disponível um banco de soros selecionados, que apresentam padrões diversos, cujos anticorpos foram previamente caracterizados por exames complementares, como anti-ENA (antígenos nucleares extraíveis) por immunoblot, anti-DNA por IFI em crithidia luciliae, bem como um banco de imagens com os possíveis padrões existentes como referência para a identificação.7,11 Além disso, o Serviço participa de um programa alternativo de qualidade externa, com trocas de amostras entre laboratórios. Esse programa foi implantado no ano de 2004 e atualmente fazem parte três laboratórios que realizam o exame FAN. A periodicidade de trocas são quatro amostras por ano, conforme preconizado pela resolução federal RDC 202/2002.
Análise estatística
Utilizou-se estatística descritiva para apresentação dos dados demográficos e proporções de testes positivos em uma planilha Excel (Microsoft, versão 2003), e o teste qui-quadrado para analisar as frequências relativas dos resultados de FAN entre os anos e entre as especialidades com o programa SPSS® (versão 14.0). Foi considerada diferença estatisticamente significativa um p < 0,001.
RESULTADOS
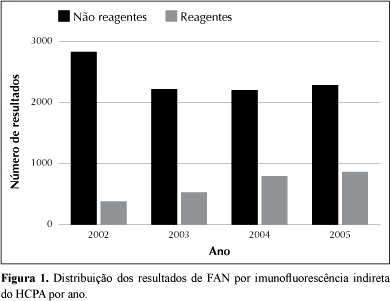
Foi realizado um total de 12.095 testes de FAN no período de janeiro de 2002 a dezembro de 2005 do SPC do HCPA. As solicitações com resultado reagente desse período foram de 2.577 (21,30%) com média anual de 644 (DP: 233), perfazendo uma média anual de 3.024 (DP: 203). O número de resultados reagentes de FAN conforme o ano foi de 369 em 2002; 535 em 2003; 807 em 2004 e 866 em 2005. Houve um acréscimo de 11,6% na proporção de resultados reagentes após a aplicação do consenso (27,13% nos anos 2004 a 2005 contra 15,54% nos anos 2002 a 2003), sendo essa diferença estatisticamente significativa pelo teste do qui-quadrado (p < 0,001) (Figura 1).
As frequências relativas de solicitação de FAN por paciente atendido (consultas e internações) referentes às dez especialidades clínicas que mais solicitaram FAN como teste de triagem no período de 2002 a 2005 estão apresentadas na Tabela 1. Observou-se que a especialidade que teve maior média de solicitação de FAN por paciente atendido foi a Reumatologia (média = 4,5±1,2%). Essa diferença entre a Reumatologia e as demais especialidades foi estatisticamente significativa pelo teste do qui-quadrado para todos os anos analisados (p < 0,001). Entretanto, observamos uma diminuição no número de solicitações do exame por paciente atendido na Reumatologia dentre os anos avaliados (p < 0,001), sendo registrado nos anos de 2004 e 2005 (pós-Consenso) um menor número de solicitações quando comparados aos anos anteriores.
Na Tabela 2, estão representadas as frequências relativas dos padrões de FAN por IFI em 2005. O padrão de imunofluorescência de FAN mais frequente foi o padrão nuclear pontilhado fino, com 52,3% (453/866) (Figura 2), seguido do padrão misto com 11,0% (95/866).
Os títulos de FAN do ano de 2005 foram na sua maioria (57,2%) títulos de valor baixo (1/80 a 1/160). Na Tabela 3, estão apresentadas as frequências dos títulos encontrados. Situação semelhante se encontra quando analisados os títulos do padrão nuclear pontilhado fino, onde se encontra 63,4% dos títulos 1/80 e 1/160.
DISCUSSÃO
A interpretação dos padrões de imunofluorescência indireta em células HEp-2 evoluiu acentuadamente no transcorrer dos últimos anos. Essa metodologia apresenta a capacidade de rastrear uma grande variedade de autoanticorpos conhecidos e desconhecidos, proporcionando a localização e provável identidade do autoantígeno. Apresenta como limitação variações na interpretação dos padrões de imunofluorescência.13 Encontra-se hoje uma pluralidade de padrões. De acordo com o Consenso Nacional de Padronização de Laudos de FAN, estão descritas mais de 25 possibilidades de padrão. Cada um pode refletir uma dada expressão antigênica reconhecida pelo seu autoanticorpo.11,12,14
Neste estudo, não foi possível fazer uma avaliação dos laudos anteriores à aplicação do Consenso, devido à variabilidade na nomenclatura para definição de um mesmo padrão de IFI.
No decorrer do estudo, registrou-se um aumento significativo no número de solicitações com resultado reagente. Apesar de os Consensos não terem o objetivo de aumentar a sensibilidade da técnica de FAN, mas sim padronizar a leitura, neles foi definido que a presença de IFI no citoplasma deve ser considerada como resultado reagente, enquanto previamente o laudo era de "FAN não reagente com presença de IFI no citoplasma", o que pode ter beneficiado outras especialidades clínicas além da Reumatologia.
Uma observação interessante foi que, na especialidade Reumatologia, houve uma diminuição no número de solicitações de FAN no decorrer desse período. O FAN não é considerado um teste de monitoramento de doença, não havendo necessidade de nova avaliação sorológica diante de um resultado reagente. Dessa forma, a diminuição no número de solicitações pode estar relacionada ao aumento da sensibilidade da técnica, com consequente diminuição de repetição de exames com resultados negativos em pacientes com suspeita de doença autoimune. Outra possível associação para o aumento na proporção de resultados reagentes pode ser atribuída ao treinamento realizado com os observadores de FAN do SPC/HCPA de acordo com o Consenso. O sistema informatizado do hospital não permitiu identificar a proporção de resultados reagentes para cada especialidade, o que permitiria confirmar essa hipótese.
Após o Consenso passaram a ser valorizados padrões não nucleares que não eram classificados anteriormente. Esses padrões podem ser relevantes em determinadas circunstâncias como, por exemplo, autoanticorpos contra compartimentos citoplasmáticos e aparelho mitótico, que são considerados também marcadores de doenças autoimunes.9,15 Porém, até hoje não foi feito um estudo que avaliasse o impacto clínico e a satisfação dos médicos perante o novo laudo de FAN proposto pelo consenso, com relação à valorização desses padrões.
Conforme já relatado por Phan et al.,13 o exame FAN é de difícil padronização. A iniciativa brasileira de padronização de FAN facilitou a interpretação do exame e pode ser uma importante ferramenta no controle de qualidade para diminuir as diferenças entre os laudos.
O padrão de imunofluorescência de FAN mais encontrado foi o padrão nuclear pontilhado fino, na sua maioria com títulos considerados baixos (1/80 e 1/160) conforme já relatado em outras populações.11,12,16,17 Nossos dados demonstram uma baixa prevalência do padrão nuclear pontilhado fino denso (nuclear pontilhado fino com placa metafásica positiva). A presença da placa positiva com pontilhado fino pode estar associada ao anticorpo antiproteína p75 kDa; e a placa metafásica negativa com pontilhado fino a anti-SSA/Ro e anti-SSB/La.7,12 O padrão nuclear pontilhado fino com placa metafásica positiva é descrito na literatura como tendo uma maior prevalência em pacientes sem evidências clínicas de doença autoimune.17
Por sua alta sensibilidade, a técnica de FAN por IFI tem como papel primordial o rastreamento de autoanticorpos, principalmente no que tange a anticorpos antinúcleo, antinucléolo e anticitoplasma.1,6,9,18,19 A importância clínica do teste de FAN está na sua associação com doenças autoimunes, apresentando resultado positivo em 95%-98% dos pacientes com LES,20 90% daqueles com esclerose sistêmica e 89% na síndrome de Sjögren.5 Na investigação diagnóstica dessas doenças, o teste do FAN não reagente está associado a um forte valor preditivo negativo.21 No entanto, esse teste pode apresentar resultado positivo em pacientes portadores de outras doenças como, por exemplo, doenças inflamatórias, doenças infecciosas ou neoplasias e ainda podem estar presentes em indivíduos saudáveis.14,22
É importante ressaltar que a solicitação desse exame deve estar embasada no contexto clínico de cada paciente. Conforme relatado por Tampoia et al.15 em um estudo analisando as solicitações do exame FAN antes e após a aplicação de um protocolo para uso racional de exames secundários ao FAN (anti-ENA e anti-DNA), observou-se que os reumatologistas solicitavam o FAN com uma maior frequência para pacientes que apresentavam dois ou mais critérios para classificação de doenças autoimunes, ao contrário dos médicos de outras especialidades que solicitavam esse exame para pacientes que apresentavam somente quadros inflamatórios.
A partir desse estudo, consideramos como factível a implantação do Consenso Brasileiro para Padronização de Laudos FAN em células HEp-2 em um hospital universitário de grande porte. O impacto dessa adoção na qualidade assistencial dos pacientes com suspeita de doença autoimune ainda deve ser mais bem investigado.
Recebido em 11/02/2008.
Aprovado, após revisão, em 01/11/08.
Este trabalho contou com apoio do Fundo de Auxílio e Ensino em Reumatologia da Sociedade Brasileira de Reumatologia.
Artigo desenvolvido no Serviço de Reumatologia e Serviço de Patologia Clínica (SPC), Hospital de Clínicas de Porto Alegre - (HCPA), Faculdade de Medicina, Universidade Federal do Rio Grande do Sul (UFRGS).
-
1Tan EM. Molecular biology of nuclear autoantigens. Adv Nephrol Necker Hosp 1993;22:213-36.
-
2Hargraves MM. Discovery of the LE cell and its morphology. Mayo Clin Proc 1969;44:579-99.
-
3Holborow EJ, Weir DM, Johnson GD. A serum factor in lupus erythematosus with affinity for tissue nuclei. Br Med J 1957;28:732-4.
-
4Beck JS. Variations in the morphological patterns of "autoimmune" nuclear fluorescence. Lancet 1961;3:1203-5.
-
5Tan EM, Feltkamp TE, Smolen JS, Butcher B, Dawkins R, Fritzler MJ, et al Range of antinuclear antibodies in "healthy" individuals. Arthritis Rheum 1997;40:1601-11.
-
6Nakamura RM, Bylund DJ, Tan EM. Current status of available standards for quality improvement of assays for detection of autoantibodies to nuclear and intracellular antigens. J Clin Lab Anal 1994;8:360-8.
-
7Humbel R. Detection of antinuclear antibodies by immunofluorescent. In: van Verookij WM, RN, editor. Manual Biological Markers of Disease, 2ed, Netherkands, Kluwer Academic Publishers, 1993.
-
8Earnshaw WC, Sullivan KF, Machlin PS, Cooke CA, Kaiser DA, Pollard TD, et al Molecular cloning of cDNA for CENP-B, the major human centromere autoantigen. J Cell Biol 1987;104:817-29.
-
9Andrade LE, Chan EK, Peebles CL, Tan EM. Two major autoantigen-antibody systems of the mitotic spindle apparatus. Arthritis Rheum 1996; 39:1643-53.
-
10Miyachi K, Fritzler MJ, Tan EM. Autoantibody to a nuclear antigen in proliferating cells. J Immunol 1978;121:2228-34.
-
11Dellavance A, Gabriel Júnior, A, Cintra AFU, Ximenes AC, Nuccitelli B, Mühlen CA et al I Consenso Brasileiro de fator antinuclear em células Hep-2. J Bras Patol Med Lab 2002;38:207-216.
-
12Dellavance A, Gabriel Júnior A, Cintra AFU, Ximenes AC, Nuccitelli B, Taliberti BH, et al II Consenso Brasileiro de fator antinuclear em células Hep-2. Rev Bras Reumatol 2003;43:129-40.
-
13Pham BN, Albarede S, Guyard A, Burg E, Maisonneuve P. Impact of external quality assessment on antinuclear antibody detection performance. Lupus 2005;14:113-9.
-
14Kavanaugh A, Tomar R, Reveille J, Solomon DH, Homburger HA. Guidelines for clinical use of the antinuclear antibody test and tests for specific autoantibodies to nuclear antigens. American College of Pathologists. Arch Pathol Lab Med 2000;124:71-81.
-
15Bloch DB, Yu JH, Yang WH, Graeme-Cook F, Lindor KD, Viswanathan A, et al The cytoplasmic dot staining pattern is detected in a subgroup of patients with primary biliary cirrhosis. J Rheumatol 2005;32:477-83.
-
16Nishimura S NK, Hisakawa N, Chikazawa H, Ookubo S, Nakatani K, Hashimoto K. Positivity for antinuclear antibody in patients with advanced rheumatoid arthritis. Acta Med Okayama 1996;50:261-5.
-
17Dellavance A, Viana VS, Leon EP, Bonfa ES, Andrade LE, Leser PG. The clinical spectrum of antinuclear antibodies associated with the nuclear dense fine speckled immunofluorescent pattern. J Rheumatol 2005;32:2144-9.
-
18Laurino CC, Fritzler MJ, Mortara RA, Silva NP, Almeida IC, Andrade LE. Human autoantibodies to diacyl-phosphatidylethanolamine recognize a specific set of discrete cytoplasmic domains. Clin Exp Immunol 2006;143:572-84.
-
19Isenberg DA, Manson JJ, Ehrenstein MR, Rahman A. Fifty years of anti-ds DNA antibodies: are we approaching journey's end? Rheumatology (Oxford) 2007;46:1052-6.
-
20Hochberg MC. Updating the American College of Rheumatology revised criteria for the classification of systemic lupus erythematosus. Arthritis Rheum 1997;40:1725.
-
21Habash-Bseiso Dana E SHY, Ingrid Glurich, Jerry W. Goldberg. Serologic Testing in Connective Tissue Diseases Clinical Medicine & Research 2005;3:190-3.
-
22Koelsch K, Zheng NY, Zhang Q, Duty A, Helms C, Mathias MD, et al Mature B cells class switched to IgD are autoreactive in healthy individuals. J Clin Invest 2007;117:1558-65.
Endereço para correspondência:
Datas de Publicação
-
Publicação nesta coleção
07 Abr 2009 -
Data do Fascículo
Abr 2009
Histórico
-
Aceito
01 Nov 2008 -
Recebido
11 Fev 2008