Resumos
A terapia anti-TNFα tem sido amplamente utilizada em diversas artropatias inflamatórias crônicas, em especial artrite reumatoide (AR). No entanto, há preocupações quanto à segurança e ao risco de doenças infecciosas nos pacientes. O objetivo deste artigo é descrever um caso de hanseníase, forma virchowiana, em paciente com AR em uso de terapia anti-TNFα. Dessa forma, a vigilância dos eventos adversos deve ser rigorosa, especialmente no que diz respeito às doenças infecciosas. É recomendada investigação apropriada de lesões cutâneas em paciente recebendo terapia anti-TNFα, visto que o quadro clínico inicial pode ser inespecífico, especialmente em regiões endêmicas como o Brasil.
bloqueadores TNFα; artrite reumatoide; reações adversas; hanseníase
TNF blockers have been used in the treatment of several types of chronic inflammatory arthritis, especially rheumatoid arthritis. However, many doubts regarding the safety and high risk of infectious diseases in these patients remain. The main objective of this report was to present a case of lepromatous leprosy in a rheumatoid arthritis patient using TNF blockers. The development of adverse events should be rigorously observed, especially those related to infectious agents. Thus, appropriate investigation of skin lesions in patients receiving anti-TNFa therapy is recommended, as the initial clinical manifestation may be unusual, particularly in endemic regions in Brazil.
TNF blockers; rheumatoid arthritis; adverse events; leprosy
RELATO DE CASO
Hanseníase virchowiana associada ao uso de inibidor do fator de necrose tumoral α : relato de caso
Daniele S FreitasI; Natalia MachadoI; Fernando V AndriguetiI; Edgard T Reis NetoII; Marcelo M PinheiroIII
IMédico-residente de Reumatologia da Disciplina de Reumatologia da Unifesp/EPM
IIPós-graduando da Disciplina de Reumatologia da Unifesp/EPM
IIIDoutor-assistente e Chefe do Ambulatório de Imunobiológicos da Disciplina de Reumatologia da Unifesp/ EPM
Endereço para correspondência Endereço para correspondência: Dr. Marcelo M Pinheiro Rua Botucatu, 740, 3º andar Disciplina de Reumatologia CEP: 04023-900. Vila Clementino, São Paulo, SP, Brasil E-mail: mpinheiro@uol.com.br
RESUMO
A terapia anti-TNFα tem sido amplamente utilizada em diversas artropatias inflamatórias crônicas, em especial artrite reumatoide (AR). No entanto, há preocupações quanto à segurança e ao risco de doenças infecciosas nos pacientes. O objetivo deste artigo é descrever um caso de hanseníase, forma virchowiana, em paciente com AR em uso de terapia anti-TNFα. Dessa forma, a vigilância dos eventos adversos deve ser rigorosa, especialmente no que diz respeito às doenças infecciosas. É recomendada investigação apropriada de lesões cutâneas em paciente recebendo terapia anti-TNFα, visto que o quadro clínico inicial pode ser inespecífico, especialmente em regiões endêmicas como o Brasil.
Palavras-chave: bloqueadores TNFα, artrite reumatoide, reações adversas, hanseníase.
INTRODUÇÃO
Os bloqueadores do TNFα são importantes e eficazes opções para o tratamento de diversas artropatias inflamatórias crônicas (AICs), em especial artrite reumatoide (AR), e que apresentam resposta inadequada ao metotrexato e/ou outras drogas modificadoras do curso de doença (DMCD). Por outro lado, também estão associados com maior frequência de eventos adversos sérios, em especial quadros infecciosos e alérgicos.
Sabe-se que o TNF é importante para a formação e manutenção do granuloma e, assim, a terapia anti-TNF pode desorganizá-lo e ocasionar reativação de infecções granulomatosas latentes como a tuberculose e a hanseníase. As peculiaridades farmacológicas e bioquímicas dos agentes anti-TNFα podem explicar as diferenças entre essas medicações, especialmente no que diz respeito aos aspectos de segurança.1,2 Os anticorpos monoclonais, quiméricos (infliximabe-IFX) ou humanos (adalimumabe-ADA) neutralizam o TNF-a solúvel e ligado à membrana com maior avidez e por tempo mais prolongado, enquanto o etanercepte (ETN) se liga, apenas, à fração solúvel e de modo mais reversível e por menor intervalo de tempo. Além disso, IFX e ADA promovem mais apoptose, bem como diminuição significativa dos níveis de interferon gama (INF-g) e de forma dose-dependente. Em contrapartida, o ETN não possui essas características.Aredução da concentração do INF-g, ainda, pode estar associada à falência da inibição do crescimento intracelular de micobactérias.3,4
O Mycobacterium leprae causa uma doença crônica com duas apresentações clínicas principais: a forma tuberculoide, representada por granulomas bem organizados com poucas micobactérias; e a virchowiana, caracterizada por lesões menos organizadas e com maior número de bacilos. A apresentação clínica é polimórfica, variando desde alterações da pele com áreas de dessensibilização e hipopigmentação, até lesões neurais mais graves ou acometimento de outros órgãos, incluindo ossos e articulações.
RELATO DE CASO
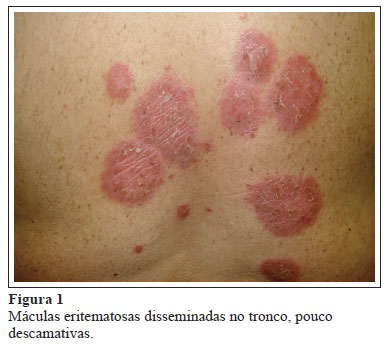
A.T.S, sexo masculino, 44 anos, com diagnóstico de AR há cinco anos caracterizada por poliartrite simétrica, aditiva, de pequenas e grandes articulações, associada à rigidez matinal prolongada, fator reumatoide e anticorpos contra peptídeos citrulinados (APF - anticorpo perinuclear) negativos e alterações radiográficas erosivas em quadris e punhos. Inicialmente, foi tratado com metotrexato e glicocorticosteroides (GC), mas devido à persistência da atividade articular e piora da capacidade articular (HAQ = 1,3), foi associado à leflunomida e, após falência dessa terapia combinada, o IFX foi iniciado. Usou metotrexato e IFX por 21 meses, sem relato de reações adversas relevantes, mas mantendo moderada atividade de doença (DAS28 entre 3,6 e 5,4). Como a resposta ao anti-TNF quimérico permanecia inadequada, optou-se pela substituição pelo ADA. Após 15 dias de uso, surgiram máculas eritematosas disseminadas pelo tronco e extremidades, não pruriginosas, não descamativas (Figura 1), associadas à febre, mialgia e espessamento do nervo ulnar. A biópsia de pele confirmou o diagnóstico de hanseníase, forma virchowiana, segundo classificação de Ridley e Jopling, com índice bacilífero de +2/+4 (Figura 2). A epidemiologia era negativa para hanseníase. A terapia anti-TNF foi interrompida e iniciado tratamento específico para hanseníase (clofazimina, rifampicina e dapsona), com programação de uso para 24 meses. Após 12 meses de poliquimioterapia, o paciente apresentou melhora das lesões cutâneas, mas manteve atividade poliarticular (DAS28 = 6,4), mesmo em uso de elevadas doses de GC (40 mg/dia de prednisona).
DISCUSSÃO
A terapia anti-TNFα está associada a uma grande variedade de infecções habituais ou oportunistas graves, além de outras manifestações relacionadascom os fenômenos alérgicos ou imunológicos. A frequência de associação entre os bloqueadores anti-TNF e as reações adversas cutâneas é divergente entre os estudos.
Wallis et al., estudando os dados do sistema de relatos de eventos adversos da FDA (Food and Drug Administration), mostraram incidência de doença granulomatosa de 238,6 e 73,5/100 mil pacientes tratados com IFX e ETN, respectivamente, durante quase cinco anos de avaliação. Entre as infecções por micobactérias, a maioria foi causada pelo Mycobacterium tuberculosis (60,2% para IFX e 46,9% para ETN), seguida por outras espécies (5,4% para IFX e 8,4% para ETN). E em apenas 0,1% delas o Mycobacterium leprae foi identificado como agente causal, sendo todos no grupo do IFX.2
Nos Estados Unidos, há relato de dois pacientes com diagnóstico de AR que desenvolveram hanseníase, forma virchowiana, após 12 a 24 meses do início do tratamento com IFX.5 Recentemente, Oberstein et al. mostraram os detalhes de um paciente com quadro de poliartrite simétrica e resposta inadequada aos GC e MTX, proveniente da região amazônica, que desenvolveu rash macular difuso, com biópsia compatível com hanseníase, forma tuberculoide, após o uso de ADA.6 Nosso paciente utilizou IFX por quase dois anos e não desenvolveu reação adversa significativa clinicamente aparente, porém, após duas semanas da substituição para o ADA, ele desenvolveu lesões cutâneas características de hanseníase, forma virchowiana. Sabe-se que a história natural da hanseníase se caracteriza por um curso lento até o surgimento das lesões de pele, entretanto, no presente caso, existia estreita relação temporal entre a modificação do agente anti-TNF e o aparecimento do quadro cutâneo. Não é possível afirmar com certeza se a troca do agente anti-TNF poderia ter sido a responsável pelo desencadeamento da doença ou se existia uma infecção latente em desenvolvimento e a modificação da medicação foi, somente, uma coincidência temporal.
Mais uma vez, as características imunogênicas dos bloqueadores do TNF (monoclonal quimérico versus humano, por exemplo) podem explicar a razão da manifestação cutânea tardia da hanseníase. Desse modo, sendo o IFX de natureza quimérica e, por conseguinte, mais imunogênico, poder-se-ia supor que existiriam mais anticorpos antiquimera (HACAs), com potencial menor concentração do agente no microambiente hansênico e, assim, neutralização da desorganização do granuloma. Após a modificação para um agente totalmente humano, pode ter havido maior bloqueio do TNF, uma vez que o agente não é neutralizado pelos anticorpos anti-IFX ou HACAs. Esses aspectos (troca do agente anti-TNF e a forma clínica da hanseníase) tornam esse caso inédito aos previamente relatados.
Manifestações musculoesqueléticas podem ocorrer durante reações da hanseníase7 e podem mimetizar as AICs, podendo atrasar o correto diagnóstico. Na hanseníase, as articulações acometidas são semelhantes às observadas na AR (como punhos, metacarpofalângicas, interfalângicas proximais, metatarsofalângicas, joelhos), acompanhadas por rigidez matinal.8 Fator reumatoide pode estar presente nesses pacientes,9 embora, mais recentemente, Ribeiro et al. tenham mostrado baixa prevalência desse autoanticorpo e do anticorpo contra os peptídeos citrulinados cíclicos (anti-CCP) em nosso meio.10 O exato mecanismo pelo qual os bloqueadores do TNFα ocasionam a reativação de infecções granulomatosas latentes não é bem conhecido, mas especula-se que a desorganização do granuloma esteja relacionada, diretamente, com próprio TNF e com o desequilíbrio da produção e da ativação da liberação de IFNg e IFNa, bem como a complexa interação entre linfócitos circulantes e células epitelioides e macrófagos locais (imunidade adquirida e inata). Munk et al. demonstraram que elevadas concentrações plasmáticas do receptor solúvel I do TNFα, em pacientes com hanseníase, forma virchowiana, podem ocasionar regulação ineficiente da atividade inflamatória, por inibir a atividade citolítica do TNF in vitro. Esse achado sugere que a atividade regulatória do receptor solúvel do TNF é parcialmente prejudicada em pacientes com hanseníase, forma virchowiana, mas não nas outras formas clínicas da doença.11
Nos três casos relatados anteriormente na literatura,5,6 o diagnóstico diferencial entre AR ou artrite relacionada à hanseníase permaneceu incerto. Em contrapartida, no caso relatado, o paciente apresentava poliartrite erosiva e simétrica de pequenas e grandes articulações cinco anos antes do aparecimento da hanseníase, evoluindo com anquilose grave de quadris e ombros, achados articulares que não são observados em pacientes com hanseníase isoladamente. Essas peculiaridades podem auxiliar no diagnóstico diferencial entre as manifestações musculoesqueléticas da hanseníase e da AR. É importante ressaltar, ainda, que, em geral, o quadro articular melhora após o tratamento da hanseníase, aspecto que não ocorreu no caso apresentado.
CONCLUSÃO
A terapia anti-TNFα tem sido precoce e amplamente utilizada para o tratamento de diversas AICs que apresentam resposta inadequada ao metotrexato e outras DMCD. No entanto, os riscos devem ser muito bem ponderados e discutidos com o paciente, especialmente a reativação de infecções granulomatosas latentes como tuberculose e hanseníase, endêmicas no Brasil. Dessa forma, recomenda-se ampla, adequada e cuidadosa avaliação antes do início dos bloqueadores TNFα, com o objetivo de minimizar as reações adversas. Além disso, mais atenção deve ser dada aos quadros cutâneos que surgem ou se exacerbam nesses pacientes.
Recebido em 18/11/2009
Aprovado, após revisão, em 16/04/2010
Declaramos a inexistência de conflitos de interesse
Disciplina de Reumatologia da Universidade Federal de São Paulo (Unifesp)
-
1Domm S, Cinatl J, Mrowietz U. The impact of treatment with tumour necrosis factor-a antagonists on the course of chronic viral infections: a review of the literature. Br J Dermatol 2008; 159:1217-28.
-
2Wallis RS, Broder MS, Wong JY, Hanson ME, Beenhouwer DO. Granulomatous Infectious Diseases Associated with Tumor Necrosis Factor Antagonists. Clin Infect Dis.2004; 38:1261-5.
-
3Winthrop LK. Risk and prevention of tuberculosis and other serious opportunistic infections associated with the inhibition of tumor necrosis factor. Nat Clin Pract Rheumatol 2006; 2:602-11.
-
4Furst DE, Wallis R, Broder M, Beenhouwer DO. Tumor Necrosis Factor Antagonists: Different Kinetics and/or Mechanisms of Action May Explain Differences in the Risk for Developing Granulomatous Infection. Semin Arthritis Rheum 2006; 36(3):159-67.
-
5Scollard DM, Joyce MP, Gillis TP. Development of Leprosy and Type 1 Leprosy Reactions after Treatment with Infliximab: A Report of 2 Cases. Clin Infect Dis 2006; 43:19-22.
-
6Oberstein EM ,Kkromo O, Tozman EC. Type I reaction of hansen's disease with Exposure to adalimumab: a case report. Arthritis Rheum 2008; 59:1040-3.
-
7Miladi MI, Feki I, Bahloul Z, Jlidi R, Mhiri C. Chronic inflammatory joint disease revealing borderline leprosy. Joint Bone Spine 2006; 73:314-7.
-
8Pereira HL, Ribeiro SL, Sato EI. Rheumatic manifestation em leprosy. Acta Reumatol Port 2008; 33(4):407-14.
-
9Atkin SL, Welbury RR, Stanfield E, Beavis D, Iwais B, Dick WC. Clinical and laboratory studies of inflammatory polyarthritis in patients with leprosy in Papua New Guinea. Ann Rheum Dis 1987; 46:688-90.
-
10Ribeiro SLE, Pereira HLA, Silva P, Neves RMS, Sato EI. Anticyclic citrullinated peptide antibodies and rheumatoid factor in leprosy patients with articular involviment. Braz J Med Biol Res 2008; 41:1005-10.
-
11Munk ME, Anding P, Schettini APM, Cunha MG, Kaufmann SHE. Soluble tumor necrosis factor alpha receptors in sera from Leprosy patients. Infect Immun 1999; 67:423-5.
Endereço para correspondência:
Datas de Publicação
-
Publicação nesta coleção
12 Jul 2010 -
Data do Fascículo
Jun 2010
Histórico
-
Aceito
16 Abr 2010 -
Recebido
18 Nov 2009