Resumos
OBJETIVOS: O presente estudo teve por objetivo descrever o processo de implementação de um registro nacional em um país em desenvolvimento (Brasil) e relatar os principais resultados preliminares do registro BiobadaBrasil. MATERAL E MÉTODOS: Através de um acordo com a PANLAR, o protocolo Biobadaser foi utilizado como modelo para a implementação de um novo registro no nosso país. Durante os dois primeiros anos desse esforço, o protocolo original foi adaptado, traduzido e apresentado a todos os reumatologistas brasileiros. Durante dez meses, dados de 1.037 pacientes (750 tratados com biológicos e 287 controles) de 15 centros foram coletados. RESULTADOS: A maioria dos pacientes tinha artrite reumatoide (AR) (n = 723). Infliximabe foi o agente anti-TNF mais usado, e a exposição total a biológicos foi 2.101 pacientes-ano. A razão mais comum para suspensão da droga foi ineficiência ou perda de efetividade (50%), e 30% dos pacientes interromperam o tratamento devido a eventos adversos. Três casos de tuberculose foram observados no grupo biológico, representando maior incidência do que aquela da população brasileira geral. Infecções foram observadas em 23% dos pacientes do grupo biológico, sendo o trato respiratório superior o local mais comumente afetado. Apenas um caso de hanseníase tuberculoide foi observado. Nenhuma morte nem malignidade atribuível ao efeito dos medicamentos foi observada até fevereiro de 2010. CONCLUSÕES: A implementação do registro foi bem sucedida. Embora recente, o registro BiobadaBrasil já forneceu importantes dados.
agentes antirreumáticos; Brasil; banco de dados
OBJECTIVES: The present study aimed at describing the implementation process of a national registry in a developing country (Brazil) and at reporting the main preliminary results of the BiobadaBrasil registry. MATERIAL AND METHODS: Through a PANLAR agreement, the Biobadaser protocol was used as a model for implementing the new registry in our country. During the first two years of this effort, the original protocol was adapted, translated, and presented to all Brazilian rheumatologists. For ten months, data of 1,037 patients (750 subjects treated with biological drugs and 287 control subjects) from 15 centers were collected. RESULTS: Most patients had rheumatoid arthritis (RA) (n = 723). Infliximab was the most frequently used anti-TNF agent, and the total exposure to biologic drugs was 2,101 patient-years. The most common reason for interrupting drug use was lack or loss of efficacy (50%), while 30% withdrew from the treatment arm due to adverse events. Three cases of tuberculosis were observed in the biologic group, with an incidence higher than that of the general Brazilian population. Infections were observed in 23% of the biologic group, and the upper respiratory tract was the most commonly affected site. Only one case of tuberculoid leprosy was observed. No deaths or malignancies attributed to drug effects were observed as of February 2010. CONCLUSIONS: The implementation of the BiobadaBrasil registry was successful, and, although recent, the registry has provided important data.
antirheumatic agents; Brazil; database
ARTIGO ORIGINAL
Registro brasileiro de biológicos: processo de implementação e resultados preliminares do BiobadaBrasil
David C TittonI; Ines Guimarães SilveiraII; Paulo Louzada-JuniorIII; Andre L HayataIV; Hellen Mary S. CarvalhoV; Roberto RanzaVI; Lucila S. RezendeVII; Geraldo Castelar PinheiroVIII; Jair Licio F. SantosIX; Jose Roberto MirandaX; Jozelio Freitas CarvalhoXI; Manoel Barros BertoloXII; Marlene FreireXIII; Morton A. ScheinbergXIV; Thelma L SkareXV; Vander FernandesXVI; Washington BianchiXVII; Ieda Maria M LaurindoXVIII
IHospital das Clínicas da Universidade Federal do Paraná - UFPR, Curitiba, PR; Professor de Reumatologia da Faculdade de Medicina da UFPR, Curitiba, PR
IIHospital São Lucas da PUC-RS, Porto Alegre, RS; Professora de Reumatologia da Faculdade de Medicina da PUC-RS
IIIHospital das Clínicas da Faculdade de Medicina de Ribeirão Preto da USP; Professor Livre-docente da Faculdade de Medicina de Ribeirão Preto da USP
IVMédico-reumatologista - Centro de Reumatologia, Osasco, SP
VHospital de Base do Distrito Federal, Brasília, DF
VIHospital de Clínicas da Universidade Federal de Uberlândia - UFUB; Professor de Reumatologia da Faculdade de Medicina da UFUB, MG
VIIHospital das Clínicas da UFPR, Curitiba, PR
VIIIHospital Universitário Pedro Ernesto, Rio de Janeiro, RJ; Professor de Reumatologia da Faculdade de Medicina da Universidade Estadual do Rio de Janeiro - UERJ, RJ
IXDivisão de Epidemiologia Hospital das Clínicas da Faculdade de Medicina de Ribeirão Preto da USP; Professor Titular da Faculdade de Medicina de Ribeirão Preto da USP
XMédico-reumatologista - Artrocenter Clínica Médica LTDA, Taubaté, SP
XIHospital das Clínicas da USP-CEDMAC, São Paulo, SP; Faculdade de Medicina da USP, São Paulo, SP
XIIHospital das Clínicas da Faculdade de Ciências Médicas da UNICAMP, Campinas, SP; Professor Livre-docente da Faculdade de Ciências Médicas da UNICAMP, Campinas, SP
XIIIHospital da Universidade Federal do Triângulo Mineiro - UFTM, Uberaba, MG; Professor de Reumatologia da Faculdade de Medicina da UFTM, Uberaba, MG
XIVCentro Hospitalar Abreu Sodré-AACD, São Paulo, SP; Livre-docente da USP, São Paulo, SP
XVHospital Universitário Evangélico, Curitiba, PR; Professora de Reumatologia da Faculdade de Medicina da PUC-PR, Curitiba, PR
XVIHospital Geral Universitário, Cuiabá, MT; Universidade Federal do Mato Grosso
XVIISanta Casa da Misericórdia, Rio de Janeiro, RJ
XVIIIHospital das Clínicas da USP, São Paulo, SP; Faculdade de Medicina da USP, São Paulo, SP
Correspondência para Correspondência para: Paulo Louzada-Junior Av Bandeirantes, 3900 Ribeirão Preto, SP, Brasil, CEP: 14048-900 E-mail: plouzada@fmrp.usp.br
RESUMO
OBJETIVOS: O presente estudo teve por objetivo descrever o processo de implementação de um registro nacional em um país em desenvolvimento (Brasil) e relatar os principais resultados preliminares do registro BiobadaBrasil.
MATERAL E MÉTODOS: Através de um acordo com a PANLAR, o protocolo Biobadaser foi utilizado como modelo para a implementação de um novo registro no nosso país. Durante os dois primeiros anos desse esforço, o protocolo original foi adaptado, traduzido e apresentado a todos os reumatologistas brasileiros. Durante dez meses, dados de 1.037 pacientes (750 tratados com biológicos e 287 controles) de 15 centros foram coletados.
RESULTADOS: A maioria dos pacientes tinha artrite reumatoide (AR) (n = 723). Infliximabe foi o agente anti-TNF mais usado, e a exposição total a biológicos foi 2.101 pacientes-ano. A razão mais comum para suspensão da droga foi ineficiência ou perda de efetividade (50%), e 30% dos pacientes interromperam o tratamento devido a eventos adversos. Três casos de tuberculose foram observados no grupo biológico, representando maior incidência do que aquela da população brasileira geral. Infecções foram observadas em 23% dos pacientes do grupo biológico, sendo o trato respiratório superior o local mais comumente afetado. Apenas um caso de hanseníase tuberculoide foi observado. Nenhuma morte nem malignidade atribuível ao efeito dos medicamentos foi observada até fevereiro de 2010.
CONCLUSÕES: A implementação do registro foi bem sucedida. Embora recente, o registro BiobadaBrasil já forneceu importantes dados.
Palavras-chave: agentes antirreumáticos, Brasil, banco de dados.
INTRODUÇÃO
Novas modalidades de tratamento centradas em terapias biológicas sem dúvida melhoraram os desfechos para os pacientes com artrite reumatoide (AR) grave e definitivamente criaram novas perspectivas no campo da reumatologia.1 Além disso, esses benefícios foram estendidos a outras doenças, como espondilite anquilosante (EA),2 artrite psoriática (APs),3 artrite idiopática juvenil (AIJ),4 e lúpus eritematoso sistêmico (LES).5
Desde a introdução dos agentes anti-TNF e, mais tarde, de outras terapias biológicas, a segurança desses agentes em comparação a placebo vem sendo demonstrada em ensaios clínicos.6 No entanto, a segurança a longo prazo, em particular relacionada a infecção grave e malignidade, assim como a eventos adversos raros e inesperados, não foi adequadamente avaliada nesses ensaios.7 Estudos abertos com frequência não refletem com precisão a rotina diária dos pacientes, uma vez que incluem apenas aqueles previamente avaliados em ensaios clínicos randomizados. Além disso, sistemas nacionais de farmacovigilância podem não ser fontes exatas de informação para a abordagem dessas imprecisões, uma vez que os eventos adversos podem ser significativamente subnotificados. Tal falta de informação a respeito de acompanhamento a longo prazo levou à criação de registros locais capazes de coletar dados de uma variada população de pacientes tratados na prática diária. Até o momento, a maioria dos registros atuais é patrocinada por sociedades nacionais de reumatologia, principalmente em países europeus8 e nos Estados Unidos.9 Ao longo da última década, tais registros coletaram uma enorme quantidade de dados que vêm sendo compartilhados em todo o mundo.8
As realidades europeia e americana podem ser diferentes daquelas de outros países, em particular de um país em desenvolvimento como o Brasil, que é tão extenso quanto a Europa Ocidental e semelhante em tamanho aos Estados Unidos. Características peculiares do Brasil, tais como a diversidade genética de sua população,10 situações socioeconômicas únicas e certas doenças endêmicas, determinaram o estabelecimento de um a registro nacional de pacientes em uso de terapias biológicas para doenças reumatológicas. O principal propósito de tal registro foi desenvolver um grande estudo epidemiológico prospectivo para monitorar pacientes que recebem esses novos medicamentos.
O presente estudo teve por objetivo descrever o processo de implementação de um registro nacional em um país em desenvolvimento e mostrar os principais resultados preliminares do registro BiobadaBrasil.
MATERIAL E MÉTODOS
Para se estabelecer um novo registro, os pontos fortes e fracos de registros atuais tiveram que ser considerados. Além disso, algumas características únicas do país e seu Sistema Nacional de Saúde (SNS) teriam que ser contempladas. Para o registro brasileiro, os seguintes pontos foram considerados prioritários:
a) Incluir um grupo de controle interno de pacientes recebendo as drogas modificadoras de doença (DMARDs) tradicionais (comparadores).
b) Garantir a qualidade dos dados no que se refere tanto à acurácia quanto à manutenção de um fluxo constante de informação.
c) Incluir clínicas privadas e centros públicos/acadêmicos, uma vez que ambos os tipos de instituição são parte do SNS brasileiro. No Brasil, os biológicos (i.e., agentes anti-TNF) podem ser obtidos no sistema de saúde pública de forma gratuita, e podem ser comprados através de companhias de seguro privadas.
d) Encorajar a participação voluntária contínua de centros e reumatologistas.
e) Estabelecer financiamento próprio e independente, sem interferência de patrocinadores.
Como acontece em outros registros (BSBR,11 CORRONA,9 RABBIT,12 ARTIS,13 BIOBADASER,14 DANBIO15), o BiobadaBrasil foi promovido por uma sociedade de reumatologia, a Sociedade Brasileira de Reumatologia (SBR)16, e teve por objetivo incluir todos os biológicos licenciados para o tratamento de qualquer doença reumática (indicação regular e off-label) por um período de acompanhamento indefinido. Através de uma iniciativa da PANLAR (BIOBADAMERICA), o protocolo espanhol (BIOBADASER)17 foi disponibilizado para a SBR, e foi considerado capaz de satisfazer às necessidades do país, pois abordava de maneira apropriada algumas das prioridades listadas acima. Incluiu uma coorte interna de pacientes em uso de não biológicos, que serviram como grupo-controle. O grupo-controle incluiu pacientes iniciando o tratamento com uma DMARD tradicional e pacientes que precisaram de uma dose aumentada devido à falha de pelo menos uma DMARD (estratégias de troca ou combinação de terapias). A utilização desses critérios de inclusão teve por objetivo minimizar os problemas da inclusão de diferentes populações quando da comparação da gravidade de doença. A dificuldade para estabelecer um grupo-controle apropriado é um obstáculo para qualquer novo registro, devendo sempre ser levado em consideração por ocasião da análise dos resultados. Além disso, o sistema de monitoramento do registro espanhol teve a vantagem do monitoramento online, através de ligações telefônicas semianuais e avaliação anual no local (através de processo de amostragem ao acaso).
Para ser atrativo para os centros acadêmicos e privados e para garantir o interesse continuado dos participantes do estudo, os seguintes incentivos foram adotados: bolsas de estudos, certificados de excelência, prontuários eletrônicos, acesso a um sistema online de informação compartilhada, status VIP em eventos de reumatologia e reuniões exclusivas com especialistas em reumatologia. O registro é patrocinado pela SBR e conta com a parceria de todas as companhias farmacêuticas fabricantes de biológicos licenciados atualmente no país (cotas iguais). A independência do registro foi assegurada em termos de design, controle, conduta, análise e publicação. Informação relacionada a despesas e dados em geral são fornecidos com regularidade a todas as companhias parceiras; no entanto, relatos detalhados sobre eventos adversos de cada biológico são disponibilizados apenas para a respectiva companhia farmacêutica.
Cinco centros foram escolhidos (fase I) para iniciar oficialmente o registro BiobadaBrasil em janeiro de 2009. Esses cinco centros (quatro em hospitais universitários públicos, um em uma clínica privada) distantes entre si 400-3.000 km, assumiram a responsabilidade de tradução, adaptação cultural e padronização dos procedimentos e relatórios. Durante essa fase, 150 pacientes entraram no registro. Em abril de 2009, o projeto foi apresentado e aberto para contribuições de todos os membros da SBR (fase II). Os dados foram coletados de todos os centros participantes, com 30 pacientes incluídos sem quaisquer problemas pendentes de monitoração a partir de fevereiro de 2010. Aprovação dos comitês de ética e consentimento livre e informado foram exigidos de todos os centros participantes.
MÉTODOS ESTATÍSTICOS
A taxa acumulada de descontinuação foi calculada utilizando-se métodos atuariais, considerando-se o tempo de observação desde a admissão até a primeira saída. O teste de log-rank foi usado para comparar as curvas de sobrevida dos grupos AR, EA, e outras. Todas as análises foram realizadas com o programa Stata 9.1 (StataCorp LP, College Station, TX, EUA). O nível de significância estatística adotado foi p < 0.05.
RESULTADOS
Além dos cinco centros iniciais, 18 outros centros (incluindo uma clínica privada), distantes 80-4.000 km (Figura 1), concordaram em participar do registro BiobadaBrasil. Um total de 1.037 pacientes desses centros foi registrado a partir de fevereiro de 2010. Outros 18 centros estão no momento passando pelo processo de aprovação para juntarem-se ao registro, que, desde a sua apresentação para os reumatologistas brasileiros, vem crescendo continuamente em número de pacientes e centros participantes (Figura 1).
Um total de 1.037 pacientes, definido como grupo total, foi dividido em dois grupos: um recebendo tratamento com biológicos (biológico; n = 750) e outro recebendo tratamento com DMARDs (controle; n = 287). Nos dois grupos, AR foi diagnosticada na maioria dos pacientes (69,7% grupo total); tal prevalência de AR foi maior no grupo-controle (89,9%) comparada àquela no grupo biológico (68,9%; p < 0,001; Tabela 1). Espondiloartrite correspondeu a 21,2% dos diagnósticos (n = 220), tendo a EA sido identificada em 66% (n = 145), a APs em 27,3% (n = 60), a espondiloartrite relacionada à doença de Crohn em 4% (n = 9) e a espondiloartrite indiferenciada em 2,7% (n = 6). Mulheres corresponderam a 72% dos pacientes e a idade média foi de 47,3 ± 13,8 anos. O tempo médio de exposição ao tratamento foi de 2,09 ± 2,39 anos, sendo que 750 pacientes usavam biológicos e 287 usavam apenas DMARDs. A maioria dos pacientes do estudo (85%) foi recrutada de hospitais públicos, enquanto 15% originaram-se dos dois serviços privados. As características dos pacientes acham-se resumidas na Tabela 1.
No geral, infliximabe foi o inibidor de TNF mais comumente usado, seguido por adalimumabe e etanercepte (Tabela 2). Biológicos, como abatacepte, rituximabe e tocilizumabe, não foram usados na EA. Rituximabe foi também usado em LES (n = 6), síndrome de sobreposição (n = 1), AIJ (n = 1) e síndrome de Sjögren (n = 1).
A exposição total aos inibidores de TNF durante os primeiros quatro anos de uso foi de 2.101 pacientes-ano para o grupo total (taxa de incidência = 7,9%), sendo 1.306 pacientes-ano para o grupo AR (taxa de incidência = 9,2%), 386 pacientesano para o grupo EA (taxa de incidência = 4,9%) e 407 pacientes-ano para o grupo 'outras doenças' (taxa de incidência = 6,6%). Pacientes comAR tiveram exposições mais longas em termos de pacientes-ano e maior frequência de tentativas de vários tratamentos biológicos diferentes (Tabela 2).
A suspensão da terapia biológica (Tabela 3) foi mais frequentemente relacionada à ineficiência ou perda de eficácia do que a efeitos adversos no estudo como um todo (50% vs. 32%) e em pacientes comAR (55% vs. 28%). Embora as frequências de ineficiência ou perda de eficácia e de eventos adversos tenham sido diferentes entre os grupos teste e controle, nenhuma análise estatística foi conduzida devido ao pequeno tamanho do grupo-controle. Para os pacientes com EA, frequências semelhantes para ineficiência ou perda de eficácia (50%) e para eventos adversos (50%) foram encontradas, embora o pequeno tamanho da amostra tenha impedido análise estatística definitiva. Três mortes ocorreram, todas em pacientes com AR. Duas dessas mortes ocorreram no grupo biológico, tendo um paciente morrido devido a infecção viral H1N1 e o outro devido a aneurisma gigante de carótida extracraniana. No grupo-controle, um paciente morreu devido a infarto agudo do miocárdio (Tabela 3).
As infecções foram os eventos adversos mais frequentes em pacientes usando biológicos (n = 206, Tabela 4). Os locais mais comuns de infecção foram trato respiratório superior (28,6%), trato urinário (27,6%), pele e partes moles (18,9%) (Tabela 4). O padrão de eventos adversos foi semelhante ao observado em outros registros. Até o momento, um caso de doença tropical endêmica (hanseníase tuberculoide) foi relatado, e três casos de tuberculose ativa foram detectados no grupo usando tratamento anti-TNF. Em um dos casos, a tuberculose era pulmonar e, em dois, disseminada, mas, em todos os três, houve recuperação total. Durante o período de observação, quatro casos de câncer foram relatados (mama e útero).
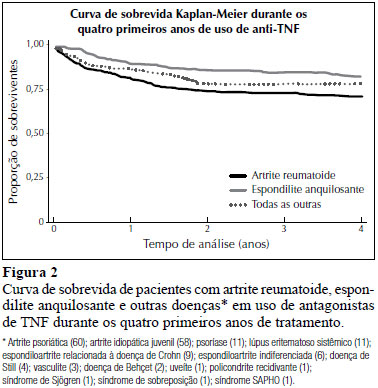
A Figura 2 representa a probabilidade acumulada de sobrevida para os três grupos de doença (AR, EA, e outras), tendo-se utilizado a descontinuação do medicamento como desfecho. A duração do uso de antagonistas de TNF na EA foi significativamente maior do que na AR com um, dois, três e quatro anos (Figura 2), e a diferença foi maior com exposições prolongadas (p < 0,05; teste de log-rank).
DISCUSSÃO
Em 1959, um grupo de especialistas brasileiros em reumatologia reuniu esforços para resolver um problema de comunicação e compartilhar experiências em um país de dimensões continentais. Como resultado dessa colaboração, a SBR foi fundada. Hoje, a SBR16 tem 1.250 membros, todos com título de especialista em reumatologia emitido pela SBR e obtido através de exame rigoroso, que consiste em avaliações escritas, orais e práticas, além de uma análise criteriosa de currículo. A medicina da era moderna requer informação e conhecimento científicos atualizados, e o fornecimento dessa informação é um dos principais objetivos da SBR. As novas terapias contra doenças autoimunes trouxeram uma nova perspectiva à reumatologia. Como muitos países desenvolveram registros para coletar informação autorreferida, a SBR decidiu acompanhá-los e conectar-se a essa rede inovadora de compartilhamento de informação. Para tal, em dezembro de 2007, a SBR iniciou a implementação do registro nacional, utilizando a experiência e a tecnologia de um dos primeiros registros europeus, o BIOBADASER espanhol.17 Entre as razões que levaram à escolha do BIOBADASER, citam-se: o fato de que o mesmo já havia sido testado e estava em uso; ser escrito em língua latina; e ter sido oferecido através de um acordo com a PANLAR como uma extensão da BIOBADAMERICA.
Com área total de 8.456.510 km2, o Brasil é dividido em 26 estados federais e um distrito federal,18 tendo sido o principal desafio inicial a criação de um projeto que fosse acessível a todos os reumatologistas em cada região. Tal tarefa apresentou alguns obstáculos, pois cada estado tem um perfil genético, racial e sociocultural único, doenças endêmicas incluindo infecções tropicais, acesso desigual a medicamentos, dispari dades econômicas e desafios geográficos. Aprincípio, o registro foi amplamente discutido e sua implementação planejada em detalhes, com tradução para o português e posterior adaptação cultural para garantir boa qualidade de informação, redução de potenciais vieses, e atrair os reumatologistas brasileiros. Em consequência, 23 centros ativos de dez estados estão participando já no primeiro ano de funcionamento. Em se considerando os centros que aguardam aprovação dos comitês de ética, obtém-se um total de 41 centros em 15 estados diferentes (Figura1).
Um dos principais objetivos desse projeto é assegurar a boa qualidade dos dados; para tal, todos os centros receberam um manual de procedimentos de operação padrão e foram continuamente monitorados por um membro da equipe profissional. Cada centro assumiu a responsabilidade de monitorar o prontuário médico de cada paciente uma vez por ano. A seleção desses dados foi aleatória e compreendeu 20% do total de pacientes incluídos no registro.
O BiobadaBrasil inclui todos os pacientes submetidos a terapia biológica e em acompanhamento rigoroso com dados completos registrados no prontuário médico. No Brasil, a SBR publicou diretrizes nacionais para AR, EA e APs19,20 que são seguidas pela maioria dos reumatologistas brasileiros. No entanto, existem algumas indicações off-label, em que cada médico pode prescrever medicações segundo seu próprio discernimento. O BiobadaBrasil não interfere com as indicações individuais para terapia biológica, e cada reumatologista é responsável por decidir iniciar ou parar uma medicação.
Esses são dados preliminares, e o registro é relativamente pequeno; portanto, ainda é muito cedo para se extrair conclusões específicas. Além disso, nossa coorte interna de controle é pequena, principalmente devido ao fato de que na fase I do nosso projeto, os cinco centros incluíram quase que só pacientes expostos à terapia biológica. Logo, o grupo-controle não pode ser comparado ao grupo biológico de modo estatisticamente significativo. Acreditamos que uma coorte que inclua um grupo maior de pacientes usando DMARDs tradicionais seja essencial para o desenvolvimento de dados melhores a respeito da segurança dos biológicos, tendo por objetivo a existência de pelo menos um controle para cada paciente em terapia biológica. No entanto, encontramos resultados únicos e originais nos 1.037 pacientes incluídos de janeiro de 2009 a fevereiro de 2010. Uma observação muito importante foi feita quando da inclusão de pacientes da prática privada. Digno de nota é o fato de que 15% dos pacientes da nossa série originaram-se de apenas duas fontes privadas. Não há dados precisos nem oficiais a respeito da assistência não pública para a obtenção de biológicos, mas estima-se que 15%-20% dos pacientes originam-se da esfera da prática privada. Tal observação reforça a importância de companhias privadas de seguro saúde. No Brasil, os pacientes têm acesso a medicamentos através de ordem judicial, e o grande número de pacientes originados da prática privada pode refletir a dificuldade de acesso público a biológicos.
É importante notar que, no Brasil, o infliximabe foi o primeiro biológico a ser comercializado (em 2000) e o primeiro a ser indicado para o tratamento de AR pelo SNS (em 2002). Adalimumabe e etanercepte chegaram ao mercado dois anos mais tarde, tendo sido aprovados pelo SNS para o tratamento de AR seis anos depois. Até o final de 2009, entretanto, os três agentes anti-TNF estavam aprovados para o tratamento de EA e APs. Rituximabe, abatacepte e tocilizumabe foram disponibilizados pela primeira vez no Brasil em 2006, 2007 e 2009, respectivamente, para o tratamento deAR, mas ainda não foram disponibilizados através do SNS. Essa disponibilidade poderia explicar, pelo menos em parte, a maior frequência do uso de infliximabe em comparação a outros biológicos, a maior exposição ao medicamento e a maior taxa de troca de medicamentos em AR em comparação aos pacientes com EA.
De acordo com o tempo médio de exposição a biológicos de nossos pacientes (1,8 ± 1,8 ano), observamos descontinuação de medicamentos em 195/880 (22,2%), que é semelhante à taxa de interrupção observada em outros registros.8 Interessante notar que 50% das suspensões de medicamentos deveram-se a ineficiência ou perda da eficácia, enquanto apenas 30% foram atribuídas a graves eventos adversos. De acordo com estudos prévios,21,22 pacientes com EA parecem ter uma taxa menor de descontinuação de medicamentos devido a ineficiência ou perda da eficácia do que pacientes com AR (6% e 12%, respectivamente). Em contraste, tanto AR quanto EA tiveram frequências semelhantes de eventos adversos (7% e 6%, respectivamente). Assuntos relacionados a acesso a medicamento e impedimentos governamentais ou judiciais foram outras razões primárias para interrupção da terapia biológica. Além disso, como observado em outros registros, a sobrevida média foi maior para pacientes com EA em comparação àqueles com AR no grupo biológico.21 Isso se explica em parte pela menor idade e menor número de comedicações vistos em pacientes com EA (SpA) em comparação àqueles com AR, pois idade e comedicações estão associadas a maior número de eventos adversos.23,24
As infecções são uma grande preocupação para pacientes em uso de terapias biológicas e devem receber atenção especial no registro. Como relatado por Listing et al., observamos maior frequência de infecções no grupo submetido ao tratamento com biológicos.25 Entretanto, enquanto Listing relatou uma frequência de infecção de 15%, nossa coorte teve uma incidência maior, 23%. Especula-se que essa maior taxa de infecção possa estar relacionada ao aumento da exposição a outros imunossupressores, comorbidades, uso de corticosteroides e atividade da doença.24 Por outro lado, nossos dados sugerem que isso se deva mais provavelmente a um efeito direto dos agentes anti-TNF e que todas as infecções sejam mais frequentes em pacientes em uso de terapia biológica do que naqueles que usam DMARDs. Além disso, infecções do trato respiratório baixo, especialmente pneumonia, foram as mais comuns, o que está de acordo com relatos de outros registros.8 Infecção pelo herpes zóster é uma outra grande preocupação em pacientes em terapia biológica, considerando-se o fato de que estudos recentes têm relatado uma incidência crescente daquela infecção nesse subgrupo de pacientes.25,26 Uma recente revisão sistemática da literatura24 demonstrou taxas mais baixas de infecção por herpes zóster em pacientes com AR tratados com DMARDs tradicionais, como metotrexato. Isso é confirmado pelo nosso estudo, no qual dez pacientes do grupo biológico desenvolveram infecção pelo herpes zóster em comparação a nenhum indivíduo no grupocontrole. Infecções bacterianas cutâneas (erisipelas), ósseas e articulares também foram mais comuns no grupo biológico. Infelizmente, no grupo biológico, houve uma morte devida a pneumonia viral pelo H1N1 durante a pandemia mundial em 2009. Como já discutido por outros autores e pelo nosso próprio grupo, estamos cientes de que a potencial subnotificação de infecções leves, em especial no grupo-controle, pode ser uma importante variável confundidora e limitação desse tipo de registro.25,27,28
Considerando-se que a tuberculose (TB) permanece um importante problema de saúde pública no Brasil, essa infecção micobacteriana foi persistentemente investigada em nossa coorte através da realização de testes cutâneos de PPD em cada paciente de acordo com as diretrizes nacionais e recomendações da SBR.14,19,20 O Brasil ocupa a 14ª posição na lista de 22 países com a maior carga de TB, sendo responsável por 31% de todos os casos de TB da região Latino-Americana da Organização Mundial de Saúde (OMS). A despeito da vacinação BCG compulsória no Brasil, estima-se ainda uma incidência de 25-49/100.000 casos de TB ativa.29 Importante notar que, a despeito da baixa frequência de três casos de TB ativa não fatal no grupo tratado com agentes anti-TNF, a incidência por 100.000 pacientes na nossa coorte foi impressionantemente mais alta do que a esperada. Existe algum nível de proteção contra TB conferida pelo TNF,30 e estamos cientes da possibilidade de maior incidência de infecção micobacteriana em pacientes em uso de inibidores de TNF.
Estudo brasileiro mostrou a baixa prevalência de PPD reativo antes do uso de infliximabe em pacientes com AR, EA e artrite psoriásica, indicando que este teste possa ter um valor limitado para o rastreamento da tuberculose em pacientes que receberam terapia com biológicos.31
Além disso, acredita-se que o foco em doenças tropicais seja fundamental para um registro na América do Sul. Entretanto, observamos apenas um caso de hanseníase tuberculoide, e nenhum caso de histoplasmose ou outra doença granulomatosa foi relatado.
A ocorrência de reações agudas, embora raras, podem ser graves, sendo observadas mais comumente após as aplicações iniciais, tanto subcutâneas como intravenosas.32
Até o momento, nosso registro não observou qualquer evento adverso raro ou inesperado, e nem pode comparar o risco de malignidade entre os grupos biológico e controle.
CONCLUSÕES
Embora ainda muito precoce no que concerne à sua implementação, o registro BiobadaBrasil coletou dados que podem ser relevantes para a prática rotineira e estudos acadêmicos. Para um país com enormes dimensões geográficas e heterogeneidade cultural e socioeconômica, adequada coleta de dados e monitoramento de evento são necessários para que se desenvolva um conjunto de informações uniforme e coerente. Acreditamos que o registro BiobadaBrasil fornecerá dados de referência necessários sobre as atuais práticas reumatológicas brasileiras relacionadas a indicações para início e troca de medicações e perfis de segurança dos medicamentos mais comumente usados. Sem dúvida, períodos mais longos de observação melhorarão o conhecimento e as práticas clínicas no campo da reumatologia. Concluímos que os principais objetivos da implementação de um registro nacional foram atingidos com sucesso.
Contribuições dos autores
Todos os autores estiveram envolvidos no delineamento do manuscrito, coleta de dados, revisão crítica do mesmo, tendo todos aprovado sua versão final a ser publicada. Os dados apresentados foram obtidos de centros participantes do registro BiobadaBrasil, tendo incluído pelo menos 30 pacientes até 31 de janeiro de 2010.
Agradecimentos
Agradecemos especialmente à BIOBADASER pelo apoio e encorajamento no desenvolvimento de nossos registros, e ao Dr. Fernando Neubarth (Presidente da SBR 2006-8), que acreditou que a Sociedade Brasileira de Reumatologia era capaz de desenvolver esse projeto. Somos gratos a todos os nossos colegas e equipe do grupo BiobadaBrasil pela cooperação e fornecimento de dados.
Submetido em 28/1/2011.
Aprovado, após revisão, em 29/1/2011.
BiobadaBrasil é patrocinado pela Sociedade Brasileira de Reumatologia.
DC Titton, HMS Carvalho, IG Silveira, LS Rezende, R Ranza, P Louzada-Junior, IMM Laurindo (estão nos Conselhos Consultivos da Schering-Plough, Pfizer-Wyeth e Roche) receberam honorários para ministrar palestras para os laboratórios Abbott, Pfizer-Wyeth e Schering-Plough.
Comitê de Ética: # 7694/2009.
Disciplina de Reumatologia da Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo - USP, SP, Brasil.
-
1Deighton CM, George E, Kiely PD, Ledingham J, Luqmani RA, Scott DG. Updating the British Society for Rheumatology guidelines for anti-tumour necrosis factor therapy in adult rheumatoid arthritis (again). Rheumatology (Oxford). 2006; 45:649-52.
-
2Sidiropoulos PI, Hatemi G, Song IH, Avouac J, Collantes E, Hamuryudan V, et al. Evidence-based recommendations for the management of ankylosing spondylitis: systematic literature search of the 3E Initiative in Rheumatology involving a broad panel of experts and practicing rheumatologists. Rheumatology (Oxford). 2008; 47:355-61.
-
3Ritchlin CT, Kavanaugh A, Gladman DD, Mease PJ, Helliwell P, Boehncke WH, et al. Treatment recommendations for psoriatic arthritis. Ann Rheum Dis. 2009; 68:1387-94.
-
4Ilowite NT. Update on biologics in juvenile idiopathic arthritis. Curr Opin Rheumatol. 2008; 20:613-8.
-
5Cambridge G, Leandro MJ, Teodorescu M, Manson J, Rahman A, Isenberg DA, et al. B cell depletion therapy in systemic lupus erythematosus: effect on autoantibody and antimicrobial antibody profiles. Arthritis Rheum 2006; 54:3612-22.
-
6Gartlehner G, Hansen RA, Jonas BL, Thieda P, Lohr KN. The comparative efficacy and safety of biologics for the treatment of rheumatoid arthritis: a systematic review and metaanalysis. J Rheumatol. 2006; 33:2398-408.
-
7Donahue KE, Gartlehner G, Jonas DE, Lux LJ, Thieda P, Jonas BL, et al. Systematic review: comparative effectiveness and harms of disease-modifying medications for rheumatoid arthritis. Ann Intern Med 2008; 148:124-34.
-
8Zink A, Askling J, Dixon WG, Klareskog L, Silman AJ, Symmons DP. European biologicals registers: methodology, selected results and perspectives. Ann Rheum Dis. 2009; 68:1240-6
-
9Sokka T, Willoughby J, Yazici Y, Pincus T. Databases of patients with early rheumatoid arthritis in the USA. Clin Exp Rheumatol. 2003; 21(5 Suppl 31):S146-53.
-
10Louzada-Júnior P, Freitas MV, Oliveira RD, Deghaide NH, Conde RA, Bertolo MB, et al. A majority of Brazilian patients with rheumatoid arthritis HLA-DRB1 alleles carry both the HLA-DRB1 shared epitope and anti-citrunillated peptide antibodies. Braz J Med Biol Res 2008; 41:493-9.
-
11Watson K, Symmons D, Griffiths I, Silman A. The British Society for Rheumatology biologics register. Ann Rheum Dis. 2005; 64 Suppl 4:iv42-3.
-
12Zink A, Listing J, Klindworth C, Zeidler H; German Collaborative Arthritis Centres. The national database of the German Collaborative Arthritis Centres: I. Structure, aims, and patients. Ann Rheum Dis. 2001; 60:199-206.
-
13van Vollenhoven RF, Askling J. Rheumatoid arthritis registries in Sweden. Clin Exp Rheumatol. 2005; 23(5 Suppl 39):S195-200.
-
14Gómez-Reino JJ, Carmona L, Valverde VR, Mola EM, Montero MD; BIOBADASER Group.Treatment of rheumatoid arthritis with tumor necrosis factor inhibitors may predispose to significant increase in tuberculosis risk: a multicenter active-surveillance report. Arthritis Rheum. 2003; 48:2122-7.
-
15Hetland ML, Unkerskov J, Ravn T, Friis M, Tarp U, Andersen LS, et al. Routine database registration of biological therapy increases the reporting of adverse events twentyfold in clinical practice. First results from the Danish Database (DANBIO). Scand J Rheumatol. 2005; 34:40-4.
-
16Brazilian Society of Rheumatology website. http://www.reumatologia.com.br Acessado em janeiro de 2011.
» link -
17BIOBADASER website. http://www.biobadaser.ser.es/ Acessado em janeiro de 2011.
» link -
18Brazilian Institute of Geography and Statistics 2008 website. http://www.sidra.ibge.gov.br/bda/territorio/tabunit.asp?n=6&t=2&z=t&o=4 Acessado em janeiro de 2011.
» link -
19Bertolo MB, Brenol CV, Schainberg CG, Neubarth F, Lima FAC, Laurindo IM, et al. Update on the Brazilian consensus for the diagnosis and treatment of rheumatoid arthritis. Rev Bras Reumatol 2007; 47:151-159.
-
20Sampaio-Barros PD, Azevedo VF, Bonfiglioli R, Campos WR, Carneiro SCS, Carvalho MAP, et al. First update on the Brazilian consensus for the diagnosis and treatment of spondyloarthropathies: other spondyloarthropathies. Rev Bras Reumatol 2007; 47:233-249.
-
21Carmona L, Gómez-Reino JJ, BIOBADASER Group. Survival of TNF antagonists in spondylarthritis is better than in rheumatoid arthritis. Data from the Spanish registry BIOBADASER. Arthritis Res Ther 2006; 8:R72.
-
22Saad AA, Ashcroft DM, Watson KD, Symmons DP, Noyce PR, Hyrich KL; on behalf of the BSRBR. Efficacy and safety of anti-TNF therapies in psoriatic arthritis: an observational study from the British Society for Rheumatology Biologics Register. Rheumatology (Oxford). 2010; 49:697-705.
-
23Shelton PS, Fritsch MA, Scott MA: Assessing medication appropriateness in the elderly: a review of available measures. Drugs Aging 2000; 16:437-450.
-
24Leombruno JP, Einarson TR, Keystone EC. The safety of anti-tumour necrosis factor treatments in rheumatoid arthritis: meta and exposure-adjusted pooled analyses of serious adverse events. Ann Rheum Dis. 2009; 68(7):1136-45.
-
25Listing J, Strangfeld A, Kary S, Rau R, von Hinueber U, Stoyanova-Scholz M, et al. Infections in patients with rheumatoid arthritis treated with biologic agents. Arthritis Rheum 2005; 52:3403-12.
-
26Strangfeld A, Listing J, Herzer P, Liebhaber A, Rockwitz K, Richter C, et al. Risk of herpes zoster in patients with rheumatoid arthritis treated with anti-TNF-alpha agents. JAMA. 2009; 301:737-44.
-
27Dixon WG, Watson K, Lunt M, Hyrich KL, British Society for Rheumatology Biologics Register Control Centre Consortium, Silman AJ, et al., on behalf of the British Society for Rheumatology Biologics Register. Rates of serious infection, including site-specific and bacterial intracellular infection, in rheumatoid arthritis patients receiving anti-tumor necrosis factor therapy: results from the British Society for Rheumatology Biologics Register. Arthritis Rheum 2006; 54:2368-76.
-
28Bongartz T, Sutton AJ, Sweeting MJ, Buchan I, Matteson EL, Montori V. Anti-TNF antibody therapy in rheumatoid arthritis and the risk of serious infections and malignancies: systematic review and meta-analysis of rare harmful effects in randomized controlled trials. JAMA 2006; 295:2275-85.
-
29Global tuberculosis control: a short update to the 2009 report. Available on http://www.who.int/tb/publications/global_report/2009/update/en/) website. Acessado em janeiro de 2011.
-
30Carmona L, Gómez-Reino JJ, Rodríguez-Valverde V, Montero D, Pascual-Gómez E, Mola EM, et al. Effectiveness of recommendations to prevent reactivation of latent tuberculosis infection in patients treated with tumor necrosis factor antagonists. Arthritis Rheum 2005; 52:1766-1772.
-
31Callado MR, Lima JR, Nobre CA, Vieira WP. Low prevalence of reactive PPD prior to infliximab use: comparative study on a population sample of Hospital Geral de Fortaleza Rev Bras Reumatol. 2011; 51:46-52.
-
32de Moraes JC, Aikawa NE, Ribeiro AC, Saad CG, Carvalho JF, Pereira RM et al. Immediate complications of 3,555 injections of anti-TNFα. Rev Bras Reumatol. 2010; 50:165-75.
Datas de Publicação
-
Publicação nesta coleção
04 Maio 2011 -
Data do Fascículo
Abr 2011
Histórico
-
Recebido
28 Jan 2011 -
Aceito
29 Jan 2011