RECOMENDAÇÕES DA SOCIEDADE BRASILEIRA DE REUMATOLOGIA
Recomendações sobre diagnóstico e tratamento da espondilite anquilosante* * Trabalho realizado com a chancela da Sociedade Brasileira de Reumatologia.
Percival Degrava Sampaio-BarrosI,II,** ** Autor para correspondência. E-mail: pdsampaiobarros@uol.com.br (P.D. Sampaio-Barros). ; Mauro KeisermanIII; Eduardo de Souza MeirellesIV; Marcelo de Medeiros PinheiroV; Antonio Carlos XimenesVI; Valderílio Feijó AzevedoVII; Rubens BonfiglioliVIII; Sueli CarneiroIX,X; Roberto RanzaXI; Wanderley Marques BernardoXII; Célio Roberto GonçalvesI,XIII
IDisciplina de Reumatologia, Faculdade de Medicina, Universidade de São Paulo (FMUSP), São Paulo, SP, Brasil
IIPresidente da Comissão de Espondiloartrites da Sociedade Brasileira de Reumatologia (2006-2012), São Paulo, SP, Brasil
IIIHospital São Lucas, Pontifícia Universidade Católica de Porto Alegre, Porto Alegre, RS, Brasil
IVServiço de Reumatologia, Instituto de Ortopedia e Traumatologia, FMUSP, São Paulo, SP, Brasil
VUniversidade Federal de São Paulo, São Paulo, SP, Brasil
VIHospital Geral de Goiânia, Goiânia, GO, Brasil
VIIUniversidade Federal do Paraná, Curitiba, PR, Brasil
VIIIPontifícia Universidade Católica de Campinas, Campinas, SP, Brasil
IXUniversidade Federal do Rio de Janeiro, Rio de Janeiro, RJ, Brasil
XUniversidade Estadual do Rio de Janeiro, Rio de Janeiro, RJ, Brasil
XIUniversidade Federal de Uberlândia, Uberlândia, MG, Brasil
XIICoordenador do Projeto Diretrizes da Associação Médica Brasileira, São Paulo, SP, Brasil
XIIIPresidente da Comissão de Espondiloartrites da Sociedade Brasileira de Reumatologia (2012-2014), São Paulo, SP, Brasil
Introdução
O conceito das espondiloartropatias soronegativas foi estabelecido em 1974, quando os pesquisadores ingleses Moll e Wright propuseram que se agrupassem em um mesmo conjunto algumas doenças até então consideradas completamente distintas entre si, mas que, na verdade, apresentavam diversas características comuns. Tais características englobavam aspectos clínicos (dor axial inflamatória associada à artrite, predominante em grandes articulações de membros inferiores, e entesopatias periféricas), radiológicos (sacroiliíte) e laboratoriais (soronegatividade para o fator reumatoide, pois até a década de 1970 alguns pesquisadores consideravam a espondilite anquilosante, EA, como o componente axial da artrite reumatoide) em indivíduos com predisposição genética (ligada ao antígeno de histocompatibilidade HLA-B27). Esse conjunto incluiu a EA, a artrite psoriásica, a artrite reativa e as artropatias enteropáticas (associadas às doenças inflamatórias intestinais).1
Em 2009, especialistas do grupo ASAS (Assessment on SpondyloArthritis International Society) propuseram a troca do nome do grupo para espondiloartrites (EpA), enfatizando os componentes axial ("espondilo") e periférico ("artrite") das doenças do grupo. Ao mesmo tempo, foram propostos critérios classificatórios para EpA axiais2,3 e, posteriormente, EpA periféricas.4 Essas mudanças também incluíram a descrição dos critérios para diagnóstico de sacroiliíte por ressonância magnética (RM).5 A proposição desses novos critérios diagnósticos e de classificação contribuiu para caracterizar melhor o amplo espectro das doenças do grupo.
Entre as doenças do grupo das EpA, sem dúvida a EA é a mais frequente e aquela que mais bem representa o conjunto das manifestações clássicas das EpA. Um número significativo de pacientes com diagnóstico de EpA indiferenciada, que inicialmente poderiam ser denominados EpA axial não radiológica ou EpA periférica nos dias de hoje, evoluirão como EA no seguimento a longo prazo.6 Por isso, o conhecimento dos critérios classificatórios de EpA e de EA é importante no diagnóstico e no seguimento dos pacientes do grupo. Com o advento de novos tratamentos para a EA, a importância de um diagnóstico precoce e a instituição de um tratamento específico se faz necessária, a fim de melhorar a qualidade de vida desses pacientes, geralmente adultos jovens no auge de sua vida produtiva.
1. Quais são os critérios clínicos para que um indivíduo seja considerado acometido por uma espondiloartrite?
Espondiloartrite axial
O grupo ASAS conduziu um estudo Delphi, com a participação de todos os seus membros titulares, selecionando todas as possíveis variáveis que deveriam ser avaliadas em um paciente com EpA axial. Essas variáveis foram avaliadas em um estudo prospectivo que incluiu 647 pacientes com dor nas costas de mais de três meses de duração, sem causa definida ou diagnóstico conhecido, com ou sem sintomas periféricos, e que iniciaram sintomas antes dos 45 anos de idade, seguidos em 25 centros universitários de 16 países.
Após avaliação estatística, foram propostos critérios fundamentados em duas variáveis principais: a sacroiliíte por imagem (radiografia de bacia e/ou RM) e o antígeno de histocompatibilidade HLA-B27. A presença de uma variável principal (sacroiliíte por imagem ou HLA-B27 positivo) e de um (quando sacroiliíte por imagem) ou dois (quando HLA-B27 positivo) critérios característicos das EpA [lombalgia inflamatória, artrite periférica, entesite, dactilite, psoríase cutânea, doença de Crohn ou retocolite ulcerativa, boa resposta ao anti-inflamatório não hormonal (AINH), história familiar de EpA, HLA-B27 positivo, proteína C-reativa elevada] é decisiva para que o paciente seja classificado como EpA axial. A sensibilidade desse grupo de critérios foi de 82,9%, e a especificidade foi de 84,4%2,3(B).
Espondiloartrite periférica
Os critérios do grupo ASAS para EpA periférica são: manifestações articulares periféricas (artrite ou entesite ou dactilite) associadas a uma ou mais variáveis (psoríase, doença inflamatória intestinal, infecção prévia, HLA-B27, uveíte, imagem de sacroiliíte), ou a dois ou mais parâmetros (artrite, entesite, dactilite, lombalgia inflamatória no passado, história familiar de espondiloartrite), em pacientes com manifestações periféricas de início antes de 45 anos de idade. A sensibilidade desses critérios é de 79,5%, e a especificidade é de 83,3%. Então, em ambiente clínico de prevalência elevada de EpA periférica (66,2%), a utilização desse critério diagnóstico eleva a probabilidade de certeza diagnóstica para 90%4(B).
Recomendação 1
Atualmente, o melhor grupo de critérios que permite classificar um paciente como EpA axial ou EpA periférica é aquele proposto pelo grupo ASAS.
2. Qual é o papel da ressonância magnética na avaliação inicial de uma espondiloartrite axial?
Diagnóstico
A utilização da RM, por meio dos componentes edema, erosão, infiltração gordurosa e anquilose, permite fazer o diagnóstico de EpA axial com sensibilidade e especificidade de 90% e 97%, respectivamente, conferindo razão de verossimilhança positiva de 30 e, portanto, certeza diagnóstica de 97% quando positiva e de 91% quando negativa7(A).
O diagnóstico de um número maior que cinco lesões gordurosas de Romanus (sinal elevado nas imagens de T1 na RM) está associado ao diagnóstico de EpA axial em pacientes com lombalgia, com certeza de 86% (razão de verossimilhança: 12,6)8(B).
Prognóstico
A combinação de sacroiliíte intensa, diagnosticada na RM, com HLA-B27 positivo, prediz o desenvolvimento de futura EA (oito anos de seguimento), com sensibilidade e especificidade de 62% e 92%, respectivamente, sendo a probabilidade pós-teste positiva de 80%, e negativa de 83%. A sacroiliíte importante, isolada, prediz o diagnóstico com probabilidade pós-teste positiva de 50%, e negativa de 84%9(A).
A persistência de inflamação ativa nos ângulos vertebrais (shiny corners), diagnosticada pela RM, em pacientes com EA em tratamento com anti-TNFα durante dois anos de seguimento prediz o aumento de 14,9% (number needed to harm, NNH: 7) no risco de desenvolvimento de novos sindesmófitos. Nos casos em que a inflamação foi tratada com anti-TNFα, esse risco está aumentado em 11,4% (NNH: 8)10(A).
O seguimento de dois a sete anos de pacientes com EpA axial, e a avaliação das mudanças sacroilíacas (escore Danish - erosão, edema e infiltração gordurosa), por meio da RM, demonstram que as alterações crônicas têm risco aumentado nos pacientes com EA. Os escores de atividade > 2, crônico > 1, de erosão > 1 e de infiltração gordurosa > 4, no início do seguimento, estão associados à cronicidade das alterações sacroilíacas, com acurácia diagnóstica de 74%, 77%, 79% e 68%, respectivamente11(A).
Recomendação 2
Em pacientes com EpA axial, a ressonância magnética tem importância diagnóstica e prognóstica.
3. Quando o HLA-B27 deve ser solicitado em um paciente com espondiloartrite axial?
Espondiloartrite axial
A prevalência de HLA-B27 positivo em pacientes com EpA axial está aumentada em 38,2%, em comparação com pacientes sem EpA axial. O HLA-B27 é um dos critérios classificatórios obrigatórios; quando associado com outras variáveis (como imagem e critérios clínicos), permite classificar um paciente como EpA axial, com sensibilidade e especificidade de 83,7% e 83,3%, respectivamente, levando à certeza diagnóstica de 83% quando positivo e negativo3(B).
Espondilite anquilosante
Em pacientes com EA, a prevalência de HLA-B27 positivo pode ser de 90,2%. Comparados com pacientes HLA-B27 negativo, os pacientes com EA têm duração maior de doença, aumento de 23,6% (NNH: 4) no uso prévio ou atual de AINH e aumento de 18,9% (NNH: 4) no risco de indicação de biológicos (critério ASAS). Os pacientes HLA-B27 positivo podem ter maior gravidade da doença, como aumento no risco de comorbidades ocular (38,9% vs. 12,5%), pulmonar (4,2% vs. 0%) e cardíaca (4.3% vs. 0%), associado a valores mais elevados dos índices funcional (Bath Ankylosing Spondylitis Functional Index - BASfi) e de atividade de doença (Bath Ankylosing Spondylitis Disease Activity Index - BASDAI)12(B).
A análise dos fatores preditores de EA em pacientes com lombalgia inflamatória demonstra que a sacroiliíte diagnosticada na RM, quando associada ao HLA-B27 positivo, aumenta a especificidade e a sensibilidade diagnósticas, em comparação com a presença isolada da imagem, de 84% para 92%, e de 33% para 62%, respectivamente. Apenas o HLA-B27 positivo é capaz de predizer doença com 48% de probabilidade e de afastar doença quando negativo com probabilidade de 88%13(A).
Na avaliação de pacientes com EA divididos pela idade de início da doença (< 20 anos, 21-30 anos, 31-40 anos e > 40 anos), o HLA-B27 positivo é achado em 94,6%, 90,2%, 74,1%, e 61,2% dos pacientes, respectivamente. Então, o HLA-B27 positivo está associado a idade mais jovem de início14(B).
A chance da presença do gene HLA-B27 em pacientes com EA de caráter familial é 344% maior que em pacientes com espondilite esporádica15(B).
Recomendação 3
O HLA-B27 é útil principalmente na avaliação prognóstica, especialmente em pacientes com EA, sobretudo com relação ao tempo de início da doença.
4. Quais são as evidências para o uso da reabilitação física em pacientes com espondilite anquilosante?
O tratamento de pacientes com EA baseado na reabilitação postural e da musculatura flexora e extensora, de acordo com o método Reeducação Postural Global (RPG), ou por meio de 20 exercícios (de mobilidade e flexibilidade cervical, torácica, e de coluna lombar; alongamento de musculatura flexora e fortalecimento de musculatura extensora e exercícios de expansibilidade torácica), determina significativa melhora em relação à situação pré-tratamento, mensurada por meio dos escores Bath Ankylosing Spondylitis Metrologic Index (BASMI, que inclui teste de Schöber modificado, rotação cervical, flexão lombar e distância intermaleolar), BASDAI e BASfi. A comparação entre as duas formas de tratamento revela melhores resultados com a reabilitação postural pelo método RPG em até um ano de seguimento16,17(A).
Pacientes com EA submetidos a programas regulares de reabilitação de quatro semanas de duração são submetidos à avaliação, após 28 semanas, quanto ao estado de saúde (avaliação global do paciente, dor, rigidez matinal, BASfi, BAS-DAI e fadiga) e segundo o critério ASAS-IC (Assessments in Ankylosing Spondylitis working group's Improvement Criteria). Os programas oferecem avaliação personalizada de fisioterapia, exercícios em grupo, terapia passiva, relaxamento e educação do paciente, com diferença em dois componentes - resistência versus mobilidade. Após 16 semanas, ambas as formas de reabilitação (resistência e mobilidade) apresentam melhora significativa nas diversas variáveis (exceto BASDAI), mas a reabilitação centrada na mobilidade leva a um aumento na proporção de pacientes que alcançam ASAS20 e ASAS40 em 27% (number needed to treat, NNT: 4) e 19% (NNT: 5), em comparação com a resistência. Em 28 semanas de seguimento, os resultados são superiores nos pacientes com dominância no componente mobilidade. Em 16 semanas ainda, a mobilidade aumenta o benefício, medido pelo teste de Schöber (20% e 40%), em 18% e 19%, respectivamente, e com relação à melhora na flexão lateral (20% e 40%), em 37% e 36%, respectivamente18(A).
Recomendação 4
Os programas de reabilitação resultam em benefício aos pacientes com EA, especialmente durante o período de realização dos mesmos. Os programas específicos centrados na melhora do componente mobilidade apresentam melhores resultados.
5. Quais são as evidências para o uso de corticosteroides em pacientes com espondilite anquilosante?
A comparação entre duas doses de metilprednisona (375 mg vs. 1 g IV por três dias) no tratamento de pacientes com EA não responsivos aos AINH demonstra que mobilidade lombar e torácica, dor e rigidez matinal melhoram em ambas as doses, sem diferença entre elas. Os eventos adversos ocorrem em ambos os grupos, sendo os principais tontura, boca seca, distúrbios de sono, irritabilidade, impotência e ganho de peso19(A). A metilprednisona não tem sido mais utilizada na prática clínica desde a última década, devido a seus efeitos colaterais e ao surgimento de modalidades terapêuticas mais avançadas.
O tratamento de pacientes com EA com dor lombar há mais de três meses, por meio da injeção de 40 mg de acetato de triamcinolona na articulação sacroilíaca, guiado por tomografia computadorizada (TC), permite demonstrar, após seis meses de seguimento, que há redução na intensidade da dor (avaliada por escala visual analógica - EVA) e na sacroiIiíte (avaliada por RM), com sinais de aumento de resposta de 72% (NNT: 1). Há também redução significativa no consumo de AINH e no sinal de Mennell de 31% (NNT: 3)20,21(B).
Recomendação 5
A injeção intra-articular com acetato de triamcinolona nas sacroilíacas pode trazer benefício de curto a médio prazos, sendo opção terapêutica para os casos não responsivos ao uso de AINH e com dor isolada nas sacroilíacas. Não há evidências que permitam avaliar o uso de baixas doses de prednisona (ou corticosteroide equivalente) em espondilite anquilosante.
6. Em que situações o uso contínuo de AINH deve ser recomendado em pacientes com espondilite anquilosante?
A comparação do uso de piroxicam 20 mg/dia, meloxicam 15 mg/dia ou meloxicam 22,5 mg/dia em pacientes com EA, durante 52 semanas, revela redução na intensidade da dor em 27%, 28% e 27%, respectivamente. O aumento na porcentagem de resposta (Ankylosing Spondylitis Functional Index - ASfi) é semelhante, com 6 semanas e 12 meses de seguimento, no tratamento com piroxicam, meloxicam 15 mg e meloxicam 22,5 mg, sendo de 20%, 33% e 26%, respectivamente. Uma pequena porcentagem (16% - NNT: 6) de pacientes utilizando meloxicam 22,5 mg tem que descontinuar o tratamento durante 12 meses, em comparação com os demais regimes de tratamento. Em 52 semanas, há sinais de aumento de eventos adversos gastrointestinais de 19%, 7% e 5%, respectivamente22(A).
Pacientes com EA e dor entre 40 mm e 100 mm (EVA) tratados com etoricoxibe 90 mg/dia, etoricoxibe 120 mg/dia ou naproxeno 500 mg 2x/dia, apresentam melhora significativa nos desfechos dor na coluna (100-mm EVA), na atividade da doença pela avaliação global do paciente (100-mm EVA) e avaliação funcional (BASfi) após seis semanas de seguimento. Comparando as medicações, o etoricoxibe tem resultados superiores ao naproxeno, enquanto as doses de etoricoxibe têm resultados semelhantes. Há aumento na proporção dos pacientes que atingem o critério de remissão parcial no etorocoxibe 90 mg (NNT: 9), no etorocoxibe 120 mg (NNT: 7) e no naproxeno (NNT: 16). Não há diferença entre eventos adversos, sendo os mais comuns: cefaleia, diarreia, queimação retroesternal, infecção respiratória, eventos gastrointestinais e cardiovasculares23(A).
Em pacientes que necessitam de tratamento diário com AINH e que apresentem intensidade da dor superior a 50 mm (EVA), a comparação entre celecoxibe 200 mg/dia, celecoxibe 400 mg/dia ou naproxeno 500 mg 2x/dia, em 12 semanas, demonstra que os três regimes de tratamento produzem melhora e benefício em relação à intensidade da dor, atividade da doença (avaliação global do paciente - EVA), melhora funcional (BASfi) e eventos adversos. O regime com menor efeito é o do celecoxibe 200 mg.
O evento adverso mais frequente é o distúrbio gastrointestinal, sendo o mais comum a dispepsia. Com o naproxeno há ocorrência de eventos graves (úlcera e hemorragia)24(A). A comparação do celecoxibe 200 mg ou 400 mg com o diclofenaco 75 mg 2x/dia demonstra aumento de 13% (NNH: 8) em eventos adversos gastrointestinais no diclofenaco25(A).
Frente à ação analgésica em pacientes com EA, o número necessário para tratar (NNT), em seis semanas de seguimento, do etoricoxibe 90 mg, do etoricoxibe 120 mg e do naproxeno 1 g, relativo à melhora da dor na coluna (> 30%), foi de 2, 2 e 3, respectivamente; em relação à melhora > 30% no escore BASDAI, o NTT foi de 2, 2 e 3, respectivamente26(A).
Utilizar AINH (celocoxibe 100 mg ou 200 mg 2x/dia) contínuo ou por demanda durante dois anos em pacientes com EA pode levar a benefícios relacionados aos sinais e sintomas e à progressão radiológica da lesão (Stoke Ankylosing Spondylitis Spine Score) ou a danos relacionados a eventos adversos. Os sinais e sintomas após 24 meses de seguimento são semelhantes entre os dois regimes de tratamento, mas a progressão radiológica é três vezes maior no regime por demanda em comparação com o regime contínuo. Apesar de haver mais eventos adversos no regime contínuo, a diferença não é significativa. Os eventos adversos mais frequentes são hipertensão, dor abdominal e dispepsia27(A).
Recomendação 6
O uso contínuo de AINH é mais eficaz que o uso por demanda. Em pacientes com intensidade de dor moderada a intensa, a prescrição de inibidores COX-2 é opção terapêutica de longo prazo.
7. Quais são as evidências para o uso de drogas de base convencionais (metotrexato e sulfasalazina, entre outras) em pacientes com espondilite anquilosante?
Metotrexato
Há evidência de que o uso de metotrexato 10 mg/semana durante 24 semanas em pacientes com EA não produz diferença na atividade da doença, medido pelo BASDAI, e na mobilidade, medido pelo BASMI, quando comparado com pacientes sem tratamento com metotrexato28(B).
A resposta (índice composto) ao tratamento de pacientes com EA com metotrexato 7,5 mg/semana por 24 semanas é considerada quando obtém-se resultado > 20% em ao menos cinco das seguintes escalas: a) Intensidade da rigidez matinal (EVA); b) Bem estar físico (EVA); c) Atividade da doença (BAS-DAI); d) Função (BASfi); e) Função (Health Assessment Questionnaire for Spondyloarthropathies - HAQ-S); f) Atividade da doença (Avaliação global do médico - EVA); g) Atividade da doença (Como você descreve o nível atual de atividade da doença?). Ao comparar esses pacientes com pacientes sem uso de metotrexato, observamos aumento de 42% (NNT: 2) na resposta (índice composto) em 24 semanas e aumento de 32% (NNT: 3) na resposta (BASDAI). Os eventos adversos não diferem entre pacientes em uso ou não de metotrexato29(A).
Sulfasalazina
Não há diferença entre o início do tratamento com sulfasalazina (2 a 3 g/dia) e após 3-36 meses de tratamento, quanto aos desfechos de função física, dor, mobilidade de coluna, artrite periférica e avaliação global do paciente. Entretanto, quando comparamos os desfechos de resposta entre os pacientes tratados com sulfa e os não tratados, verifica-se diferença significativa favorável ao tratamento. Quanto ao desfecho rigidez na coluna, o tratamento com sulfasalazina produz benefício reduzindo o escore (EVA), apesar de não haver diferença no desfecho duração da rigidez matinal. Há aumento de 0,47 no risco de perda de aderência devido a eventos adversos nos pacientes tratados com sulfa (redução do risco relativo), com relato de reação adversa grave (erupção eritematosa pruriginosa, com náusea, anorexia e insônia)30(A).
Em pacientes com EpA axial, a remissão (critérios ASAS e RM) em 48 semanas é superior em pacientes tratados com etanercepte (33%) em comparação com a sulfasalazina (11%). Entretanto, após um ano de seguimento não há diferença na manutenção de resposta entre as duas formas de tratamento31(B).
Leflunomida
Em pacientes com EA, o número de respondedores de acordo com o critério ASAS20 com o uso da leflunomida (27%) é semelhante a pacientes não submetidos ao tratamento (20%). Após 24 meses de tratamento não há diferenças significativas na atividade da doença (BASG), no índice de atividade da doença (BASDAI), no índice funcional (BASfi), na dor, na mobilidade (BASMI) e no edema articular. Há aumento de 20% (NNH: 5) no risco de eventos adversos: distúrbios gastrointestinais, infecções respiratórias, dermatite e prurido, fadiga, trombose venosa e aumento de enzimas hepáticas32(A).
Recomendação 7
O metotrexato e a sulfasalazina representam opções terapêuticas para a espondilite anquilosante.
8. Quais são as indicações para o uso dos agentes biológicos bloqueadores do fator de necrose tumoral (drogas anti-TNF) na espondilite anquilosante?
Infliximabe
O tratamento de pacientes com EA ativa e grave (BASDAI > 4 e dor na coluna > 4 mm - EVA), por meio de infusão endovenosa de infliximabe (5 mg/kg) nas semanas 0, 2, e 6 pode produzir benefícios relacionados à regressão na atividade da doença em 50%, medida pelos critérios de atividade da doença (BASDAI), índice funcional (BASfi) e mobilidade (BASMI).
O infliximabe é eficaz em todos os critérios: há aumento de 44% (NNT: 2) na porcentagem de pacientes com melhora no BASDAI (melhora de 50%), em 12 semanas, com melhora de 38% no escore em relação à semana anterior ao início do tratamento; redução de 27% (NNT: 4) e de 17% (NNT: 6) na porcentagem de artrite e entesite após 12 semanas; redução de 37% (NNT: 3) no uso de AINH (50%); e aumento de 28% (NNT: 4) no número de pacientes sem necessidade de uso de AINH no período. O evento adverso mais frequente é a infecção respiratória, podendo também ocorrer tuberculose ganglionar, febre ou leucopenia33(A).
A manutenção do tratamento com infliximabe (5 mg/kg a cada seis semanas) após a fase inicial (semanas 0, 2, e 6) e após 54 semanas demonstra que 47% dos pacientes (NNT: 2) têm redução no BASDAI (redução de 50%). O uso de medicações tem redução de 70% com índices de redução de artrite periférica e entesite de 33,3% (NNT: 3) e redução nas hospitalizações em 31% (NNT: 3)34,35(B).
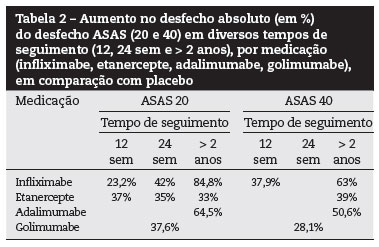
No seguimento de dois anos, 58% dos pacientes alcançaram ao menos 50% de redução no escore BASDAI, nível semelhante de resposta em um ano. Dos pacientes tratados, 94% e 85% alcançaram ao menos 20% de resposta no BASDAI nas semanas 54 e 102, respectivamente. As mudanças no escore BASfie BASMI são significativas em relação ao início do tratamento, e semelhantes entre um e dois anos de seguimento36(A). Durante o segundo ano de seguimento, 90% dos pacientes reportam eventos adversos, sendo os mais frequentes a infecção respiratória, a rinite, o herpes, a osteoporose, a síncope, a pancreatite e a metrorragia37(B). Após três anos (156 semanas) de seguimento, a resposta ao tratamento medida pelo ASAS40 é de 50%38(B). Após cinco anos de seguimento, a resposta ASAS20 e ASAS40 é de 84% e 63%, respectivamente39(B).
No final de oito anos de seguimento, um estado de menor atividade da doença (BASDAI < 3) está presente em 63,6% dos pacientes, resultado semelhante ao obtido em três meses de seguimento; além disso, 71,4% permanecem com valores de BASDAI < 3. A resposta ASAS20 está mantida em 84,8%, e a BASDAI50 está presente em 57,6% dos casos. Os eventos adversos presentes são tuberculose, granulomatose alérgica, pancreatite e piora do estado geral. Há redução de entesite em 30,3% (NNT: 3), da artrite periférica em 21,2% (NNT: 5) e da uveíte anterior em 36% (NNT: 3)40(B).
O critério ASAS20 como medida de resposta ao tratamento de pacientes com EA é composto por ao menos 20% de melhora após o tratamento, com melhora absoluta de ao menos uma unidade (escala de 0 a 10) em ao menos três dos seguintes domínios, sem deterioração na condição inicial: avaliação global do paciente, dor em coluna, função (BASfi) e rigidez matinal (questões 5 e 6 do BASDAI). Pacientes com EA com BASDAI > 4 e dor na coluna > 4 mm (EVA) tratados com 5 mg/ kg de infliximabe nas semanas 0, 2, 6, 12 e 18 apresentam aumento de 42% (NNT: 2) na resposta ASAS20 e de 21,1% (NNT: 5) na resposta parcial ASAS após 24 semanas de seguimento. A resposta BASDAI aumenta em 40,3% (NNT: 2), e a resposta BASfiem 34,2% (NNT: 3). Há ocorrência de eventos adversos graves, como tontura, colecistite, artrite, leucocitose, pneumonia, hemiparesia, lombalgia, febre e ganglioneuroma36(A).
Em pacientes com EA e escore BASDAI > 4 o tratamento com infliximabe 3 mg/kg nas semanas 0, 2 e 6 determina, em 12 semanas de seguimento, aumento na porcentagem de pacientes que atingem o ASAS20 em 23,2% (NNT: 4), e que atingem o ASAS40 em 37,9% (NNT: 3). Até um ano de seguimento a dose elevada para 5 mg/kg mantém a resposta clínica. Os eventos adversos mais frequentes são nasofaringite, infecção respiratória, prurido, náusea, tontura, cefaleia e febre41(A).
Etanercepte
Pacientes com EA ativa, definida como lombalgia inflamatória, rigidez matinal por ao menos 45 minutos e atividade da doença moderada, submetidos a tratamento com etanercepte 25 mg SC, 2x/semana, por quatro meses, aumentam em 50% (NNT: 2) a resposta ao tratamento, definida como melhora > 20% em três de cinco medidas de atividade da doença (ASAS, BASfi, avaliação global do paciente e escore de edema articular). As reações adversas mais comuns são infecções leves, diarreia, tinitus, e cefaleia42(A).
Em pacientes com EA ativa (BASDAI > 4 e dor em coluna > 4 mm - EVA) o tratamento com etanercepte 25 mg SC 2x /semana, por seis semanas, produz os seguintes benefícios: aumento da resposta no escore BASDAI50 em 51% (NNT: 2), aumento no escore ASAS20 de 53,6% (NNT: 2) e aumento na descontinuidade de uso de AINH em 55% (NNT: 2). No seguimento de três meses, 75% dos pacientes apresentam recorrência, e o evento adverso mais comum é infecção respiratória43(A).
O tratamento de pacientes com EA ativa (escore de 30 mm para rigidez matinal medido por EVA, escore de 30 mm para dois de três parâmetros - avaliação global do paciente, lombalgia medido por EVA e escore BASfi) com etanercepte 25 mg SC 2x/semana, durante 24 semanas, determina aumento de 31% (NNT: 3) no ASAS20 em 12 semanas, aumento de 35% (NNT: 3) no ASAS20 em 24 semanas, melhora no escore BASDAI e na mobilidade. Em relação aos eventos adversos, os mais comuns são: linfadenopatia, celulite, infecção respiratória, colite ulcerativa, obstrução intestinal e fraturas ósseas44(A). A proporção de pacientes que, após 192 semanas de tratamento, alcançou as respostas ASAS20 e ASAS40 é de 81% e 69%, respectivamente, com aumento de 33% e 39% em comparação com o escore de duas semanas de tratamento45(B).
Considerando atividade da EA como a intensidade > 30 mm (EVA) medida em quatro domínios [inflamação de coluna (escore), lombalgia, avaliação global da atividade da doença e função física], a prescrição de etanercepte (25 mg, 2x/semana) durante 12 semanas determina aumento de 37% (NNT: 3) na resposta ASAS20, aumento de 50% na resposta ASAS50, melhora de 43% na inflamação de coluna e na lombalgia, redução de 37% na avaliação global do paciente, melhora de 35% no índice funcional (BASfi) e melhora de 62% no índice de atividade de doença (BASDAI). Os eventos adversos mais comuns são: reação alérgica ou hemorragia no local da injeção, cefaleia, náusea, astenia, tontura, diarreia, prurido, dor abdominal e parestesia46(A).
Pacientes com EA apresentando um dos critérios que definem anquilose de coluna grave (quais sejam, duas pontes intervertebrais adjacentes e/ou fusão na coluna lombar; três pontes intervertebrais adjacentes e/ou fusão da coluna torácica; ou duas pontes intervertebrais adjacentes e/ou fusão na coluna cervical) podem ser tratados com etanercepte 50 mg/ semana durante 12 semanas. Esse tratamento leva à melhora dos seguintes parâmetros: aumento de 34% (NNT: 3) na porcentagem de pacientes que alcançam ASAS20; aumento de 23% (NNT: 5) nos pacientes que atingem BASDAI50; aumento de 25% (NNT: 4) no número de pacientes com melhora medida pelo Minimum Clinically Important Improvement (MCII); e melhora nos parâmetros de função pulmonar (capacidade vital - CV), CV forçada, relação FEV1/CV. Os eventos adversos mais frequentes são reação infusional e neutropenia47(A).
EA com atividade inflamatória (BASDAI > 4 e dor em coluna > 4) mantida por mais de 12 semanas, não responsiva ao tratamento com ao menos dois AINH por ao menos três meses, pode ser tratada com etanercepte 50 mg/semana ou 100 mg/ semana, durante 12 semanas, obtendo como resultados: ausência de diferença entre as duas formas de tratamento com relação aos parâmetros ASAS20, ASAS40, remissão parcial e BASDAI. Os eventos adversos em ambos os regimes de tratamento não são diferentes, sendo os principais: infecções, desordens gastrointestinais e reações infusionais48(A).
Adalimumabe
O tratamento de pacientes com EA não responsiva à AINH com adalimumabe 40 mg em semanas alternadas, por 24 semanas, reduz a dor [medida pelos escores dor total na coluna (EVA), dor noturna (EVA), Medical Outcomes Study Short Form-36 Health Survey (SF-36)], melhora a fadiga e a atividade da doença (medida pelo BASDAI), e melhora a rigidez matinal (BASfi)49(B).
Pacientes com EA tratados com adalimumabe 40 mg, em semanas alternadas, por 24 semanas, apresentam benefício com relação à atividade da doença (BASDAI), à função (BASfi) e à qualidade de vida [medida pelo AS Quality of Life Questionnaire (ASQoL)]. Há aumento de 27,2% (NNT: 4) no escore Minimum Clinically Important Difference (MCID). A resposta/melhora medida pelo escore ASAS20 e ASAS40 é mantida em dois anos de tratamento, sendo de 64,5% e 50,6%, respectivamente. O seguimento desses pacientes por três e cinco anos de tratamento demonstra estabilidade na resposta medida pelos diversos escores, incluindo o SF-3650-52(A).
Golimumabe
Pacientes com EA, com escore BASDAI > 4, escore de dor em coluna > 4 (EVA) e resposta inadequada ao uso prévio de AINH ou drogas modificadoras do curso da doença, quando tratados com golimumabe 50 mg ou 100 mg a cada quatro semanas, por 24 semanas, apresentam os seguintes resultados: aumento na resposta ASAS20 de 37,6% e 38,2% nas doses de 50 mg e 100 mg, respectivamente; aumento na resposta ASAS40 de 28,1% e 38,9% nas doses de 50 mg e 100 mg, respectivamente; e aumento da porcentagem de pacientes que alcançam escore BASDAI50 em 36,1% (NNT: 3). Até a 24ª semana, a proporção de pacientes que experimentou ao menos um evento adverso é de 79,9%, sem diferença com relação à dose, mas com aumento em relação a pacientes que não fazem uso da droga ativa, estando entre eles: nasofaringite, infecção respiratória, fadiga, cefaleia, diarreia, eritema na injeção e aumento nas enzimas hepáticas. A proporção de pacientes com um evento adverso grave é de 3,6% com 50 mg e de 6,4% com 100 mg, estando entre eles: infarto do miocárdio, fadiga, depressão, hipertensão, dor torácica, blefarite, náusea, vomitos, hepatite, influenza-like, dor nas extremidades e ganho de peso53(A). Há sinais de benefício com relação à qualidade do sono [medido pelo Jenkins Sleep Evaluation Questionnaire (JSEQ)]54(A). O seguimento desses pacientes por dois anos mostra manutenção da boa resposta por meio dos diferentes escores55.
Recomendação 8
Os pacientes com espondilite anquilosante ativa e grave, definida clinicamente como BASDAI > 4, e dor na coluna > 4 mm (EVA) e por ausência de resposta em três meses a AINH e/ou a drogas modificadoras do curso da doença podem ser tratados com infliximabe 3-5 mg/kg a cada seis a oito semanas em até oito anos de seguimento; ou com etanercepte 50 mg por semana, em até quatro anos de seguimento; ou com adalimumabe 40 mg em semanas alternadas, em até cinco anos de seguimento; ou com o golimumabe 50 mg a cada quatro semanas, em até dois anos de seguimento.
9. Existe diferença de eficácia entre as drogas anti-TNF em pacientes com espondilite anquilosante?
Os principais resultados individuais de eficácia de infliximabe, etanercepte, adalimumabe e golimumabe nos desfechos BASDAI, ASAS, descontinuidade de AINH, hospitalização, artrite e entesite estão descritos a seguir.
Infliximabe
O infliximabe é eficaz nos seguintes critérios: aumento de 44% (NNT: 2) na porcentagem de pacientes com melhora no BAS-DAI50, em 12 semanas, com melhora de 38% no escore em relação à semana anterior ao início do tratamento; redução de 27% (NNT: 4) e de 17% (NNT: 6) na porcentagem de artrite e entesite após 12 semanas; redução de 37% (NNT: 3) do uso de AINH (50%); aumento de 28% (NNT: 4) no número de pacientes sem necessidade de uso de AINH no período33(A).
Após 54 semanas, observa-se que 47% dos pacientes (NNT: 2) têm redução de 50% no BASDAI; o uso de outras medicações tem redução de 70%; há redução de 33,3% (NNT: 3) de artrite periférica e entesite; e há redução nas hospitalizações em 31% (NNT: 3)34,35(B).
No seguimento de dois anos, 58% dos pacientes alcançaram ao menos 50% de redução no BASDAI, nível semelhante à resposta em um ano. Dos pacientes tratados, 94% e 85% alcançaram ao menos 20% de resposta no BASDAI nas semanas 54 e 102, respectivamente37(B).
A eficácia medida pelo ASAS40 é de 50%37(B).Após cinco anos de seguimento, as respostas ASAS20 e ASAS40 são de 84% e 63%, respectivamente39(B). No final de oito anos de seguimento, um estado de menor atividade da doença (BASDAI < 3) está presente em 63,6% dos pacientes - resultado semelhante ao obtido em três meses de seguimento. Além disso, 71,4% permanecem com valores de BASDAI < 3; a resposta ASAS20 está mantida em 84,8%, e a BASDAI50 está presente em 57,56% dos casos40(B).
Após 24 semanas de seguimento, apresentam aumento de 42% (NNT: 2) na resposta ASAS20 e de 21,1% (NNT: 5) na resposta parcial ASAS. A resposta BASDAI aumenta em 40,3% (NNT: 2), e a resposta BASfiem 34,2% (NNT: 3)40(A). Em 12 semanas de seguimento, determina aumento de 23,2% (NNT: 4) na porcentagem de pacientes que atingem o ASAS20 e de 37,9% (NNT: 3) nos que atingem o ASAS4040(A).
Etanercepte
O uso do etanercepte traz benefícios aos pacientes tratados: aumenta a resposta BASDAI50 em 51% (NNT: 2), o escore ASAS20 em 53,6% (NNT: 2) e a descontinuidade de uso de AINH em 55% (NNT: 2)40(A). Além disso, determina o aumento de 31% (NNT: 3) no ASAS20 em 12 semanas, o aumento de 35% (NNT: 3) no ASAS20 em 24 semanas e a melhora no escore BASDAI e na mobilidade44(A).
A proporção de pacientes que, após 192 semanas de tratamento, alcança as respostas ASAS20 e ASAS40 é de 81% e 69%, respectivamente, com aumento de 33% e 39%, em comparação com o escore de duas semanas de tratamento45(B).
O uso de etanercepte determina aumento de 37% (NNT: 3) na resposta ASAS20, e de 50% na resposta ASAS50, melhora de 43% na inflamação de coluna e na lombalgia, redução de 37% na avaliação global do paciente e melhora de 35% no BASfie de 62% no BASDAI46(A).
Adalimumabe
A resposta/melhora medida pelo escore ASAS20 e ASAS40 é mantida em dois anos de tratamento, sendo de 64,5% e 50,6%, respectivamente50,51(A).
Golimumabe
Em 24 semanas, apresenta os seguintes resultados: aumento de 37,6% e 38,2% na resposta ASAS20 nas doses de 50 mg e 100 mg, respectivamente; aumento 28,1% e 38,9% na resposta ASAS40 nas doses de 50 mg e 100 mg, respectivamente; e aumento em 36,1% (NNT: 3) da porcentagem de pacientes que alcançam BASDAI5053,54(A).
Síntese dos resultados por desfecho
As tabelas 1, 2 e 3 mostram a síntese dos resultados dos desfechos BASDAI, ASAS e redução do uso de AINH, respectivamente.
Artrite e entesite
Infliximabe
Redução de 27% (NNT: 4) e de 17% (NNT: 6) - 12 semanas. Redução de 33% (NNT: 3) - 54 semanas.
Hospitalização
Infliximabe
Redução de 31% (NNT: 3) - 54 semanas.
Os desfechos comuns entre as medicações permitem compará-las indiretamente por meio do cálculo do NNT dos desfechos principais: BASDAI 20 e 50, ASAS 20 e 40 e redução no uso de AINH (50%) (tabela 4).
Recomendação 9
Os agentes biológicos anti-TNF (infliximabe, etanercepte, adalimumabe e golimumabe) demonstraram benefício no tratamento de pacientes com EA, em relação aos critérios BASDAI e ASAS, e ao uso de AINH. Nenhuma droga mostrou-se mais eficaz que as outras.
10. Existe diferença de segurança entre as drogas anti-TNF em pacientes com espondilite anquilosante?
Existe informação heterogênea relativa a eventos adversos entre as quatro medicações a serem expostas, provavelmente devido a fatores como o tempo de seguimento, ao número de estudos consistentes disponíveis, à multiplicidade dos eventos que ocorrem, e à parcial informação recuperada. Apesar disso, muitos eventos adversos são comuns a todas as formas de tratamento.
Infliximabe
O evento adverso mais frequente é infecção respiratória, podendo ocorrer tuberculose ganglionar, febre, granulomatose pulmonar ou leucopenia. A descontinuidade por eventos adversos sérios ocorre em 12%33(A).
Alta proporção de pacientes (82,2%) apresenta mais de um evento adverso. A maioria dos eventos adversos é de gravidade moderada, sendo que 3,5% dos pacientes apresentam eventos adversos sérios (tontura, colecistite, artrite, leucocitose, pneumonia, hemiparesia, lombalgia, febre e ganglioneuroma), e 2,7% dos pacientes descontinuam o tratamento. Outros eventos adversos são faringite, rinite, elevação transitória das enzimas hepáticas, e náusea36(A).
Há ocorrência de 12% de eventos adversos graves, sendo a taxa de descontinuidade de 6%. Durante o segundo ano de seguimento, 90% dos pacientes reportam eventos adversos, sendo os mais frequentes: infecção respiratória, rinite, herpes, mialgia, pancreatite e reação infusional37(B).
Podem ocorrer 90,8% de eventos adversos, com maioria de moderada intensidade, 18,4% graves, requerendo hospitalização 9,2%, e descontinuidade de 2,6%. Os eventos adversos mais frequentes são nasofaringite, infecção respiratória, prurido, náusea, tontura, cefaleia e febre41(A).
Dos pacientes que descontinuam o tratamento, 55% o fazem em função de eventos adversos, dos quais os mais frequentes são aumento das enzimas hepáticas, reação infusional e perda da eficácia. Outros eventos adversos presentes são: tuberculose, granulomatose alérgica, pancreatite e piora do estado geral. Há redução de 30,3% (NNT: 3) na entesite, de 21,2% (NNT: 5) na artrite periférica e de 36% (NNT: 3) na uveíte anterior40(B).
Etanercepte
As reações adversas mais comuns são: infecções leves, reações no local da injeção, diarreia, tinitus, fasciculação orbicular, cefaleia e infecções respiratórias, náusea, astenia, tontura, dor abdominal e parestesias42,43,46(A).
Pode haver descontinuidade de 5% no tratamento com etanercepte por eventos adversos, sendo os mais comuns: linfadenopatia, celulite, infecção respiratória, colite ulcerativa, obstrução intestinal e fraturas ósseas44(A).
Os eventos adversos graves (câncer de pulmão e neutropenia, 5%) podem levar a descontinuidade do tratamento. Os eventos adversos mais frequentes (62% dos casos) são: reação infusional e neutropenia47(A).
Cinquenta por cento dos pacientes podem apresentar eventos adversos, sendo 5% destes graves (diarreia com dor abdominal e distensão). Os principais deles são infecções, desordens gastrointestinais e reações infusionais48(A).
Adalimumabe
Durante dois anos de uso de adalimumabe, os eventos adversos moderados mais comuns (5%) são nasofaringite, infecção respiratória e cefaleia, doença de Crohn, sendo 10% de eventos adversos graves, 4,5% de eventos levando à descontinuidade, neoplasias em 1,3%, e uveítes em 3,9%50(A).
Golimumabe
Até a 24ª semana, a proporção de pacientes que experimentam ao menos um evento adverso é de 79,9%, sem diferença com relação à dose, mas com aumento em relação a pacientes que não fazem uso da droga ativa, estando entre eles: nasofaringite, infecção respiratória, fadiga, cefaleias, diarreia, eritema na injeção, aumento nas enzimas hepáticas, e ao menos uma infecção (48,6%). A proporção de pacientes com um evento adverso grave é de 3,6% com 50 mg e de 6,4% com 100 mg, estando entre eles: infarto do miocárdio, fadiga, depressão, hipertensão, dor torácica, blefarite, náusea, vomitos, hepatite, influenza-like, dor nas extremidades e ganho de peso. Por esses eventos, 2,9% descontinuam o tratamento53(A).
Recomendação 10
Os eventos adversos moderados e graves, e a descontinuidade ao tratamento apresentam índices e tipos semelhantes nos quatro regimes de tratamento (infliximabe, etanercepte, adalimumabe e golimumabe). Nenhuma droga mostrou-se mais segura que as outras.
11. O uso da terapia anti-TNF é capaz de reduzir o dano estrutural em pacientes com espondilite anquilosante?
Infliximabe
O tratamento de pacientes com EA com infliximabe 5 mg/ kg reduz o número de lesões ósseas (pela RM) em 30 semanas de seguimento. Esse resultado é superior quando combinado ao metotrexato, em comparação ao tratamento isolado com metotrexato. Um aumento significativo na densidade mineral óssea ocorre em pacientes tratados com infliximabe, sobretudo no fêmur, na bacia e na coluna56(A).
Em pacientes com EA tratados com infliximabe 5 mg/ kg, a cada seis semanas, por três anos, podem ser avaliados pelo Stokes Ankylosing Spondylitis Spinal Score modificado (mSASSS), considerando como lesão a presença de ao menos um sindesmofito (mSASSS > 2), e pela progressão radiográfica, definida como mudança de 0 a 1 para sindesmófitos ou anquilose (mSASSS > 2). Nesse período há aumento do escore mSASSS e do número maior de pacientes (aumento de 11,3% - NNH: 8) com lesões radiológicas, sendo o desenvolvimento de novas lesões maior nos primeiros dois anos de tratamento, desacelerando no período seguinte57(B).
O uso de infliximabe 5 mg/kg durante 96 semanas em pacientes com EA leva a aumento no escore mSASSS, sendo que 34% têm piora de um ou mais pontos no escore. Além disso, parte desses pacientes pioram dois ou mais pontos no escore (19,9%), três ou mais (14,7%) e quatro ou mais pontos (10,9%)58(B).
Etanercepte
As mudanças no escore radiológico de lesão óssea (mSASSS) na coluna cervical e lombar, após 96 meses de tratamento com etanercepte, são semelhantes às que ocorrem em pacientes sem tratamento, com piora no escore em relação ao início do tratamento59(B).
Recomendação 11
O uso de drogas anti-TNF (infliximabe e etanercepte) não produz redução no dano estrutural em pacientes com espondilite anquilosante.
12. Existem evidências para eficácia e segurança das drogas anti-TNF nas manifestações extra-articulares em pacientes com espondilite anquilosante?
Uveíte
Entre pacientes com EA tratados com infliximabe, a incidência de uveíte anterior é de 3,4 por 100 pacientes/ano em comparação com pacientes tratados com etanercepte, de incidência 7,9 por 100 pacientes/ano. Em pacientes não tratados a incidência de uveíte anterior é de 15,6 por 100 pacientes/ ano, diferença significativa em comparação com as medicações anti-TNF60(B).
O uso de adalimumabe 40 mg em semanas alternadas por 12 semanas em pacientes com EA reduz a incidência de uveíte anterior em 51% (NNT: 2); reduz, em 58% (NNT: 2), a incidência de uveíte anterior em pacientes com história de uveíte, em 68% (NNT: 2) em pacientes com história recente, em 50% (NNT: 2) em pacientes com uveíte anterior sintomática e em 45% (NNT: 2) em pacientes com uveíte crônica; e reduz a recorrência de uveíte em 58% (NNT: 2)61(B).
Doença inflamatória intestinal
Em pacientes com EA, estima-se a incidência de doenças inflamatórias intestinais (doença de Crohn e colite ulcerativa) em 1,3 casos por 100 pacientes/ano. O tratamento desses pacientes com anti-TNF por período de 14 a 156 semanas tem resultados distintos na dependência do uso do infliximabe, etanercepte ou adalimumabe: 0,2 paciente/ano, 2,2 pacientes/ano e 2,3 pacientes/ano, respectivamente, sendo essa diferença favorável e significativa ao uso de infliximabe. O tratamento com infliximabe (0,04) reduz o risco de doença inflamatória intestinal em 42% (NNT: 2), quando comparado ao etanercepte, e em 12% (NNT: 8) quando comparado com o adalimumabe62(B).
Psoríase
A utilização de adalimumabe, etanercepte e infliximabe em pacientes com EA pode cursar com o desenvolvimento de psoríase [psoríase vulgar (placa psoriásica) ou palmoplantar pustulosa], em tempo médio de quatro meses. Entretanto, em cerca de 40% de pacientes com psoríase de base o uso de anti-TNF pode produzir resolução das lesões63(C).
Osteoporose
Como efeito do uso de agentes anti-TNF após dois anos em pacientes com EA, pode haver aumento da densidade mineral óssea em coluna e fêmur, independente da presença de sindesmófitos lombares. As mudanças na densidade óssea da coluna lombar estão correlacionadas, em dois anos de seguimento, às mudanças nos escores BASDAI e BASfi. Não há diferenças entre os resultados obtidos com o infliximabe e o etanercepte64(C).
Recomendação 12
Com relação às manifestações extra-articulares, os medicamentos anti-TNF reduzem a incidência de uveíte anterior em pacientes com espondilite anquilosante, podem reduzir a incidência de doença inflamatória intestinal (especialmente o infliximabe), apresentam resultados controversos quanto a benefício ou dano em relação à indução de psoríase cutânea, e causam aumento da densidade mineral óssea alinhado com a resposta clínica em espondilite anquilosante.
13. Quais são as evidências que suportam a troca (switch) de agentes anti-TNF em pacientes com espondilite anquilosante?
Dos pacientes com EA que apresentam descontinuidade do tratamento com infliximabe (5 mg/kg a cada seis a oito semanas, durante os últimos dois anos) por falha clínica (ausência de redução no escore BASDAI), 70% respondem à troca por etanercepte, com redução no BASDAI médio de 7,1 (± 3,6) para 4,1 (± 7,3), em 10 meses de seguimento65(C).
Pacientes com EA tratados com 5 mg/kg de infliximabe a cada oito semanas, com falha em manter uma resposta clínica de 20% de acordo com o critério ASAS20, podem ser tratados com 50 mg de etanercepte por 24 a 54 semanas, sem apresentar eventos adversos graves (reação infusional, tontura, cefaleia), mas com os seguintes benefícios: 78% de resposta ASAS20, 52% de ASAS50 e 39% de ASAS70, em 24 semanas; e 74% de resposta ASAS20, 61% de ASAS50 e 39% de ASAS70, em 54 semanas; mudança no escore BASDAI de 6,9 (± 1,3) para 3,1 (± 3,1) na 24ª semana e de 2,9 (± 1,7) na 54ª semana66(B).
Ao definirmos resposta ao tratamento com anti-TNF em pacientes com EA a partir de resposta de 50% no escore BAS-DAI, uma resposta clínica é obtida em 75% dos pacientes que mudaram de infliximabe para etanercepte, e em 57,1% naqueles que trocaram de etanercepte para adalimumabe. Pacientes que trocaram de agente anti-TNF por eventos adversos ou eficácia inadequada apresentam resposta clínica semelhante (70% e 61,5%, respectivamente). Os pacientes que trocaram de infliximabe para etanercepte após três meses mostram resposta em 83,3% (NNT: 1)67(B).
O uso de medicações anti-TNF (infliximabe, etanercepte, adalimumabe) no tratamento de pacientes com EA pode, após 12 semanas, determinar 88% de resposta clínica (medida pelos escores BASDAI e BASfi). Dos pacientes que não respondem, ou que durante o tratamento, apesar da resposta, apresentam reações adversas, 13% trocam de anti-TNF, sendo que desses, 93% apresentam resposta clínica após a mudança68(C).
Pacientes com EA severa em tratamento com infliximabe, etanercepte ou adalimumabe podem precisar trocar de anti-TNF (17% dos casos) devido a ineficácia (67%) ou eventos adversos (28%). Desses pacientes, 67% e 86% mantêm resposta (medida pela redução de 50% no BASDAI) em 6 e 12 meses, respectivamente. O valor médio do BASDAI (IQR) antes da troca é de 6,92, e após a troca de tratamento , em 3, 6 e 12 meses, é de 3,98, 3,70 e 2,92, respectivamente69(B).
Dos 38% dos pacientes com EA que não obtiveram resposta clínica após o tratamento com agentes anti-TNF em três a quatro meses, cerca de 24% e 11%, respectivamente, precisam de um segundo e terceiro agente anti-TNF diferente. Dos pacientes tratados com o segundo anti-TNF, 46% obtêm resposta adequada. Dos pacientes que requerem o terceiro agente anti-TNF, 100% obtêm resposta completa70(B).
Pacientes que trocam de medicações anti-TNF (16%) são tratados com seu primeiro medicamento (etanercepte, infliximabe ou adalimumabe) por média de 294 dias, e começam o segundo anti-TNF em média de 32 dias após descontinuar o primeiro. O etanercepte é administrado SC, na dose de 25 mg 2x/semana ou 50 mg 1x/semana. O infliximabe é prescrito IV nas semanas 0, 2, 6 e a cada seis a oito semanas, com dose média de 4-5 mg/kg. O adalimumabe é administrado SC na dose de 40 mg quinzenal. Após três meses da primeira troca de anti-TNF, a resposta clínica medida por BASDAI50, ASAS20 e ASAS40 é de 25%, 47% e 30%, respectivamente. Após três meses de tratamento com o segundo anti-TNF, a resposta medida pelo BASDAI50, ASAS20 e ASAS40 é alcançada em 28%, 40% e 30%, respectivamente. Não há diferença na resposta obtida entre a primeira e a segunda troca71(B).
A troca de anti-TNF por resposta insuficiente ou eventos adversos pode produzir aumento em três meses de 14% e 21% na resposta BASDAI 50 e ASAS 40, respectivamente, na primeira e segunda troca71(B).
Recomendação 13
A troca de agente anti-TNF pode representar uma opção de estratégia terapêutica quando ocorre resposta clínica inadequada ou eventos adversos.
14. Quanto tempo se deve utilizar uma droga anti-TNF no seguimento de um paciente com espondilite anquilosante?
O tratamento da EA por 102 semanas com infliximabe (5 mg/ kg) demonstra que os resultados de aumento de 42% na resposta clínica (ASAS20), obtidos na 24ª semana, são mantidos nesse segundo período. A resposta clínica medida pelo ASAS20 nas duas semanas de tratamento aumenta de 34% para 89%. Apesar de até a 102ª semana 97,5% dos pacientes apresentarem eventos adversos, durante o período de tratamento não há diferença de ocorrência de eventos adversos entre a 24ª semana e a 102ª semana. O aumento em relação a pacientes não tratados com infliximabe é de de 22% (NNH: 5). O evento adverso mais frequente é a infecção do trato respiratório superior (48,7%)72(A).
No seguimento de dois anos, 58% dos pacientes tratados com infliximabe alcançaram ao menos 50% de redução no escore BASDAI, nível semelhante de resposta em um ano. Dos pacientes tratados, 94% e 85% alcançaram ao menos 20% de resposta no BASDAI nas semanas 54 e 102, respectivamente. Os eventos adversos no segundo ano (90% dos pacientes) de tratamento ocorrem em proporção semelhante ao primeiro ano37(B).
A remissão parcial, definida como escore < 2 em cada um dos quatro domínios ASAS (PatGA, NRS-P, BASfie BASDAI), é atingida em 34,2% dos pacientes com EA em cinco anos de tratamento com infliximabe, em comparação a 36,8% com três anos de tratamento. Após cinco anos de tratamento, a eficácia do infliximabe permanece estável em relação a tratamento de três anos, com escore médio BASDAI de 2,5 e 2,5, escore BASfide 3,0 e 2,9, PatGA de 2,7 e 2,6 e BASMI de 2,8 e 2,6, respectivamente. Não há diferença na ocorrência de eventos adversos entre os dois períodos (94%)39(B).
Ao final de oito anos de seguimento, um estado de menor atividade da doença (BASDAI < 3) está presente em 63,6% dos pacientes tratados com infliximabe, resultado semelhante ao obtido em três meses de seguimento; além disso, 71,4% permanecem com valores de BASDAI < 3. A resposta ASAS20 está mantida em 84,8%, e a BASDAI50 está presente em 57,6% dos casos. Dos pacientes que descontinuam o tratamento, 55% o fazem devido a eventos adversos, dos quais os mais frequentes são aumento das enzimas hepáticas, reação infusional e perda da eficácia40(B).
Durante cinco anos de seguimento há aumento de 50% (NNT: 2) na adesão ao tratamento com infliximabe, por redução na recorrência dos sintomas73(B).
A proporção de pacientes que após 192 semanas de tratamento com etanercepte alcançou a resposta ASAS20 é de 81%, e de 69% para ASAS40, com aumento de 33% e 39%, respectivamente, em comparação com o escore de duas semanas de tratamento. Há aumento de 14,1% em eventos adversos e de 4,7% em descontinuidade, quando comparado com pacientes não tratados com etanercepte45(B).
A resposta/melhora ao tratamento com adalimumabe, medida pelos escores ASAS20 e ASAS40, é mantida durante três anos de tratamento, sendo de 64,5% e 50,6%, respectivamente. Além disso, o benefício medido pelos escores BASDAI, BASfie SF-36, obtidos na 24ª semana, são mantidos até a 156ª semana. Os eventos adversos levam à descontinuidade em 4,5% dos casos em dois anos de tratamento com adalimumabe, e em 30% em três anos50(A).
Recomendação 14
A utilização de drogas anti-TNF na espondilite anquilosante por longo prazo costuma manter resposta clínica, sem aumento de eventos adversos. Atualmente, estima-se que seu uso deva ser por tempo indeterminado.
15. Existem evidências para o uso de agentes biológicos com outros mecanismos de ação na espondilite anquilosante?
Rituximabe
O tratamento de pacientes com EA ativa (BASDAI > 4) sem antecedentes de uso de anti-TNF com 1000 mg de rituximabe durante 24 semanas produz resposta clínica ASAS20, ASAS40 ou BASDAI50, de 30%, 10% e nenhuma resposta, respectivamente. Em pacientes com antecedente de falha terapêutica ao anti-TNF, a resposta ASAS20, ASAS40 ou BASDAI50 é de 40%, 30% e 50%, respectivamente74(B).
Tocilizumabe
Paciente com diagnóstico de EA e doença de Crohn não responsiva ao tratamento com três agentes biológicos (infliximabe, abatacepte e certolizumabe), tratada por 11 meses com tocilizumabe (8 mg/kg a cada 15 semanas), apresentou BASfiestável (6,0), melhora do BASDAI de 6,1 para 4,3, e redução do edema e da rigidez matinal75(C). Paciente com EA não responsiva a infliximabe, etanercepte e adalimumabe, medicado com tocilizumabe 8 mg/kg a cada quatro semanas, apresenta, após 26 semanas, melhora BASDAI de 6,1 para 3,6 e redução no ASDAS (Ankylosing Spondylitis Disease Activity Score) de 5,8 para 1,6, apesar de a RM demonstrar persistência dos sinais inflamatórios76(C). Paciente com EA com falha terapêutica após cinco anos de tratamento com medicações anti-TNF (infliximabe, etanercepte e adalimumabe), tratada com tocilizumabe 8 mg/kg, apresentou, após quatro semanas, redução BASDAI de 3 para 0,9, BASfide 6 para 1,5 e ASDAS de 2,2 para 1,3 (após 12 meses, a redução de ASDAS foi de 0,9)77(C).
Abatacepte
Em pacientes com diagnóstico de EA e doença ativa (escores BASDAI e dor lombar > 4), o tratamento com abatacepte durante 24 semanas leva a resposta ASAS40 em 13% dos pacientes sem antecedente de uso de anti-TNF e em 0% em pacientes não responsivos, independente de tratamento prévio com ao menos dois AINH. O mesmo ocorre com a resposta ASAS20, com índices de 27% e 20%, respectivamente. Não há sinais de resposta nos escores BASDAI e ASDAS nos pacientes, sejam os sem contato prévio com anti-TNF ou sem resposta78(B).
Recomendação 15
O uso de rituximabe e abatacepte não é eficaz, e não justifica seu uso em pacientes com espondilite anquilosante. A evidência disponível de tocilizumabe não permite recomendá-lo.
Conflitos de interesse
Sampaio-Barros PD: Participação em boards dos laboratórios Abbott, MSD e Pfizer. Recebeu pagamento para palestras e participação em congressos, simpósios e jornadas dos laboratórios Abbott, Actelion, Jansenn, MSD, Pfizer e Roche. Principal Investigador em ensaios clínicos executados no Brasil pelo laboratório Roche.
Keiserman M: Participação em consultorias aos laboratórios Abbott, MSD e Pfizer. Recebeu pagamento para palestras e participação em congressos, simpósios e jornadas dos laboratórios Abbott, Actelion, Janssen, MSD, Pfizer e Roche. Investigador em ensaios clínicos executados no Brasil pelos laboratórios Bristol-Myers-Squibb, MSD e Roche.
Meirelles ES: Participação em boards dos laboratórios Janssen e Pfizer. Recebeu de pagamento para palestras e participação em congressos, simpósios e jornadas dos laboratórios Abbott, AstraZeneca, Janssen, Lilly, MSD, Pfizer, Roche, Sanofi-Aventis e Servier. Investigador principal em ensaios clínicos executados no Brasil pelos laboratórios Novartis e Roche.
Pinheiro MM: Participação em board da MSD. Recebeu pagamento para palestras e participação em congressos, simpósios e jornadas dos laboratórios Abbott, Janssen, Novartis, MSD, Pfizer e Roche. Principal Investigador em ensaios clínicos executados no Brasil pela Roche.
Ximenes AC: Participação em boards dos laboratórios Bristol, MSD e Pfizer. Recebeu pagamento para palestras e participação em congressos, simpósios e jornadas dos laboratórios Abbott, Aché, Janssen, Pfizer e Roche. Principal Investigador em ensaios clínicos executados no Brasil pelos laboratórios MSD, Pfizer, Roche e UCB.
Azevedo VF: Participação em consultorias aos laboratórios Abbott, Janssen, Pfizer e Roche. Recebeu pagamento para palestras e participação em congressos, simpósios e jornadas dos laboratórios Abbott, Bristol-Myers-Squibb, Janssens, MSD e Roche. Investigador em ensaios clínicos executados no Brasil pelos laboratórios BMS, Galen Research, Roche e UCB.
Bonfiglioli R: Participação em boards dos laboratórios Abbott, MSD e Pfizer. Recebeu pagamento para palestras e participação em congressos, simpósios e jornadas dos laboratórios Abbott, Actelion, Janssen, MSD, Pfizer e Roche. Principal Investigador e/ou subinvestigador em ensaios clínicos executados no Brasil pelos laboratórios Bristol-Myers-Squibb, MSD e Roche.
Carneiro S: Participação em board do laboratório MSD. Recebeu pagamento para palestras e participação em congressos, simpósios e jornadas dos laboratórios Abbott, Janssen, MSD e Pfizer.
Ranza R: Participação em boards dos laboratórios Abbott, MSD e Pfizer. Recebeu pagamento para palestras e participação em congressos, simpósios e jornadas dos laboratórios Abbott, Janssen, MSD, Pfizer e Roche. Principal Investigador em ensaios clínicos executados no Brasil pelo laboratório Roche.
Bernardo W: Não há conflitos de interesse.
Gonçalves CR: Participação em boards dos laboratórios Abbott e MSD. Recebeu pagamento para palestras e participação em congressos, simpósios e jornadas dos laboratórios Abbott, Aché, Aventis, Janssen, MSD e Pfizer. Investigador em ensaios clínicos executados no Brasil pelo laboratório Roche.
REFERÊNCIAS
1. Moll JMH, Haslock I, MacRae IF, Wright V. Associations between ankylosing spondylitis, psoriatic arthritis, Reiter's disease, the intestinal arthropathies, and Behcet's syndrome. Medicine 1974;53:343-64.
2. Rudwaleit M, Landewé R, van der Heijde D, Listing J, Brandt J, Braun J, et al. The development of Assessment of SpondyloArthritis international Society classifi cation criteria for axial spondyloarthritis (part I): classifi cation of paper patients by expert opinion including uncertainty appraisal. Ann Rheum Dis 2009;68:770-6.
3. Rudwaleit M, van der Heijde D, Landewé R, Listing J, Akkoc N, Brandt J, et al. The development of Assessment of SpondyloArthritis international Society classifi cation criteria for axial spondyloarthritis (part II): validation and fi nal selection. Ann Rheum Dis 2009;68:777-83.
4. Rudwaleit M, van der Heijde D, Landewé R, Akkoc N, Brandt J, Chou CT, et al. The Assessment of SpondyloArthritis International Society classifi cation criteria for peripheral spondyloarthritis and for spondyloarthritis in general. Ann Rheum Dis 2011;70:25-31.
5. Rudwaleit M, Jurik AG, Hermann KG, et al Landewe R, van der Heijde D, Baraliakos X, et al. Defi ning active sacroiliitis on magnetic resonance imaging (MRI) for classifi cation of axial spondyloarthritis: a consensual approach for the ASAS/OMERACT MRI group. Ann Rheum Dis 2009;68:1520-7.
6. Sampaio-Barros PD, Bortoluzzo AB, Conde RA, Costallat LT, Samara AM, Bertolo MB. Undifferentiated spondyloarthritis: a long-term followup. J.Rheumatol 2010;37(6):1195-9.
7. Weber U, Lambert RG, Østergaard M, Hodler J, Pedersen SJ, Maksymowych WP. The diagnostic utility of magnetic resonance imaging in spondylarthritis: an international multicenter evaluation of one hundred eighty-seven subjects. Arthritis Rheum 2010;62:3048-58.
8. Bennett AN, Rehman A, Hensor EM, Marzo-Ortega H, Emery P, McGonagle D. The fatty Romanus lesion: aMoll JMH, Haslock I, MacRae IF, Wright V. Associations between ankylosing spondylitis, psoriatic arthritis, Reiter's disease, the intestinal arthropathies, and Behcet's syndrome. Medicine 1974;53:343-64.non-inflammatory spinal MRI lesion specifi c for axial spondyloarthropathy. Ann Rheum Dis 2010;69:891-4.
9. Bennett AN, McGonagle D, O'Connor P, Hensor EM, Sivera F, Coates LC, et al. Severity of baseline magnetic resonance imaging-evident sacroiliitis and HLA-B27 status in early inflammatory back pain predict radiographically evident ankylosing spondylitis at eight years. Arthritis Rheum 2008;58:3413-8.
10. Maksymowych WP, Chiowchanwisawakit P, Clare T, Pedersen SJ, Østergaard M, Lambert RG. Inflammatory lesions of the spine on magnetic resonance imaging predict the development of new syndesmophytes in ankylosing spondylitis: evidence of a relationship between inflammation and new bone formation. Arthritis Rheum 2009;60:93-102.
11. Madsen KB, Schiøttz-Christensen B, Jurik AG. Prognostic signifi cance of magnetic resonance imaging changes of the sacroiliac joints in spondyloarthritis--a followup study. J Rheumatol 2010;37:1718-27.
12. Freeston J, Barkham N, Hensor E, Emery P, Fraser A. Ankylosing spondylitis, HLA-B27 positivity and the need for biologic therapies. Joint Bone Spine 2007;74:140-3.
13. Bennett AN, McGonagle D, O'Connor P, Hensor EM, Sivera F, Coates LC, et al. Severity of baseline magnetic resonance imaging-evident sacroiliitis and HLA-B27 status in early inflammatory back pain predict radiographically evident ankylosing spondylitis at eight years. Arthritis Rheum 2008;58:3413-8.
14. Rudwaleit M, Haibel H, Baraliakos X, Listing J, Märker- Hermann E, Zeidler H, et al. The early disease stage in axial spondylarthritis: results from the German Spondyloarthritis Inception Cohort. Arthritis Rheum 2009;60:717-27.
15. Joshi R, Reveille JD, Brown MA, Weisman MH, Ward MM, Gensler LS, et al. Is there a higher genetic load of susceptibility loci in familial ankylosing spondylitis? Arthritis Care Res (Hoboken) 2012;64:780-4.
16. Fernández-de-Las-Peñas C, Alonso-Blanco C, Morales- Cabezas M, Miangolarra-Page JC. Two exercise interventions for the management of patients with ankylosing spondylitis: a randomized controlled trial. Am J Phys Med Rehabil 2005;84:407-19.
17. Fernández-de-Las-Peñas C, Alonso-Blanco C, Alguacil- Diego IM, Miangolarra-Page JC. One-year follow-up of two exercise interventions for the management of patients with ankylosing spondylitis: a randomized controlled trial. Am J Phys Med Rehabil 2006;85:559-67.
18. Staalesen Strumse YA, Nordvåg BY, Stanghelle JK, Røisland M, Winther A, Pajunen PA, et al. Effi cacy of rehabilitation for patients with ankylosing spondylitis: comparison of a four-week rehabilitation programme in a Mediterranean and a Norwegian setting. J Rehabil Med 2011;43:534-42.
19. Peters ND, Ejstrup L. Intravenous methylprednisolone pulse therapy in ankylosing spondylitis. Scand J Rheumatol 1992;21:134-8.
20. Braun J, Bollow M, Seyrekbasan F, Häberle HJ, Eggens U, Mertz A, et al. Computed tomography guided corticosteroid injection of the sacroiliac joint in patients with spondyloarthropathy with sacroiliitis: clinical outcome and followup by dynamic magnetic resonance imaging. J Rheumatol 1996;23:659-64.
21. Bollow M, Braun J, Taupitz M, Häberle J, Reibhauer BH, Paris S, et al. CT-guided intraarticular corticosteroid injection into the sacroiliac joints in patients with spondyloarthropathy: indication and follow-up with contrast-enhanced MRI. J Comput Assist Tomogr 1996;20:512-21.
22. Dougados M, Gueguen A, Nakache JP, Velicitat P, Veys EM, Zeidler H, et al. Ankylosing spondylitis: what is the optimum duration of a clinical study? A one year versus a 6 weeks non-steroidal anti-inflammatory drug trial. Rheumatology (Oxford) 1999;38:235-44.
23. van der Heijde D, Baraf HS, Ramos-Remus C, Calin A, Weaver AL, Schiff M, et al. Evaluation of the effi cacy of etoricoxib in ankylosing spondylitis: results of a fi ftytwo- week, randomized, controlled study. Arthritis Rheum 2005;52:1205-15.
24. Barkhuizen A, Steinfeld S, Robbins J, West C, Coombs J, Zwillich S. Celecoxib is effi cacious and well tolerated in treating signs and symptoms of ankylosing spondylitis. J Rheumatol 2006;33:1805-12.
25. Sieper J, Klopsch T, Richter M, Kapelle A, Rudwaleit M, Schwank S, et al. Comparison of two different dosages of celecoxib with diclofenac for the treatment of active ankylosing spondylitis: results of a 12-week randomised, double-blind, controlled study. Ann Rheum Dis 2008;67:323-9.
26. Peloso PM, Gammaitoni A, Smugar SS, Wang H, Moore AR. Longitudinal numbers-needed-to-treat (NNT) for achieving various levels of analgesic response and improvement with etoricoxib, naproxen, and placebo in ankylosing spondylitis. BMC Musculoskelet Disord 2011;12:165.
27. Wanders A, van der Heijde D, Landewé R, Béhier JM, Calin A, Olivieri I, et al. Nonsteroidal antiinflammatory drugs reduce radiographic progression in patients with ankylosing spondylitis: a randomized clinical trial. Arthritis Rheum 2005;52:1756-65.
28. Roychowdhury B, Bintley-Bagot S, Bulgen DY, Thompson RN, Tunn EJ, Moots RJ. Is methotrexate effective in ankylosing spondylitis? Rheumatology (Oxford) 2002;41:1330-2.
29. Gonzalez-Lopez L, Garcia-Gonzalez A, Vazquez-Del-Mercado M, Muñoz-Valle JF, Gomez-Nava JI. Effi cacy of methotrexate in ankylosing spondylitis: a randomized, double blind, placebo controlled trial. J Rheumatol 2004;31:1568-74.
30. Chen J, Liu C. Is sulfasalazine effective in ankylosing spondylitis? A systematic review of randomized controlled trials. J Rheumatol 2006;33:722-31.
31. Song IH, Althoff CE, Haibel H, Hermann KG, Poddubnyy D, Listing J, et al. Frequency and duration of drug-free remission after 1 year of treatment with etanercept versus sulfasalazine in early axial spondyloarthritis: 2 year data of the ESTHER trial. Ann Rheum Dis 2012;71:1212-5.
32. van Denderen JC, van der Paardt M, Nurmohamed MT, de Ryck YM, Dijkmans BA, van der Horst-Bruinsma IE. Double blind, randomised, placebo controlled study of leflunomide in the treatment of active ankylosing spondylitis. Ann Rheum Dis 2005;64:1761-4.
33. Braun J, Brandt J, Listing J, Zink A, Alten R, Golder W, et al. Treatment of active ankylosing spondylitis with infliximab: a randomized controlled multicentre trial. Lancet 2002;359:1187-93.
34. Braun J, Brandt J, Listing J, Zink A, Alten R, Burmester G, et al. Long-term effi cacy and safety of infliximab in the treatment of ankylosing spondylitis: an open, observational, extension study of a three-month, randomized, placebo-controlled trial. Arthritis Rheum 2003;48:2224-33.
35. Listing J, Brandt J, Rudwaleit M, Zink A, Sieper J, Braun J. Impact of anti-tumour necrosis factor alpha treatment on admissions to hospital and days of sick leave in patients with ankylosing spondylitis. Ann Rheum Dis 2004;63:1670-2.
36. van der Heijde D, Dijkmans B, Geusens P, Sieper J, DeWoody K, Williamson P, et al. Ankylosing Spondylitis Study for the Evaluation of Recombinant Infliximab Therapy Study Group. Effi cacy and safety of infliximab in patients with ankylosing spondylitis: results of a randomized, placebo-controlled trial (ASSERT). Arthritis Rheum 2005;52:582-91.
37. Braun J, Brandt J, Listing J, Zink A, Alten R, Burmester G, et al. Two year maintenance of effi cacy and safety of infliximab in the treatment of ankylosing spondylitis. Ann Rheum Dis 2005;64:229-34.
38. Braun J, Baraliakos X, Brandt J, Listing J, Zink A, Alten R, et al. Persistent clinical response to the anti-TNF-alpha antibody infliximab in patients with ankylosing spondylitis over 3 years. Rheumatology (Oxford) 2005;44:670-6.
39. Braun J, Baraliakos X, Listing J, Fritz C, Alten R, Burmester G, et al. Persistent clinical effi cacy and safety of antitumour necrosis factor alpha therapy with infliximab in patients with ankylosing spondylitis over 5 years: evidence for different types of response. Ann Rheum Dis 2008;67:340-5.
40. Baraliakos X, Listing J, Fritz C, Haibel H, Alten R, Burmester GR, et al. Persistent clinical effi cacy and safety of infliximab in ankylosing spondylitis after 8 years - early clinical response predicts long-term outcome. Rheumatology (Oxford) 2011;50:1690-9.
41. Inman RD, Maksymowych WP; CANDLE Study Group. A double-blind, placebo-controlled trial of low dose infliximab in ankylosing spondylitis. J Rheumatol 2010;37:1203-10.
42. Gorman JD, Sack KE, Davis JC Jr. Treatment of ankylosing spondylitis by inhibition of tumor necrosis factor alpha. N Engl J Med 2002;346:1349-56.
43. Brandt J, Khariouzov A, Listing J, Haibel H, Sörensen H, Grassnickel L, et al. Six-month results of a double-blind, placebo-controlled trial of etanercept treatment in patients with active ankylosing spondylitis. Arthritis Rheum 2003;48:1667-75.
44. Davis JC Jr, Van Der Heijde D, Braun J, Dougados M, Cush J, Clegg DO, et al. Recombinant human tumor necrosis factor receptor (etanercept) for treating ankylosing spondylitis: a randomized, controlled trial. Arthritis Rheum 2003;48:3230-6.
45. Davis JC Jr, van der Heijde DM, Braun J, Dougados M, Clegg DO, Kivitz AJ, et al. Effi cacy and safety of up to 192 weeks of etanercept therapy in patients with ankylosing spondylitis. Ann Rheum Dis 2008;67:346-52.
46. Calin A, Dijkmans BA, Emery P, Hakala M, Kalden J, Leirisalo-Repo M, et al. Outcomes of a multicentre randomised clinical trial of etanercept to treat ankylosing spondylitis. Ann Rheum Dis 2004;63:1594-600.
47. Dougados M, Braun J, Szanto S, Combe B, Elbaz M, Geher P, et al. Effi cacy of etanercept on rheumatic signs and pulmonary function tests in advanced ankylosing spondylitis: results of a randomised double-blind placebo-controlled study (SPINE). Ann Rheum Dis 2011;70:799-804.
48. Navarro-Sarabia F, Fernández-Sueiro JL, Torre-Alonso JC, Gratacos J, Queiro R, Gonzalez C, Loza E, et al. High-dose etanercept in ankylosing spondylitis: results of a 12-week randomized, double blind, controlled multicentre study (LOADET study). Rheumatology (Oxford) 2011;50:1828-37.
49. Revicki DA, Luo MP, Wordsworth P, Wong RL, Chen N, Davis JC Jr, et al. Adalimumab reduces pain, fatigue, and stiffness in patients with ankylosing spondylitis: results from the adalimumab trial evaluating long-term safety and effi cacy for ankylosing spondylitis (ATLAS). J Rheumatol 2008;35:1346-53.
50. van der Heijde DM, Revicki DA, Gooch KL, Wong RL, Kupper H, Harnam N, et al. Physical function, disease activity, and health-related quality-of-life outcomes after 3 years of adalimumab treatment in patients with ankylosing spondylitis. Arthritis Res Ther 2009;11:R124.
51. van der Heijde D, Schiff MH, Sieper J, Kivitz AJ, Wong RL, Kupper H, et al. Adalimumab effectiveness for the treatment of ankylosing spondylitis is maintained for up to 2 years: long-term results from the ATLAS trial. Ann Rheum Dis 2009;68:922-9.
52. Sieper J, van der Heijde D, Dougados M, Brown LS, Lavie S, Pangan AL. Early response to adalimumab predicts longterm remission through 5 years of treatment in patients with ankylosing spondylitis. Ann Rheum Dis 2012;71:700-6.
53. Inman RD, Davis JC Jr, van der Heijde D, Diekman L, Sieper J, Kim SI, et al. Effi cacy and safety of golimumab in patients with ankylosing spondylitis: results of a randomized, double-blind, placebo-controlled, phase III trial. Arthritis Rheum 2008;58:3402-12.
54. Deodhar A, Braun J, Inman RD, Mack M, Parasuraman S, Buchanan J, et al. Golimumab reduces sleep disturbance in patients with active ankylosing spondylitis: results from a randomized, placebo-controlled trial. Arthritis Care Res (Hoboken) 2010;62:1266-71.
55. Braun J, Deodhar A, Inman RD, van der Heijde D, Mack M, Xu S, Hsu B. Golimumab administered subcutaneously every 4 weeks in ankylosing spondylitis: 104-week results of the GO-RAISE study. Ann Rheum Dis 2012;71:661-7.
56. Marzo-Ortega H, McGonagle D, Jarrett S, Haugeberg G, Hensor E, O'connor P, Tan AL, et al. Infliximab in combination with methotrexate in active ankylosing spondylitis: a clinical and imaging study. Ann Rheum Dis 2005;64:1568-75.
57. Baraliakos X, Listing J, Brandt J, Haibel H, Rudwaleit M, Sieper J, et al. Radiographic progression in patients with ankylosing spondylitis after 4 yrs of treatment with the anti-TNF-alpha antibody infliximab. Rheumatology (Oxford) 2007;46:1450-3.
58. van der Heijde D, Landewé R, Baraliakos X, Houben H, van Tubergen A, Williamson P et al. Study for the Evaluation of Recombinant Infliximab Therapy Study Group. Radiographic fi ndings following two years of infliximab therapy in patients with ankylosing spondylitis. Arthritis Rheum 2008;58:3063-70.
59. van der Heijde D, Landewé R, Einstein S, Ory P, Vosse D, Ni L, et al. Radiographic progression of ankylosing spondylitis after up to two years of treatment with etanercept. Arthritis Rheum 2008;58:1324-31.
60. Braun J, Baraliakos X, Listing J, Sieper J. Decreased incidence of anterior uveitis in patients with ankylosing spondylitis treated with the anti-tumor necrosis factor agents infliximab and etanercept. Arthritis Rheum 2005;52:2447-51.
61. Rudwaleit M, Rødevand E, Holck P, Vanhoof J, Kron M, Kary S, et al. Adalimumab effectively reduces the rate of anterior uveitis flares in patients with active ankylosing spondylitis: results of a prospective open-label study. Ann Rheum Dis 2009;68:696-701.
62. Braun J, Baraliakos X, Listing J, Davis J, van der Heijde D, Haibel H, et al. Differences in the incidence of flares or new onset of inflammatory bowel diseases in patients with ankylosing spondylitis exposed to therapy with anti-tumor necrosis factor alpha agents. Arthritis Rheum 2007;57:639-47.
63. Wendling D, Balblanc JC, Briançon D, Brousse A, Lohse A, Deprez P, et al. Onset or exacerbation of cutaneous psoriasis during TNFalpha antagonist therapy. Joint Bone Spine 2008;75:315-8.
64. Briot K, Gossec L, Kolta S, Dougados M, Roux C. Prospective assessment of body weight, body composition, and bone density changes in patients with spondyloarthropathy receiving anti-tumor necrosis factor-alpha treatment. J Rheumatol 2008;35:855-61.
65. Delaunay C, Farrenq V, Marini-Portugal A, Cohen JD, Chevalier X, Claudepierre P. Infliximab to etanercept switch in patients with spondyloarthropathies and psoriatic arthritis: preliminary data. J Rheumatol 2005;32:2183-5.
66. Cantini F, Niccoli L, Benucci M, Chindamo D, Nannini C, Olivieri I, et al. Switching from infliximab to once-weekly administration of 50 mg etanercept in resistant or intolerant patients with ankylosing spondylitis: results of a fi fty-fourweek study. Arthritis Rheum 2006;55:812-6.
67. Conti F, Ceccarelli F, Marocchi E, Magrini L, Spinelli FR, Spadaro A, et al. Switching tumour necrosis factor alpha antagonists in patients with ankylosing spondylitis and psoriatic arthritis: an observational study over a 5-year period. Ann Rheum Dis 2007;66:1393-7.
68. Coates LC, Cawkwell LS, Ng NW, Bennett AN, Bryer DJ, Fraser AD, et al. Real life experience confi rms sustained response to long-term biologics and switching in ankylosing spondylitis. Rheumatology (Oxford) 2008;47:897-900.
69. Pradeep DJ, Keat AC, Gaffney K, Brooksby A, Leeder J, Harris C. Switching anti-TNF therapy in ankylosing spondylitis. Rheumatology (Oxford) 2008;47:1726-7.
70. Haberhauer G, Strehblow C, Fasching P. Observational study of switching anti-TNF agents in ankylosing spondylitis and psoriatic arthritis versus rheumatoid arthritis. Wien Med Wochenschr 2010;160:220-4.
71. Lie E, van der Heijde D, Uhlig T, Mikkelsen K, Rødevand E, Koldingsnes W, et al. Effectiveness of switching between TNF inhibitors in ankylosing spondylitis: data from the NOR-DMARD register. Ann Rheum Dis 2011;70:157-63.
72. Braun J, Deodhar A, Dijkmans B, Geusens P, Sieper J, Williamson P, et al. Effi cacy and safety of infliximab in patients with ankylosing spondylitis over a two-year period. Arthritis Rheum 2008;59:1270-8.
73. Heldmann F, Brandt J, van der Horst-Bruinsma IE, Landewe R, Sieper J, Burmester GR, et al. The European ankylosing spondylitis infliximab cohort (EASIC): a European multicentre study of long term outcomes in patients with ankylosing spondylitis treated with infliximab. Clin Exp Rheumatol 2011;29:672-80.
74. Song IH, Heldmann F, Rudwaleit M, Listing J, Appel H, Braun J, et al. Different response to rituximab in tumor necrosis factor blocker-naive patients with active ankylosing spondylitis and in patients in whom tumor necrosis factor blockers have failed: a twenty-four-week clinical trial. Arthritis Rheum 2010;62:1290-7.
75. Brulhart L, Nissen MJ, Chevallier P, Gabay C. Tocilizumab in a patient with ankylosing spondylitis and Crohn's disease refractory to TNF antagonists. Joint Bone Spine 2010;77:625-6.
76. Henes JC, Horger M, Guenaydin I, Kanz L, Koetter I. Mixed response to tocilizumab for ankylosing spondylitis. Ann Rheum Dis 2010;69:2217-8.
77. Cohen JD, Ferreira R, Jorgensen C. Ankylosing spondylitis refractory to tumor necrosis factor blockade responds to tocilizumab. J Rheumatol 2011;38:1527.
78. Song IH, Heldmann F, Rudwaleit M, Haibel H, Weiss A, Braun J, et al. Treatment of active ankylosing spondylitis with abatacept: an open-label, 24-week pilot study. Ann Rheum Dis 2011;70:1108-10.
Elaboração final
Dezembro de 2012
Descrição do método de elaboração das evidências
Os integrantes da Comissão de Espondiloartrites da Sociedade Brasileira de Reumatologia (biênio 2010-2012) participaram do Curso de Elaboração de Evidências da Associação Médica Brasileira, em São Paulo, durante o primeiro semestre de 2011. As questões foram concluídas em reunião presencial da Comissão de Espondiloartrites no dia 15 de outubro de 2011, durante a XVIII Jornada Cone Sul de Reumatologia, em Florianópolis (SC, Brasil), e foram posteriormente aprovadas por todos os coordenadores do Registro Brasileiro de Espondiloartrites. As 15 questões clínicas consideradas rele vantes foram estruturadas por meio da estratégia do P.I.C.O. (Paciente; Intervenção ou Indicador; Comparação; Outcome). As estratégias de busca avaliaram as bases de dados MEDLINE, EMBASE, Scielo/Lilacs, Cochrane Library até fevereiro de 2012 (Apêndice). Os artigos selecionados na primeira estratégia de busca foram submetidos à avaliação crítica das evidências, utilizando-se o escore de Jadad. Posteriormente, foram elaboradas as respostas das recomendações cada referência bibliográfi ca selecionada apresentava o correspondente grau de recomendação e força de evidência científi ca. Para as recomendações fi nais, as referências bibliográfi cas foram atualizadas até agosto de 2012, redigidas em texto único pelo coordenador, e submetidas aos coautores em dois turnos, para elaboração do texto final.
Grau de recomendação e força de evidência
A: Estudos experimentais e observacionais de melhor consistência.
B: Estudos experimentais e observacionais de menor consistência.
C: Relatos de casos (estudos não controlados).
D: Opinião desprovida de avaliação crítica, baseada em consensos, estudos fisiológicos ou modelos animais.
Objetivo
Estabelecer as recomendações para o manejo (critérios classificatórios e avaliação por ressonância magnética e genética) das espondiloartrites e para o tratamento da espondilite anquilosante.
Apêndice
Questão 1
Quais são os critérios clínicos para que um indivíduo seja considerado acometido por uma espondiloartrite?
Spondylitis, Ankylosing OR Bechterew's Disease OR Ankylosing Spondyloarthritis OR Rheumatoid Spondylitis OR Marie-Struempell Disease AND specificity[Title/Abstract]
Questão 2
Qual é o papel da ressonância magnética na avaliação inicial de uma espondiloartrite axial?
(Spondylitis, Ankylosing OR Bechterew's Disease OR Ankylosing Spondyloarthritis OR Rheumatoid Spondylitis OR Marie-Struempell Disease) AND Magnetic Resonance Imaging AND (specificity[Title/Abstract] OR (prognos*[Title/Abstract] OR (first[Title/Abstract] AND episode[Title/Abstract]) OR cohort[Title/Abstract]))
Questão 3
Quando o HLA-B27 deve ser solicitado em um paciente com espondiloartrite axial?
(Spondylitis,Ankylosing OR Bechterew's Disease OR Ankylosing Spondyloarthritis OR Rheumatoid Spondylitis OR Marie-Struempell Disease) AND HLA-B27 AND (specificity[Title/ Abstract] OR (prognos*[Title/Abstract] OR (first[Title/Abstract] AND episode[Title/Abstract]) OR cohort[Title/Abstract]))
Questão 4
Quais são as evidências para o uso da reabilitação física em pacientes com espondilite anquilosante?
(Spondylitis,Ankylosing OR Bechterew's Disease OR Ankylosing Spondyloarthritis OR Rheumatoid Spondylitis OR Marie-Struempell Disease) AND HLA-B27 AND (specificity[Title/ Abstract] OR (prognos*[Title/Abstract] OR (first[Title/Abstract] AND episode[Title/Abstract]) OR cohort[Title/Abstract]))
Questão 5
Quais são as evidências para o uso de corticosteroides em pacientes com espondilite anquilosante?
(Spondylitis,Ankylosing OR Bechterew's Disease OR Ankylosing Spondyloarthritis OR Rheumatoid Spondylitis OR Marie-Struempell Disease) AND (Steroids OR Androstanes OR Androstanols OR Androstenes OR Cardanolides OR Cardenolides OR Cardiac Glycosides OR Sterols OR Cyclosteroids OR Estranes OR Estrenes OR Gonanes OR Homosteroids OR Testolactone OR Hydroxysteroids OR Ketosteroids OR 17-Ketosteroids OR Norsteroids OR orandrostanes OR Norpregnanes OR Pregnanes OR Pregnadienes OR Pregnanediol OR Pregnanediones OR regnanetriol OR Pregnanolone OR Pregnatrienes OR Pregnenes OR Tetrahydrocortisol OR Sapogenins OR Secosteroids OR Beclomethasone OR Chlormadinone OR Cyproterone OR Fluorinated OR Betamethasone OR Dexamethasone OR Flumethasone OR Fluocinolone OR Fluocortolone OR Fluorometholone OR Fluoxymesterone OR Fluprednisolone OR Flurandrenolone OR Flurogestone OR Paramethasone OR Triamcinolone OR Prednisolone OR Hydrocortisone OR corticosteroids OR Mineralocorticoids OR Glucocorticoids OR Hydroxycorticosteroids) AND ((clinical[Title/Abstract] AND trial[Title/Abstract]) OR clinical trials[MeSH Terms] OR clinical trial[Publication Type] OR random*[Title/Abstract] OR random allocation[MeSH Terms] OR therapeutic use[MeSH Subheading])
Questão 6
Em que situações o uso contínuo de AINH deve ser recomendado em pacientes com espondilite anquilosante?
(Spondylitis, Ankylosing OR Bechterew's Disease OR Ankylosing Spondyloarthritis OR Rheumatoid Spondylitis OR Marie-Struempell Disease) AND (Anti-Inflammatory Agents OR Cyclooxygenase 2 OR COX-2 OR rofecoxib OR Ibuprofen OR celecoxib OR Naproxen OR Acetaminophen OR NSAID OR paracetamol OR parecoxib OR diclofenac OR aspirin OR meloxicam OR acetylsalicylic OR piroxicam) AND (randomized controlled trial[Publication Type] OR (randomized Title/ Abstract] AND controlled[Title/Abstract] AND trial[Title/ Abstract]))
Questão 7
Quais são as evidências para o uso de drogas de base convencionais (metotrexato e sulfasalazina, entre outras) em pacientes com espondilite anquilosante?
Spondylitis,Ankylosing OR Bechterew's Disease OR Ankylosing Spondyloarthritis OR Rheumatoid Spondylitis OR Marie-Struempell Disease AND (methotrexate OR leflunomide OR sulfasalazine OR gold sodium OR hydroxychloroquine OR ciclosporin)
Questão 8
Quais são as indicações para o uso dos agentes biológicos bloqueadores do fator de necrose tumoral (drogas anti-TNF) na espondilite anquilosante?
Spondylitis, Ankylosing OR Bechterew's Disease OR Ankylosing Spondyloarthritis OR Rheumatoid Spondylitis OR Marie-Struempell Disease AND (Tumor Necrosis Factor-alpha OR golimumab OR infliximab OR adalimumab OR etanercept)
Questão 9
Existe diferença de eficácia entre as drogas anti-TNF em pacientes com espondilite anquilosante?
Spondylitis, Ankylosing OR Bechterew's Disease OR Ankylosing Spondyloarthritis OR Rheumatoid Spondylitis OR Marie-Struempell Disease AND (Tumor Necrosis Factor-alpha OR golimumab OR infliximab OR adalimumab OR etanercept)
Questão 10
Existe diferença de segurança entre as drogas anti-TNF em pacientes com espondilite anquilosante?
Spondylitis, Ankylosing OR Bechterew's Disease OR Ankylosing Spondyloarthritis OR Rheumatoid Spondylitis OR Marie-Struempell Disease AND (Tumor Necrosis Factor-alpha OR golimumab OR infliximab OR adalimumab OR etanercept)
Questão 11
O uso da terapia anti-TNF é capaz de reduzir o dano estrutural em pacientes com espondilite anquilosante?
Spondylitis, Ankylosing OR Bechterew's Disease OR Ankylosing Spondyloarthritis OR Rheumatoid Spondylitis OR Marie-Struempell Disease AND (Tumor Necrosis Factor-alpha OR golimumab OR infliximab OR adalimumab OR etanercept)
Questão 12
Existem evidências para eficácia e segurança das drogas anti-TNF nas manifestações extra-articulares em pacientes com espondilite anquilosante?
(Spondylitis, Ankylosing OR Bechterew's Disease OR Ankylosing Spondyloarthritis OR Rheumatoid Spondylitis OR Marie-Struempell Disease) AND (Tumor Necrosis Factor-alpha OR golimumab OR infliximab OR adalimumab OR etanercept) AND (Uveitis OR Iridocyclitis OR Cardiovascular Diseases OR Pulmonary Fibrosis OR Lung diseases OR Extra-articular OR Extra articular OR Inflammatory Bowel Diseases OR psoriatic arthritis OR Psoriasis OR Crohn Disease OR bone)
Questão 13
Quais são as evidências que suportam a troca (switch) de agentes anti-TNF em pacientes com spondilite anquilosante?
Spondylitis, Ankylosing OR Bechterew's Disease OR Ankylosing Spondyloarthritis OR Rheumatoid Spondylitis OR Marie-Struempell Disease AND switch* AND (randomized controlled trial[Publication Type] OR (randomized[Title/ Abstract] AND controlled[Title/Abstract] AND trial[Title/Abstract]))
Questão 14
Quanto tempo se deve utilizar uma droga anti-TNF no seguimento de um paciente com espondilite anquilosante?
(Spondylitis, Ankylosing OR Bechterew's Disease OR Ankylosing Spondyloarthritis OR Rheumatoid Spondylitis OR Marie-Struempell Disease) AND (Tumor Necrosis Factor-alpha OR golimumab OR infliximab OR adalimumab OR etanercept)
Questão 15
Existem evidências para o uso de agentes biológicos com outros mecanismos de ação na espondilite anquilosante?
Spondylitis, Ankylosing OR Bechterew's Disease OR Ankylosing Spondyloarthritis OR Rheumatoid Spondylitis OR Marie-Struempell Disease AND (rituximab OR tocilizumab OR abatacept OR Antibodies, Monoclonal)
-
1Moll JMH, Haslock I, MacRae IF, Wright V. Associations between ankylosing spondylitis, psoriatic arthritis, Reiter's disease, the intestinal arthropathies, and Behcet's syndrome. Medicine 1974;53:343-64.
-
2Rudwaleit M, Landewé R, van der Heijde D, Listing J, Brandt J, Braun J, et al. The development of Assessment of SpondyloArthritis international Society classifi cation criteria for axial spondyloarthritis (part I): classifi cation of paper patients by expert opinion including uncertainty appraisal. Ann Rheum Dis 2009;68:770-6.
-
3Rudwaleit M, van der Heijde D, Landewé R, Listing J, Akkoc N, Brandt J, et al. The development of Assessment of SpondyloArthritis international Society classifi cation criteria for axial spondyloarthritis (part II): validation and fi nal selection. Ann Rheum Dis 2009;68:777-83.
-
4Rudwaleit M, van der Heijde D, Landewé R, Akkoc N, Brandt J, Chou CT, et al. The Assessment of SpondyloArthritis International Society classifi cation criteria for peripheral spondyloarthritis and for spondyloarthritis in general. Ann Rheum Dis 2011;70:25-31.
-
5Rudwaleit M, Jurik AG, Hermann KG, et al Landewe R, van der Heijde D, Baraliakos X, et al. Defi ning active sacroiliitis on magnetic resonance imaging (MRI) for classifi cation of axial spondyloarthritis: a consensual approach for the ASAS/OMERACT MRI group. Ann Rheum Dis 2009;68:1520-7.
-
6Sampaio-Barros PD, Bortoluzzo AB, Conde RA, Costallat LT, Samara AM, Bertolo MB. Undifferentiated spondyloarthritis: a long-term followup. J.Rheumatol 2010;37(6):1195-9.
-
7Weber U, Lambert RG, Østergaard M, Hodler J, Pedersen SJ, Maksymowych WP. The diagnostic utility of magnetic resonance imaging in spondylarthritis: an international multicenter evaluation of one hundred eighty-seven subjects. Arthritis Rheum 2010;62:3048-58.
-
9Bennett AN, McGonagle D, O'Connor P, Hensor EM, Sivera F, Coates LC, et al. Severity of baseline magnetic resonance imaging-evident sacroiliitis and HLA-B27 status in early inflammatory back pain predict radiographically evident ankylosing spondylitis at eight years. Arthritis Rheum 2008;58:3413-8.
-
10Maksymowych WP, Chiowchanwisawakit P, Clare T, Pedersen SJ, Østergaard M, Lambert RG. Inflammatory lesions of the spine on magnetic resonance imaging predict the development of new syndesmophytes in ankylosing spondylitis: evidence of a relationship between inflammation and new bone formation. Arthritis Rheum 2009;60:93-102.
-
11Madsen KB, Schiøttz-Christensen B, Jurik AG. Prognostic signifi cance of magnetic resonance imaging changes of the sacroiliac joints in spondyloarthritis--a followup study. J Rheumatol 2010;37:1718-27.
-
12Freeston J, Barkham N, Hensor E, Emery P, Fraser A. Ankylosing spondylitis, HLA-B27 positivity and the need for biologic therapies. Joint Bone Spine 2007;74:140-3.
-
13Bennett AN, McGonagle D, O'Connor P, Hensor EM, Sivera F, Coates LC, et al. Severity of baseline magnetic resonance imaging-evident sacroiliitis and HLA-B27 status in early inflammatory back pain predict radiographically evident ankylosing spondylitis at eight years. Arthritis Rheum 2008;58:3413-8.
-
14Rudwaleit M, Haibel H, Baraliakos X, Listing J, Märker- Hermann E, Zeidler H, et al. The early disease stage in axial spondylarthritis: results from the German Spondyloarthritis Inception Cohort. Arthritis Rheum 2009;60:717-27.
-
15Joshi R, Reveille JD, Brown MA, Weisman MH, Ward MM, Gensler LS, et al. Is there a higher genetic load of susceptibility loci in familial ankylosing spondylitis? Arthritis Care Res (Hoboken) 2012;64:780-4.
-
16Fernández-de-Las-Peñas C, Alonso-Blanco C, Morales- Cabezas M, Miangolarra-Page JC. Two exercise interventions for the management of patients with ankylosing spondylitis: a randomized controlled trial. Am J Phys Med Rehabil 2005;84:407-19.
-
17Fernández-de-Las-Peñas C, Alonso-Blanco C, Alguacil- Diego IM, Miangolarra-Page JC. One-year follow-up of two exercise interventions for the management of patients with ankylosing spondylitis: a randomized controlled trial. Am J Phys Med Rehabil 2006;85:559-67.
-
18Staalesen Strumse YA, Nordvåg BY, Stanghelle JK, Røisland M, Winther A, Pajunen PA, et al. Effi cacy of rehabilitation for patients with ankylosing spondylitis: comparison of a four-week rehabilitation programme in a Mediterranean and a Norwegian setting. J Rehabil Med 2011;43:534-42.
-
19Peters ND, Ejstrup L. Intravenous methylprednisolone pulse therapy in ankylosing spondylitis. Scand J Rheumatol 1992;21:134-8.
-
20Braun J, Bollow M, Seyrekbasan F, Häberle HJ, Eggens U, Mertz A, et al. Computed tomography guided corticosteroid injection of the sacroiliac joint in patients with spondyloarthropathy with sacroiliitis: clinical outcome and followup by dynamic magnetic resonance imaging. J Rheumatol 1996;23:659-64.
-
21Bollow M, Braun J, Taupitz M, Häberle J, Reibhauer BH, Paris S, et al. CT-guided intraarticular corticosteroid injection into the sacroiliac joints in patients with spondyloarthropathy: indication and follow-up with contrast-enhanced MRI. J Comput Assist Tomogr 1996;20:512-21.
-
22Dougados M, Gueguen A, Nakache JP, Velicitat P, Veys EM, Zeidler H, et al. Ankylosing spondylitis: what is the optimum duration of a clinical study? A one year versus a 6 weeks non-steroidal anti-inflammatory drug trial. Rheumatology (Oxford) 1999;38:235-44.
-
23van der Heijde D, Baraf HS, Ramos-Remus C, Calin A, Weaver AL, Schiff M, et al. Evaluation of the effi cacy of etoricoxib in ankylosing spondylitis: results of a fi ftytwo- week, randomized, controlled study. Arthritis Rheum 2005;52:1205-15.
-
24Barkhuizen A, Steinfeld S, Robbins J, West C, Coombs J, Zwillich S. Celecoxib is effi cacious and well tolerated in treating signs and symptoms of ankylosing spondylitis. J Rheumatol 2006;33:1805-12.
-
25Sieper J, Klopsch T, Richter M, Kapelle A, Rudwaleit M, Schwank S, et al. Comparison of two different dosages of celecoxib with diclofenac for the treatment of active ankylosing spondylitis: results of a 12-week randomised, double-blind, controlled study. Ann Rheum Dis 2008;67:323-9.
-
26Peloso PM, Gammaitoni A, Smugar SS, Wang H, Moore AR. Longitudinal numbers-needed-to-treat (NNT) for achieving various levels of analgesic response and improvement with etoricoxib, naproxen, and placebo in ankylosing spondylitis. BMC Musculoskelet Disord 2011;12:165.
-
27Wanders A, van der Heijde D, Landewé R, Béhier JM, Calin A, Olivieri I, et al. Nonsteroidal antiinflammatory drugs reduce radiographic progression in patients with ankylosing spondylitis: a randomized clinical trial. Arthritis Rheum 2005;52:1756-65.
-
28Roychowdhury B, Bintley-Bagot S, Bulgen DY, Thompson RN, Tunn EJ, Moots RJ. Is methotrexate effective in ankylosing spondylitis? Rheumatology (Oxford) 2002;41:1330-2.
-
29Gonzalez-Lopez L, Garcia-Gonzalez A, Vazquez-Del-Mercado M, Muñoz-Valle JF, Gomez-Nava JI. Effi cacy of methotrexate in ankylosing spondylitis: a randomized, double blind, placebo controlled trial. J Rheumatol 2004;31:1568-74.
-
30Chen J, Liu C. Is sulfasalazine effective in ankylosing spondylitis? A systematic review of randomized controlled trials. J Rheumatol 2006;33:722-31.
-
31Song IH, Althoff CE, Haibel H, Hermann KG, Poddubnyy D, Listing J, et al. Frequency and duration of drug-free remission after 1 year of treatment with etanercept versus sulfasalazine in early axial spondyloarthritis: 2 year data of the ESTHER trial. Ann Rheum Dis 2012;71:1212-5.
-
32van Denderen JC, van der Paardt M, Nurmohamed MT, de Ryck YM, Dijkmans BA, van der Horst-Bruinsma IE. Double blind, randomised, placebo controlled study of leflunomide in the treatment of active ankylosing spondylitis. Ann Rheum Dis 2005;64:1761-4.
-
33Braun J, Brandt J, Listing J, Zink A, Alten R, Golder W, et al. Treatment of active ankylosing spondylitis with infliximab: a randomized controlled multicentre trial. Lancet 2002;359:1187-93.
-
34Braun J, Brandt J, Listing J, Zink A, Alten R, Burmester G, et al. Long-term effi cacy and safety of infliximab in the treatment of ankylosing spondylitis: an open, observational, extension study of a three-month, randomized, placebo-controlled trial. Arthritis Rheum 2003;48:2224-33.
-
35Listing J, Brandt J, Rudwaleit M, Zink A, Sieper J, Braun J. Impact of anti-tumour necrosis factor alpha treatment on admissions to hospital and days of sick leave in patients with ankylosing spondylitis. Ann Rheum Dis 2004;63:1670-2.
-
36van der Heijde D, Dijkmans B, Geusens P, Sieper J, DeWoody K, Williamson P, et al. Ankylosing Spondylitis Study for the Evaluation of Recombinant Infliximab Therapy Study Group. Effi cacy and safety of infliximab in patients with ankylosing spondylitis: results of a randomized, placebo-controlled trial (ASSERT). Arthritis Rheum 2005;52:582-91.
-
37Braun J, Brandt J, Listing J, Zink A, Alten R, Burmester G, et al. Two year maintenance of effi cacy and safety of infliximab in the treatment of ankylosing spondylitis. Ann Rheum Dis 2005;64:229-34.
-
38Braun J, Baraliakos X, Brandt J, Listing J, Zink A, Alten R, et al. Persistent clinical response to the anti-TNF-alpha antibody infliximab in patients with ankylosing spondylitis over 3 years. Rheumatology (Oxford) 2005;44:670-6.
-
39Braun J, Baraliakos X, Listing J, Fritz C, Alten R, Burmester G, et al. Persistent clinical effi cacy and safety of antitumour necrosis factor alpha therapy with infliximab in patients with ankylosing spondylitis over 5 years: evidence for different types of response. Ann Rheum Dis 2008;67:340-5.
-
40Baraliakos X, Listing J, Fritz C, Haibel H, Alten R, Burmester GR, et al. Persistent clinical effi cacy and safety of infliximab in ankylosing spondylitis after 8 years - early clinical response predicts long-term outcome. Rheumatology (Oxford) 2011;50:1690-9.
-
41Inman RD, Maksymowych WP; CANDLE Study Group. A double-blind, placebo-controlled trial of low dose infliximab in ankylosing spondylitis. J Rheumatol 2010;37:1203-10.
-
42Gorman JD, Sack KE, Davis JC Jr. Treatment of ankylosing spondylitis by inhibition of tumor necrosis factor alpha. N Engl J Med 2002;346:1349-56.
-
43Brandt J, Khariouzov A, Listing J, Haibel H, Sörensen H, Grassnickel L, et al. Six-month results of a double-blind, placebo-controlled trial of etanercept treatment in patients with active ankylosing spondylitis. Arthritis Rheum 2003;48:1667-75.
-
44Davis JC Jr, Van Der Heijde D, Braun J, Dougados M, Cush J, Clegg DO, et al. Recombinant human tumor necrosis factor receptor (etanercept) for treating ankylosing spondylitis: a randomized, controlled trial. Arthritis Rheum 2003;48:3230-6.
-
45Davis JC Jr, van der Heijde DM, Braun J, Dougados M, Clegg DO, Kivitz AJ, et al. Effi cacy and safety of up to 192 weeks of etanercept therapy in patients with ankylosing spondylitis. Ann Rheum Dis 2008;67:346-52.
-
46Calin A, Dijkmans BA, Emery P, Hakala M, Kalden J, Leirisalo-Repo M, et al. Outcomes of a multicentre randomised clinical trial of etanercept to treat ankylosing spondylitis. Ann Rheum Dis 2004;63:1594-600.
-
47Dougados M, Braun J, Szanto S, Combe B, Elbaz M, Geher P, et al. Effi cacy of etanercept on rheumatic signs and pulmonary function tests in advanced ankylosing spondylitis: results of a randomised double-blind placebo-controlled study (SPINE). Ann Rheum Dis 2011;70:799-804.
-
48Navarro-Sarabia F, Fernández-Sueiro JL, Torre-Alonso JC, Gratacos J, Queiro R, Gonzalez C, Loza E, et al. High-dose etanercept in ankylosing spondylitis: results of a 12-week randomized, double blind, controlled multicentre study (LOADET study). Rheumatology (Oxford) 2011;50:1828-37.
-
49Revicki DA, Luo MP, Wordsworth P, Wong RL, Chen N, Davis JC Jr, et al. Adalimumab reduces pain, fatigue, and stiffness in patients with ankylosing spondylitis: results from the adalimumab trial evaluating long-term safety and effi cacy for ankylosing spondylitis (ATLAS). J Rheumatol 2008;35:1346-53.
-
50van der Heijde DM, Revicki DA, Gooch KL, Wong RL, Kupper H, Harnam N, et al. Physical function, disease activity, and health-related quality-of-life outcomes after 3 years of adalimumab treatment in patients with ankylosing spondylitis. Arthritis Res Ther 2009;11:R124.
-
51van der Heijde D, Schiff MH, Sieper J, Kivitz AJ, Wong RL, Kupper H, et al. Adalimumab effectiveness for the treatment of ankylosing spondylitis is maintained for up to 2 years: long-term results from the ATLAS trial. Ann Rheum Dis 2009;68:922-9.
-
52Sieper J, van der Heijde D, Dougados M, Brown LS, Lavie S, Pangan AL. Early response to adalimumab predicts longterm remission through 5 years of treatment in patients with ankylosing spondylitis. Ann Rheum Dis 2012;71:700-6.
-
53Inman RD, Davis JC Jr, van der Heijde D, Diekman L, Sieper J, Kim SI, et al. Effi cacy and safety of golimumab in patients with ankylosing spondylitis: results of a randomized, double-blind, placebo-controlled, phase III trial. Arthritis Rheum 2008;58:3402-12.
-
54Deodhar A, Braun J, Inman RD, Mack M, Parasuraman S, Buchanan J, et al. Golimumab reduces sleep disturbance in patients with active ankylosing spondylitis: results from a randomized, placebo-controlled trial. Arthritis Care Res (Hoboken) 2010;62:1266-71.
-
55Braun J, Deodhar A, Inman RD, van der Heijde D, Mack M, Xu S, Hsu B. Golimumab administered subcutaneously every 4 weeks in ankylosing spondylitis: 104-week results of the GO-RAISE study. Ann Rheum Dis 2012;71:661-7.
-
56Marzo-Ortega H, McGonagle D, Jarrett S, Haugeberg G, Hensor E, O'connor P, Tan AL, et al. Infliximab in combination with methotrexate in active ankylosing spondylitis: a clinical and imaging study. Ann Rheum Dis 2005;64:1568-75.
-
57Baraliakos X, Listing J, Brandt J, Haibel H, Rudwaleit M, Sieper J, et al. Radiographic progression in patients with ankylosing spondylitis after 4 yrs of treatment with the anti-TNF-alpha antibody infliximab. Rheumatology (Oxford) 2007;46:1450-3.
-
58van der Heijde D, Landewé R, Baraliakos X, Houben H, van Tubergen A, Williamson P et al. Study for the Evaluation of Recombinant Infliximab Therapy Study Group. Radiographic fi ndings following two years of infliximab therapy in patients with ankylosing spondylitis. Arthritis Rheum 2008;58:3063-70.
-
59van der Heijde D, Landewé R, Einstein S, Ory P, Vosse D, Ni L, et al. Radiographic progression of ankylosing spondylitis after up to two years of treatment with etanercept. Arthritis Rheum 2008;58:1324-31.
-
60Braun J, Baraliakos X, Listing J, Sieper J. Decreased incidence of anterior uveitis in patients with ankylosing spondylitis treated with the anti-tumor necrosis factor agents infliximab and etanercept. Arthritis Rheum 2005;52:2447-51.
-
61Rudwaleit M, Rødevand E, Holck P, Vanhoof J, Kron M, Kary S, et al. Adalimumab effectively reduces the rate of anterior uveitis flares in patients with active ankylosing spondylitis: results of a prospective open-label study. Ann Rheum Dis 2009;68:696-701.
-
62Braun J, Baraliakos X, Listing J, Davis J, van der Heijde D, Haibel H, et al. Differences in the incidence of flares or new onset of inflammatory bowel diseases in patients with ankylosing spondylitis exposed to therapy with anti-tumor necrosis factor alpha agents. Arthritis Rheum 2007;57:639-47.
-
63Wendling D, Balblanc JC, Briançon D, Brousse A, Lohse A, Deprez P, et al. Onset or exacerbation of cutaneous psoriasis during TNFalpha antagonist therapy. Joint Bone Spine 2008;75:315-8.
-
64Briot K, Gossec L, Kolta S, Dougados M, Roux C. Prospective assessment of body weight, body composition, and bone density changes in patients with spondyloarthropathy receiving anti-tumor necrosis factor-alpha treatment. J Rheumatol 2008;35:855-61.
-
65Delaunay C, Farrenq V, Marini-Portugal A, Cohen JD, Chevalier X, Claudepierre P. Infliximab to etanercept switch in patients with spondyloarthropathies and psoriatic arthritis: preliminary data. J Rheumatol 2005;32:2183-5.
-
66Cantini F, Niccoli L, Benucci M, Chindamo D, Nannini C, Olivieri I, et al. Switching from infliximab to once-weekly administration of 50 mg etanercept in resistant or intolerant patients with ankylosing spondylitis: results of a fi fty-fourweek study. Arthritis Rheum 2006;55:812-6.
-
67Conti F, Ceccarelli F, Marocchi E, Magrini L, Spinelli FR, Spadaro A, et al. Switching tumour necrosis factor alpha antagonists in patients with ankylosing spondylitis and psoriatic arthritis: an observational study over a 5-year period. Ann Rheum Dis 2007;66:1393-7.
-
68Coates LC, Cawkwell LS, Ng NW, Bennett AN, Bryer DJ, Fraser AD, et al. Real life experience confi rms sustained response to long-term biologics and switching in ankylosing spondylitis. Rheumatology (Oxford) 2008;47:897-900.
-
69Pradeep DJ, Keat AC, Gaffney K, Brooksby A, Leeder J, Harris C. Switching anti-TNF therapy in ankylosing spondylitis. Rheumatology (Oxford) 2008;47:1726-7.
-
70Haberhauer G, Strehblow C, Fasching P. Observational study of switching anti-TNF agents in ankylosing spondylitis and psoriatic arthritis versus rheumatoid arthritis. Wien Med Wochenschr 2010;160:220-4.
-
71Lie E, van der Heijde D, Uhlig T, Mikkelsen K, Rødevand E, Koldingsnes W, et al. Effectiveness of switching between TNF inhibitors in ankylosing spondylitis: data from the NOR-DMARD register. Ann Rheum Dis 2011;70:157-63.
-
72Braun J, Deodhar A, Dijkmans B, Geusens P, Sieper J, Williamson P, et al. Effi cacy and safety of infliximab in patients with ankylosing spondylitis over a two-year period. Arthritis Rheum 2008;59:1270-8.
-
73Heldmann F, Brandt J, van der Horst-Bruinsma IE, Landewe R, Sieper J, Burmester GR, et al. The European ankylosing spondylitis infliximab cohort (EASIC): a European multicentre study of long term outcomes in patients with ankylosing spondylitis treated with infliximab. Clin Exp Rheumatol 2011;29:672-80.
-
74Song IH, Heldmann F, Rudwaleit M, Listing J, Appel H, Braun J, et al. Different response to rituximab in tumor necrosis factor blocker-naive patients with active ankylosing spondylitis and in patients in whom tumor necrosis factor blockers have failed: a twenty-four-week clinical trial. Arthritis Rheum 2010;62:1290-7.
-
75Brulhart L, Nissen MJ, Chevallier P, Gabay C. Tocilizumab in a patient with ankylosing spondylitis and Crohn's disease refractory to TNF antagonists. Joint Bone Spine 2010;77:625-6.
-
76Henes JC, Horger M, Guenaydin I, Kanz L, Koetter I. Mixed response to tocilizumab for ankylosing spondylitis. Ann Rheum Dis 2010;69:2217-8.
-
77Cohen JD, Ferreira R, Jorgensen C. Ankylosing spondylitis refractory to tumor necrosis factor blockade responds to tocilizumab. J Rheumatol 2011;38:1527.
-
78Song IH, Heldmann F, Rudwaleit M, Haibel H, Weiss A, Braun J, et al. Treatment of active ankylosing spondylitis with abatacept: an open-label, 24-week pilot study. Ann Rheum Dis 2011;70:1108-10.
Datas de Publicação
-
Publicação nesta coleção
16 Set 2013 -
Data do Fascículo
Jun 2013