Resumos
A ativação farmacológica dos receptores 5-HT2C induz comportamentos de defesa em modelos animais. O estudo busca investigar se o bloqueio seletivo de receptores 5-HT2C no hipocampo ventral (HV) previne comportamentos defensivos induzidos por um agonista de receptor 5-HT2C administrado perifericamente em ratos expostos ao labirinto em cruz elevado (LCE). Quinze minutos após injeções intraperitoniais (IP, 1ml/kg) do agonista 5-HT2C WAY-161503, ratos foram microinjetados bilateralmente no HV com o antagonista seletivo de receptores 5-HT2C SB-242084 (0, 0,1, 0,5 ou 1.5μg). Dez minutos após, cada animal foi exposto ao LCE para o registro de categorias de ansiedade. Injeções sistêmicas do WAY-161503 reduziram seletivamente as explorações nos braços abertos e aumentaram padrões de avaliação de risco. Esse efeito foi atenuado de maneira dose-dependente pela microinjeção de SB-242084 no HV, confirmando a ação ansiogênica de agonistas 5-HT2C e sugerindo que esse perfil comportamental seja mediado, pelo menos em parte, por receptores 5-HT2C do HV.
receptor 5-HT2C; hipocampo ventral; labirinto em cruz elevado
Pharmacological 5-HT2C receptor activation induces defensive behaviors in several animal models of anxiety. The present study investigated whether the selective blockade of 5-HT2C receptors in the ventral hippocampus (VH) prevents defensive behaviors induced by a 5-HT2C agonist administered systemically in rats exposed to the elevated plus-maze (EPM). Fifteen minutes after intraperitonial (IP, 1ml/kg) injections of the selective 5-HT2C receptor agonist WAY-161503 (3 mg/kg), rats were bilaterally microinjected with the selective 5-HT2C antagonist SB-242084 (0, 0.1, 0.5 or 1.5μg) into the VH. Ten minutes after, each animal was exposed to the EPM for measuring classical and ethological anxiety measures. IP WAY-161503 injections selectively decreased open-arm exploration while increasing risk-assessment. This anxiogenic-like action was dose-dependently attenuated by intra-VH SB-242084 microinjections. These results not only further confirm the anxiogenic-like action of 5-HT2C agonists, but also suggest that this behavioral profile might be mediated at least in part by VH 5-HT2C receptors.
5-HT2C receptor; ventral hippocampus; elevated plus-maze
DOSSIÊ: NEUROCIÊNCIA E PSICOPATOLOGIA
Envolvimento de receptores 5-HT2C do hipocampo ventral em comportamentos de defesa de ratos no labirinto em cruz elevado
Involvement of ventral hippocampus 5-HT2C receptors on defensive behaviors of rats in the elevated plus-maze
Marília Greidinger CarvalhoI; Graziela Furtado Scarpelli FerreiraII; Marcelo de Faria SalvianoIII; Flávia Martins da SilvaIV; Kalliu Carvalho CoutoV; Sérgio Henrique de Souza AlvesVI; Antonio Pedro de Mello CruzVII
IInstituto de Educação Superior de Brasília
IIUniversidade Católica de Brasília
IIIInstituto Federal de Brasília
IVUniversidade Católica de Brasília
VPsicólogo autônomo
VIInstituto de Educação Superior de Brasília e Centro Universitário de Brasília
VIIInstituto de Psicologia da Universidade de Brasília
RESUMO
A ativação farmacológica dos receptores 5-HT2C induz comportamentos de defesa em modelos animais. O estudo busca investigar se o bloqueio seletivo de receptores 5-HT2C no hipocampo ventral (HV) previne comportamentos defensivos induzidos por um agonista de receptor 5-HT2C administrado perifericamente em ratos expostos ao labirinto em cruz elevado (LCE). Quinze minutos após injeções intraperitoniais (IP, 1ml/kg) do agonista 5-HT2C WAY-161503, ratos foram microinjetados bilateralmente no HV com o antagonista seletivo de receptores 5-HT2C SB-242084 (0, 0,1, 0,5 ou 1.5μg). Dez minutos após, cada animal foi exposto ao LCE para o registro de categorias de ansiedade. Injeções sistêmicas do WAY-161503 reduziram seletivamente as explorações nos braços abertos e aumentaram padrões de avaliação de risco. Esse efeito foi atenuado de maneira dose-dependente pela microinjeção de SB-242084 no HV, confirmando a ação ansiogênica de agonistas 5-HT2C e sugerindo que esse perfil comportamental seja mediado, pelo menos em parte, por receptores 5-HT2C do HV.
Palavras-chave: receptor 5-HT2C; hipocampo ventral; labirinto em cruz elevado.
ABSTRACT
Pharmacological 5-HT2C receptor activation induces defensive behaviors in several animal models of anxiety. The present study investigated whether the selective blockade of 5-HT2C receptors in the ventral hippocampus (VH) prevents defensive behaviors induced by a 5-HT2C agonist administered systemically in rats exposed to the elevated plus-maze (EPM). Fifteen minutes after intraperitonial (IP, 1ml/kg) injections of the selective 5-HT2C receptor agonist WAY-161503 (3 mg/kg), rats were bilaterally microinjected with the selective 5-HT2C antagonist SB-242084 (0, 0.1, 0.5 or 1.5μg) into the VH. Ten minutes after, each animal was exposed to the EPM for measuring classical and ethological anxiety measures. IP WAY-161503 injections selectively decreased open-arm exploration while increasing risk-assessment. This anxiogenic-like action was dose-dependently attenuated by intra-VH SB-242084 microinjections. These results not only further confirm the anxiogenic-like action of 5-HT2C agonists, but also suggest that this behavioral profile might be mediated at least in part by VH 5-HT2C receptors.
Keywords: 5-HT2C receptor; ventral hippocampus; elevated plus-maze.
Desde as observações originais que antagonistas serotoninérgicos ou drogas que diminuem os níveis encefálicos de serotonina (5-hidroxitriptamina; 5-HT) apresentavam efeito ansiolítico (Graeff & Schoenfeld, 1970; Robichaud & Sledge, 1969; Stein, Wise, & Berger, 1973), o envolvimento desse neurotransmissor na ansiedade foi amplamente confirmado (Gordon & Hen, 2004; Graeff, 2002; Griebel, 1995; Millan, 2005; Ohara, Nagai, Suzuki, & Ochiai, 1998). No entanto, a participação precisa desse envolvido ainda não foi elucidada, sobretudo pelo fato de a neurotransmissão serotoninérgica ser demasiadamente complexa, incluindo sete famílias (5-HT1 - 5-HT7) distribuídas em catorze subtipos de receptores [5-HT1A, 5-HT1B, 5-HT1D, 5-HT1E, 5-HT1F, 5-HT2A, 5-HT2B, 5-HT2C, 5-HT3, 5-HT4, 5-HT5A, 5-HT5B, 5-HT6 e 5-HT7] (Hoyer, Hannon, & Martin, 2002; Pompeiano, Palácios, & Mengod, 1994). Destes, os receptores 5-HT1A, 5-HT2 e 5-HT3 são as mais diretamente envolvidas na ansiedade. Por exemplo, o primeiro ansiolítico de ação serotoninérgica específica, a buspirona, tem seu mecanismo de ação mediado pelo subtipo de receptor 5-HT1A (Nichols & Nichols, 2008).
Nos últimos anos, o envolvimento do subtipo 5-HT2C de receptor serotoninérgico na modulação da ansiedade vem ganhando destaque. Diversas drogas que se ligam preferencialmente ou seletivamente como agonistas e antagonistas nesse subtipo de receptor foram selecionadas (Bourin & Dhonnchadha, 2005; Kennett, Lightowler, Trail, Bright, & Bromidge, 2000; Martin, Ballard, & Higgins, 2002; Millan, 2005; Quérée & Sharp, 2009; Wood, 2003). O padrão de resultados com a administração periférica desses ligantes, ainda que variados e altamente dependentes de peculiaridades metodológicas que incluem desde o tipo de modelo de animal até a seletividade para os receptores 5-HT2C e rota de administração, pode ser assim resumido: agonistas causam efeito ansiogênico e antagonistas bloqueiam ou atenuam esses efeitos. Antagonistas administrados isoladamente, na ausência do agonista, são desprovidos de atividade intrínseca ou causam efeitos ansiolíticos discretos ou, paradoxalmente, efeitos ansiogênicos (Alves, Pinheiro, Motta, Landeira-Fernandez, & Cruz, 2004; Durand, Mormèd, & Chaouloff, 2003; Filip & Bader 2009; Gomes et al., 2010; Jones, Duxon, & King, 2002; Mosher, Smith, & Greenshaw, 2006; Setem, Pinheiro, Motta, Morato, & Cruz, 1999).
O interesse pela administração intraencefálica de drogas seletivas para o subtipo 5-HT2C de receptor serotoninérgico também tem crescido (para revisões ver Menard & Treit, 1999; Millan, 2005), mas ainda não se tem um panorama completo do tipo de efeito que causam nas principais estruturas neurais envolvidas nas reações de defesa, nas quais a serotonina comprovadamente desempenha importante papel.
As principais vias serotoninérgicas no encéfalo originam-se nos núcleos da rafe mesencefálica (McQuade & Sharp, 1997; Millan, 2003). O núcleo mediano da rafe se projeta para o septo medial, hipotálamo anterior e hipocampo dorsal. Já o núcleo dorsal da rafe envia projeções serotoninérgicas para o córtex pré-frontal, septo lateral, estriado dorsal, córtex entorinal, matéria cinzenta periaquedutal, amígdala e o hipocampo ventral (Azmitia & Segal, 1978; McQuade & Sharp, 1997; Pompeiano, Palácios, & Mengod, 1994). As projeções para a amígdala (Davis, Rainnie, & Cassell, 1994; LeDoux, 2000; Rainnie, 1999) e hipocampo ventral (Alves et al., 2004) estão implicadas na modulação da ansiedade frente a situações de perigo em potencial, enquanto a que se projeta para a matéria cinzenta periaquedutal parecem modular reações de medo e pânico diante de situações reais de perigo proximal (Deakin & Graeff, 1991).
Todas essas estruturas pós-sinápticas que recebem serotonina a partir do núcleo dorsal da rafe têm grandes concentrações de receptores 5-HT2C (Clemett, Punhanim, Duxonm, Blackburnm, & Fone, 2000; Hill et al., 2011; Kristiansen & Dahl, 1996; Mammounas, Mullen, O'Hearn, & Molivier, 1991; Millan, 2003; Pompeiano, Palácios, & Mengod, 1994; Vertes, 1991). Com exceção da matéria cinzenta periaquedutal, onde a própria serotonina e agonistas serotoninérgicos exercem efeito "antipânico" (para revisões, ver Deakin & Graeff, 1991; Graeff, 2004), agonistas 5-HT2C microinjetados diretamente na amígdala (Campbell & Merchant, 2003; Zangrossi & Graeff, 1994) ou no hipocampo ventral (Alves et al., 2004; Scarpelli, Alves, Landeira-Fernandez, & Cruz, 2008) promovem efeitos ansiogênicos em diversos modelos animais de ansiedade.
Se agonistas 5-HT2C são ansiogênicos quando microinjetados diretamente na amígdala ou no hipocampo ventral, o bloqueio farmacológico de receptores 5-HT2C nessas estruturas deve então promover efeito ansiolítico, por si só, ou ser capaz de antagonizar os efeitos ansiogênicos de agonistas 5-HT2C administrados perifericamente. Em estudo prévio de nosso laboratório (Cruz et al., 2005), a infusão intra-amigdalóide de ritanserina, um antagonista 5-HT2 não seletivo com maior afinidade pelos receptores 5-HT2C (Kristiansen & Dahl, 1996), não produziu efeito ansiolítico por si só, mas aboliu a ansiedade induzida pela administração sistêmica do agonista preferencial 5-HT2C MK-212 em ratos expostos ao labirinto em cruz elevado (LCE). Mais recentemente demonstramos que a ativação de receptores 5-HT2C diretamente no hipocampo ventral aumentou estados de ansiedade (Scarpelliet et al., 2008) em dois modelos animais de ansiedade. Com base nesses resultados, o presente experimento investigou os efeitos do bloqueio seletivo de receptores 5-HT2C diretamente no hipocampo ventral sobre estados de ansiedade induzidos farmacologicamente pela administração periférica de um agonista seletivo de receptores 5-HT2C em ratos expostos ao LCE. As drogas escolhidas para o estudo foram o agonista seletivo de receptores 5-HT2C WAY-161503, administrado intraperitonialmente, e o antagonista seletivo desses receptores, o SB-24084, microinjetado bilateralmente no hipocampo ventral.
Método
Sujeitos
Foram utilizados ratos Wistar machos, experimentalmente ingênuos e com pesos que variaram entre 180 e 260 g. Os animais provieram da empresa BIOAGRI (Brasília-DF) e foram alojados por 15 dias antes do experimento no biotério de manutenção do Laboratório de Psicobiologia do Instituto de Psicologia da Universidade de Brasília.
Os animais foram alojados em grupos de quatro animais, em gaiolas-viveiro (45 x 28 x 13 cm) de polietileno com serragem no fundo trocada diariamente. Todos tiveram livre acesso à comida e água e foram mantidos sob um ciclo claro-escuro de 12h (fase clara de 7h às 19h00). Os procedimentos experimentais seguiram as normas preconizadas pela Sociedade Brasileira de Neurociências e Comportamento (SBNeC) e balizadas pelo National Institutes of Health Guide for Care and Use of Laboratory Animals (revisada em 1999).
Equipamentos
O LCE consistiu de dois braços abertos (50 x 10 cm) e dois braços fechados (50 x 10 x 40 cm), elevados a 50 cm do solo. Os braços abertos e fechados cruzavam-se perpendicularmente entre si, formando uma figura em formato de cruz, delimitada por uma arena central de 10 x 10 cm. Circundando os braços abertos e com a finalidade de minimizar o número de quedas dos animais foi colocada uma pequena borda (1 cm) de acrílico transparente. O aparato foi acondicionado em uma sala com isolamento acústico parcial, iluminada por uma lâmpada incandescente vermelha (60-W) posicionada 150 cm acima da arena central.
As sessões experimentais foram observadas e gravadas com o auxílio de um sistema de vídeo-câmera e o filme correspondente a cada animal foi analisado posteriormente por um observador treinado na análise das categorias comportamentais, porém sem ter conhecimento do tratamento farmacológico recebido por cada animal.
Drogas
Para as injeções periféricas utilizou-se o agonista 5-HT2C seletivo WAY-161503 [Hidroclorido (8,9-Dichloro-2,3,4,4a-tetrahydro-1H-pyrazino[1,2-a]quinoxalin-5(6H)-onehydrochloride)], solubilizado em salina estéril (0,9%) e injetado intraperitonialmente (1 ml/kg) na dose de 3 mg/kg. Para as infusões no hipocampo ventral, que se deram 15 minutos após as injeções periféricas, utilizou-se o antagonista seletivo 5-HT2C SB-242084 [(6-Chloro-2,3-dihydro-5-methyl-N-[6-[(2-methyl-3-pyridinyl)oxy]-3-pyridinyl]-1H-indole-1-carboxyamidedihydrochloride)]. Esta droga foi solubilizada em salina estéril e microinjetada (0,2 ml) bilateralmente no hipocampo ventral nas doses de 0,1, 0,5 ou 1,5μg. A dose periférica do WAY-161503 e a faixa de doses centrais do SB-24084 foram escolhidas com base nos estudos prévios de Gomes et al. (2010) e Cruz et al. (2005), respectivamente. Ambas as drogas (TOCRIS Bioscience, Ballwin, Missouri, USA) foram solubilizadas no dia dos testes comportamentais.
Cirurgia
Após anestesia com tiopental sódico (40 mg/kg), cada animal foi colocado cuidadosamente pelas hastes auriculares no estereotáxico. Ali receberam uma injeção subcutânea de cloridrato de lidocaína na região cirúrgica, em um volume apenas suficiente para formar uma pequena bolha. Um pedaço oval da pele circunscrita à região cirúrgica foi retirado para se ter acesso à calota craniana. Após limpeza do campo e visualização dos pontos de referência no crânio, três orifícios foram abertos na calota craniana através de uma broca, dois deles para a colocação e fixação das cânulas e um orifício adicional no qual foi colocado um parafuso que auxiliou a fixação do cimento acrílico na superfície da calota craniana.
Tendo bregma como referência (Paxinos & Watson, 1998), duas cânulas foram implantadas 1 mm acima do hipocampo ventral, uma em cada hemisfério, nas seguintes coordenadas: AP = - 4,8; LM = 5,0; DV = 6,0. Com o objetivo de evitar entupimentos, foram fixados mandris no interior das cânulas, os quais só foram retirados no dia dos testes comportamentais. Um período mínimo de sete dias de recuperação pós-cirúrgica foi dado para os animais antes da realização dos testes comportamentais.
Microinjeção
Para as microinjeções utilizou-se um sistema composto por um tubo de polietileno transparente (PE10, 50 cm), tendo uma de suas extremidades conectada em uma seringa de Hamilton (10 ml) e outra extremidade conectada em uma cânula interna de 3 mm de diâmetro externo. A extremidade do tubo conectada à cânula interna foi preenchida com a substância a ser microinjetada, enquanto aquela conectada à seringa de Hamilton foi preenchida com água destilada. Separando as duas substâncias havia uma pequena bolha de ar cujo deslocamento em milímetros correspondia ao volume microinjetado. Imediatamente após a retirada do mandril, a cânula interna foi cuidadosamente conectada à cânula-guia, ultrapassando a mesma em 0,5 mm. As microinjeções foram feitas em um volume de 0,2 ml, em cerca de 30 segundos. Para evitar refluxo e favorecer a absorção, a cânula interna só foi retirada da cânula-guia após um período adicional de 2 minutos.
Exposição ao LCE
Dez minutos após as microinjeções, os animais foram expostos ao LCE por 5 minutos. Foram registrados o número de entradas e o tempo gasto em cada braço. A partir desse registro foram calculadas as porcentagens de entradas e de tempo gasto nos braços abertos. Como medidas adicionais as estes índices clássicos de ansiedade no teste registrou-se ainda o tempo gasto nas categorias espreitar (padrões de avaliação de risco caracterizados por saída parcial de um braço fechado com as patas dianteiras e cabeça, espreitando com movimentos pendulares o centro e a entrada dos braços abertos) e esquadrinhar (colocação da cabeça sobre a beirada de um braço aberto, esquadrinhando em qualquer direção). Estas duas medidas etologicamente fundamentadas foram validadas previamente como medidas de ansiedade no labirinto em cruz elevado (Cruz, Frei, & Graeff, 1994) e têm se mostrado úteis na detecção de efeitos de drogas serotoninérgicas (Setem, Pinheiro, Motta, Morato, & Cruz, 1999). O número absoluto de entradas nos braços fechados refletiu atividade locomotora.
Histologia
Ao término dos testes comportamentais, os animais foram sacrificados com uma sobredose de tiopental de sódio e perfundidos intracardialmente com uma sequência de solução salina e outra de formol a 15%. Os encéfalos foram removidos e mantidos em formol a 10% por um período mínimo de 10 dias para que pudessem ser seccionados (50-60 µm) em planos coronais.
Análise estatística
Os dados foram analisados por uma análise de variância de duas vias (two-way ANOVA), com o primeiro fator, em dois níveis, correspondendo à injeção periférica (salina ou WAY-161503) e o segundo fator, em quatro níveis, correspondendo à microinjeção das três doses de SB-24084 ou de salina no hipocampo ventral. No caso de diferença estatisticamente significante, utilizou-se o teste de Bonferroni para comparações post hoc. O nível de significância adotado foi de p < 0,05.
Resultados
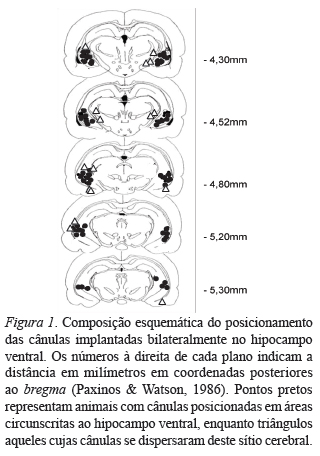
A Figura 1 ilustra a composição dos pontos de microinjeção com base na análise histológica. Dos 64 animais, 47 (73%) tiveram suas cânulas posicionadas em áreas circunscritas ao hipocampo ventral. Animais cujas cânulas se posicionaram fora do hipocampo ventral (n = 15) foram retirados das análises.
Os efeitos do tratamento farmacológico sobre os índices clássicos de ansiedade no labirinto em cruz elevado são ilustrados na Figura 2. Conforme observado, a injeção periférica do WAY-161503 reduziu as porcentagens de entrada e de tempo gasto nos braços abertos, um efeito que foi prevenido de maneira dose-dependente pela infusão do SB-24084 no hipocampo ventral. Consistentemente, a ANOVA de duas vias indicou uma interação significante entre as injeções periféricas do WAY-161503 e as doses de SB-24084 microinjetadas no hipocampo ventral [F(3, 62) = 8,17, p < 0,05]. Comparações post hoc revelaram que o WAY-161503 reduziu significantemente (ps < 0,05) as porcentagens de entrada e tempo gasto nos braços abertos em comparação com o grupo de animais-controle tratado periférica e centralmente com salina. A droga também reduziu significantemente (p < 0,05) a porcentagem de tempo gasto nos braços abertos em relação ao grupo tratado perifericamente com salina e microinjetado com a dose mais baixa (0,1 mg) de SB-24084 no hipocampo ventral. Essa redução foi prevenida pela microinjeção do SB-24084 nas demais doses, de maneira que não houve diferença estatisticamente significante entre os grupos injetados perifericamente com o WAY-161503 e microinjetados com SB-24084 nas doses de 0,5 e 1,5 μg em relação aos animais tratados perifericamente com salina (ps > 0,05).
Esse mesmo padrão de resultados foi detectado pelas categorias espreitar e esquadrinhar, conforme ilustrado na Figura 3. ANOVA indicou interação significante entre as injeções periféricas do WAY-161503 e as doses de SB-24084microinjetadas no hipocampo ventral [F(3, 62) = 18,47, p < 0,05]. Comparações post hoc revelaram que, em comparação com o grupo injetado intraperitonialmente com salina, o WAY-161503 aumentou significantemente o tempo gasto na categoria espreitar (p < 0,05) e diminuiu significantemente o tempo na categoria esquadrinhar (p < 0,05). Esses efeitos foram prevenidos pela infusão de todas as doses do SB-24084 no hipocampo ventral (ps > 0,05).
Todos os efeitos observados sobre essas medidas clássicas e etológicas de ansiedade se deram na ausência de alteração significante sobre o número absoluto de entradas nos braços fechados [F(3, 62) = 3,83, p > 0,05] (dados não ilustrados).
Discussão
A administração periférica do WAY-161503 causou um efeito ansiogênico robusto, o qual foi detectado não só pela redução da porcentagem de entradas nos braços abertos, porcentagem de tempo nesses braços e tempo em esquadrinhar, mas também pelo aumento do tempo em espreitar, esta última categoria relacionada a padrões de avaliação de risco (Cruz et al., 1994). O fato de o número absoluto de entradas nos braços fechados não ter sido alterado pela droga indica ausência de interferência locomotora nos efeitos ansiogênicos observados.
O padrão comportamental decorrente da ativação farmacológica dos receptores 5-HT2C pelo WAY-161503 corrobora resultados recentes de nosso laboratório com esta mesma droga administrada perifericamente (Gomes et al., 2010), bem como está de acordo com os efeitos ansiogênicos vastamente documentados para outros agonistas 5-HT2C não apenas no labirinto em cruz elevado, mas também em outros modelos animais, incluindo o campo aberto, a interação social em ratos, a transição claro-escuro, a resposta de congelamento condicionada (Griebelet al., 1994; Kennett et al., 2000; Kennett, Whitton, Shah, & Curzon, 1989; Kimura et al., 2009; Li, Jiang, & Wang, 2012; Setem et al., 1999).
A microinjeção do antagonista 5-HT2C SB-24084 no hipocampo ventral preveniu os efeitos ansiogênicos induzidos pela administração periférica do agonista 5-HT2C WAY-161503. Isto ocorreu para todas as doses de SB-24084, exceto para a menor dose da droga (0,1 µg). Considerando que tanto o agonista 5-HT2C WAY-161503 quanto o antagonista 5-HT2C SB-24084 se ligam com altíssima afinidade no subtipo 5-HT2C (Boothman, Raley, Denk, Hirani, & Sharp 2006; Campbell & Merchant, 2003), esses resultados apontam para uma importante participação dos receptores 5-HT2C do hipocampo ventral na modulação de estados de ansiedade de ratos no labirinto em cruz elevado.
A sugestão de que os efeitos ansiogênicos do WAY-161503 tenham sido mediados pela ativação de receptores 5-HT2C no hipocampo ventral encontra também respaldo no estudo de Scarpelliet al. (2008) no qual esse mesmo agonista 5-HT2C exerceu ação ansiogênica ao ser microinjetado diretamente no hipocampo ventral. Em estudo anterior, Alveset al. (2004) já haviam demonstrado que o agonista preferencial 5-HT2C MK-212 aumenta o estado de ansiedade de ratos no labirinto em cruz elevado quando microinjetado no hipocampo ventral, mas não no hipocampo dorsal.
O hipocampo ventral, bem como a amígdala e a matéria cinzenta periaquedutal, recebem projeções serotoninérgicas advindas do núcleo dorsal da rafe mesencefálica. Evidências histoquímicas e farmacológicas indicam se tratar de uma via com preferência pelo subtipo 5-HT2C de receptor seroninérgico (Clemett et al., 2000; Garcia-Alcover, Segura, Garcia Pena, Martinez-Torres, & Miledi, 2006; McQuade & Sharp, 1997). No entanto, essas estruturas parecem desempenhar papéis diferentes na modulação da ansiedade. Por exemplo, a própria serotonina e agonistas serotoninérgicos são ansiogênicos quando microinjetados diretamente na amígdala, mas promovem efeito do tipo "antipânico" na matéria cinzenta periaquedutal (Gomes & Nunes-De-Souza, 2009; Graeff, 2002, 2004). Neste sentido, os resultados do presente estudo sugerem uma participação do hipocampo ventral semelhante à da amígdala nessa circuitaria neural subjacente à ansiedade, o que está de acordo com resultados recentes descritos por Christianson et al. (2010) e Moyaet al. (2011). Portanto, a ativação dos receptores 5-HT2C seria acompanhada de um aumento na ansiedade, enquanto o bloqueio desses receptores exerceria um efeito ansiolítico.
No presente estudo, no entanto, o bloqueio seletivo dos receptores 5-HT2C do hipocampo ventral aboliu a ansiedade induzida pela ativação farmacológica do WAY-161503 administrado perifericamente, mas esse bloqueio, por si só, não causou efeito ansiolítico, considerando que nenhuma das doses do SB-24084 foi capaz de atenuar os níveis basais de ansiedade nos animais pré-tratados perifericamente com salina. De maneira semelhante, Cruz et al. (2005) demonstraram em ratos expostos ao labirinto em cruz elevado que a infusão intra-amigdalóide do antagonista 5-HT2ritanserinapreveniu a ansiedade induzida pela administração sistêmica do agonista preferencial 5-HT2C MK-212, mas foi incapaz de produzir efeito ansiolítico sozinha.Esse mesmo padrão de resultado para antagonistas 5-HT2C foi observado recentemente em outra forma de labirinto elevado, o labirinto em T elevado (Yamashita, Bortoli, & Zangrossi-Jr, 2011). Talvez esses tipos dois de labirinto em cruz elevado sejam mais sensíveis para detectar efeitos de drogas serotoninérgicas quando os níveis basais de ansiedade já são elevados, a exemplo do que foi obtido no presente estudo pelas injeções periféricas do WAY-161503 que antecederam a microinjeção do antagonista SB-24084 no hipocampo ventral. Este é um aspecto interessante que merece ser investigado mais detalhadamente em estudos futuros.
Em conjunto nossos resultados não apenas acrescentam novas evidências de que a ativação farmacológica dos receptores 5-HT2C desencadeia comportamentos de defesa, mas sugerem que pelo menos em parte esses efeitos podem ser mediados pelos receptores 5-HT2C do hipocampo ventral.
Recebido em 20.jul.11
Revisado em 17.fev.12
Aceito em 06.abr.12
Marília Greidinger Carvalho, mestre em Ciências do Comportamento, é farmacêutica e professora no Instituto de Educação Superior de Brasília. Endereço: SQN 112 Bloco H Ap. 108 Brasília / DF - 70762-080. Telefone: (61) 9116-6102 / (61) 3273-8140. E-mail: mariliagc@gmail.com
Graziela Furtado Scarpelli Ferreira, doutora em Ciências do Comportamento, é psicóloga e professora na Universidade Católica de Brasília. E-mail: graziela.furtado@gmail.com
Marcelo de Faria Salviano,Biólogo, doutorando em Ciências do Comportamento, é professor do Instituto Federal de Brasília. E-mail: salvibio@yahoo.com.br
Flávia Martins da Silva, mestre em Ciências do Comportamento, é psicóloga, química e professora na Universidade Católica de Brasília. E-mail: flaviams@ucb.br
Kalliu Carvalho Couto, é psicólogo autônomo. E-mail: kalliu.pesquisador@yahoo.com.br
Sérgio Henrique de Souza Alves, doutor em Psicobiologia, é psicólogo e professor no Instituto de Educação Superior de Brasília e no Centro Universitário de Brasília. E-mail: sergiohenrique.alves@gmail.com
Antonio Pedro de Mello Cruz, doutor em Psicobiologia e Pós-Doutor em Neurociências do Comportamento, é psicólogo e professor Associado no Instituto de Psicologia da Universidade de Brasília. E-mail: apmcruz@unb.br
- Alves, S. H., Pinheiro, G., Motta, V., Landeira-Fernandez, J., & Cruz, A. P. M. (2004). Anxiogenic effects in the rat elevated plus-maze of 5-HT2C agonists into ventral but not dorsal hippocampus. Behavioural Pharmacology, 15, 37-43.
- Azmitia, E. C., & Segal, M. (1978). An autoradiographic analysis of the differential acending projections of the dorsla and median raphe nuclei in the rat. Journal of Comparative Neurology, 179(3), 641-667.
- Boothman, L., Raley, J., Denk, F., Hirani, E., & Sharp, T. (2006). In vivo evidence that 5-HT(2C) receptors inhibit 5-HT neuronal activity via a GABAergic mechanism. British Journal of Pharmacology, 149, 861-869.
- Bourin, M., & Dhonnchadha, B. A. N. (2005).5-HT2 receptors and anxiety. Drug Development Research, 65, 133-140.
- Campbell, B. M., & Merchant, K. M. (2003). Serotonin 2C receptors within the basolateral amygdala induce acute fear-like responses in an open-field environment. Brain Research, 993, 1-9.
- Clemett, D. A., Punhani, T., Duxon, M. S., Blackburn, T. P., & Fone, K. C. (2000). Immunohistochemical localization of the 5-HT2C receptor protein in the rat CNS. Neuropharmacology, 39, 123-132.
- Christianson, J. P., Ragole, T., Amat, J., Greenwood, B. N., Strong, P. V., Paul, E. D., ... & Maie, S. F. (2010). 5-hydroxytryptamine 2C receptors in the basolateral amygdala are involved in the expression of anxiety after uncontrollable traumatic stress. Biological Psychiatry, 67(4), 339-345.
- Cruz, A. P. M., Frei, F., & Graeff, F. G. (1994). Ethopharmacological analysis of rat behavior on the elevated plus-maze. Pharmacology Biochemistry & Behavior, 49(1), 171-176.
- Cruz, A. P. M., Pinheiro, G., Alves. S. H., Ferreira, G., Mendes, M., Faria, L., ... & Landeira-Fernandez, J. (2005). Behavioral effects of systemically administered MK-212 areprevented by ritanserinmicroinfusion into the basolateral amygdala of rats exposed to the elevated plus-maze. Psychopharmacology, 182, 345-354.
- Davis, M., Raiunnie, D., & Cassell, M. (1994). Neurotransmission in therat amygdala related to fear and anxiety. Trends in Neuroscience, 17, 17-24.
- Deakin, J. F. W., & Graeff, F. G. (1991). 5-HT and mechanisms of defense. Journal of Psychopharmacology, 5(4), 305-315.
- Durand, M., Mormèd, P., & Chaouloff, F. (2003). Wistar-Kyoto rats are sensitive to the hypolocomotor and anxiogenic effects of mCPP. Behavioural Pharmacology, 14, 173-177.
- Filip, M., & Bader, M. (2009). Overview on 5-HT receptors and their role in physiology and pathology of the central nervous system. Pharmacological Reports, 61, 761-777.
- Garcia-Alcover, G., Segura, L. C., Garcia Pena, M., Martinez-Torres, A., & Miledi, R. (2006). Ontogenetic distribution of 5-HT2C, 5-HT2A, and 5-HT7 receptors in the rat hippocampus. Gene Expression, 13, 53-57.
- Gomes, F., Greidinger, M., Salviano, M., Conton, K., Scarpelli, G., Alves, S. H., & Cruz, A. P. M. (2010). Antidepressant-and anxiogenic-like effects of acute 5-HT2C receptor activation in rats exposed to the forced swim test and elevated plus-maze. Psychology & Neuroscience, 3, 245-249.
- Gomes, K. S., & Nunes-De-Souza, R. L. (2009). Implication of the 5-HT2A and 5-HT2C (but not 5HT1A) receptors located within the periaqueductal gray in the elevated plus-maze testretest paradigm in mice. Progress in Neuro-Psychopharmacology and Biological Psychiatry, 33(7), 1261-1269.
- Gordon, J. A., & Hen, R. (2004). The serotonin system and anxiety. Neuromolecular Medicine, 5, 27-40.
- Graeff, F. G. (2002). On serotonin and experimental anxiety. Psychopharmacology, 163, 467-476.
- Graeff, F. G. (2004). Serotonin, the periaquedutalgray and panic. Neuroscience and Biobehavioral Reviews, 28, 239-259.
- Graeff, F. G., & Schoenfeld, R. I. (1970). Tryptaminergic mechanisms in punished and nonpunished behavior. Journal of Pharmacology and Experimental Therapeutics, 173, 277-283.
- Griebel, G. (1995). 5-Hydroxytryptamine-interacting drugs in animal models of anxiety disorders: more than 30 years of research. Psychopharmacology Therapeutics, 65(3), 319-395.
- Griebel, G., Moreau, J. L., Jenck, F., Mutel, V., Martin, J. R., & Misslin, R. (1994). Evidence that tolerance to the anxiogenic-like effects of mCPP does not involve alteration in the function of 5-HT(2C) receptors in the rat choroid plexus. Behavioural Pharmacology, 5, 642-645.
- Hill, R. A., Murray, S. S., Halley, P. G., Binder, M. D., Martin, S. J., & van den Buuse, M. (2011). Brain-derived neurotrophic factor expression is increased in the hippocampus of 5-HT2C receptor knockout mice. Hippocampus, 21(4) 434-445.
- Hoyer, D., Hannon, J. P., & Martin, G. R. (2002).Molecular, pharmacological and functional diversity of 5-HT receptors. Pharmacology Biochemistry and Behavior, 71, 533-554.
- Jones, N., Duxon M. S., & King, S. M. (2002). 5-HT2C receptor mediation of unconditioned escape behaviour in the unstable elevated exposed plus maze. Psychopharmacology, 164, 214-220.
- Kennett, G. A., Whitton, P., Shah, K., & Curzon, G. (1989). Anxiogenic-like effects of mCPP and TFMPP in animal models are opposed by 5-HT1C receptor antagonists. European Journal of Pharmacology, 164, 445-454.
- Kennett, G. A., Lightowler, S., Trail, B., Bright, F., & Bromidge, S. (2000). Effects of RO 60 0175, a 5-HT2C receptor agonist, in three animal models of anxiety. European Journal of Pharmacology, 397, 197-204.
- Kimura, A., Stevenson, P. L., Carter, R. N., MacColl, G., French, K. L., Simons, J. P., ... Holmes, M. C. (2009). Over expression of 5-HT2C receptors in forebrain leads to elevated anxiety and hypoactivity. European Journal of Neuroscience, 30(2), 299-306.
- Kristiansen, K., & Dahl, S. G. (1996).Molecular modeling of serotonin, ketanserin, ritanserin and their 5-HT2C receptor interactions. European Journal of Pharmacology, 306, 95-210.
- Ledoux, J. E. (2000). Emotion circuits in the brain. Annual Review of Neuroscience, 23, 155-184.
- Li, Q., Luo, T., Jiang, X., & Wang, J. (2012). Anxiolytic effects of 5-HT1A receptors and anxiogenic effects of 5-HT2C receptors in the amygdala of mice. Neuropharmacology, 62(1), 474-484.
- Mammounas, L. A., Mullen, C. A., O'Hearn, E., & Molivier, M. E. (1991). Dual serotonergic projections to forebrain in the rat: morphologically distinct 5-HT axon terminals exhibit differential vulnerability to neurotoxic amphetamine derivatives. Journal of Comparative Neurology, 314, 558-586.
- Martin, J. R., Ballard, T. M., & Higgins, G. A. (2002). Influence of the 5-HT2C receptor antagonist, SB-242084, in tests of anxiety. Pharmacology, Biochemistry and Behavior, 71, 615-625.
- McQuade, R., & Sharp, T. (1997). Functional mapping of dorsal and median raphe 5-hydroxytryptamine pathways in forebrain of therat using microdialysis. Journal of Neurochemistry, 62, 791-796.
- Menard, J., & Treit, D. (1999). Effects of centrally administered anxiolytic compounds in animal models of anxiety. Neuroscience and Biobehavioral Reviews, 23, 591-613.
- Millan, M. J. (2003).The neurobiology and control of anxious states. Progress in Neurobiology, 70, 83-244.
- Millan, M. J. (2005). Serotonin 5-HT2C receptors as a target for the treatment of depressive and anxious states: focus on novel therapeutic strategies. Thérapie, 60(5), 441-460.
- Mosher, T. M., Smith, J. G., & Greenshaw, A. J. (2006). Aversive stimulus properties of the 5-HT2C receptor agonist WAY 161503 in rats. Neuropharmacology, 51, 641-650.
- Moya, P. R., Fox, M. A., Jensen, C. L., Laporte, J. L., French, H. T., Wendland, J. R., Murphy, D. L. (2011). Altered 5-HT2C receptor agonist-induced responses and 5-HT2C receptor RNA editing in the amygdala of serotonin transporter knockout mice. BMC Pharmacology, 11, 3. doi:10.1186/1471-2210-11-3
- Nichols, D. E., & Nichols, C. D. (2008). Serotonin receptors. Chemical Reviews, 108, 1614-1641.
- Ohara, K., Nagai, M., Suzuki, Y., & Ochiai, M. (1998). Association between anxiety disorders and a functional polymorphism in the serotonin transporter gene. Psychiatry Research, 81(2), 277-279.
- Paxinos, G., & Watson, C. (1998). The rat brain in stereotaxic coordinates (2nd edition). Nova Iorque: Academic Press.
- Pompeiano, M., Palácios, J. M., & Mengod, G. (1994). Distribution of the serotonin 5-HT2 receptor family mRNAs: comparison between 5-HT2A and 5-HT2C receptors. Molecular Brain Research, 23, 163-178.
- Quérée, S. P., & Sharp, T. (2009). Further pharmacological characterization of 5-HT2Creceptor agonist-induced inhibition of 5-HTneuronal activity in the dorsal raphe nucleus in vivo. British Journal of Pharmacology, 158, 1477-1485.
- Rainnie, D. G. (1999). Serotonergic modulation in the rat basolateral amygdala. Journal of Neurophysiology, 82(1), 69-85.
- Robichaud, R. C., & Sledge, K.L. (1969). The effects of p-chlorophenylalanine on experimentally induce conflict in the rat. Life Sciences, 8, 965-969.
- Scarpelli, G., Alves, S. H., Landeira-Fernandez, J., & Cruz, A. P. M. (2008). Effects of two selective 5-HT2C receptor-acting compounds into the ventral hippocampus of rats exposed to the elevated plus-maze. Psychology & Neuroscience, 1, 87-96.
- Setem, J., Pinheiro, A. P., Motta, V., Morato, S., & Cruz, A.P.M. (1999). Ethopharmacological analysis of 5-HT ligands on the rat elevated plus-maze. Pharmacology Biochemistry and Behavior, 62(3), 515-521.
- Stein, L., Wise, C. D., & Berger, B. D. (1973). Antianxiety actions of benzodiazepines: Decrease in activity of serotonin neurons in the punishment systems. In S. Gratini, E. Mussini, & L. O. Randell (Orgs.), Benzodiazepines (pp. 299-326). Nova Iorque: Raven Press.
- Vertes, R. P. (1991). A PHA-L analysis of ascending projections of the dorsal raphe nucleus in the rat. Journal of Comparative Neurology, 313, 643-668.
- Wood, M. D. (2003). Therapeutic potential of 5-HT2C receptor antagonists in the treatment of anxiety disorders.Current Drug Targets CNS and Neurology Disorders, 2, 383-387.
- Yamashita, P. S. M, Bortoli, V., & Zangross-Jr, H. (2011). 5-HT2C receptor regulation of defensive responses in the rat dorsal periaqueductal gray. Neuropharmacology, 60(2-3) 216-222.
- Zangrossi, H., & Graeff, F. G. (1994). Behavioral effects of intra-amygdala injections of GABA and 5-HT acting drugs in the elevated plus-maze. Brazilian Journal of Medical and Biological Research, 27, 2453-2456.
Datas de Publicação
-
Publicação nesta coleção
27 Jul 2012 -
Data do Fascículo
Abr 2012
Histórico
-
Recebido
20 Jul 2011 -
Aceito
06 Abr 2012 -
Revisado
17 Fev 2012