Resumos
OBJETIVO: Avaliação da segurança e eficácia do uso de células progenitoras autólogas da medula óssea (CMMO) no tratamento da Osteonecrose da Cabeça Femoral (OCF) de pacientes portadores de anemia falciforme. MÉTODOS: Foram estudados 8 pacientes portadores de anemia falciforme, com OCF nos estágios I e II (classificação de Ficat e Arlet). As CMMO retiradas da crista ilíaca posterior foram concentradas e reinfundidas na área central da osteonecrose. Os principais parâmetros avaliados foram segurança, sintomas clínicos e progressão da doença, através da avaliação clínica (Harris Hip Score) e radiológica. RESULTADOS: A maior parte dos pacientes (7 em 8) referiu melhora dos sintomas após o tratamento. Não houve complicações durante o procedimento anestésico e cirúrgico. A medida do escore (Harris Hip Score) no pré-operatório foi 78,5 +/- 6,2 pontos, com aumento significativo destes valores no pós-operatório (98,3 +/- 2,5 pontos) (p< 0,001). As avaliações radiográficas e os parâmetros celulares foram favoráveis. CONCLUSÃO: O implante autólogo de CMMO parece ser seguro e eficaz no tratamento dos estágios iniciais da OCF em pacientes falciformes. Embora os resultados iniciais sejam promissores, sua interpretação é limitada pelo número de pacientes avaliados e o período curto de duração do seguimento pós-operatório. Necessita-se estender o grupo em estudo e os parâmetros celulares avaliados.
Osteonecrose; Doença falciforme; Transplante autólogo; Células da medula óssea; Células-tronco
PURPOSE: To assess the efficacy and safety of autologous bone-marrow mononuclear cells (BMMC) implantation in necrotic lesions of the femoral head in patients with sickle cell disease. METHODS: We studied eight patients with stage-I or -II femoral head osteonecrosis according to the system by Ficat and Arlet. BMMCs were harvested and re-infused into the necrotic zone. The primary endpoints studied were safety, clinical symptoms and disease progression, these being assessed according to the Harris hip score (HHS) and to X-ray studies. RESULTS: After eight months, seven of the eight patients reported improvement from symptoms. There were no complications during anesthetic and surgery procedures. There was a significant postoperative increase in the HHS (98.3 +/- 2.5 points) compared to preoperative HHS (78.5 +/- 6.2 points) (p< 0.001). X-ray evaluation and cell parameters were found to be favorable. CONCLUSION: The autologous bone-marrow mononuclear cells implantation seems to be a safe and effective treatment for early stages of femoral head osteonecrosis in patients with sickle cell disease. Although promising, the interpretation of these early results is limited due to the small sample and to the short duration of follow-up. Further studies and advanced cellular assays are required to confirm the results.
Osteonecrosis; Sickle cell disease; Autologous transplantation; Bone marrow cells; Stem cells
ARTIGO ORIGINAL
Tratamento da Osteonecrose da Cabeça Femoral com celulas progenitoras autólogas em anemia falciforme
Gildásio Cerqueira DaltroI; Vitor Antonio FortunaII; Marco Aurélio Salvino de AraújoIII; Paulo Itamar Ferraz LessaIV; Uirassú de Assis Batista SobrinhoV; Radovan BorojevicVI
IProfessor Adjunto, Hospital Universitário Professor Edgard Santos, Universidade Federal da Bahia
IIProfessor Adjunto, Instituto de Ciências de Saúde, Universidade Federal da Bahia
IIIMédico Hematologista, Hospital Universitário Professor Edgard Santos, Universidade Federal da Bahia
IVFisioterapeuta, Hospital Universitário Professor Edgard Santos, Universidade Federal da Bahia
VResidente, Hospital Universitário Professor Edgard Santos, Universidade Federal da Bahia
VIProfessor Titular, Instituto de Ciências Biomédicas, Universidade Federal do Rio de Janeiro
Endereço para correspondências Endereço para correspondências: Prof. Gildásio C. Daltro Departamento de Cirurgia Hospital Universitário Professor Edgard Santos Universidade Federal da Bahia, Salvador, BA Rua: Augusto Viana, s/m Canela Salvador - Bahia - Brasil - CEP:40110-170 email: gildasiohupes@hotmail.com
RESUMO
OBJETIVO: Avaliação da segurança e eficácia do uso de células progenitoras autólogas da medula óssea (CMMO) no tratamento da Osteonecrose da Cabeça Femoral (OCF) de pacientes portadores de anemia falciforme.
MÉTODOS: Foram estudados 8 pacientes portadores de anemia falciforme, com OCF nos estágios I e II (classificação de Ficat e Arlet). As CMMO retiradas da crista ilíaca posterior foram concentradas e reinfundidas na área central da osteonecrose. Os principais parâmetros avaliados foram segurança, sintomas clínicos e progressão da doença, através da avaliação clínica (Harris Hip Score) e radiológica.
RESULTADOS: A maior parte dos pacientes (7 em 8) referiu melhora dos sintomas após o tratamento. Não houve complicações durante o procedimento anestésico e cirúrgico. A medida do escore (Harris Hip Score) no pré-operatório foi 78,5 +/- 6,2 pontos, com aumento significativo destes valores no pós-operatório (98,3 +/- 2,5 pontos) (p< 0,001). As avaliações radiográficas e os parâmetros celulares foram favoráveis.
CONCLUSÃO: O implante autólogo de CMMO parece ser seguro e eficaz no tratamento dos estágios iniciais da OCF em pacientes falciformes. Embora os resultados iniciais sejam promissores, sua interpretação é limitada pelo número de pacientes avaliados e o período curto de duração do seguimento pós-operatório. Necessita-se estender o grupo em estudo e os parâmetros celulares avaliados.
Descritores: Osteonecrose; Doença falciforme; Transplante autólogo; Células da medula óssea; Células-tronco.
INTRODUÇÃO
As hemoglobinopatias falciformes incluem uma variedade de doenças caracterizadas pela presença da hemoglobina S (HbS). Entre os afro-descendentes do novo mundo, o genótipo heterozigoto atinge 10% nos EUA, mais de 6% no S-SE do Brasil, e até 15,7% no Estado da Bahia(1). A homozigose da mutação (HbSS) ou a associação com outras hemoglobinopatias, em particular com HbC (HbSC), gera uma doença devastadora e crônica, associando uma anemia grave à doença vaso-oclusiva sistêmica, com a progressiva degeneração de vasos sanguíneos. No sistema ósteo-articular, uma das mais graves manifestações da doença falcêmica é a osteonecrose, mais frequentemente observada na cabeça femoral.
A osteonecrose da cabeça femoral incide em 10% a 30% da população falcêmica(2,3). Sem tratamento específico, a diminuição do fluxo sangüíneo na cabeça femoral provoca degeneração na arquitetura trabecular, colapso do osso subcondral e artrose secundária, em até 70% dos casos(4). Estas complicações tardias requerem intervenção cirúrgica como a artroplastia, que além de ser um procedimento invasivo com índices altos de morbi-mortalidade, apresenta resultados insatisfatórios em até 50% dos pacientes falciformes após 5 10 anos(5). Como a osteonecrose da cabeça de fêmur ocorre principalmente em indivíduos jovens, prefere-se um tratamento que preserve em vez de substituir a cabeça do fêmur, sempre que possível. Entretanto, não existe uma técnica disponível completamente satisfatória para o tratamento dos estágios iniciais da osteonecrose femoral, o que representa um desafio aos ortopedistas.
A medula óssea aspirada da crista ilíaca contém células progenitoras mesenquimais, com potencial osteogênico e condrogênico, além de células progenitoras endoteliais, capazes de contribuir com vasculogênese e angiogênese, providenciando o reparo vascular. Estes atributos foram explorados por vários grupos que desenvolveram estudos experimentais e clínicos empregando o implante autólogo de células mononucleares da medula óssea (CMMO) na cicatrização, recuperação da citoarquitetura óssea e regeneração do fluxo sanguíneo local de tecidos lesionados e isquêmicos(6).
Estudos clínicos prospectivos recentes do tratamento da osteonecrose femoral pelo implante autólogo de CMMO e descompressão percutânea mostraram resultados eficazes e seguros. Dentre as diversas etiologias que contribuem para esta patologia, os pacientes falcêmicos apresentam os melhores prognósticos para a terapia, com índice menor que 5% de insucesso recorrendo à artroplastia de quadril após 8 anos(7,8).
A evolução do quadro clínico geral da anemia falciforme e, mais especificamente da osteonecrose femoral, depende do perfil da mutação gênica que a causa, e do padrão dos hábitos sociais, alimentares e sanitários da população envolvida(9). O objetivo do nosso trabalho é avaliar a exeqüibilidade, segurança e eficácia do tratamento da osteonecrose femoral pela descompressão percutânea e implante autólogo de CMMO em pacientes falciformes no estado da Bahia.
MATERIAIS E MÉTODOS
Seleção dos pacientes.
Entre março e setembro de 2006, 8 pacientes foram submetidos ao procedimento de implante autólogo de células mononucleares de medula óssea, segundo a técnica descrita por Hernigou e Beaujean(8). Foram considerados elegíveis para o estudo os pacientes com doença falciforme recebidos nos ambulatórios de hematologia do Hospital Universitário Professor Edgard Santos (HUPES, UFBA) e da Fundação Hemocentro da Bahia (HEMOBA), Salvador, BA, Brasil, que apresentaram osteonecrose da cabeça do fêmur no estágio I, II e III de acordo com o sistema de classificação radiográfica de Ficat et Arlet(10) ou A, B ou C da classificação de Steinberg(11) (Tabela 1), e com um mínimo de 20 pontos no questionário sobre dor e atividades da vida diária(12).
O diagnóstico da OCF foi estabelecido pelas imagens radiográficas no plano anteroposterior e latero-lateral ou imagens de Ressonância Magnética Nuclear (RMN) procurando definir as seguintes características: presença de colapso da cabeça femoral; presença de faixa de esclerose na cabeça femoral; sinal da crescente; duplo sinal na ressonância magnética em T2; cisto ou esclerose na cabeça femoral; dor no quadril à atividade; foco de baixa intensidade em T1 (Tabela 1).
Foram excluídos do protocolo com terapia celular os pacientes nos estágios IV de Ficat e acima de C na classificação de Steinberg; portadores de infecção óssea no membro atingido pela necrose; presença de cirurgia prévia no mesmo membro da lesão; presença de doença neoplásica, ou de outra patologia que pudesse inviabilizar a terapia; condições clinicas que contra-indiquem o procedimento.
O protocolo utilizado no presente trabalho foi aprovado pela Comissão de Ética em Pesquisa da Maternidade Climério de Oliveira, (HUPES, UFBA) e pelo Comitê Nacional de Ética em Pesquisa (CONEP). Todos os pacientes participantes assinaram termo de consentimento livre e esclarecido previamente aprovado pelo Comitê de Ética Institucional.
Caracterização dos pacientes
A Tabela 2 apresenta a estratificação dos dados relativos aos pacientes avaliados distribuídos em relação ao sexo, idade, peso e diagnóstico.
Os ensaios hematológicos dos pacientes foram realizados em aparelho automático Coulter T 890. O diagnóstico da doença e o perfil de expressão de hemoglobinas nos pacientes falciformes foram confirmados pelo método de eletroforese em fitas de acetato de celulose, pH 8,4 e eletroforese em agar-citrato, pH 5,3 (Harris Hip Score)(13).
Coleta e processamento de células da medula óssea.
Aproximadamente 100 ml de medula óssea foram obtidos por punção e aspiração da crista ilíaca posterior dos pacientes, sob anestesia geral, no Centro Cirúrgico do HUPES-UFBA. O aspirado filtrado foi processado no separador de células SEPAX, (Biosafe, Suíça). As células mononucleares (CMMO) isoladas e purificadas em gradiente de Ficoll-PaqueTM Plus (Amersham Biosciences) (d=1,077 g/mL) foram ressuspensas em volume final (~25 ml) de solução salina fisiológica com 5% de albumina sérica humana e acondicionadas para injeção. Uma pequena fração da suspensão celular foi separada para ensaios de imunofenotipagem, viabilidade celular e ensaios microbiológicos.
Fenotipagem celular e controle de qualidade.
A viabilidade das células infundidas, verificada por exclusão de Azul de Trypan, foi superior a 95%. O estudo da presença de eventuais contaminantes microbiológicos, monitorados por hemocultura e testes microbiológicos tradicionais, apresentou resultados negativos.
A identificação e quantificação de populações leucocitárias na fração de CMMO foram avaliadas por citometria de fluxo. A expressão de proteínas marcadoras de superfície característica das linhagens celulares foi analisada por anticorpos monoclonais anti-CD34 (células progenitoras hematopoiéticas pluripotentes) acoplado com ficoeritrina e anti-CD45 (pan-marcador de leucócitos) acoplado com PerCp (Becton Dickison). Anticorpos murinos de mesmo isótipo foram empregados como controle. Vinte mil células marcadas foram adquiridas e analisadas em Sistema de Citometria de Fluxo FACSCalibur (BD Bioscience) e programa CellQuest e WinMDI v 2.8.
Descompressão da osteonecrose e enxerto de células progenitoras autólogas
A descompressão foi feita através da transfixação percutânea e óssea utilizando-se agulha trefina (diâmetro 3 mm). O procedimento foi previamente planejado com uso das imagens de RMN, e o posicionamento da agulha na área da cabeça femoral monitorado por radioscopia. Após a descompressão, a fração concentrada de CMMO foi infundida na área de osteonecrose com auxílio de um pequeno trocar. Cada paciente recebeu uma infusão das CMMOs na área central da osteonecrose, através, normalmente, de apenas uma perfuração para injeção. O extravasamento da fração de CMMO infundida foi evitado por um pequeno tampão sanguíneo local.
Avaliação Clínica e Radiográfica
Os pacientes foram avaliados no pré-operatório e no pós-operatório após três e seis meses, ou quando necessário. A avaliação da dor, função, amplitude de movimento articular e deformidades ocorreram segundo o escore sugerido por Harris(12) que atribui uma escala de pontuação de 0-100 a estes parâmetros. A função do quadril foi classificada de acordo com o Harris Hip Score, como excelente (91 a 100 pontos), bom (81 a 90 pontos), moderado (70 a 80 pontos) e insuficiente (< 70 pontos).
Foram avaliadas as radiografias do quadril no pré-operatório, no pós-operatório imediato e a cada três meses para examinar o tamanho da lesão, a presença de sinais indicativos de edema medular e alterações degenerativas, conforme Tabela 1.
Analise Estatística
O teste t pareado para análise de variâncias foi empregado para determinar a significância das diferenças observadas entre os valores do Harris Hip Score pré- e pós-operatório. Foram considerados significativos, valores de p <0,05. Os coeficientes de correlação entre os resultados das avaliações clínicas e os fatores celulares foram determinados através do teste de correlação de Spearman.
RESULTADOS
Nenhum dos pacientes apresentou alterações na saturação de oxigênio, pulso, pressão sangüínea, fratura intertrocantérica ou outras complicações durante o procedimento anestésico e cirúrgico. A duração média do procedimento foi de 2,5 (1,5 4)h. A injeção da fração de CMMO ocorreu aproximadamente 1,5 h após a coleta da medula óssea. Não se observou infecção, hematomas ou dor crônica no local da injeção da fração de CMMOs.
Avaliação Clínica e Radiográfica
No exame pré-operatório, a maioria dos pacientes apresentou dores acentuadas, e no pós-operatório, 7 pacientes relataram ausência de dor após três meses do procedimento. Os resultados do questionário apresentaram um Harris Hip Score médio no pré-operatório de 78,5 +/- 6,2 pontos. Após 3 e 6 meses o índice médio associado foi 98,3 +/- 2,5 pontos. Os escores do questionário foram significativamente melhores no pós-operatório (p<0,001 - teste t pareado) (Tabela 3). Esta diferença significativa indicou uma recuperação favorável das funções do quadril, diminuição da dor e elevação da qualidade das atividades diárias destes pacientes, apesar do número relativamente limitado de casuística.
Os resultados referentes ao aspecto radiográfico foram menos significativos do que os resultados clínicos. Nos pacientes cuja evolução clínica foi favorável, os quadris foram radiograficamente estáveis, sem progressão ou regressão patente do tamanho da lesão. Não houve correlação estatisticamente significativa entre o estagiamento radiográfico e o Harris Hip Score, devido, principalmente, ao número da amostra e período relativamente curto de avaliação pós-operatória.
Satisfacão do Paciente
No grupo de oito pacientes, todos que apresentaram resultados satisfatórios relataram contentamento com o procedimento e revelaram que se submeteriam ao procedimento de novo, caso necessário, no outro lado do quadril. 75% dos pacientes relataram diminuição no consumo de medicação analgésica após o procedimento. 12,5% dos pacientes relataram limitações moderadas ou mínimas nas atividades diárias, após 3 meses transcorridos o procedimento.
Análise da fração de CMMO infundida
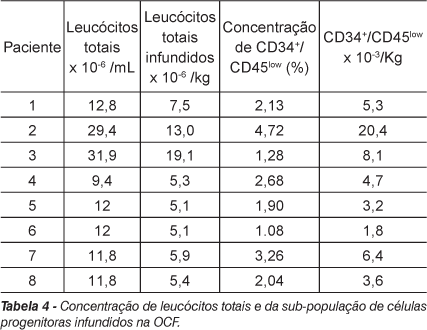
Dois parâmetros foram avaliados diretamente na fração de CMMO purificada: 1) a contagem de células nucleadas (o número de leucócitos totais por 1,0 mL de aspirado medular re-infundido); e 2) a prevalência de células Cd34+/Cd45low por 106 células nucleadas totais. A quantificação do número de células mononucleares expressando os antígenos CD34+/Cd45low foi considerada representativa do número de células progenitoras pluripotentes implantadas, por correlacionar-se positivamente com o número de células hemangioblastícas progenitoras e com a regeneração de tecidos tratados, de acordo com a literatura(14). Além destas células progenitoras, a população de células nucleadas da medula óssea também contém células mesenquimais osteoprogenitoras e outras células mononucleares, algumas das quais podem ser fonte de citocinas angiogênicas e osteogênicas, com relevância clínica. Os resultados com o número de leucócitos totais infundidos e a freqüência de células progenitoras estão apresentados na Tabela 4.
Um volume médio de 120 mL de medula óssea foi aspirado da crista ilíaca posterior de cada paciente. O número de leucócitos totais obtidos na fração concentrada de CMMO variou de 9,4 31,9 milhões de células/mL, com média de 16,4 +/- 8,8 milhões/mL. Não foi possível estabelecer correlação linear perfeita entre o número total de células nucleadas e o sexo, peso e o Harris Hip Score pré-ou pós-operatório. Observou-se uma fraca correlação entre o número total de células mononucleadas e a idade dos pacientes (teste de Spearman, r = 0,30) e o número total de células CD34+/Cd45low purificadas (r = 0,69). O número total médio de células CD34+/Cd45low infundidas foi 0,41 +/- 0,4 milhões de células, variando de 0,13 a 1,4 milhões. Não se observou nenhuma alteração na prevalência de células progenitoras com o aumento da idade (r = 0,10), peso (r = 0,18) e o resultado do Harris Hip Score pós-operatório (r = 0,20). Observou-se uma correlação fraca inversa entre células progenitoras CD34+ e valores de Harris Hip Score pré-operatório indicando diminuição na prevalência destas células em pacientes com maior comprometimento articular (r = -0,40). A análise geral dos coeficientes de correlação não indicou diferenças significativas entre a progressão clínica e parâmetros avaliados na fração de CMMO, provavelmente devido ao pequeno número amostral de pacientes que ingressaram no estudo e ao período recente de avaliação pós-operatório.
DISCUSSÃO
Este é o primeiro ensaio clínico no Brasil de terapia celular de necrose avascular da cabeça de fêmur em pacientes falcêmicos. O objetivo principal foi a avaliação da exeqüibilidade e segurança do procedimento. Em complemento, os dados preliminares foram coletados sobre a eficácia da descompressão central combinada com infusão autóloga de CMMO no tratamento de osteonecrose de cabeça de fêmur sintomática de pacientes falcêmicos.
Nossos resultados indicam que este tratamento diminuiu a dor e outros sintomas articulares associados aos estágios iniciais da osteonecrose femoral e, ao menos no período de oito meses de avaliação, estabilizou a progressão da doença.
Apesar de os pacientes falcêmicos normalmente apresentarem alta prevalência de complicações relacionadas à anestesia e cirurgia, além das complicações intrínsecas, nós não observamos nenhum episódio durante ou posteriormente ao procedimento. Não se observou pacientes com eventos de crise dolorosa ou infecção superficial nos primeiros dias após a cirurgia de descompressão e infusão celular. Fratura intertrocantérica, infecção ou embolismo, que foram descritos em estudos de descompressão e infusão celular(8,15), não foram observados em nosso estudo.
Segundo descrito na literatura, a prevalência de osteonecrose em pacientes com doença falciforme é elevada, alcançando até 50% dos indivíduos, coincidindo com a maior incidência de complicações na adolescência(16,17). O envolvimento de ambos os quadris é visto entre 40-91% dos pacientes. Como demonstrado por Hernigou et al(4), a progressão para o colapso da cabeça femoral nos pacientes falciformes ocorre em 90% dos casos em dois anos após o diagnóstico inicial da osteonecrose em estágio I. A ineficiência e falência das artroplastias totais de quadril nestes pacientes são particularmente elevadas, com incidência de dor e limitações substanciais de movimento em 75% dos pacientes falcêmicos(18,19). Estes estudos sugerem que a progressão clínica da osteonecrose femoral em pacientes com doença falciforme é mais freqüente e mais rápida do que tem sido descrito para outras patologias com osteonecroses não-traumáticas. Nosso estudo considera estas conclusões e propõe uma intervenção cirúrgica associada ao implante de CCMO como uma tentativa de prevenir ou retardar a progressão da doença, e/ou regenerar o tecido lesado.
Inúmeros procedimentos buscam preservar em vez de substituir a cabeça femoral nos pacientes com osteonecrose. A infusão celular e descompressão da cabeça femoral combinadas é uma técnica alternativa que tem sido avaliada por vários grupos desde 2000(4) demonstrando resultados satisfatórios, o que estimulou nosso estudo. A técnica de descompressão central emprega uma ou várias trefinas de 8 ou 10 mm como estratégia para alcançar a maior porção da lesão osteonecrótica. Este método é o mais frequentemente usado, porém seus efeitos invasivos são controversos(15). Em acordo com Heningou e Beaujeanl(8), o nosso protocolo emprega a trefina de 3 mm em um único acesso da área necrótica, direcionado pelo monitoramento radiográfico. Esta técnica não é plenamente equivalente à descompressão central, permitindo um procedimento menos invasivo e apropriado para a extensão da doença.
As propriedades osteogênicas e angio/vasculogênicas da fração de CMMO da medula óssea estão bem estabelecidas. A fração de CMMO aumenta a vascularização e oxigenação de tecidos isquêmicos, além de acelerar a cicatrização de fraturas em artrites crônicas(20). Espera-se que uma única injeção de células mononucleares na área necrótica do osso resulte em um processo de neoformação óssea e reparo, que às vezes ocorre espontaneamente(19). Teoricamente, os progenitores hemangioblásticos e osteogênicos da medula óssea podem repovoar os segmentos de osso necrótico com células viáveis e ativas. Embora estes tópicos não tenham sido abordas em nosso estudo, estudos futuros serão conduzidos para avaliar estas hipóteses.
O indicador mais importante de sucesso da terapia celular da osteonecrose femoral é de eliminar ou retardar o colapso femoral e a necessidade de outra cirurgia, em particular a artroplastia. Os resultados deste estudo são promissores, embora a sua interpretação seja limitada pelo número de pacientes e pelo curto período de avaliação. As evidências radiológicas da regeneração do tecido ósseo femoral são esperadas a partir de 12 meses após a terapia, e a estabilização da estrutura óssea deve ser acompanhada ao longo de vários anos.
Ensaios posteriores serão realizados para ponderar o êxito desta técnica com maior tempo de avaliação. Indicações e contra-indicações específicas para este método serão definidas baseadas na população em estudo. Além disto, parâmetros celulares serão claramente estabelecidos que permitam relacionar propriamente a injeção de CMMO com o sucesso na osteonecrose femoral.
Trabalho recebido em 08/02/07
aprovado em 19/09/07
Trabalho realizado no Departamento de Cirurgia, Hospital Universitário Professor Edgard Santos, Universidade Federal da Bahia
- 1. Adorno EV, Couto FD, Moura Neto JP, Menezes JF, Rego M, Reis MG, et al. Hemoglobinopathies in newborns from Salvador, Bahia, Northeast Brazil. Cad Saude Publica. 2005; 21:292-8.
- 2. Hernigou P, Galacteros F, Bachir D, Goutallier D. Deformities of the hip in adults who have sickle cell disease and had avascular necrosis in childhood. J Bone Joint Surg Am.1991; 73:8192.
- 3. Acurio MT, Friedman RJ. Hip arthroplasty in patients with sickle-cell haemoglobinopathy. J Bone Joint Surg Br. 1992; 74:367-71.
- 4. Hernigou P, Habibi A, Bachir D, Galacteros F. The natural history of asymptomatic osteonecrosis of the femoral head in adults with sickle cell disease. J Bone Joint Surg Am. 2006; 88:2565-72.
- 5. Al-Mousawi F, Malki A, Al-Aradi A, Al-Bagali M, Al-Sadadi A, Booz MM. Total hip replacement in sickle cell disease. Int Orthop. 2002; 26:157-61.
- 6. Srivastava D, Ivey KN. Potential of stem-cell-based therapies for heart disease. Nature. 2006; 441:1097-9.
- 7. Gangji V, Hauzeur JP, Matos C, De Maertelaer V, Toungouz M, Lambermont M. Treatment of osteonecrosis of the femoral head with implantation of autologous bone-marrow cells. J Bone Joint Surg Am. 2004; 86:1153-60.
- 8. Hernigou P, Beaujean F. Treatment of osteonecrosis with autologous bone marrow grafting. Clin Orthop Relat Res. 2002; (405):14-23.
- 9. Steinberg MH, Adewoye AH. Modifier genes and sickle cell anemia. Curr Opin Hematol. 2006; 13:131-6.
- 10. Ficat P, Arlet J. [Pre-radiologic stage of femur head osteonecrosis: diagnostic and therapeutic ossibilities]. Rv Chir Orthop Reparatrice Appar Mot. 1973; 59:(Suppl 1):26-38.
- 11. Steinberg ME, Hayken GD, Steinberg DR. A quantitative system for staging avascular necrosis. J Bone Joint Surg Br. 1995; 77:34-41.
- 12. Harris WH. Traumatic arthritis of the hip after deslocation and acetabular fractures: treatment by mold arthroplasty. J Bone Joint Surg Am. 1969; 51: 737-55.
- 13. Lyra IM, Goncalves MS, Braga JA, Gesteira Mde F, Carvalho MH, Saad ST, et al. Clinical, hematological, and molecular characterization of sickle cell anemia pediatric patients from two different cities in Brazil. Cad Saude Publica. 2005; 21:1287-90.
- 14. Tateishi-Yuyama E, Matsubara H, Murohara T, Ikeda U, Shintani S, Masaki H, et al. Therapeutic Angiogenesis Using Cell Transplantation (TACT) Study Investigators. Therapeutic angiogenesis for patients with limb ischaemia by autologous transplantation of bone-marrow cells: a pilot study and a randomised controlled trial. Lancet. 2002; 360:427-35.
- 15. Neumayr LD, Aguilar C, Earles AN, Jergesen HE, Haberkern CM, Kammen BF, et al. Physical therapy alone compared with core decompression and physical therapy for femoral head osteonecrosis in sickle cell disease. Results of a multicenter study at a mean of three years after treatment. J Bone Joint Surg Am. 2006; 88:2573-82.
- 16. Mukisi-Mukaza M, Elbaz A, Samuel-Leborgne Y, Keclard L, Le Turdu-Chicot C, Christophe-Duchange E, et al. Prevalence, clinical features, and risk factors of osteonecrosis of the femoral head among adults with sickle cell disease. Orthopedics. 2000; 23:357-63.
- 17. Acurio MT, Friedman RJ. Hip arthroplasty in patients with sickle-cell haemoglobinopathy. J Bone Joint Surg Br. 1992; 74:367-71.
- 18. Davis ET, McKee MD, Waddell JP, Hupel T, Schemitsch EH. Total hip arthroplasty following failure of free vascularized fibular graft. J Bone Joint Surg Am. 2006; 88(Suppl 3):110-5.
- 19. Cheng EY, Thongtrangan I, Laorr A, Saleh KJ. Spontaneous resolution of osteonecrosis of the femoral head. J Bone Joint Surg Am. 2004; 86:2594-9.
- 20. Hernigou P, Poignard A, Beaujean F, Rouard H.Percutaneous autologous bone-marrow grafting for nonunions. Influence of the number and concentration of progenitor cells. J Bone Joint Surg Am. 2005; 87:1430-7.
Datas de Publicação
-
Publicação nesta coleção
05 Maio 2008 -
Data do Fascículo
2008
Histórico
-
Aceito
19 Set 2007 -
Recebido
08 Fev 2007