Resumos
Objetivou-se avaliar procedimentos de manipulação visando o controle de perdas de β-caroteno e licopeno em couve e tomate preparados em uma Unidade de Alimentação e Nutrição (UAN) hospitalar. Os critérios adotados não utilizados previamente pela UAN foram: armazenamento por 24 h sob refrigeração (10°C), sanitização por 15 min e distribuição logo após o preparo. As hortaliças foram coletadas após a recepção e depois de cada etapa de manipulação. A análise foi realizada por cromatografia líquida de alta eficiência (CLAE), usando como fase móvel metanol, acetato de etila e acetonitrila (50:40:10). A ANOVA (α = 0,05) foi utilizada para detecção de diferenças significativas. Não foram encontradas diferenças significativas quanto ao conteúdo dos componentes entre as etapas de manipulação, mas houve redução importante das taxas de retenção. Para β-caroteno em couve, verificou-se retenção de 68,2% após 60 minutos de exposição para consumo, enquanto em tomate, 91,96% do conteúdo desse composto foi preservado após 120 minutos de espera até a distribuição. Não foi observada redução importante na taxa de retenção de licopeno. Os procedimentos avaliados na UAN hospitalar contribuíram para controlar as perdas de carotenóides nas hortaliças, pois sua retenção foi elevada, sendo sugerida sua adoção em outras UAN.
Beta-caroteno; Licopeno; Couve; Tomate; CLAE; UAN hospitalar
The aim of this study was to assess the handling procedures of kale and tomatoes in a hospital foodservice (HFS) in order to control loss of β-carotene and licopene. The adopted measures, up to then not used by the HFS, were: 24-h storage under refrigeration (10°C), hygienizing for 15 min and distribution immediately after preparation. Vegetable samples were collected after reception and after each stage of manipulation in the HFS. The samples were analyzed using high performance liquid chromatography (HPLC) with a mobile phase of methanol, ethyl acetate and acetonitrile (50:40:10). ANOVA (α = 0.05) was used to detect significant differences. No significant differences in the content of the components were found between the different stages of manipulation but there was an important decrease in the retention rates. In kale a retention rate of 68.2% for β-carotene was verified 60 minutes after preparation whereas in tomatoes 91.96% of this compound were preserved for 120 minutes after preparation. No important decrease was observed in the retention of licopene. The high retention rates showed that the evaluated procedures contributed to control the loss of carentoids in vegetables and therefore these measures should be adopted in other HFS.
Beta-carotene; Licopene; Kale; Tomato; HPLC; Hospital foodservice
OPINIÃO OPINION
Controle de perdas de carotenóides em hortaliças preparadas em unidade de alimentação e nutrição hospitalar
Control of carotenoid loss in vegetables prepared in a hospital foodservice
Ceres Mattos Della LuciaI; Flávia Milagres CamposII; Gardênia Márcia Silva Campos MataI; Helena Maria Pinheiro Sant'AnaI
IUniversidade Federal de Viçosa. Av. Peter Henry Rolfs, s/n, Campus Universitário. 36570-000 Viçosa MG. ceresnut@yahoo.com.br
IIUNI-BH
RESUMO
Objetivou-se avaliar procedimentos de manipulação visando o controle de perdas de β-caroteno e licopeno em couve e tomate preparados em uma Unidade de Alimentação e Nutrição (UAN) hospitalar. Os critérios adotados não utilizados previamente pela UAN foram: armazenamento por 24 h sob refrigeração (10°C), sanitização por 15 min e distribuição logo após o preparo. As hortaliças foram coletadas após a recepção e depois de cada etapa de manipulação. A análise foi realizada por cromatografia líquida de alta eficiência (CLAE), usando como fase móvel metanol, acetato de etila e acetonitrila (50:40:10). A ANOVA (α = 0,05) foi utilizada para detecção de diferenças significativas. Não foram encontradas diferenças significativas quanto ao conteúdo dos componentes entre as etapas de manipulação, mas houve redução importante das taxas de retenção. Para β-caroteno em couve, verificou-se retenção de 68,2% após 60 minutos de exposição para consumo, enquanto em tomate, 91,96% do conteúdo desse composto foi preservado após 120 minutos de espera até a distribuição. Não foi observada redução importante na taxa de retenção de licopeno. Os procedimentos avaliados na UAN hospitalar contribuíram para controlar as perdas de carotenóides nas hortaliças, pois sua retenção foi elevada, sendo sugerida sua adoção em outras UAN.
Palavras-chave: Beta-caroteno, Licopeno, Couve, Tomate, CLAE, UAN hospitalar
ABSTRACT
The aim of this study was to assess the handling procedures of kale and tomatoes in a hospital foodservice (HFS) in order to control loss of β-carotene and licopene. The adopted measures, up to then not used by the HFS, were: 24-h storage under refrigeration (10°C), hygienizing for 15 min and distribution immediately after preparation. Vegetable samples were collected after reception and after each stage of manipulation in the HFS. The samples were analyzed using high performance liquid chromatography (HPLC) with a mobile phase of methanol, ethyl acetate and acetonitrile (50:40:10). ANOVA (α = 0.05) was used to detect significant differences. No significant differences in the content of the components were found between the different stages of manipulation but there was an important decrease in the retention rates. In kale a retention rate of 68.2% for β-carotene was verified 60 minutes after preparation whereas in tomatoes 91.96% of this compound were preserved for 120 minutes after preparation. No important decrease was observed in the retention of licopene. The high retention rates showed that the evaluated procedures contributed to control the loss of carentoids in vegetables and therefore these measures should be adopted in other HFS.
Key words: Beta-carotene, Licopene, Kale, Tomato, HPLC, Hospital foodservice
Introdução
Os carotenóides são o grupo mais disseminado de pigmentos na natureza, com mais de seiscentas estruturas químicas já caracterizadas1; entretanto, apenas cerca de cinqüenta deles possuem atividade biológica2. Esses compostos vêm despertando grande interesse em virtude de sua importância na prevenção de determinados tipos de câncer (como câncer de pulmão, mama, cavidade oral, cólon e reto), de doenças cardiovasculares e catarata, na ação inibidora nas mucosas contra úlceras gástricas e na atuação sobre o sistema imunológico.
O licopeno, um carotenóide com importante função fisiológica, é responsável pela coloração vermelho-alaranjada de frutas e hortaliças nas quais está presente. Esse carotenóide não tem atividade de provitamina A, mas tem um efeito protetor direto contra radicais livres, sendo considerado um potente antioxidante protetor da camada celular por reação com os radicais peróxidos e com o oxigênio molecular, principalmente3. O β-caroteno, por sua vez, além de possuir atividade provitamina A, apresenta propriedades antioxidantes, protegendo o corpo contra certas doenças, retardando o envelhecimento, além de ser utilizado como corante natural para produtos alimentícios2.
A deficiência de vitamina A (DVA) é considerada um problema grave em mais de sessenta países. Em todo o mundo, estima-se que cerca de 4,4 milhões de pré-escolares sofram com os sinais clínicos da carência de vitamina A e que 127 milhões apresentem a deficiência na forma subclínica. Mesmo os inquéritos nacionais sendo escassos, no Brasil, a prevalência de DVA está estimada entre 16 e 74% em crianças menores de seis anos4. Os inquéritos bioquímicos disponíveis no Brasil confirmam que a DVA é um problema de saúde pública nos estados de São Paulo, Minas Gerais, Pernambuco, Paraíba, Bahia e Amazonas5.
Dada a dificuldade de consumo dos produtos de origem animal devido ao seu custo mais elevado, as hortaliças e frutas contribuem com quantidades expressivas de provitaminas A para suprir a necessidade diária da vitamina. Hortaliças, como couve e tomate, podem ser produzidas praticamente durante todo o ano e sua aquisição é acessível para a maior parte da população. A couve (Brassica oleracea) destaca-se entre as hortaliças folhosas ricas em carotenóides devido a sua facilidade de produção e consumo em boa parte do território nacional6.
No Brasil, o tomate (Lycopersicom esculentum) é um dos alimentos mais consumidos, seja cru ou processado, por indivíduos de todas as classes sociais. Embora não seja considerado uma fonte rica de compostos pró-vitamina A, o tomate e seus produtos merecem atenção em termos de valor de vitamina A devido à facilidade de ser encontrado e de seus preços acessíveis. Por outro lado, é uma excelente fonte de licopeno. Uma vez que outros efeitos benéficos atribuídos aos carotenóides, tais como a prevenção do câncer e melhora da atividade imunológica, não são restritos aos precursores de vitamina A, todos os alimentos ricos em carotenóides, como o tomate, devem ser considerados6.
Devido à alta capacidade de oxidação dos carotenóides, o valor nutricional desses alimentos pode ser reduzido durante as diversas etapas a que são submetidos desde a colheita até a ingestão pelo consumidor7. É de suma importância prever tais perdas e estabelecer medidas preventivas e critérios que possam ser adotados para minimizar o prejuízo nutricional tanto em domicílio, quanto em serviços de alimentação de coletividades.
Assim como os demais riscos que comprometem a qualidade dos alimentos, a perda do valor nutricional está relacionada à saúde dos consumidores e não é menos importante que as demais, embora suas conseqüências, potencialmente, só serão percebidas em médio e longo prazo. A utilização de boas práticas de manipulação no controle de perdas do valor nutricional pode ser de grande utilidade em Unidades de Alimentação e Nutrição (UAN). No entanto, é necessário estabelecer quais medidas podem ser tomadas para controlar a perda de vitaminas, sem ferir os critérios já estabelecidos para garantir a qualidade microbiológica6.
O propósito desse estudo foi avaliar procedimentos de manipulação, visando à validação de critérios relativos a medidas preventivas para o controle de perdas de carotenóides em hortaliças preparadas em uma UAN hospitalar, por meio da avaliação do conteúdo desses nutrientes após condições padronizadas de estocagem, preparo e distribuição.
Material e métodos
Material
Foram utilizados couve (Brassica oleracea, var. manteiga) e tomate (Lycopersicom esculentum, var. santa cruz) coletados em uma UAN hospitalar. As amostras de couve e tomate foram transportadas até o Laboratório de Análise de Vitaminas da Universidade Federal de Viçosa, embaladas em sacos plásticos, acondicionadas em isopor com gelo.
Reagentes e outros materiais
Para preparo das amostras, utilizou-se reagentes com grau de pureza para análise (p.a.). Para filtração das amostras, foram usados papel de filtro livre de cinzas Inlab, tipo 50, 9 cm de diâmetro; seringas descartáveis esterilizadas de 5 mL, da Plastipack 25 x 7, parede fina 22G1; unidades filtrantes HV Millex, em polietileno, 0,45 mm de porosidade da Millipore, Brasil. Para preparação das fases móveis, foram utilizados metanol da Tedia, USA; acetonitrila da Tedia, USA e acetato de etila OmniSolv da Mallinckroat Chemicals, USA, todos grau HPLC.
Métodos
UAN colaboradora e experimentos realizados
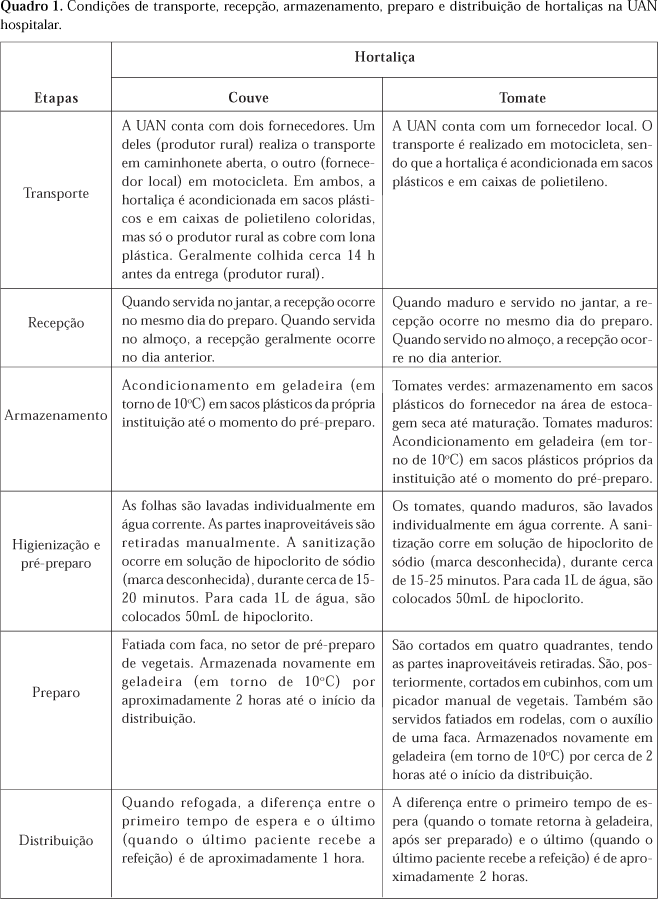
Participou do estudo uma UAN hospitalar de médio porte, situada na cidade de Viçosa, MG. A rotina de manipulação das hortaliças foi analisada e registrada através de formulários previamente estabelecidos.
Experimento 1: nesta fase, foi testado o efeito do armazenamento por 24 horas em temperatura de refrigeração (10°C), seguido da imersão em solução sanitizante por 15 minutos, sendo realizada análise do conteúdo de carotenóides após cada uma dessas etapas. Amostras representativas de cada hortaliça foram coletadas, armazenadas em sacos plásticos, identificadas e acondicionadas em isopor com gelo para o transporte até o laboratório.
Experimento 2: nesta fase, foram analisados os efeitos das condições de sanitização por 15 minutos e distribuição imediatamente após o preparo. O tomate também foi coletado 60 e 120 minutos após o preparo e a couve refogada, 30 e 60 minutos após o preparo, para verificar se os tempos reais utilizados na UAN acarretariam perdas significativamente maiores quando comparadas aos critérios utilizados. As amostras foram coletadas após cada uma das etapas descritas (coleta 1: após sanitização; coleta 2: logo após o preparo; demais coletas: após cada um dos tempos de espera). Como a freqüência de couve no cardápio era reduzida, somente a couve refogada teve suas concentrações de carotenóides avaliadas.
O grupo controle consistiu nas amostras de couve e tomate que não sofreram nenhum tipo de tratamento (armazenamento, sanitização ou preparo).
O experimento foi realizado com três repetições, em diferentes dias, sempre respeitando a freqüência das hortaliças no cardápio da UAN.
Extração e análise de carotenóides
A extração e análises das amostras foram realizadas com as luzes apagadas, tomando-se o cuidado de proteger os pigmentos da luz e do oxigênio, usando papel alumínio para cobrir as vidrarias, frascos de vidro âmbar e cortinas do tipo black-out.
O processo de extração8 realizado foi: pesaram-se cerca de 5 gramas de tomate e 3 gramas de couve; logo após, foram adicionados em torno de 70 mL de acetona resfriada à amostra, que foi triturada em microtriturador. Para as amostras de couve crua, foi utilizado um passo adicional9, que consistiu na utilização de um banho em vibrador ultrassônico, para facilitar a extração dos carotenóides, durante 20 minutos. O material foi filtrado a vácuo em funil de büchner utilizando-se papel de filtro. A extração com acetona foi repetida até o resíduo do filtro se tornar incolor. Em amostras de couve cuja preparação foi refogada, foi utilizado, com modificações, um procedimento9, que consistiu na solidificação do óleo em congelador por um período de 2 horas após a trituração. Em seguida, o filtrado foi transferido, aos poucos, para um funil de separação, onde foram adicionados 50 mL de éter de petróleo resfriado, para que ocorresse a transferência dos pigmentos da acetona para o éter. Cada fração foi lavada com água destilada três vezes, para retirar toda a acetona.
A concentração do material foi feita da seguinte maneira: acrescentou-se sulfato de sódio anidro ao éter de petróleo para retirar qualquer resíduo de água que, porventura, tivesse restado e que pudesse prejudicar a evaporação do material; a evaporação do extrato em éter de petróleo foi feita em evaporador rotativo na temperatura de 33°C; os pigmentos foram, então, redissolvidos em quantidade conhecida de éter de petróleo (balão volumétrico de 25 mL) e armazenados em frascos de vidro âmbar em congelador, até a análise dos carotenóides.
O material obtido da extração de pigmentos foi utilizado na realização das análises por cromatografia líquida de alta eficiência (CLAE). Uma alíquota (2mL) do extrato armazenado em éter de petróleo foi evaporada sob fluxo de nitrogênio e, em seguida, recuperada em quantidade conhecida de acetona. O extrato foi, então, filtrado em unidade filtrante HV Millex e injetado na coluna cromatográfica para análise. As condições cromatográficas10, com algumas modificações foram: cromatógrafo líquido de alta eficiência, Shimadzu, munido de bomba de alta pressão, modelo LC-10AT VP; injetor automático com loop de 50µL, modelo SIL-10AF; detector de arranjo de diodos UV-Visível, modelo SPD-M10A; software Multi System modelo Class VP 6.12, para controle de até 4 sistemas; coluna Phenomenex C18, 250 x 4,6 mm; 5 µm; fase móvel composta de metanol: acetato de etila: acetonitrila (50:40:10); fluxo: 1,5 mL/minuto; tempo de corrida de 9 minutos. Os cromatogramas foram lidos a 450 nm. As análises e pós-análises foram controladas por um computador acoplado ao sistema.
Preparo das curvas padrão, identificação e quantificação de carotenóides
Para construção da curva padrão de β-caroteno, após a quantificação em espectrofotômetro, foram injetados 5 e 10µL de uma solução de 5µg/mL; 20, 30 e 50µL de uma solução de 10µg/mL; 50µL de uma solução de 20µg/mL e 50µL de uma solução de 40µg/mL de β-caroteno (Sigma, USA). Para a curva padrão de licopeno, utilizou-se como padrão o pigmento extraído de tomate, separado por cromatografia de coluna aberta e quantificado por espectrofotometria. Foram injetados 15, 30 e 50µL de uma solução 7,88 mg/mL e 30 e 50 mL de uma solução 1,97 µg/ mL de licopeno.
A identificação dos componentes nas amostras de hortaliças foi feita comparando-se os tempos de retenção obtidos para os padrões e para as amostras, analisados sob as mesmas condições. Além disso, foram comparados os espectros de absorção dos padrões e dos picos de interesse nas amostras, utilizando o detector de arranjos de diodos.
A partir das curvas padrão obtidas, foi calculada a concentração dos compostos presentes nas amostras. O valor real da concentração nas amostras foi obtido pelos cálculos das diluições realizadas.
Cálculos
As porcentagens de retenção de β-caroteno e licopeno foram calculadas de acordo com a equação: 100 - [(conteúdo inicial - conteúdo final) / conteúdo inicial x 100], em que o conteúdo inicial corresponde à amostra controle (antes de qualquer manipulação) e o conteúdo final às amostras após todas as etapas de manipulação.
Para que pudessem ser realizadas comparações entre as quantidades reais de β-caroteno e licopeno na couve crua e refogada, as porcentagens de retenção real dos compostos foram calculadas de acordo com seguinte equação9:
Resultados e discussão
Procedimentos operacionais utilizados pela UAN
A partir das observações do processo de produção das hortaliças estudadas, evidenciou-se a presença de condições que provavelmente estariam contribuindo para a perda de carotenóides, como: transporte inadequado das hortaliças até a UAN; falhas durante o processo de sanitização (as hortaliças não ficavam completamente submersas na solução); manutenção das hortaliças em temperatura ambiente após o preparo; e o grande intervalo de tempo entre o preparo e a distribuição (Quadro 1).
Análises qualitativas
O perfil cromatográfico obtido para β-caroteno e licopeno mostra uma eficiente separação, indicando que a quantificação dos teores nas amostras foi realizada de forma confiável (Figura 1).
Análises quantitativas
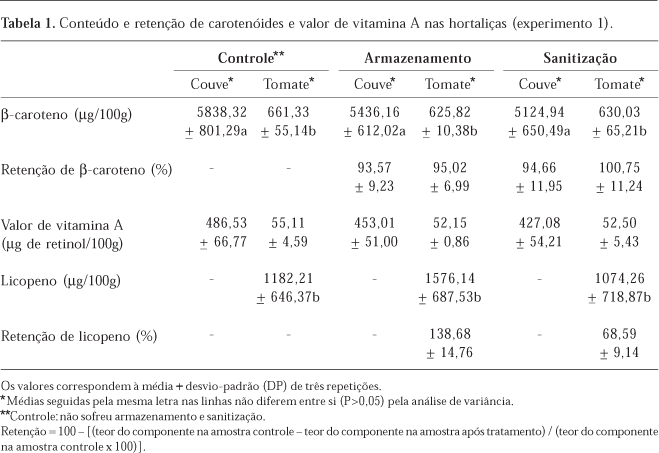
O conteúdo de β-caroteno e licopeno nas amostras relativas ao armazenamento e à sanitização (experimento 1) não apresentou diferença estatisticamente significativa em relação ao controle, em ambas as hortaliças estudadas (Tabela 1). Os valores de retenção foram elevados, o que demonstra que os critérios sugeridos para estocagem e sanitização parecem ter minimizado as perdas de β-caroteno e licopeno que poderiam estar ocorrendo com as condições operacionais utilizadas como rotina. Os teores de licopeno variaram entre 1074,26 e 1576,14 µg/100g e os de β-caroteno entre 625,82 e 661,33 µg/100g em tomate. A variação do conteúdo de carotenóides em tomates está intimamente relacionada à variedade e ao grau de maturação, já que são esses os principais pigmentos responsáveis pela alteração de cor durante o amadurecimento11. Ao testar a influência da temperatura de armazenamento e o tempo de sanitização nos teores de licopeno e β-caroteno em tomates, não foram verificadas diferenças estatisticamente significativas no conteúdo quanto ao tipo de estocagem (em temperatura ambiente ou sob refrigeração) nem quanto ao tempo de sanitização6. No presente trabalho, o armazenamento por 24 horas sob refrigeração e a imersão em solução sanitizante também não influenciaram significativamente os teores e as retenções de licopeno e β-caroteno dos tomates. Em couve, o conteúdo de β-caroteno variou entre 5124,94 e 5838,32 µg/100g, sem diferenças significativas quanto ao armazenamento e à sanitização.
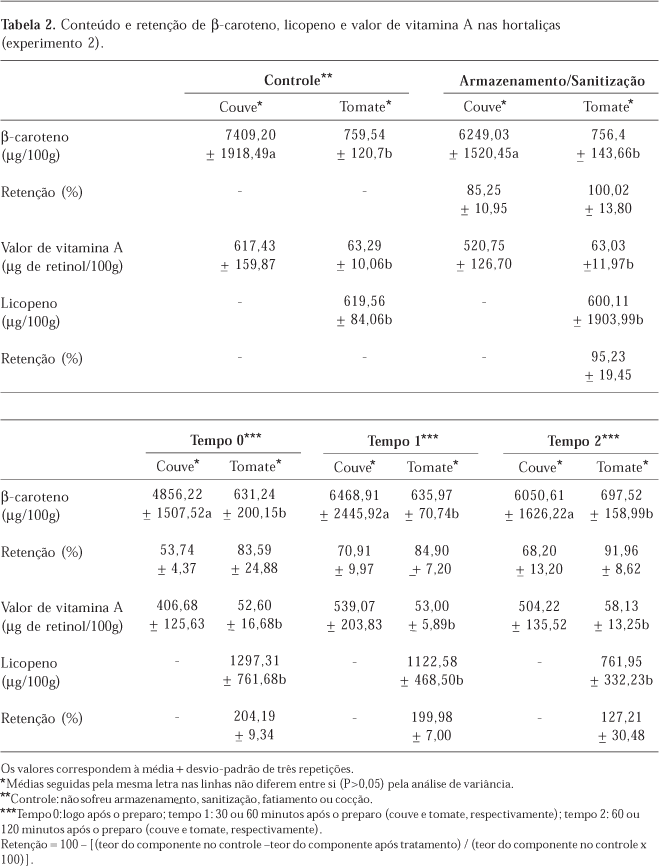
A Tabela 2 mostra os resultados obtidos para o experimento 2. Primeiramente, analisou-se o efeito do armazenamento seguido de sanitização sobre a amostra controle, que não sofreu tratamentos. Os tempos de espera até a distribuição (0, 60 e 120 minutos para o tomate e 0, 30 e 60 minutos para a couve) foram comparados à amostra obtida após armazenamento e sanitização. Os teores de licopeno variaram entre 600,11 e 1297,31 µg/100g e os de β-caroteno entre 631,24 e 759,54 µg/100g em tomate. Em couve, os conteúdos de β-caroteno variaram entre 4856,22 e 7409,20µg/100g.
Em um estudo6, observou-se que o tipo de corte e o tempo de exposição para consumo não interferiram no conteúdo de β-caroteno em tomates, não sendo possível determinar quais práticas de manipulação seriam mais indicadas para o fatiamento e a distribuição para consumo. Apesar disso, sabe-se que o aumento do tempo e da superfície de exposição ao oxigênio e a luz podem elevar as perdas de nutrientes em alimentos. Desta forma, recomenda-se principalmente reduzir o tempo entre o preparo e o consumo.
Observa-se que não houve diferença estatisticamente significativa entre os conteúdos de β-caroteno e licopeno nas hortaliças estudadas durante as diferentes etapas de manipulação, quando comparadas ao controle (Tabela 2). Ressalta-se que, mesmo durante o processo de cocção da couve, as perdas, em termos de conteúdo, não foram observadas. Entretanto, quando se analisa a retenção de β-caroteno em couve, verifica-se que apenas 68,2% de seu conteúdo inicial foi preservado após 60 minutos de exposição. Em tomate, ao contrário, as perdas foram bastante reduzidas: após 120 minutos de espera até a distribuição, 91,96% do conteúdo inicial de β-caroteno foi preservado, possivelmente devido ao fato de a casca do tomate ter exercido efeito protetor, evitando possíveis perdas para o meio.
Nesse estudo, para as amostras de couve cuja preparação foi refogada, utilizou-se como procedimento a solidificação do óleo e sua retirada, visando à substituição da saponificação e reduzindo as chances de perdas durante a extração9. Alguns estudos10,13,14 têm realizado a saponificação em certos tipos de amostras para hidrolisar ésteres de carotenóides e remover interferentes, como clorofilas. Na maioria dos casos, a saponificação resulta em perda de carotenóides12. Para amostras com alta concentração de lipídios, a saponificação pode exigir condições mais drásticas, o que pode causar perda dos carotenóides em estudo13.
Vários autores têm descrito perdas de carotenóides, quando as amostras são submetidas a diferentes processos culinários12. Sabe-se que o tempo e a temperatura de cocção podem causar degradação dos carotenóides10.
Entretanto, ainda há divergência na literatura sobre os efeitos do cozimento sobre o teor de carotenóides de vegetais. Alguns autores mostram que o cozimento pode causar perda15, enquanto outros estudos encontraram resultados opostos, em que as perdas foram inexistentes ou houve aumento dos teores12-14. Este aumento tem sido atribuído a uma maior eficiência na extração devido ao fato do tratamento térmico inativar enzimas oxidativas e desnaturar os complexos carotenóide-proteína existente nas células vegetais14.
Alguns estudos têm mostrado que a biodisponibilidade de carotenóides em vegetais pode aumentar com o processamento16. Em revisão sobre o efeito do processamento de vegetais sobre a biodisponibilidade de carotenóides17, concluiu-se que o tratamento térmico pode aumentar a biodisponibilidade. Assim, é possível que, mesmo havendo perdas significativas após o processamento, os carotenóides que se mantêm sejam melhor absorvidos. O licopeno, por exemplo, tem sua biodisponibilidade aumentada com o processamento, devido à liberação da matriz do alimento. Com isso, molho de tomate e purê de tomate são tidos como melhores fontes biodisponíveis de licopeno do que as demais fontes de alimentos não cozidos, tais como o tomate cru4.
Utilizando o fator de conversão para β-caroteno, em que 12 µg de β-caroteno equivalem a 1 Equivalente de Atividade de Retinol (RAE)18, pode-se calcular o valor de vitamina A das hortaliças estudadas. Uma porção de 100 g de tomate analisado nesta pesquisa fornece 56 ìg de retinol, equivalentes a 9% e 11% das necessidades diárias para homens e mulheres adultos, respectivamente. Já uma porção de 100 g de couve fornece, em média, 494 µg de retinol, correspondentes a 80% das necessidades diárias de homens e 92% das necessidades diárias de mulheres18.
Conclusão
Para a manipulação de couve e tomate em UAN, recomenda-se o armazenamento em temperatura de refrigeração, imersão em solução sanitizante pelo tempo recomendado pelo fabricante (15 minutos) e distribuição imediatamente após o preparo.
Os critérios avaliados na UAN hospitalar contribuem para controlar as perdas de carotenóides nas hortaliças, uma vez que, de maneira geral, a retenção dos componentes foi elevada. Sugere-se a adoção dos critérios utilizados em outras UAN.
Colaboradores
CM Della Lucia trabalhou na pesquisa e na metodologia; FM Campos, na concepção do projeto e nas análises estatísticas; GMSC Mata, na metodologia e HM Pinheiro-Sant'Ana, na concepção do projeto, na orientação e na revisão final do artigo.
Agradecimentos
Ao PIBIC/CNPq/UFV, pelo apoio financeiro.
Artigo apresentado em 12/01/2006
Aprovado em 20/07/2007
Versão final apresentada em 28/06/2007
- 1. Fraser PD, Bramley PM. The biosynthesis and nutritional uses of carotenoids. Progress in Lipid Research 2004; 43:228-265.
- 2. Olson JA. Carotenoids. In: Shils ME, Olson JA, Shike M, Ross AC. Modern nutrition in health and disease Baltimore: Williams & Wilkins; 1999. p.525-541.
- 3. Moritz B, Tramonte VLC. Biodisponibilidade do licopeno. Rev Nutr [periódico da Internet]. 2006. [acessado 2006 Ago 11]; 19(2): [cerca de 6 páginas]. Disponível em: http://www.scielo.br/scielo.php? script=sci_arttext&pid=S1415-52732006000200013 &lng=en&nrm=iso>
- 4. West Jr KP. Extent of vitamin A deficiency among preschool children and women of reproductive age. J Nutr 2002; 132:2857-2866.
- 5. Ramalho RA, Flores H, Saunders C. Hipovitaminose A no Brasil: um problema de saúde pública. Rev. Saúde Pública 2002; 34:56-63.
- 6. Campos FM. Avaliação de práticas de manipulação de hortaliças visando a preservação de vitamina C e carotenóides [dissertação]. Viçosa (MG): Universidade Federal de Viçosa; 2006.
- 7. Bianchi MLP, Antunes LMG. Radicais livres e os principais antioxidantes da dieta. Rev Nutr 1999; 12(2):123-130.
- 8. Rodriguez DB, Raymundo LC, Lee T, Simpson KL, Chichester CO. Carotenoid pigment changes in ripening Momordica charantia fruits. Ann Botanic 1976; 40:615-624.
- 9. De Sá MC, Rodriguez-Amaya D. Optimization of HPLC quantification of carotenoids in cooked green vegetables - Comparison of analytical and calculated data. J Food Composition Anal 2004; 17:37-51.
- 10. Pinheiro-Sant'ana HM, Stringheta PC, Brandão SCC, Azeredo RMC. Carotenoid retention and vitamin A value in carrot (Daucus carota L.) prepared by food service. Food Chem 1998, 61:145-51.
- 11. Lois LM, Rodríguez-Concepción M, Gallego F, Campos N, Boronat A. Carotenoid biosynthesis during tomato fruit development: regulatory role of 1-deoxy-D-xylulose 5-phosphate synthase. The Plant J 2000; 22(6):503-513.
- 12. Granado F, Olmedilla B, Blanco I, Rojas-Hidalgo E. Carotenoid composition in raw and cooked Spanish vegetables. J Agric Food Chem 1992; 40:2135-2140.
- 13. Hart DJ, Scott KJ. Development and evaluation of an HPLC method for the analysis of carotenoids in foods, and the measurement of the carotenoid content of vegetables and fruits commonly consumed in the UK. Food Chem 1995; 54:101-111.
- 14. Lessin WJ, Catigani GL, Schwartz SJ. Quantification of cis-trans isomers of provitamin a carotenoids in fresh and processed fruits and vegetables. J Agric Food Chem 1997; 45:3728-3732.
- 15. Godoy HT, Rodriguez-Amaya DB. Occurrence of cis-isomers of provitamins A in Brazilian vegetables. J Agric Food Chem 1998; 46:3081-3086.
- 16. Rock CL. Carotenoids: biology and treatment. Pharm Ther 1997; 6(3):185-197.
- 17. Hof KHVH, Gartner C, West CE, Tijburg LBM. Potential of vegetable processing to increase the delivery of carotenoids to man. Int J Vitamin Nutr Res 1998; 68(6):366-370.
-
18Institute of Medicine. Food and Nutrition Board. Standing Committee on the Scientific Evaluation of Dietary Reference Intakes. Dietary Reference Intakes: for Vitamin A, Vitamin K, Arsenic, Boron, Cromium, Copper, Iodine, Iron, Manganese, Molybdenium, Nickel, Silicon, Vanadium and Zinc Washington: National Academy Press; 2001.
Datas de Publicação
-
Publicação nesta coleção
28 Ago 2008 -
Data do Fascículo
Out 2008
Histórico
-
Aceito
20 Jul 2007 -
Recebido
12 Jan 2006