Resumos
Avaliou-se a segurança da ivermectina (IVOMEC 1% injetável), um fármaco muito utilizado, administrado a ratas prenhes, no início da fase organogênica, em dosagem até 60 vezes superior (12mg/kg) a utilizada para o tratamento de escabiose em caninos e felinos. Os resultados revelaram ausência de toxicidade sistêmica e reprodutiva, fundamentados na ausência de alterações no desenvolvimento ponderal, consumo de água e ração, absorções embrionárias, massa relativa e exame histopatológico dos órgãos das ratas prenhes, bem como na massa corporal, vitalidade dos fetos, número de fetos por fêmea e alterações macroscópicas externas. Conclui-se pela segurança da ivermectina, quando administrada, em dose única, no início da fase de organogênese de ratas prenhes.
Ivermectina; Toxicidade
In order to evaluate the possible effect of ivermectin used on pregnant animals, Wistar rats were treated orally on sixth pregnancy day, with dosage of 20 and 60 times higher than therapeutic dosage used to treat scabiosis in dogs and cats. During all pregnant period, body weight, water and pellet food consuption of dams were determined. The dams were sacrificed at term for the evaluation of maternal and fetal parameters. The numbers of corporea lutea, post implantation loss and living and death fetuses were recorded. Also the organs of dams were removed, weighted and histopatologically examined. Fetuses were weighted, sexed, examined for external macroscopic malformations. Results showed absence of systemic and reproductive toxicity. It is concluded that ivermectin is no toxic to the dams and fetus, when administered in the beginning of organogenic period.
Ivermectin; Toxicity
Efeitos da ivermectina (Ivomec® 1% injetável) administrada a ratas Wistar durante o período de organogênese
Effects of the endectocid ivermectin (Ivomec(r) 1% injection) on pregnants females wistar rats
Vanessa Maraschin Möller; Eliane Dallegrave; Ricardo Coelho; Janaína Pereira; Augusto Langeloh
Departamento de Farmacologia do Instituto de Ciências Básicas da Saúde da Universidade Federal do Rio Grande do Sul, Porto Alegre RS
Endereço para correspondência Endereço para correspondência AUGUSTO LANGELOH Departamento de Farmacologia Instituto de Ciências Básicas da Saúde -UFRGS Avenida Bento Gonçalves, 9090 91540-000 Porto Alegre, RS e-mail: langeloh@vortex.ufrgs.br
RESUMO
Avaliou-se a segurança da ivermectina (IVOMEC 1% injetável), um fármaco muito utilizado, administrado a ratas prenhes, no início da fase organogênica, em dosagem até 60 vezes superior (12mg/kg) a utilizada para o tratamento de escabiose em caninos e felinos. Os resultados revelaram ausência de toxicidade sistêmica e reprodutiva, fundamentados na ausência de alterações no desenvolvimento ponderal, consumo de água e ração, absorções embrionárias, massa relativa e exame histopatológico dos órgãos das ratas prenhes, bem como na massa corporal, vitalidade dos fetos, número de fetos por fêmea e alterações macroscópicas externas. Conclui-se pela segurança da ivermectina, quando administrada, em dose única, no início da fase de organogênese de ratas prenhes.
Palavras-chave: Ivermectina. Toxicidade.
SUMMARY
In order to evaluate the possible effect of ivermectin used on pregnant animals, Wistar rats were treated orally on sixth pregnancy day, with dosage of 20 and 60 times higher than therapeutic dosage used to treat scabiosis in dogs and cats. During all pregnant period, body weight, water and pellet food consuption of dams were determined. The dams were sacrificed at term for the evaluation of maternal and fetal parameters. The numbers of corporea lutea, post implantation loss and living and death fetuses were recorded. Also the organs of dams were removed, weighted and histopatologically examined. Fetuses were weighted, sexed, examined for external macroscopic malformations. Results showed absence of systemic and reproductive toxicity. It is concluded that ivermectin is no toxic to the dams and fetus, when administered in the beginning of organogenic period.
Key-words: Ivermectin. Toxicity.
Introdução
Avermectinas e milbemicinas são lactonas macrocíclicas usadas em ruminantes, eqüínos, suínos e em caninos, para o controle de endo e ectoparasitas1. Apresentam ação inibidora do GABA, promovendo hiperpolarização do neurônio e, conseqüentemente, inibindo a transmissão nervosa2. Segundo Andrade3, estudos recentes sugerem que o fármaco interfere principalmente na inibição da absorção de nutrientes em nematódeos. Nas dosagens recomendadas (0,2mg/kg, SC, em ruminantes e eqüinos; 0,3mg/kg, SC, em suínos e 0,006 0,012mg/kg, VO, em caninos), apresentam uma considerável margem de segurança4. Na clínica de pequenos animais, a ivermectina está sendo usada para o tratamento da sarna sarcóptica, demodécica, notoédrica e otodécica de cães e gatos em dosagens bem acima da recomendada para estas espécies e por longos períodos, sem aprovação do seu uso pelo FDA. Segundo Willense5, a demodicose de cães e gatos pode ser efetivamente tratada com ivermectina na dose de 0,4 -0,6mg/kg/dia, via oral, por alguns meses. Contra a escabiose, conforme o mesmo autor, a ivermectina é empregada na dose 0,2mg/kg, via subcutânea, a intervalos de 7 a 10 dias.
Campbell e Benz (1984) apud Roberson6 afirmaram que a ivermectina é segura para uso em animais reprodutores e gestantes, mas Ayres e Almeida4 observaram efeitos teratogênicos, em doses superiores a recomendada em roedores. Considerando o tratamento para escabiose, demodicose, sarna notoédrica e otodécica de longa duração em animais de estimação, bem como o longo período residual deste fármaco e a necessidade de administração, muitas vezes, durante a prenhez, o objetivo do trabalho foi avaliar a segurança da ivermectina, administrada no início da organogênese em ratas prenhes (o modelo experimental aceito internacionalmente).
Material e Método
Animais
Foram utilizadas 30 ratas Wistar do biotério da UFRGS com 120-140 dias de idade mantidas em ambiente com ciclo claro/escuro de 12 horas, temperatura de 22ºC ± 2ºC e umidade controlada. Estes animais receberam ração comercial Nuvilab CR1 (Nuvilab® Nutrientes Ltda. Colombo PR) e água à vontade. Foram mantidas, tratadas e ao final, submetidas à eutanásia conforme normas éticas recomendáveis.
Acasalamento
No período de acasalamento, as ratas virgens foram acasaladas na proporção de 3:1, por um período de 12 horas (ciclo escuro). A constatação da cópula foi realizada no final do período escuro, mediante a presença de espermatozóides no esfregaço vaginal. Este foi considerado o primeiro dia de prenhez, e as fêmeas foram mantidas em caixas individuais até o final do experimento.
Tratamento
As fêmeas foram divididas em 3 grupos (n=10): grupo controle, grupo ivermectina 4mg/kg e 12mg/kg. Os animais tratados receberam ivermectina 1% (Ivomec® 1% solução injetável. Campinas SP. Merial), em única dose, SC, no 6º dia de prenhez (início da fase de organogênese). As fêmeas do grupo controle receberam solução fisiológica, pela mesma via e volume.
Desenvolvimento ponderal, consumo de água e ração
A massa corporal das fêmeas foi medida diariamente durante todo o período de prenhez. O consumo de água e ração foi mensurado a cada 3 dias até o final da prenhez, sendo este relacionado com a massa corporal média dos 3 dias e calculado a percentagem, de acordo com a fórmula: consumo% = (consumo de 3 dias/massa corporal média dos 3 dias) x 100.
Eutanásia
As fêmeas foram anestesiadas com tiopental sódico (35mg/kg, via intraperitoneal) no 21º dia de prenhez. O abdômen foi incisado, o útero exposto, dissecado e removido juntamente com os ovários. A massa uterina foi mensurada, seguida de incisão longitudinal com exposição dos fetos. A massa das demais vísceras, como cérebro, pulmão, coração, rins, fígado e baço, também foram avaliadas e encaminhadas para histopatologia em formol a 10,00%. Nos ovários, contou-se o número de corpos lúteos e, no útero, o número de implantes uterinos. As perdas embrionárias foram calculadas conforme as seguintes fórmulas7:
a) Perdas pré-implantação:
b) Perdas pré-implantação:
Fetos
Os fetos foram removidos do útero, identificados individualmente, verificado o sexo, avaliada a vitalidade e as alterações macroscópicas externas.
Histopatologia
Os órgãos das fêmeas foram fixados em formol a 10,00% e, após alguns dias, removidos e incluídos em parafina, com posterior corte dos blocos e preparação das lâminas para coloração de hematoxilina/eosina, e examinados no microscópico.
Análise estatística
Os resultados foram submetidos ao teste de análise de variância de medida repetida e de uma via (ANOVA) e qui-quadrado. As variáveis quantitativas foram comparadas por meio da análise de variância, e as qualitativas foram comparadas por meio do teste qui-quadrado. O nível de significância foi estabelecido para uma confiança de 95,00%.
Resultados
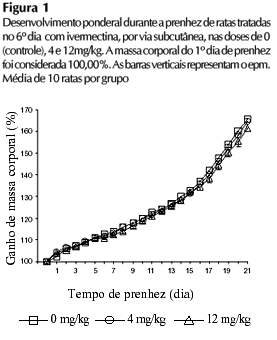
O tratamento com ivermectina nas doses de 4 e 12mg/kg, no 6º dia de prenhez não afetou significantemente (F(2, 27)=0,24, P=0,78, ANOVA de medida repetida) o ganho relativo de massa corporal (Figura 1), nem o consumo de água (F(2, 27)=0,81, P=0,45, ANOVA de medida repetida) e ração (F(2, 27)=0,14, P=0,86, ANOVA de medida repetida) com relação à massa corporal das fêmeas durante a prenhez (Figura 2).
A Tabela 1 apresenta os índices reprodutivos de ratas tratadas, SC, com ivermectina nas doses de 4mg/kg e 12mg/kg, no 6º dia de prenhez. Com relação à massa corporal dos fetos por ninhada (F(2,27)=0,61, P=0,57), número de corpos lúteos (F(2,27)=0,25, P=0,77), número de sítios de implantação (F(2,27)=0,08, P=0,91) e número médio de fetos/fêmea (F(2,27)=0,02, P=0,97), não houve diferenças significantes entre os grupos tratados e o controle.
A massa relativa de órgãos das ratas tratadas, por via subcutânea, com ivermectina nas doses de 4mg/kg e 12mg/kg, no 6º dia de prenhez não demonstrou diferença significante entre os grupos (Tabela 2). A análise de variância de única via dos respectivos órgãos revelou: cérebro (F(2,27)=2,63, P=0,08), pulmões (F(2,27)=0,46, P =0,63), coração (F(2,27)=1,58, P=0,22), fígado (F(2,27)=0,03, P =0,96), rim esquerdo (F(2,27)=0,26, P=0,76), rim direito (F(2,27)=0,78, P =0,46) e útero (F(2,27)=0,02, P =0,97).
Os órgãos não apresentaram alterações anátomo ou histopatológicas, com exceção dos pulmões de algumas ratas tratadas e algumas do grupo controle que apresentaram discreta congestão pulmonar.
A Tabela 3 apresenta variáveis relacionadas aos fetos provenientes de ratas tratadas, por via subcutânea, com ivermectina nas doses de 4 e 12mg/kg, no 6º dia de prenhez, mediante a realização de cesariana. Verifica-se que não houve diferenças significativas entre os grupos. Não foram observadas alterações macroscópicas externas nos fetos dos grupos avaliados.
Discussão
Os resultados obtidos revelaram que a ivermectina aplicada por via subcutânea no 6º dia de prenhez nas doses de 4mg/kg e 12mg/kg foi um fármaco seguro para a utilização durante a fase organogênica da prenhez em ratas Wistar. Em estudos feitos com cães e animais de laboratório, observou-se que doses elevadas de ivermectina (camundongos: 0,4mg/kg/dia, coelhos: 3mg/kg/dia e ratos: 10mg/kg/dia) provocam palato fendido, em baixa freqüência nos ratos, coelhos e camundongos. Já casos de membros anteriores deformados, foram observados somente em fetos de coelhos. Em ratos, os efeitos de toxicidade materna e teratogênica apareceram com 10mg/kg/dia8. Neste trabalho, usou-se a droga com dose superior a de 10mg/kg, sem provocar malformações externas nos fetos, com a diferença de ser aplicação única no 6º dia de prenhez, período que inicia a fase de organogênese, considerando que a ivermectina permanece por longo período no organismo. O longo efeito residual dispensa, segundo a literatura consultada, doses repetidas em intervalos curtos, encontrando-se resíduos no fígado e gordura de bovinos até o 28º dia após a aplicação4.
Com relação à toxicidade materna, a ivermectina mostrou-se segura na dose de 4mg/kg assim como na de 12mg/kg, as quais correspondem respectivamente a 20 e 60 vezes a dosagem utilizada em cães e gatos no combate à escabiose, segundo Willense5. O desenvolvimento ponderal, o consumo de água e de ração das fêmeas prenhes não foram afetados nas dosagens utilizadas neste experimento. Os fígados das ratas tratadas não apresentaram alterações histopatológicas, nem hepatomegalia estatisticamente significativas, ainda que os resíduos maiores se concentram nesse órgão e na gordura corporal9. Nesse sentido, as informações são conflitantes, pois Ayres e Almeida4 relataram que as altas concentrações de ivermectina encontram-se na pele e pulmões. Em nosso ensaio, as ratas não apresentaram sinais de distúrbios neurológicos, embora em outras espécies, como nos cães, que receberam doses de 2,5; 5 e 10mg/kg, via oral, observou-se êmese, salivação, midríase, ausência de reflexo pupilar, tremores, ataxia e sedação8.
Com relação à toxicidade fetal, Poul10 administrou a dose de 1, 2 e 4mg/kg do 6º ao 20º dia de prenhez, e do 2º ao 20º dia de lactação, observando 100,00% de mortalidade nos filhotes. O experimento com a dose de 4mg/kg, administrada somente na prenhez, a mesma usada no presente trabalho, provocou 22,00% de mortalidade e afetou o comportamento dos filhotes; portanto, existem dúvidas com relação a via de intoxicação uterina ou leite materno. Lankas, Minsker e Robertson11, descobriram que doses de 0,4mg/kg/dia de ivermectina, administradas por via oral, às ratas prenhes e lactantes provocaram toxicidade em neonatos, devido a concentração no leite ser 3 a 4 vezes superior a do plasma. Os dados do presente trabalho são compatíveis, de certa forma, com os encontrados por Lankas, Minsker e Robertson11, já que doses elevadas de ivermectina como 4mg/kg e 12mg/kg não provocaram malformações externas e mortalidade pré-natal, e segundo este autor, a toxicidade ocorre no período pós-parto, por via leite materno. Com relação aos dados de mortalidade fetal, encontrados por Poul10, a discordância de resultados justifica-se pelo fato de tratar as ratas com 4mg/kg diariamente durante a prenhez. Em dosagem única, como neste experimento, não houve mortalidade nesta dose de ivermectina e nem numa dose 3 vezes maior (12mg/kg).
Conclui-se que a ivermectina, não induziu toxicidade sistêmica, reprodutiva e nem malformações externas nos fetos, em dosagens até 60 vezes superior a terapêutica preconizada contra escabiose, quando administrado, por via subcutânea em aplicação única, no 6º dia de prenhez em ratas.
Recebido para publicação: 10/06/2002
Aprovado para publicação: 03/06/2003
-
1- LYNN, R. C. Antiparasitic drugs. In: BOWMAN, D. D. Parasitology for veterinarians. 7. ed. Philadelphia: W. B. Saunders, 1999. p. 235-274.
-
2- SARTOR, I. F.; BICUDO, P. L. Agentes empregados no controle de ectoparasitos. In: SPINOSA, H. S.; GORNIAK, S. L.; BERNARDI, M. M. Farmacologia aplicada à veterinária. 2.ed. Rio de Janeiro: Guanabara Koogan, 1999. p. 489.
-
3- ANDRADE, S. F. Manual de terapêutica veterinária. 2. ed. São Paulo: Roca, 2002. p. 469-470; p. 528.
-
4- AYRES, M. C. C.; DE ALMEIDA, M. A. O. Agentes antinematódeos. In: SPINOSA, H. S., GORNIAK, S. L. e BERNARDI, M. M. Farmacologia aplicada à veterinária. 2. ed. Rio de Janeiro: Guanabara Koogan, 1999. p. 460-463.
-
5- WILLENSE, T. Dermatologia clínica de cães e gatos. 2. ed. São Paulo: Manole, 1998. p. 29-33.
-
6- ROBERSON, E. L. Drogas usadas contra nematódeos. In: BOOTH, N. H.; McDONALD, L. E. Farmacologia e terapêutica em veterinária. 6. ed. Rio de Janeiro: Guanabara Koogan, 1992. p. 740-741.
-
7- LEMONICA, I. P.; DAMASCENO, D. C.; DI-STASI, L. C. Study of embriotoxic effects of an extract of rosemary (Rosamarinus officinalis L.) Braz. J. Med. Biol. Res v. 29, p. 223-227, 1996.
-
8- ANIMAL SAFETY. NADA 138-412 New Jersey: Merck Sharp & Dohme Research Laboratories. Disponível em: <http://www.verity.fda.gov.>. Acesso em: 18 maio 2001.
-
9- SUTHERLAND, I. H.; CAMPBELL, W. C. Development, pharmacokinetics and mode of action of ivermectin. Acta Leiden, v. 59, n. 1-2. p. 161-168, 1990.
-
10- POUL, J. M. Effects of perinatal ivermectin exposure on behavioral development of rats. Neurotoxicology Teratology, v. 10, n. 3, p. 267-272, 1988.
-
11- LANKAS, G. R.; MINSKER D. H.; ROBERTSON, R. T. Effects of ivermectin on reproduction and neonatal toxicity in rats. Food Chem. Toxicol, v. 27, n. 8, p. 523-529, 1989.
Datas de Publicação
-
Publicação nesta coleção
06 Maio 2004 -
Data do Fascículo
2003
Histórico
-
Aceito
03 Jun 2003 -
Recebido
10 Jun 2002