Resumos
Extratos aquosos da planta medicinal Achillea millefolium contêm macromoléculas de interesse para desenvolver fitodefensivos para a agricultura. Duas frações de mil folhas foram obtidas por ultrafiltração, E1 (contendo moléculas maiores que 30 kDa), e E3 (peptídeos entre 1 e 10 kDa) que inibiram o crescimento das bactérias fitopatogênicas Ralstonia solanacearum, gram-negativa, e Clavibacter michiganensis subsp. michiganensis, gram-positiva, com dependência de concentração. Os valores de concentração inibitória mínima (CIM) para ambos os extratos e bactérias foram baixos, entre 20 e 80µM. A CIM relativa à proteína total evidenciou a presença de macromoléculas muito ativas em E3, embora com baixa concentração proteica. E3 se aplica à prospecção de peptídeos antimicrobianos. Estimar a CIM relativa à quantidade de amostra vegetal valorizou o potencial antimicrobiano natural de E1, que contém alta concentração proteica. E1e E3 se aplicam ao desenvolvimento de fitodefensivos para uso biotecnológico. A ultrafiltração fracionou as amostras de forma nativa, rápida, e com baixo custo; além de dessalinizar, clarificar, purificar, e concentrar E1 e E3. Esse estudo inédito sobre a separômica e a ação antimicrobiana de extratos macromoleculares aquosos de mil folhas sugere que plantas cicatrizantes podem apresentar grande potencial para desenvolver fitodefensivos agrícolas naturais não danosos, à semelhança de medicamentos fitoterápicos.
Macromoléculas de defesa; peptídeos antimicrobianos; Ralstonia solanacearum; Clavibacter michiganensis subsp. michiganensis; concentração inibitória mínima relativa
Aqueous extracts from the medicinal plant Achillea millefolium contain macromolecules of interest to develop agrochemicals for agriculture. Two fractions of "mil folhas" were obtained by ultrafiltration, E1 (containing molecules larger than 30 kDa) and E3 (peptides between 1 and 10 kDa), which inhibited the growth of phytopathogenic bacteria Ralstonia solanacearum, gram-negative, and Clavibacter michiganensis subsp. michiganensis, gram-positive, concentration-dependent. The values of minimum inhibitory concentration (MIC) for both extracts and both bacteria were low, ranging from 20 to 80µM. The MIC relative to total protein evidenced the presence of very active macromolecules in E3, although showing low protein concentration. E3 applies to the prospection of antimicrobial peptides. The estimated MIC relative to the amount of plant sample valued the natural antimicrobial potential of E1, which contains high protein concentration. E1 and E3 can be used in the development of agrochemicals for biotechnological purposes. The ultrafiltration procedure fractionated the samples in a rapid and native way and at a low cost; it also desalted, clarified, concentrated and purified both E1 and E3. This pioneering study on the separomics and on the antimicrobial activity of macromolecular aqueous extracts from "mil folhas" suggests that healing plants have great potential to develop non-harmful agricultural natural agrochemicals, similarly to the available phytotherapic drugs.
Defense macromolecules; antimicrobial peptides; Ralstonia solanacearum; Clavibacter michiganensis subsp. michiganensis; relative minimum inhibitory concentration
Fitodefensivos em plantas medicinais: macromoléculas hidrofílicas de folhas de mil folhas (Achillea millefolium L.) inibem o crescimento in vitro de bactérias fitopatogênicas
Agrochemicals in medicinal plants: hydrophilic macromolecules from leaves of "mil folhas" (Achillea millefolium L.) inhibit in vitro growth of phytopathogenic bacteria
Tessarollo, N.G.I, II; Carrijo, L.C.I, II; Barbosa, M.O.I, II; Almeida, H.O.I, II; Pereira, T.H.A.I, II; Magalhães Jr., M.J.I, II; Leite, J.P.V.I; Pereira, P.R.G.III; Baracat-Pereira, M.C.I, II, * * baracat@ufv.br
IDepartamento de Bioquímica e Biologia Molecular
IIInstituto de Biotecnologia Aplicada à Agropecuária
IIIDepartamento de Fitotecnia, Universidade Federal de Viçosa, CEP: 36.570-000, Viçosa - Brasil
RESUMO
Extratos aquosos da planta medicinal Achillea millefolium contêm macromoléculas de interesse para desenvolver fitodefensivos para a agricultura. Duas frações de mil folhas foram obtidas por ultrafiltração, E1 (contendo moléculas maiores que 30 kDa), e E3 (peptídeos entre 1 e 10 kDa) que inibiram o crescimento das bactérias fitopatogênicas Ralstonia solanacearum, gram-negativa, e Clavibacter michiganensis subsp. michiganensis, gram-positiva, com dependência de concentração. Os valores de concentração inibitória mínima (CIM) para ambos os extratos e bactérias foram baixos, entre 20 e 80µM. A CIM relativa à proteína total evidenciou a presença de macromoléculas muito ativas em E3, embora com baixa concentração proteica. E3 se aplica à prospecção de peptídeos antimicrobianos. Estimar a CIM relativa à quantidade de amostra vegetal valorizou o potencial antimicrobiano natural de E1, que contém alta concentração proteica. E1e E3 se aplicam ao desenvolvimento de fitodefensivos para uso biotecnológico. A ultrafiltração fracionou as amostras de forma nativa, rápida, e com baixo custo; além de dessalinizar, clarificar, purificar, e concentrar E1 e E3. Esse estudo inédito sobre a separômica e a ação antimicrobiana de extratos macromoleculares aquosos de mil folhas sugere que plantas cicatrizantes podem apresentar grande potencial para desenvolver fitodefensivos agrícolas naturais não danosos, à semelhança de medicamentos fitoterápicos.
Palavras-chave: Macromoléculas de defesa, peptídeos antimicrobianos, Ralstonia solanacearum, Clavibacter michiganensis subsp. michiganensis, concentração inibitória mínima relativa.
ABSTRACT
Aqueous extracts from the medicinal plant Achillea millefolium contain macromolecules of interest to develop agrochemicals for agriculture. Two fractions of "mil folhas" were obtained by ultrafiltration, E1 (containing molecules larger than 30 kDa) and E3 (peptides between 1 and 10 kDa), which inhibited the growth of phytopathogenic bacteria Ralstonia solanacearum, gram-negative, and Clavibacter michiganensis subsp. michiganensis, gram-positive, concentration-dependent. The values of minimum inhibitory concentration (MIC) for both extracts and both bacteria were low, ranging from 20 to 80µM. The MIC relative to total protein evidenced the presence of very active macromolecules in E3, although showing low protein concentration. E3 applies to the prospection of antimicrobial peptides. The estimated MIC relative to the amount of plant sample valued the natural antimicrobial potential of E1, which contains high protein concentration. E1 and E3 can be used in the development of agrochemicals for biotechnological purposes. The ultrafiltration procedure fractionated the samples in a rapid and native way and at a low cost; it also desalted, clarified, concentrated and purified both E1 and E3. This pioneering study on the separomics and on the antimicrobial activity of macromolecular aqueous extracts from "mil folhas" suggests that healing plants have great potential to develop non-harmful agricultural natural agrochemicals, similarly to the available phytotherapic drugs.
Key words: Defense macromolecules, antimicrobial peptides, Ralstonia solanacearum, Clavibacter michiganensis subsp. michiganensis, relative minimum inhibitory concentration.
INTRODUÇÃO
A busca pelo controle alternativo de pragas e doenças na agricultura é estratégica para reduzir o uso de defensivos agrícolas de alta toxicidade, visando conciliar a produção de alimentos seguros e a preservação ambiental (Farooq et al., 2011). Plantas medicinais representam rica fonte de compostos naturais a serem explorados para identificar novos princípios de defesa, incluindo-se peptídeos antimicrobianos (AMPs) e compostos macromoleculares (García-Olmedo et al., 2001; Belting & Wittrup, 2009). Apesar do amplo uso em humanos e da aceitação popular e técnica (Franco & Fontana, 2006; Plantamed, 2010), as plantas medicinais são pouco exploradas para identificar defensivos de plantas.
Achillea millefolium L. (Asteraceae), popularmente conhecida no Brasil como "mil folhas" ou "milfólio", é uma planta medicinal utilizada mundialmente há mais de 3.000 anos, especialmente como extratos alcoólicos e óleos essenciais, pelas propriedades fitoterápicas, incluindo-se cicatrizante (Candan et al., 2003; Plantamed, 2010). Caravaca (2000) descreveu a passagem histórica da cura de feridas de batalha por folhas de mil folhas. Monografias no assunto encontram-se postadas na Farmacopéia Portuguesa (Cunha & Roque, 2009) e na British Herbal Pharmacopoeia (1996). Investigações fitoquímicas de extratos alcoólicos levaram ao isolamento de pequenos metabólitos, como lactonas, sesquiterpenos e flavonóides (Sant'Anna et al., 2009), sugerindo o controle de fitopatógenos pelos componentes do óleo essencial de mil folhas. Schwan-Estrada et al. (2000) quantificaram a produção das fitoalexinas deoxiantocianidinas em mesocótilos de sorgo, e de gliceolinas em cotilédones de soja, após tratamento com extratos de quinze plantas medicinais (incluindo-se mil folhas), e apontaram o potencial uso desses extratos no controle de fitopatógenos e na indução de resistência das plantas contra doenças.
Não foram, entretanto, localizados estudos sobre macromoléculas antimicrobianas do extrato aquoso, como peptídeos e proteínas, envolvidas nas atividades de mil folhas, ou avaliações funcionais e estruturais dos constituintes. Poucos estudos envolvem extratos aquosos de mil folhas (Frey & Meyers, 2010; Kintzios et al., 2010).
Os AMPs menores que 10 kDa são descritos como ubíquos na natureza (Zhang & Falla, 2006; Badosa et al., 2007; Montesinos, 2007). Muitos apresentam amplo espectro de ação contra bactérias gram-negativas, gram-positivas, fungos, vírus e, ou, protozoários, sendo efetivos em concentrações tão baixas quanto a milimolar (García-Olmedo et al., 2001). Podem se apresentar como agregados antimicrobianos, com ação rápida e específica sobre membranas, o que minimiza a geração de patógenos resistentes (Powers & Hancock, 2003). Em plantas, os AMPs constitutivos ou induzidos atuam como efetores da defesa (Hancock & Rozek, 2002), e são classificados dentre as proteínas "relacionadas à patogênese" (proteínas "PR"). As PR6, PR12, PR13 e PR14 correspondem, respectivamente, a inibidores de proteases (8 kDa), defensinas (5 a 7 kDa), tioninas (5 kDa) e proteínas transferidoras de lipídeos (LTPs, 7 e 9 kDa) (Sels et al., 2008). Macromoléculas proteicas também atuam na defesa como sinalizadores moleculares, ou por combinações proteicas moleculares que podem mediar o transporte ou a ação de compostos de defesa (Juliano, 2007; Belting & Wittrup, 2009). Há interesse biotecnológico nos AMPs, nas proteínas e nos agregados proteicos como agentes potenciais para o controle de fitopatógenos (Reddy et al., 2004; Aerts et al., 2008; Belting & Wittrup; 2009), especialmente contra bactérias gram-negativas, pois acometem importantes culturas, e contra as quais há poucos defensivos disponíveis.
A prospecção de macromoléculas biologicamente ativas de plantas é dificultada pela alta complexidade bioquímica dos extratos aquosos vegetais. Assim, as metodologias selecionadas para o isolamento devem favorecer a recuperação de moléculas presentes em baixas concentrações relativas. A ultrafiltração se aplica com vantagens a esse fim por ser uma técnica rápida, eficiente, não destrutiva, de baixo custo, e capaz de dessalinizar, clarificar, purificar e concentrar simultaneamente as amostras (Cheryan, 1986).
Dado o potencial biotecnológico, e visto não haver relatos que associem os peptídeos antimicrobianos e as proteínas de defesa às propriedades antibacterianas descritas para mil folhas, esse trabalho teve como objetivo obter extratos aquosos de A. millefolium enriquecidos em proteínas e peptídeos, e avaliar o potencial de inibição do crescimento de duas bactérias fitopatogênicas, uma gram-negativa e uma gram-positiva.
MATERIAL E MÉTODO
Material biológico
Folhas completamente desenvolvidas de A. millefolium L. foram coletadas em março de 2008, no horto de plantas medicinais do grupo Entre Folhas, na Universidade Federal de Viçosa (UFV), Casa 20 da Vila Gianeti, Viçosa - MG, Brasil. A identificação da espécie foi por confrontação com a exsicata no 15.648 do Herbário VIC do Departamento de Biologia Vegetal da UFV, Viçosa - MG. As folhas foram secas por quinze dias com desumidificador e trituradas (moinho Pulverisette 14, Fritsh) a 14.000 rpm. As duas bactérias fitopatogênicas-teste, Ralstonia solanacearum, gram-negativa, e Clavibacter michiganensis subsp. michiganensis, gram-positiva, foram gentilmente cedidas pelo Laboratório de Bacteriologia de Plantas e Controle Biológico do Departamento de Fitopatologia da UFV, e culturas-estoque foram preparadas em meio (LB) contendo glicerol 50% (v/v), e armazenadas a -80ºC.
Preparo e fracionamento do extrato aquoso proteico
O extrato aquoso de folhas secas de A. millefolium foi preparado conforme Teixeira et al. (2006) e Almeida et al. (2007; 2008) com modificações, na proporção 1:20 (g de folhas: mL de tampão de extração). As folhas (40g) trituradas foram maceradas em 50mM de Tris-HCl, pH 7,0, contendo inibidores de proteases (10 mM de ácido etilenodiamino tetra-acético (EDTA), 1mM de fluoreto de fenilmetilsulfonila (PMSF), 1mM de benzamidina e 2mM de tiouréia). O homogenato foi centrifugado (20.300 g, 30 min, 4ºC), o sobrenadante foi sequencialmente ultrafiltrado (Amicon Bioseparations, Millipore, USA) em membranas com limites de exclusão de 30, 10 e 1 kDa, recuperando-se as três frações retidas. Cada fração foi precipitada com sulfato de amônio entre 35% e 75% de saturação a 4ºC, respectivamente por 2 h e 16 h; cada precipitado recuperado foi ressuspendido em Tris-HCl a 25 mM, pH 7,0, dessalinizado e concentrado novamente por ultrafiltração em membrana de 1kDa, até 2 mL. As frações nomeadas E1 (com moléculas maiores que 30kDa), E2 (moléculas entre 10 e 30kDa), e E3 (peptídeos entre 1 e 10kDa) foram recuperadas e utilizadas para eletroforeses e ensaios antibacterianos. A proteína total foi determinada pelo micro-ensaio do ácido bicinconínico ajustado por nosso grupo (Teixeira et al., 2006).
Eletroforeses desnaturantes de proteínas e de peptídeos
Eletroforese desnaturante em gel de poliacrilamida (SDS-PAGE) 12%, desenvolvida a 100 V, avaliou a presença de proteínas maiores em E1. As proteínas menores (E2) e os peptídeos (E3) foram avaliados por SDS-Tricina-PAGE (Teixeira et al., 2006) em gradiente descontínuo de três fases (16,5% T, 3% C; 9,9% T, 3% C; e 5,1% T, 2,6% C). A corrida foi a 100 V por 15 min, 80 V por 20 min, e então 60 V, perfazendo 6,5 h. Cada amostra foi preparada com 10 ou 15 µL de E1, E2 ou E3, visando comparar a constituição molecular relativa dos extratos. Para a SDS-PAGE, foram utilizados 7 µg do marcador molecular Broad Range (BioRad, USA), e, para SDS-Tricina-PAGE, 7µg de Ultra Low Range (BioRad, USA). Os géis foram desenvolvidos em cuba Mini Protean III (BioRad, USA) e revelados por coomassie blue.
Ensaios de inibição do crescimento das bactérias in vitro
E1, E2 e E3 de A. millefolium foram individualmente avaliadas contra R. solanacearum e C. michiganensis subsp. michiganensis, em três concentrações para cada fração. As bactérias em culturas-estoque foram ativadas em 3mL de meio LB líquido, a 28ºC e sob agitação, até A560 1,0. Para o preparo do inóculo, as bactérias foram novamente cultivadas sob as mesmas condições. Os ensaios antimicrobianos foram realizados em triplicata para cada amostra, bactéria e concentração, em placas de 96 poços, de fundo plano, estéreis e tampadas. A cada poço da placa foram adicionados 50µL de meio LB concentrado duas vezes (2X), 10µL do inóculo bacteriano e 40µL da fração-teste (E1, E2 ou E3) com quantidades de extrato equivalentes à extração de 0,25g, 0,5g ou 1,0g de folhas secas. Para o tratamento-controle da cultura, em ausência da amostra vegetal, foi utilizado o ensaio composto por 50µL de meio LB 2X, 10µL de inóculo e 40 µL de tampão; como controle do meio, 50µL de meio LB 2X e 50µL de tampão. As culturas foram acompanhadas pelos valores de A560 a cada duas horas. Para normalização dos resultados, todas as medidas de A560 da curva de crescimento foram subtraídas da medida de A560 correspondente ao tempo zero. A inibição foi estimada pela comparação dos valores de absorvância das curvas obtidas na presença e na ausência das amostras, cerca de duas horas após alcançar a fase de maior crescimento bacteriano. A concentração inibitória mínima (CIM) foi estimada como a concentração molar da amostra (mM) suficiente para promover 100% de inibição do crescimento de cada bactéria, a partir das curvas de crescimento obtidas por quatro concentrações da amostra, em triplicata. Para os cálculos de molaridade, foram considerados valores de massas teóricas médias de 50, 20 e 5 kDa para as moléculas presentes em E1, E2 e E3, respectivamente. A CIM específica foi também estimada em relação à massa do material vegetal extraído (g de folhas secas extraídas L-1 de ensaio) ou em relação à concentração proteica das amostras (µg de proteína mL-1 de ensaio).
RESULTADO E DISCUSSÃO
Atividades antibacterianas foram detectadas nos três extratos aquosos de A. millefolium (E1, E2 e E3) contra duas bactérias fitopatogênicas, uma gram-positiva e uma gram-negativa, com dependência de concentração (Figura 1).
FIGURA 1. Atividade das frações E1 (A e D), E2 (B e E) e E3 (C e F) contra as bactérias Ralstonia solanacearum (A, B e C) e Clavibacter michiganensis subsp. michiganensis (D, E e F), avaliadas em três concentrações. As amostras corresponderam aos extratos obtidos de (•) 0,25 g, (w) 0,5 g e ( ■) 1,0 g de folhas extraídas. O controle do meio (∆) correspondeu ao cultivo na ausência da amostra e da bactéria, e o controle da cultura (▲), ao cultivo na ausência da amostra. Os valores de desvio padrão foram inferiores a 10%.
O crescimento de R. solanacearum foi totalmente inibido pela fração macromolecular E1 (contendo compostos maiores que 30 kDa), nas duas maiores concentrações avaliadas, e foi inibido em 30% pela menor concentração, para 10 h de cultivo (Figura 1A). As inibições por E2, contendo moléculas entre 10 e 30 kDa, e pela fração peptídica E3, contendo moléculas abaixo de 10 kDa, foram inferiores a 20% nas condições avaliadas (Figuras 1B e 1C). Para C. michiganensis subsp. michiganensis, em 16 h de cultivo, houve inibição por E1 de 25, 44 e 70% para as três concentrações em ordem crescente; E2 e E3 promoveram inibições inferiores a 30%. E1 e E3 foram as frações mais efetivas.
Os valores de concentração inibitória mínima (CIM), quando relativos à massa proteica (CIMPROT), de E1 e E3 de A. millefolium para R. solanacearum e C. michiganensis subsp. michiganensis, foram inferiores a 3,0 g de proteína L-1 ensaio (Figuras 2A e 2D).
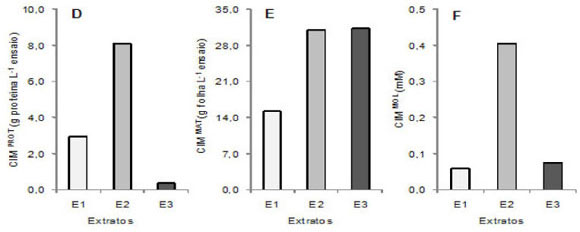
FIGURA 2. Concentração inibitória mínima relativa à proteína total (CIMPROT, A e D), à massa de folhas extraídas (CIMMAT, B e E) e à concentração molar (CIMMOL, C e F) das frações E1, E2 e E3 para Ralstonia solanacearum (A, B e C) e para Clavibacter michiganensis subsp. michiganensis (D, E e F), após 10 e 16 h de cultivo, respectivamente.
A comparação desses valores com os de CIMPROT de compostos antimicrobianos relatados é dificultada por tratar-se aqui de macromoléculas. Os valores de CIMPROT para compostos menores são comparativamente mais baixos em função do maior número de moléculas presentes em dada massa, e CIMPROT para grupos moleculares diferentes não devem ser comparados.
Os valores de CIM relativos à molaridade (CIMMOL) foram estimados entre 20 e 80 µM para E1 e E3, e para cerca de 400 µM para E2, para ambas as bactérias (Figuras 2C e 2F). Esses valores baixos de CIMMOL para E1 e E3 são resultados promissores para a prospecção de fitodefensivos macromoleculares e peptídeos de defesa, já que muitos AMPs foram descritos como efetivos em concentrações tão baixas quanto milimolar (García-Olmedo et al., 2001; Zhang & Falla, 2006).
Os valores de CIM relativa à quantidade de material vegetal extraído (CIMMAT, em g de folhas extraídas L-1 de ensaio) (Figuras 2B e 2E) permitiram evidenciar a necessidade de grande quantidade de material vegetal para obter maior atividade antibacteriana de E3.
A concentração proteica de E3, 0,24 g L-1, foi 16 e 22 vezes inferior às presentes em E1 e E2, 3,84 e 5,23 g L-1, respectivamente, indicando a presença de peptídeos muito ativos em E3 (Figuras 2C e 2F), de interesse para isolar e caracterizar AMPs. Mesmo sendo muito efetivos, esses peptídeos estavam em muito baixas concentrações em E3 e a atividade antibacteriana específica da fração foi baixa (Figuras 1C e 1F).
Assim, CIMPROT (Figuras 2A e 2D) e CIMMOL (Figuras 2C e 2F) podem ser utilizados como indicativo da eficácia antimicrobiana das moléculas contidas nos extratos, enquanto que os valores de CIMMAT evidenciam a atividade antimicrobiana total da fração (Figuras 1C e 1F). Observar que extratos proteicos concentrados são desejáveis pois, em geral, amostras proteicas diluídas são pouco estáveis bioquimicamente, e concentrar macromoléculas em solução têm alto custo. O fracionamento do extrato aquoso de mil folhas permitiu então selecionar E1 como uma fração antimicrobiana efetiva, dado o baixo valor de CIMMAT (Figuras 2B e 2E), e essa fração é composta também por molécula com alta atividade, visto os valores baixos de CIMPROT e CIMMOL (Figuras 2A, 2C, 2D e 2F). E2 não apresentou ação antimicrobiana promissora, enquanto que E3 aplica-se como fonte de peptídeos de defesa para estudos.
O potencial de E1 contra bactérias fitopatogênicas gram-positivas e gram-negativas tem alto valor biotecnológico. Novos bactericidas para uso na agricultura são dificilmente disponibilizados comercialmente, enquanto fungicidas eficazes e modernos vêm sendo ocasionalmente lançados (Lopes & Duval, 2007). Os valores de CIMPROT, CIMMOL e CIMMAT para R. solanacearum por E1 foram 2,7 vezes inferiores àqueles observados para C. michiganensis subsp. michiganensis, e muitas bactérias fitopatogências gram-negativas são de difícil controle. Há ainda interesse em AMPs presentes em E3, pois esse extrato inibiu ambas as bactérias, e apenas quatro das dez classes de AMPs de plantas inibem bactérias gram-negativas (Gartemann et al., 2003; Yao & Allen, 2007).
Diferentes macromoléculas estão presentes nos extratos após as etapas de ultrafiltração, conforme as bandas proteicas resultantes das separações eletroforéticas de E1, E2 e E3 (Figura 3). As intensidades das bandas reveladas nos géis (Figura 3) refletem as concentrações proteicas: os volumes de 10 ou 15µL separados nos géis equivaleram respectivamente a 38,4 e 57,7 µg de proteína de E1 (linhas 1 e 2); 52,3 e 78,4 µg de proteína de E2 (linhas 3 e 4) e 2,4 e 3,6 µg de proteína de E3 (linhas 5 e 6).
. Perfil de separação da fração E1 por eletroforese desnaturante em gel de poliacrilamida (SDS-PAGE) (A), e das frações E2 e E3 por SDS-Tricina-PAGE (B) do extrato aquoso de folhas de Achillea millifolium. As amostras foram: MM-BR (kDa: 7µL do marcador Broad Range (BioRad). MM-LR (kDa): 7µL do marcador Ultra Low Range (BioRad). Linhas: 10 e 15µL, respectivamente, das frações E1 (linhas 1 e 2), E2 (linhas 3 e 4) e E3 (linhas 5 e 6).
Dímeros, trímeros e outras aglomerações entre os peptídeos parecem ocorrer, dada a presença de bandas entre 15 e 27 kDa e acima de 30kDa no gel de E3 (Figura 3, linhas 5 e 6), o que corrobora nossa sugestão de aglomeração de peptídeos que não foram solubilizados durante o preparo das amostras para o gel. Bandas de E1 com MM abaixo de 30kDa (Figura 3, linhas 1 e 2) também sugerem aglomeração em E1, seja entre os próprios peptídeos, ou deles com outras macromoléculas, que são liberadas sob as condições desnaturantes do gel. A formação de associações moleculares ou aglomerações é descrita para muitos AMPs, dado o caráter parcialmente apolar, cerca de 50% de resíduos hidrofóbicos e carga de superfície positiva (García-Olmedo et al., 2001).
A ultrafiltração apresentou-se como metodologia valiosa, pois clareou os extratos de mil folhas pela eliminação de moléculas menores que 1 kDa, sob condições nativas; simplificou o conteúdo proteico, fracionou as moléculas por tamanho e enriqueceu as frações contendo peptídeos e proteínas de defesa. Equipamentos comerciais, de alto desempenho, baixo custo de aquisição e manutenção, e uso e condições não desnaturantes estão disponíveis (Cheryan, 1986). A área de estudo que envolve o preparo e fracionamento de amostras, nomeada "Separômica" (Hey et al., 2005) auxilia a prospecção de compostos de interesse biotecnológico, visto que moléculas ainda não descritas podem estar presentes em baixas concentrações celulares. As inibições observadas (Figuras 1 e 2) e os géis dos extratos (Figura 3) confirmam a efetividade dessas separações.
Todas as plantas apresentam princípios ativos múltiplos, pela presença de moléculas com diferentes valores de MM (Plantamed, 2010), e o amplo potencial dos extratos vegetais como agentes fitoterápicos é certamente resultante desse fato. Os resultados evidenciaram a possibilidade de utilização de extratos macromoleculares solúveis, especialmente E1, de A. millefolium e de outras plantas medicinais, para desenvolver fitodefensivos agrícolas, à semelhança de medicamentos fitoterápicos em uso por humanos. Proteínas simples ou associadas com peptídeos ou outras moléculas, ou associações peptídicas de altas massas moleculares podem corresponder a princípios ativos macromoleculares presentes nos extratos de A. millefolium. Juliano et al. (2001) e Belting & Wittrup (2009) relataram que a aplicação terapêutica das macromoléculas é dificultada pela limitada compreensão dos mecanismos de transporte, distribuição e estabilidade das mesmas, sendo de interesse para o estudo da veiculação e da ação dessas drogas macromoleculares nos organismos.
Empresas de biotecnologia buscam princípios ativos seguros para desenvolver produtos inovadores. Assim, visualiza-se a aplicação biotecnológica desses extratos como defensivos agrícolas naturais ou caldas fitoprotetoras, para aplicação na prevenção da contaminação de sementes, no manejo pós-colheita de frutas e de legumes, em produtos agrícolas diversos para a exportação, ou em cultivos protegidos de hortaliças, dentre outros. Há disponibilidade de material-fonte, visto que A. millefolium é uma planta medicinal para uso em humanos, de fácil cultivo e alta disponibilidade. Como extratos aquosos de mil folhas foram pouco avaliados, há certamente a necessidade de estudos sobre possível toxicidade de humanos quando da ingestão destes se adicionados a alimentos, apesar de terem origem proteica e serem originados de plantas já em amplo uso para humanos.
Assim, pode-se concluir que: 1) A detecção de frações antimicrobianas macromoleculares (E1, contendo moléculas maiores que 30 kDa, e E3, contendo moléculas entre 1 e 10 kDa) de A. millefolium, com dependência de concentração, é de grande valia para o desenvolvimento biotecnológico de agentes macromoleculares de defesa, e para o estudo das proteínas ou das associações peptídicas envolvidas, vistos os valores baixos de CIM observados especialmente para E1; 2) para o estudo de frações antimicrobianas macromoleculares, deve ser considerada a quantidade das moléculas de defesa presentes no material vegetal explorado (calculando-se CIMMAT), e não apenas a sua concentração relativa às proteínas (CIMPROT) ou relativa à molaridade (CIMMOL), o que favorece a obtenção de frações macromoleculares concentradas, ativas e estáveis; 3) E1 parece ser mais vantajoso para uso como fitodefensivo, à semelhança de fitomedicamentos, enquanto que prováveis peptídeos antimicrobianos muito efetivos, contidos em E3 na forma solúvel ou em E1 como aglomerados, poderiam ser caracterizados e superexpressos para a síntese de agentes de defesa vegetal após expressão heteróloga; 4) Estudos moleculares dos constituintes antimicrobianos de E1 e E3 de A. millefolium certamente auxiliarão a obter modelos bioquímicos estruturais e funcionais para desenvolver produtos de defesa naturais; 5) O estudo de macromoléculas como agentes de defesa é incipiente, requer ferramentas bioquímicas e biotecnológicas adequadas ao isolamento, à identificação e às caracterizações bioquímica, estrutural e funcional, e requer colaborações e esforços de especialistas para avaliar a potencialidade do material em estudo."
AGRADECIMENTO
Ao colaborador e conselheiro Professor Reginaldo da Silva Romeiro (in memoriam), pelo apoio no desenvolvimento desse e de outros trabalhos de pesquisa. Às agências de financiamento brasileiras Fundação de Amparo à Pesquisa do Estado de Minas Gerais - FAPEMIG (PROBIC e projetos); Financiadora de Estudos e Projetos - FINEP (infra-estrutura); Coordenação de Aperfeiçoamento de Pessoal de Nível Superior - CAPES (Bolsa PNPD); e Conselho Nacional de Desenvolvimento Científico e Tecnológico - CNPq (PIBIC e PQ). Ao Herbário VIC (UFV, Viçosa - MG), pelo auxílio na identificação do material vegetal.
Recebido para publicação em 17/05/2011
Aceito para publicação em 24/04/2012
- AERTS, A.M. et al. The mode of antifungal action of plant, insect and human defensins. Cellular and Molecular Life Sciences, v.65, p.2069-79, 2008.
- ALMEIDA, H.O. et al. Peptide fraction inhibiting plant pathogen growth predominated in cell wall extracts from young plants or in soluble cell fraction from expanded leaves from eggplants. Journal of Phytopathology, v.155, p.735-7, 2007.
- ALMEIDA, H.O. et al. Atividade antimicrobiana de extratos peptídicos de folhas de berinjela no controle do crescimento de Ralstonia solanacearum e Clavibacter michiganensis subsp. michiganensis Summa Phytopathologica, v.34, p.62-5, 2008.
- BADOSA, E. et al. A library of linear undecapeptides with bactericidal activity against phytopathogenic bacteria. Peptides, v.28, p.2276-85, 2007.
- BELTING, M.; WITTRUP, A. Macromolecular drug delivery: basic principles and therapeutic applications. Molecular Biotechnology, v.43, p.89, 2009.
- British Herbal Pharmacopoeia 4.ed. Exeter: British Herbal Medicine Association, 1996. 212p.
- CANDAN, F. et al. Antioxidant and antimicrobial activity of the essential oil and methanol extracts of Achillea millefolium subsp. millefolium Afan. (Asteraceae). Journal of Ethnopharmacology, v.87, p.215-20, 2003.
- CARAVACA, H.. Plantas que curam. M&M Editores Ltda - Editora Virtual Books Online (virtualbooks.com.br), 2000. 66p. (http://xa.yimg.com/kq/groups/18101135/1436055021/name/Plantas+que+Curam+ %28Hugo+de+Caravaca%29.pdf). Acesso em: 10 Fev 2012.
- CHERYAN, M. Ultrafiltration Handbook Pennsylvania: Technomic Publishg Company Inc. Lancaster, 1986. 375p.
- CUNHA, A.P.; ROQUE, O.R.; Plantas Medicinais da Farmacopéia Portuguesa: Constituintes, Controlo, Farmacologia e Utilização. Lisboa: Fundação Calouste Gulberkian, 2009. 706p.
- FAROOQ, M. et al. The role of allelopathy in agricultural pest management. Pest Management Science, n/a. doi: 10.1002/ps.2091, 2011.
- FRANCO, I.J.; FONTANA, V.L. Ervas & Plantas - A Medicina dos Simples, 6Ş. ed. Erexim: Editora Edelbra, 2006. 208p.
- FREY, F.M.; MEYERS, R. Antibacterial activity of traditional medicinal plants used by Haudenosaunee peoples of New York State. BMC Complementary and Alternative Medicine, v.10, p.64, 2010.
- GARCÍA-OLMEDO, F. et al. Antibiotic activities of peptides, hydrogen peroxide and peroxynitrite in plant defence. FEBS Letters, v.498, p. 219-22, 2001.
- GARTEMANN, K.H. et al. Clavibacter michiganensis subsp. michiganensis: first steps in the understanding of virulence of a Gram-positive phytopathogenic bacterium. Journal of Biotechnology, v.106, p.179-91, 2003.
- HANCOCK, R.E.W.; ROZEK, A. Role of membranes in the activities of antimicrobial cationic peptides. FEMS Microbiology Letters, v.206, p.143-9, 2002.
- HEY, T. et al. Artificial, non-antibody binding proteins for pharmaceutical and industrial applications. Trends Biotechnology, v.23, p.514-522, 2005.
- JULIANO, R. Bugging tumors to put drugs on target. New England Journal of Medicine, v.356, p.954 - 5, 2007.
- JULIANO, R.L., ASTRIAB-FISHER, A.; FALKE, D. Macromolecular therapeutics: emerging strategies for drug discovery in the postgenome era. Molecular Interventions, v.1, p.40-53, 2001.
- KINTZIOS, S. et al. Evaluation of the antioxidants activities of four Slovene medicinal plant species by traditional and novel biosensory assays. Journal of Pharmaceutical and Biomedical Analysis, v.53, p.773-6, 2010.
- LOPES, C.A.; DUVAL, A.M.Q. Epidemiologia e controle das bacterioses em hortaliças. In: ZAMBOLIM, L.; LOPES, C.A.; PICANÇO, M.C.; COSTA, C. (Eds.). Manejo integrado de doenças e pragas - Hortaliças Viçosa: Editora UFV, 2007, p.115-62.
- MONTESINOS, E. Synthetic antimicrobial peptides as agricultural pesticides for plant-disease control. FEMS Microbiology Letters, v.270, p.1, 2007.
- PLANTAMED - Plantas e Ervas Medicinais. Fitoterapia e Fitoterápicos. Disponível em: . Acesso em: 20 Ago 2010.
- POWERS, J.P.; HANCOCK, R.E.W. The relationship between peptide structure and antibacterial activity. Peptides, v.24, p.1681-91, 2003.
- REDDY, K.V.R.; YEDERY, R.D.; ARANHA, C. Antimicrobial peptides: premises and promises. International Journal of Antimicrobial Agents, v.24, p.536-47, 2004.
- SANT'ANNA, J.R. et al. Genotoxicity of Achillea millefolium essential oil in diploid cells of Aspergillus nidulans Phytotherapy Research, v.23, p.231-5, 2009.
- SELS, J. et al. Plant pathogenesis-related (PR) proteins: on focus on PR peptides. Plant Physiology and Biochemistry, v.46, p.941-50, 2008.
- SCHWAN-ESTRADA, K.R.F.; STANGARLIN, J.R.; CRUZ, M.E. Uso de extratos vegetais no controle de fungos fitopatogênicos. Revista Floresta, v.30, n.1/2, p.129-137, 2000.
- TEIXEIRA, F.R. et al. Bioprospection of cationic and anionic antimicrobial peptides from bell pepper leaves for inhibition of Ralstonia solanacearum and Clavibacter michiganensis ssp. michiganensis growth. Journal of Phytopathology, v.154, p.418-21, 2006.
- YAO, J.; ALLEN, C. The plant pathogen Ralstonia solanacearum needs aerotaxis for normal biofilm formation and interactions with its tomato host. Journal of Bacteriology, v.189, p.6415-24, 2007.
- ZHANG, L.; FALLA, T.J. Antimicrobial peptides: therapeutic potential. Expert Opinion in Pharmacotherapy, v.7, p.653-63, 2006.
Datas de Publicação
-
Publicação nesta coleção
18 Jun 2013 -
Data do Fascículo
2013
Histórico
-
Recebido
17 Maio 2011 -
Aceito
24 Abr 2012